1.3.2 气体摩尔体积 阿伏加德罗定律 课件 (共35张PPT)
文档属性
| 名称 | 1.3.2 气体摩尔体积 阿伏加德罗定律 课件 (共35张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-13 22:00:17 | ||
图片预览








文档简介
(共35张PPT)
第一章、认识化学科学
1.3.2气体摩尔体积
气体摩尔体积
阿伏伽德罗定律
目录
上节知识点复习
物质的量
定义:具有一定数目的微粒的集合体
公式:
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
上节知识点复习
摩尔质量的定义
摩尔质量与相对原子质量的关系
摩尔质量相关公式
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
物质的量
定义:具有一定数目的微粒的集合体
公式:
还记得:
物质的量与数量之间的关系
物质的量与质量之间的关系
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
那么问题来了
物质的量与物质的体积之间有什么关系?
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
1
2
3
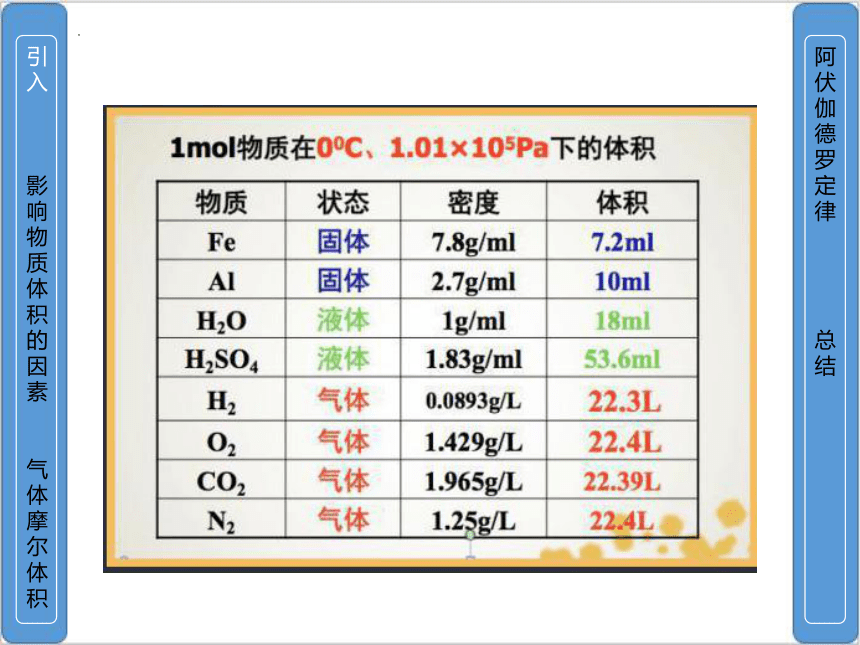
1mol不同固体、液体、气体的体积各不相同
气体体积>液体体积>固体体积
1mol气体在相同条件下体积大致相同
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
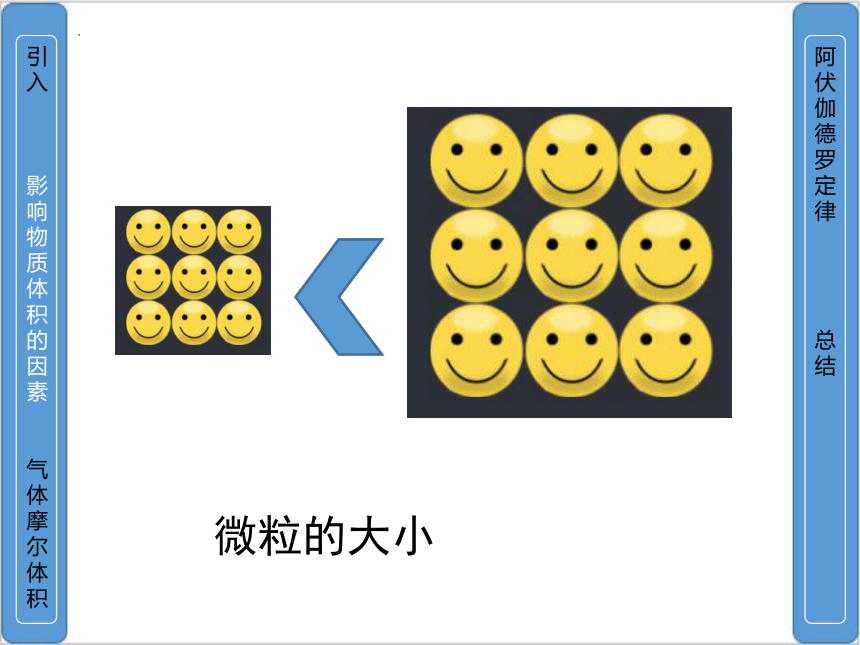
决定物质体积的因素有哪些?
微粒的多少
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
微粒的大小
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
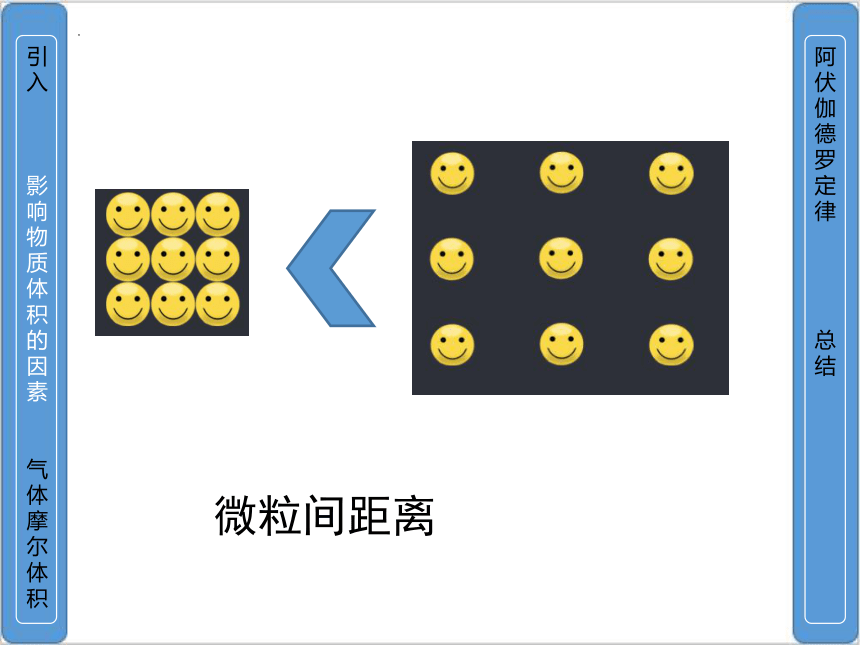
微粒间距离
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
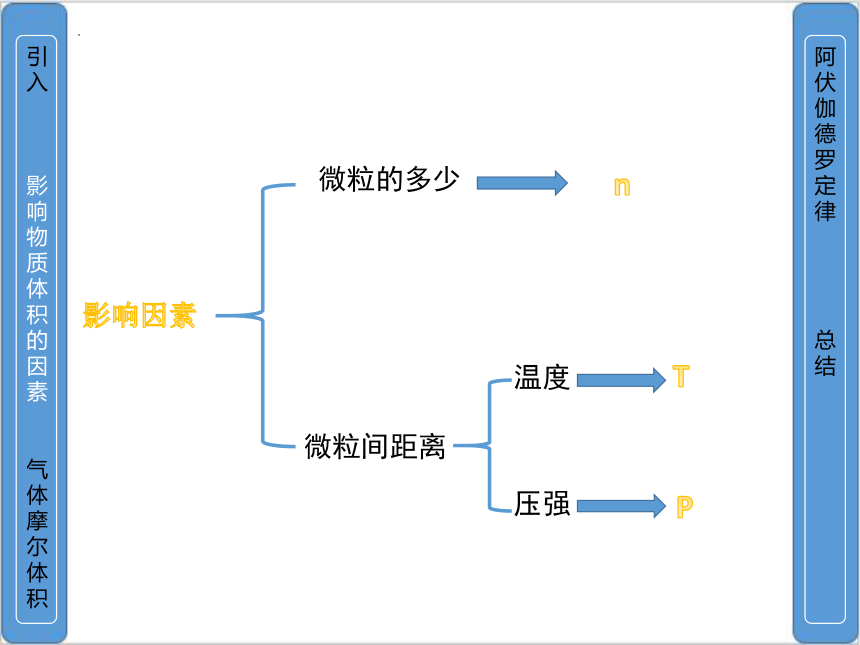
影响因素
微粒间距离
微粒的多少
n
温度
压强
T
P
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
定义:一定温度和压强下,单位物质的量的任何气体所占的体积
符号:Vm
单位:L/mol
气体摩尔体积
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
n =
公式:V=n×Vm
变形:
0℃、101KPa下,1mol任何气体所占的体积约为22.4L
0℃、101KPa(标准状况下),Vm≈22.4L/mol
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
判断:
1mol O2的体积约为22.4L
标准状况下,1mol O2的体积为22.4L
标准状况下,1mol CO和CO2的体积约为22.4L
标准状况下,1mol H2O的体积约为22.4L
X
√
√
X
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
气体摩尔体积只适用于气体,
标况下,水、SO3和戊烷不是气体
气体摩尔体积可用于单一气体也可用于混合气体
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
下列说法正确的是( )
A.在标准状况下,1mol水和1molH2的体积都约是22.4L
B.2gH2和44gCO2的体积相等
C.1mol某气体的体积为22.4L,则该气体一定处于标准状况
D.标准状况,1gH2和11.2LO2的物质的量相等
D
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
判断正误,并说明理由。
1 标况下,1mol任何物质的体积都约是22.4L
2 1mol气体的体积约为22.4L
3 标况下,1molO2 和N2 的混合气体的体积约为
22.4L
4 22.4L气体所含分子数一定大于11.2L气体所含
气体分子数
5 任何条件,气体的摩尔体积都是22.4L/mol
6 只有在标况下,气体的摩尔体积才能是
22.4L/mol
X
√
X
X
X
X
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
(1)标况下,11.2LSO2含有 个原子;
(2)标况下,22.4LSO2和CO2混合气体中含有的氧原子数为
0.5NA
2NA
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
1)在标况下0.5mol HCl气体占有的体积是多少?
2)在标况下33.6LH2 的物质的量是多少?
V=n×Vm=0.5×22.4=11.2(L)
n =
V
Vm
=
33.6 L
22 . 4 L · mol -1
= 1.5 mol
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
2
知识点
阿伏伽德罗定律
相同温度和压强下,相同体积的任何气体含有
相同数目的分子
n =
=
=
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
克拉伯龙方程:
(理想气体状态方程)
P V = n R T
*
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
阿伏加德罗定律的推论
依据:PV=nRT PM=ρRT 或 PV=
“二同”推导出“一比例”
1. 同温同压下,气体体积之比等于物质的量之比
T、P相同:
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
同温同压下,任何气体密度比等于摩尔质量之比。
T、P相同:
阿伏加德罗定律的推论
依据:PV=nRT 或 PV=
=D(相对密度)
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
T、P、V相同:
3. 同温同压下,同体积任何气体的质量比等于摩尔质量之比
阿伏加德罗定律的推论
依据:PV=nRT 或 PV=
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
同温同体积下,气体的压强之比等于物质的量之比
T、V相同:
阿伏加德罗定律的推论
依据:PV=nRT 或 PV=
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
同温同压下,相同质量的任何气体的体积与其式量成反比
T、P、m相同 :
阿伏加德罗定律的推论
依据:PV=nRT 或 PV=
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
在标准状况下的以下物质:
①10ml H2②100mlCl2 ③220mlO2 ④120mlCO2 ,
所含分子数由少到多的顺序
在同温同压下,相同质量的下列气体,
占有的体积由大到小的顺序是
①Cl2 ②N2 ③H2 ④CO2 ⑤O2
①④②③
③②⑤④①
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
下列说法正确的是
A.在常温、常压下,含有的分子数是0.5NA
B.标准状况下,18g水所占的体积约是22.4L
C.32gO2在标准状况下的体积约是22.4L
D.在同温、同压下,相同体积的任何气体所含的原子数相等
C
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
在两个密闭容器中,分别充有质量相等的甲、乙两种气体,它们的温度和密度均相同。试根据甲、乙的摩尔质量的关系,判断下列说法中正确的是( )
A.若 甲乙,则分子数:甲乙
B.若 甲乙,则气体摩尔体积:甲乙
C.若 甲乙,则气体的压强:甲乙
D.若 甲乙,则气体体积:甲乙
A
在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是( )
A.p(Ne)>p(H2)>p(O2)
B.p(O2)>p(Ne)>p(H2)
C.p(H2)>p(O2)>p(Ne)
D.p(H2)>p(Ne)>p(O2)
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
D
同温同压下,A容器中的H2 和B容器中的PH3 所含的氢原子数相等,则两个容器的体积比是( )
A.3:2 B.1:3 C.2:3 D.1:2
A
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
瓦斯中甲烷与氧气的质量比为1:4时极易爆炸,此时甲烷与氧气的体积比为
A.: B.:
C.: D.:
B
计算标准状况下,O2、N2的密度
ρ===
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
本节小结
气体摩尔体积
定义
与n、V之间的关系
重要公式
V=n×VM
n=
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
本节小结
阿伏伽德罗定律
n =
=
=
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
理想气态方程
PV=nRT
第一章、认识化学科学
1.3.2气体摩尔体积
气体摩尔体积
阿伏伽德罗定律
目录
上节知识点复习
物质的量
定义:具有一定数目的微粒的集合体
公式:
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
上节知识点复习
摩尔质量的定义
摩尔质量与相对原子质量的关系
摩尔质量相关公式
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
物质的量
定义:具有一定数目的微粒的集合体
公式:
还记得:
物质的量与数量之间的关系
物质的量与质量之间的关系
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
那么问题来了
物质的量与物质的体积之间有什么关系?
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
1
2
3
1mol不同固体、液体、气体的体积各不相同
气体体积>液体体积>固体体积
1mol气体在相同条件下体积大致相同
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
决定物质体积的因素有哪些?
微粒的多少
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
微粒的大小
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
微粒间距离
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
影响因素
微粒间距离
微粒的多少
n
温度
压强
T
P
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
定义:一定温度和压强下,单位物质的量的任何气体所占的体积
符号:Vm
单位:L/mol
气体摩尔体积
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
n =
公式:V=n×Vm
变形:
0℃、101KPa下,1mol任何气体所占的体积约为22.4L
0℃、101KPa(标准状况下),Vm≈22.4L/mol
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
判断:
1mol O2的体积约为22.4L
标准状况下,1mol O2的体积为22.4L
标准状况下,1mol CO和CO2的体积约为22.4L
标准状况下,1mol H2O的体积约为22.4L
X
√
√
X
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
气体摩尔体积只适用于气体,
标况下,水、SO3和戊烷不是气体
气体摩尔体积可用于单一气体也可用于混合气体
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
下列说法正确的是( )
A.在标准状况下,1mol水和1molH2的体积都约是22.4L
B.2gH2和44gCO2的体积相等
C.1mol某气体的体积为22.4L,则该气体一定处于标准状况
D.标准状况,1gH2和11.2LO2的物质的量相等
D
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
判断正误,并说明理由。
1 标况下,1mol任何物质的体积都约是22.4L
2 1mol气体的体积约为22.4L
3 标况下,1molO2 和N2 的混合气体的体积约为
22.4L
4 22.4L气体所含分子数一定大于11.2L气体所含
气体分子数
5 任何条件,气体的摩尔体积都是22.4L/mol
6 只有在标况下,气体的摩尔体积才能是
22.4L/mol
X
√
X
X
X
X
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
(1)标况下,11.2LSO2含有 个原子;
(2)标况下,22.4LSO2和CO2混合气体中含有的氧原子数为
0.5NA
2NA
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
1)在标况下0.5mol HCl气体占有的体积是多少?
2)在标况下33.6LH2 的物质的量是多少?
V=n×Vm=0.5×22.4=11.2(L)
n =
V
Vm
=
33.6 L
22 . 4 L · mol -1
= 1.5 mol
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
2
知识点
阿伏伽德罗定律
相同温度和压强下,相同体积的任何气体含有
相同数目的分子
n =
=
=
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
克拉伯龙方程:
(理想气体状态方程)
P V = n R T
*
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
阿伏加德罗定律的推论
依据:PV=nRT PM=ρRT 或 PV=
“二同”推导出“一比例”
1. 同温同压下,气体体积之比等于物质的量之比
T、P相同:
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
同温同压下,任何气体密度比等于摩尔质量之比。
T、P相同:
阿伏加德罗定律的推论
依据:PV=nRT 或 PV=
=D(相对密度)
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
T、P、V相同:
3. 同温同压下,同体积任何气体的质量比等于摩尔质量之比
阿伏加德罗定律的推论
依据:PV=nRT 或 PV=
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
同温同体积下,气体的压强之比等于物质的量之比
T、V相同:
阿伏加德罗定律的推论
依据:PV=nRT 或 PV=
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
同温同压下,相同质量的任何气体的体积与其式量成反比
T、P、m相同 :
阿伏加德罗定律的推论
依据:PV=nRT 或 PV=
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
在标准状况下的以下物质:
①10ml H2②100mlCl2 ③220mlO2 ④120mlCO2 ,
所含分子数由少到多的顺序
在同温同压下,相同质量的下列气体,
占有的体积由大到小的顺序是
①Cl2 ②N2 ③H2 ④CO2 ⑤O2
①④②③
③②⑤④①
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
下列说法正确的是
A.在常温、常压下,含有的分子数是0.5NA
B.标准状况下,18g水所占的体积约是22.4L
C.32gO2在标准状况下的体积约是22.4L
D.在同温、同压下,相同体积的任何气体所含的原子数相等
C
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
在两个密闭容器中,分别充有质量相等的甲、乙两种气体,它们的温度和密度均相同。试根据甲、乙的摩尔质量的关系,判断下列说法中正确的是( )
A.若 甲乙,则分子数:甲乙
B.若 甲乙,则气体摩尔体积:甲乙
C.若 甲乙,则气体的压强:甲乙
D.若 甲乙,则气体体积:甲乙
A
在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是( )
A.p(Ne)>p(H2)>p(O2)
B.p(O2)>p(Ne)>p(H2)
C.p(H2)>p(O2)>p(Ne)
D.p(H2)>p(Ne)>p(O2)
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
D
同温同压下,A容器中的H2 和B容器中的PH3 所含的氢原子数相等,则两个容器的体积比是( )
A.3:2 B.1:3 C.2:3 D.1:2
A
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
瓦斯中甲烷与氧气的质量比为1:4时极易爆炸,此时甲烷与氧气的体积比为
A.: B.:
C.: D.:
B
计算标准状况下,O2、N2的密度
ρ===
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
本节小结
气体摩尔体积
定义
与n、V之间的关系
重要公式
V=n×VM
n=
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
本节小结
阿伏伽德罗定律
n =
=
=
引入
影响物质体积的因素
气体摩尔体积
阿伏伽德罗定律
总结
理想气态方程
PV=nRT
