1.3.4 物质的量浓度的有关计算 课件 (共20张PPT)
文档属性
| 名称 | 1.3.4 物质的量浓度的有关计算 课件 (共20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-13 22:19:37 | ||
图片预览








文档简介
(共20张PPT)
物质的量浓度的
有关计算
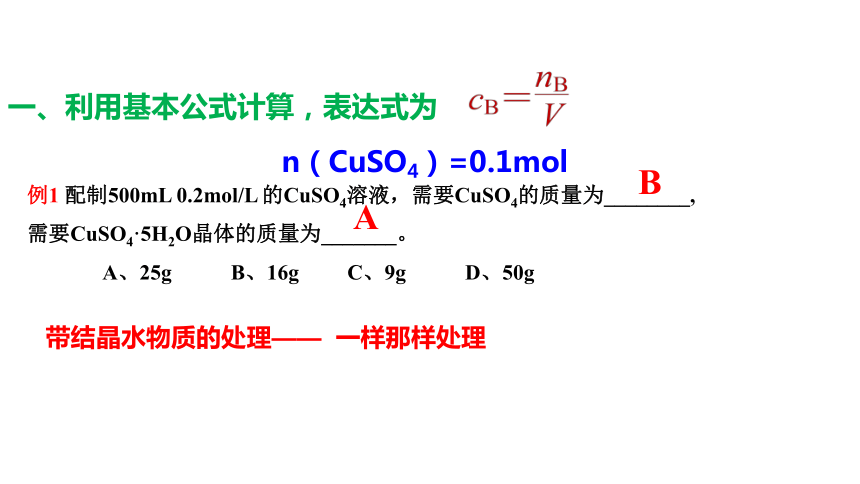
一、利用基本公式计算,表达式为
例1 配制500mL 0.2mol/L 的CuSO4溶液,需要CuSO4的质量为________,
需要CuSO4·5H2O晶体的质量为_______。
A、25g B、16g C、9g D、50g
A
带结晶水物质的处理—— 一样那样处理
B
n(CuSO4)=0.1mol
一、利用基本公式计算,表达式为
例2 已知V L Fe2(SO4)3溶液中含Fe3+ m g,则该溶液中Fe3+的物质的量浓度为 mol·L-1,
SO42-的物质的量浓度为 mol·L-1,
溶质物质的量浓度为 mol·L-1。
Fe2(SO4)3 =2Fe3+ +3 SO42-
?~ m/56V ~ ?
1 2 3
练习1:把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
D
对点训练1:电荷守恒
练习2:用10mL 0.1mol·L-1 的BaCl2溶液恰好使相同体积的
硫酸铁、硫酸锌、硫酸钾三种溶液中的SO42- 离子完全沉淀。
这三种盐溶液物质的量浓度之比是( )
A、3∶2∶2 B、1∶2∶3
C、1∶3∶3 D、3∶1∶1
Fe2(SO4)3+3BaCl2=3BaSO4+2FeCl3
ZnSO4+BaCl2=BaSO4+ZnCl2
K2SO4+BaCl2=BaSO4+2KCl
C
例3 用1 L水吸收560 L氨气(标准状况),所得氨水的密度是0.90 g·mL-1。求:
(1)氨气的物质的量是 。
(2)所得氨水溶液的物质的量浓度是 。
25 mol
15.8 mol·L-1
二、气体溶于水所得溶质物质的量浓度的计算
了解内容:
气体溶质溶于水中制得的溶液物质的量浓度的计算
在标准状况下,1 L水中溶解某气体V L,所得溶液密度为ρ g·cm-3,则c的表达式是:
溶于水时 “不同寻常”的溶质
(1)能与水发生反应的物质,溶液的溶质为生成的新物质,如
Na、Na2O、Na2O2 NaOH, SO3 H2SO4, NO2 HNO3。
(2)特殊物质溶于水的溶质:NH3溶于水后溶质为NH3·H2O,但计算浓度时仍以NH3作为溶质。
(3)含结晶水的物质溶于水,溶质为无水成分,
如CuSO4·5H2O→CuSO4,
Na2CO3·10H2O→Na2CO3。
对点训练2:
1.将标准状况下体积为V L的HCl气体溶于1 L水中,所得溶液的密度为ρ g·cm-3,试计算该溶液的物质的量浓度。(书写计算过程)
2.在标准状况下,将V L A气体(摩尔质量为M g·mol-1)溶于0.1 L水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度(mol·L-1)为( )
三、溶液的稀释或混合
(1)浓溶液加水稀释后,溶质的物质的量不变:
c(浓)·V(浓)=c(稀)·V(稀)
(2)同一溶质、不同浓度溶液的混合
c1·V1+c2·V2=c(混)·V(混)
①若指出不考虑溶液体积改变V(混)=V1 + V2
②若给出混合后溶液的密度,应根据
V(混)= 来计算。
例4 欲将0.10 mol·L-1的NaOH溶液和0.60 mol·L-1的NaOH溶液混合成0.20 mol·L-1的NaOH溶液。求两种溶液的体积比(忽略混合时溶液体积变化)。
4∶1
c1·V1+c2·V2=c(混)·V(混)
0.10 mol·L-1·V1+0.60 mol·L-1·V2
=0.20 mol·L-1·(V1+V2)
1.物质的量浓度与溶质的质量分数的相互求算
2.溶质的质量分数与溶解度的相互求算
ω=
S
100+S
×100%
3.物质的量浓度与溶解度的相互求算
C=
1000×ρ×ω
M
C=
1000×ρ×
M
S
100+S
四、物质的量浓度与质量分数、溶解度之间的求算
注:w -质量分数
ρ-溶液的密度
(单位:g·cm-3)
M-摩尔质量
配制500mL1 mol/L的H2SO4溶液,需要左图浓硫酸(98%硫酸)多少毫升?
C1× V1= C2× V2
=27.2mL
例5 市售浓硫酸中溶质的质量分数为98%,密度为1.84g/cm3。计算市售浓硫酸中H2SO4的物质的量浓度。
设浓硫酸的体积为1L,则:
公式:
浓溶液给出密度
ρ g·cm-3=1000ρ g·L
1.市售浓硫酸中溶质的质量分数为98%,密度为1.84 g·cm-3。计算市售浓硫酸中H2SO4的物质的量浓度。
C=
1000×ρ×ω
M
=18.4 mol·L-1
2. 20 ℃,某溶解度为25 g的固体物质完全溶解于水,配制成密度为1.5 g·mL-1的饱和溶液,求20 ℃时该饱和溶液的物质的量浓度 (该物质的摩尔质量为M g·mol-1)。
C=
1000×1.5×
M
25
100+25
= mol/L
300
M
10%的H2SO4溶液与30%的H2SO4溶液等体积混合,混合溶液的质量分数为?
硫酸的密度比水大,溶液浓度越大,密度越大,氨水密度比水小,溶液浓度越大,密度越小,
例6 10%的H2SO4溶液与30%的H2SO4溶液
① 等体积混合,混合溶液的质量分数为( )
②等质量混合,混合溶液的质量分数为 ( )
A > 20% B = 20%
C < 20% D 无法计算
A
B
不同浓度的硫酸按等质量混合与按等体积混合,等体积混合的质量分数大.
如果是氨水,情况相反.
1.根据概念表达式cB= 欲求cB,先求nB和V。
2.物质的量浓度、质量分数、溶解度之间的关系
课堂小结
物质的量浓度的
有关计算
一、利用基本公式计算,表达式为
例1 配制500mL 0.2mol/L 的CuSO4溶液,需要CuSO4的质量为________,
需要CuSO4·5H2O晶体的质量为_______。
A、25g B、16g C、9g D、50g
A
带结晶水物质的处理—— 一样那样处理
B
n(CuSO4)=0.1mol
一、利用基本公式计算,表达式为
例2 已知V L Fe2(SO4)3溶液中含Fe3+ m g,则该溶液中Fe3+的物质的量浓度为 mol·L-1,
SO42-的物质的量浓度为 mol·L-1,
溶质物质的量浓度为 mol·L-1。
Fe2(SO4)3 =2Fe3+ +3 SO42-
?~ m/56V ~ ?
1 2 3
练习1:把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
D
对点训练1:电荷守恒
练习2:用10mL 0.1mol·L-1 的BaCl2溶液恰好使相同体积的
硫酸铁、硫酸锌、硫酸钾三种溶液中的SO42- 离子完全沉淀。
这三种盐溶液物质的量浓度之比是( )
A、3∶2∶2 B、1∶2∶3
C、1∶3∶3 D、3∶1∶1
Fe2(SO4)3+3BaCl2=3BaSO4+2FeCl3
ZnSO4+BaCl2=BaSO4+ZnCl2
K2SO4+BaCl2=BaSO4+2KCl
C
例3 用1 L水吸收560 L氨气(标准状况),所得氨水的密度是0.90 g·mL-1。求:
(1)氨气的物质的量是 。
(2)所得氨水溶液的物质的量浓度是 。
25 mol
15.8 mol·L-1
二、气体溶于水所得溶质物质的量浓度的计算
了解内容:
气体溶质溶于水中制得的溶液物质的量浓度的计算
在标准状况下,1 L水中溶解某气体V L,所得溶液密度为ρ g·cm-3,则c的表达式是:
溶于水时 “不同寻常”的溶质
(1)能与水发生反应的物质,溶液的溶质为生成的新物质,如
Na、Na2O、Na2O2 NaOH, SO3 H2SO4, NO2 HNO3。
(2)特殊物质溶于水的溶质:NH3溶于水后溶质为NH3·H2O,但计算浓度时仍以NH3作为溶质。
(3)含结晶水的物质溶于水,溶质为无水成分,
如CuSO4·5H2O→CuSO4,
Na2CO3·10H2O→Na2CO3。
对点训练2:
1.将标准状况下体积为V L的HCl气体溶于1 L水中,所得溶液的密度为ρ g·cm-3,试计算该溶液的物质的量浓度。(书写计算过程)
2.在标准状况下,将V L A气体(摩尔质量为M g·mol-1)溶于0.1 L水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度(mol·L-1)为( )
三、溶液的稀释或混合
(1)浓溶液加水稀释后,溶质的物质的量不变:
c(浓)·V(浓)=c(稀)·V(稀)
(2)同一溶质、不同浓度溶液的混合
c1·V1+c2·V2=c(混)·V(混)
①若指出不考虑溶液体积改变V(混)=V1 + V2
②若给出混合后溶液的密度,应根据
V(混)= 来计算。
例4 欲将0.10 mol·L-1的NaOH溶液和0.60 mol·L-1的NaOH溶液混合成0.20 mol·L-1的NaOH溶液。求两种溶液的体积比(忽略混合时溶液体积变化)。
4∶1
c1·V1+c2·V2=c(混)·V(混)
0.10 mol·L-1·V1+0.60 mol·L-1·V2
=0.20 mol·L-1·(V1+V2)
1.物质的量浓度与溶质的质量分数的相互求算
2.溶质的质量分数与溶解度的相互求算
ω=
S
100+S
×100%
3.物质的量浓度与溶解度的相互求算
C=
1000×ρ×ω
M
C=
1000×ρ×
M
S
100+S
四、物质的量浓度与质量分数、溶解度之间的求算
注:w -质量分数
ρ-溶液的密度
(单位:g·cm-3)
M-摩尔质量
配制500mL1 mol/L的H2SO4溶液,需要左图浓硫酸(98%硫酸)多少毫升?
C1× V1= C2× V2
=27.2mL
例5 市售浓硫酸中溶质的质量分数为98%,密度为1.84g/cm3。计算市售浓硫酸中H2SO4的物质的量浓度。
设浓硫酸的体积为1L,则:
公式:
浓溶液给出密度
ρ g·cm-3=1000ρ g·L
1.市售浓硫酸中溶质的质量分数为98%,密度为1.84 g·cm-3。计算市售浓硫酸中H2SO4的物质的量浓度。
C=
1000×ρ×ω
M
=18.4 mol·L-1
2. 20 ℃,某溶解度为25 g的固体物质完全溶解于水,配制成密度为1.5 g·mL-1的饱和溶液,求20 ℃时该饱和溶液的物质的量浓度 (该物质的摩尔质量为M g·mol-1)。
C=
1000×1.5×
M
25
100+25
= mol/L
300
M
10%的H2SO4溶液与30%的H2SO4溶液等体积混合,混合溶液的质量分数为?
硫酸的密度比水大,溶液浓度越大,密度越大,氨水密度比水小,溶液浓度越大,密度越小,
例6 10%的H2SO4溶液与30%的H2SO4溶液
① 等体积混合,混合溶液的质量分数为( )
②等质量混合,混合溶液的质量分数为 ( )
A > 20% B = 20%
C < 20% D 无法计算
A
B
不同浓度的硫酸按等质量混合与按等体积混合,等体积混合的质量分数大.
如果是氨水,情况相反.
1.根据概念表达式cB= 欲求cB,先求nB和V。
2.物质的量浓度、质量分数、溶解度之间的关系
课堂小结
