2.1.1 元素与物质的关系 物质分类与物质性质 课件 (共23张PPT)
文档属性
| 名称 | 2.1.1 元素与物质的关系 物质分类与物质性质 课件 (共23张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 835.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-13 00:00:00 | ||
图片预览








文档简介
(共23张PPT)
第1节 元素与物质分类
第1课时 元素与物质的关系 物质分类与物质性质
1
2
3
元素与物质的关系
物质分类的方法
物质分类与物质性质
目录
Contents
引入
图书馆里有许许多多的书籍,为什么你很快就找到你需要的书?
超市里有成千上万种商品,为什么你能够迅速挑出你所需要的东西?
一、元素与物质的关系
1 . 元素与物质的关系
元素是物质的基本组成成分,物质都是由元素组成的。
由多种元素组成的纯净物叫化合物。
2 . 元素组成物质的形式
单质:
化合物:
物质
由一种元素组成的纯净物叫单质,有金属单质和非金属单质。
物质含水时一般是混合物,如CuSO4的水溶液。
但物质含结晶水是纯净物,如CuSO4·5H2O
思考:
1、由一种元素组成的物质一定是纯净物吗
2、含水的物质一定是混合物吗?
如 C60和石墨的混合物;O2和O3的混合物。
不一定,
不一定
3.元素的存在形态
元素以自身形式结合成单质时的存在状态,化合价为0价
元素与另外的元素结合成化合物时的存在状态,化合价一般不为0(正价或负价)
注意:
①金属元素有0价和正价,无负价;非金属元素有0价,正价和负价。
②化合物中各元素化合价的代数和等于0。
游离态
化合态
元素存在形态
氧元素O
O2或O3
H2O或H2O2等
【典例精讲】
1.已知由碳元素组成的单质有金刚石、石墨和足球烯(C60)等,由氧元素组成的单质有氧气、臭氧(O3)等。下列说法不正确的是( )
A.一种元素可能形成两种或多种不同的单质
B.单质的种数一定多于元素的种数
C.只含一种元素的物质不一定是纯净物
D.只含碳元素的物质在氧气中燃烧只能生成一种物质
D
2.下列元素中,可以形成两种以上单质的是( )
3.下列元素中,在自然界中既存在游离态,又存在化合态的是( )
①氮 ②氧 ③钠 ④碳 ⑤铁 ⑥氯
A.钾 B.碳 C.氯 D.钠
A.①②③ B.③④⑤ C.④⑤⑥ D.①②④⑤
B
D
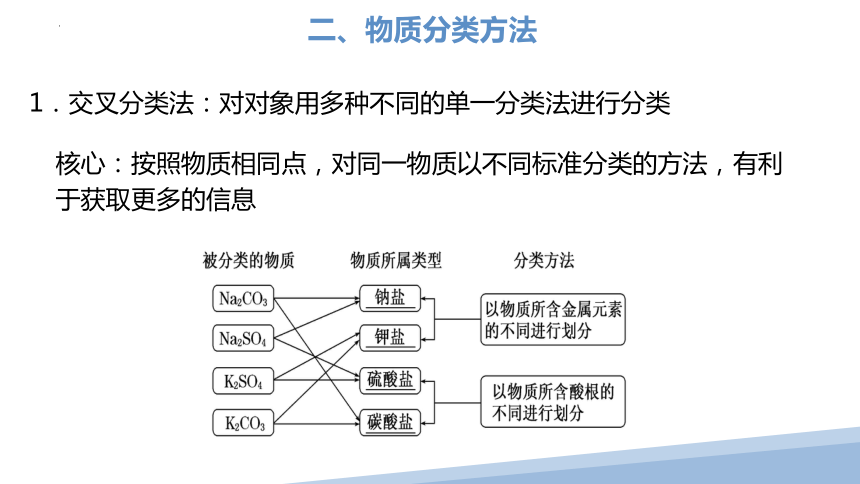
二、物质分类方法
1.交叉分类法:对对象用多种不同的单一分类法进行分类
核心:按照物质相同点,对同一物质以不同标准分类的方法,有利于获取更多的信息
2.树状分类法:根据被分对象的整体与分支的类型之间的关系,以陈列式的形状(树)来定义。
核心:对同类事物进行再分类,逻辑性很强
3.分类法的应用
初中已经学习的四大基本反应类型,初步把化学反应进行了分类,物质又如何分类呢?
① 推断物质性质
同类物质常常具有许多共性.因此可以通过物质所属类别,推测其具有的性质。
② 确定转化关系
以钙为例,用化学方程式表示钙及其化合物之间的转化关系并指明反应类型.
例如:CO2+H2O=H2CO3,那么SO2、SO3能否与水反应生成相应的酸呢?
【典例精讲】
4.分类法是一种行之有效,简单易行的科学方法,人们在认识事物时可以采取多种分类方法,下列关于“Na2CO3”的分类不正确的是( )
5.一带一路是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称。古丝绸之路贸易中的下列商品,其主要化学成分属于无机物的是( )
A.化合物 B.氧化物 C.碳酸盐 D.钠盐
A.陶瓷 B.中草药 C.香料 D.丝绸
B
A
三、物质分类与物质性质
1.根据物质的组成
2.根据组成特点和所具有的性质
CH4、NH3、PH3、H2O、HF——H的价态为+1;
NaH、CaH2——H的价态为-1
(1)氢化物
(2)氧化物
① 酸性氧化物:一类能与水作用生成酸或与碱作用只生成盐和水的氧化物
七氧化二锰 Mn2O7——Mn2O7+H2O=2HMnO4(高锰酸)
Mn2O7 +2KOH =2KMnO4 +H2O
三氧化硫 SO3、二氧化碳CO2、五氧化二磷 P2O5
三氧化铬 CrO3——2CrO3+H2O= H2Cr2O7(重铬酸)
注意:NO2、H2O、CO、NO不是酸性氧化物。
非金属氢化物
金属氢化物
2.根据组成特点和所具有的性质
③两性氧化物:Al2O3
②碱性氧化物:一类能与水作用生成碱或与酸作用只生成盐和水的氧化物
④不成盐氧化物:既不能跟酸起反应,又不能跟碱反应只生成盐和水——NO、CO、H2O
注意:Na2O2、Fe3O4不是碱性氧化物
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3+2NaOH+3H2O=2Na[Al(OH)4](鲁科版)
Na2O、BaO、CaO、Fe2O3、FeO
Ⅲ.酸性氧化物一定为酸酐;酸酐不一定为酸性氧化物,如乙酸酐[(CH3CO)2O]不属于氧化物;
Ⅳ.酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱,如SiO2、CuO
Ⅰ.金属氧化物
碱性氧化物
Ⅱ.非金属氧化物
酸性氧化物
不一定是
一定是
不一定是
不一定是
例如Fe3O4, Mn2O7,CrO3
例如Mn2O7,CrO3
例如CO,NO2
三非一定
③ 根据酸能电离出的氢离子数:一元酸、二元酸、多元酸
盐酸(HCl)、硝酸(HNO3)、硼酸 (H3BO3)、硫酸(H2SO4)、碳酸(H2CO3)、 磷酸(H3PO4)
(3)酸的分类
① 根据是否含氧:含氧酸、无氧酸
命名:含氧酸——某酸(注意:HNO3硝酸),无氧酸——氢某酸(例如盐酸是HCl气体水溶液)
② 根据酸的电离程度不同:强酸、弱酸
强酸制弱酸: 2HCl + CaCO3 =2H2O + CO2↑+ H2O
③ 按电离能力分:强碱、弱碱;
强碱:KOH、NaOH、Ca(OH)2、Ba(OH)2
弱碱:NH3·H2O+难溶性的碱
(4)碱的分类
① 按碱分子电离出氢氧根离子的个数分:
一元碱、二元碱、多元碱,NaOH、Ca(OH)2、Fe(OH)3;
② 按溶解性分:可溶性碱、难溶性碱;
可溶性碱:KOH、NaOH、Ca(OH)2、Ba(OH)2、NH3·H2O
难溶性碱:绝大部分的碱都难溶于水
(5)盐的分类
① 按是否含有氧元素:
② 按酸碱中和反应程度:
----某化某
含氧酸盐
无氧酸盐
Na2SO4
NaCl
命名
----某酸某
正盐
酸式盐
碱式盐
碳酸钠Na2CO3 硫酸钠Na2SO4
酸氢钠NaHCO3 硫酸氢钠NaHSO4
碱式碳酸铜Cu2(OH)2CO3 碱式氯化镁Mg(OH)Cl
③复盐:
硫酸铝钾:KAl(SO4)2·12H2O
硫酸亚铁铵:(NH4)2Fe(SO4)2
由两种阳离子金属离子(或铵根离子)和一种酸根离子构成的盐。
【典例精讲】
6.下列物质不属于酸性氧化物的是( )
7.下列关于氧化物的叙述正确的是( )
A.金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
B.碱性氧化物一定是金属氧化物
C.碱性氧化物都能与水化合生成碱
D.酸性氧化物一定是非金属氧化物
A.SO3 B.CO2 C.CO D.P2O5
B
C
8.下列各组物质,按混合物、酸、碱、盐、氧化物顺序排列的是( )
A.食用盐、硝酸、熟石灰、纯碱、四氧化三铁
B.盐酸、硫酸、纯碱、胆矾、一氧化氮
C.氨水、氯化氢、苛性钠、生石灰、干冰
D.碘酒、食用醋、烧碱、绿矾、石灰石
A
9.下列每组物质中都有一种物质与其他物质在分类上不同。试分析每组中物质的组成规律,将这种不同于其他物质的物质找出来填在横线上。
① NaCl、KCl、NaClO、BaCl2__________;
② HClO3、KClO3、Cl2、NaClO3___________;
③ H3PO4、H4SiO4、HCl、H2SO4________;
④ 铜、金、汞、钠_____________________;
⑤ 空气、N2、HCl气体、CuSO45H2O晶体_____________________。
NaClO
Cl2
HCl
汞
空气
第1节 元素与物质分类
第1课时 元素与物质的关系 物质分类与物质性质
1
2
3
元素与物质的关系
物质分类的方法
物质分类与物质性质
目录
Contents
引入
图书馆里有许许多多的书籍,为什么你很快就找到你需要的书?
超市里有成千上万种商品,为什么你能够迅速挑出你所需要的东西?
一、元素与物质的关系
1 . 元素与物质的关系
元素是物质的基本组成成分,物质都是由元素组成的。
由多种元素组成的纯净物叫化合物。
2 . 元素组成物质的形式
单质:
化合物:
物质
由一种元素组成的纯净物叫单质,有金属单质和非金属单质。
物质含水时一般是混合物,如CuSO4的水溶液。
但物质含结晶水是纯净物,如CuSO4·5H2O
思考:
1、由一种元素组成的物质一定是纯净物吗
2、含水的物质一定是混合物吗?
如 C60和石墨的混合物;O2和O3的混合物。
不一定,
不一定
3.元素的存在形态
元素以自身形式结合成单质时的存在状态,化合价为0价
元素与另外的元素结合成化合物时的存在状态,化合价一般不为0(正价或负价)
注意:
①金属元素有0价和正价,无负价;非金属元素有0价,正价和负价。
②化合物中各元素化合价的代数和等于0。
游离态
化合态
元素存在形态
氧元素O
O2或O3
H2O或H2O2等
【典例精讲】
1.已知由碳元素组成的单质有金刚石、石墨和足球烯(C60)等,由氧元素组成的单质有氧气、臭氧(O3)等。下列说法不正确的是( )
A.一种元素可能形成两种或多种不同的单质
B.单质的种数一定多于元素的种数
C.只含一种元素的物质不一定是纯净物
D.只含碳元素的物质在氧气中燃烧只能生成一种物质
D
2.下列元素中,可以形成两种以上单质的是( )
3.下列元素中,在自然界中既存在游离态,又存在化合态的是( )
①氮 ②氧 ③钠 ④碳 ⑤铁 ⑥氯
A.钾 B.碳 C.氯 D.钠
A.①②③ B.③④⑤ C.④⑤⑥ D.①②④⑤
B
D
二、物质分类方法
1.交叉分类法:对对象用多种不同的单一分类法进行分类
核心:按照物质相同点,对同一物质以不同标准分类的方法,有利于获取更多的信息
2.树状分类法:根据被分对象的整体与分支的类型之间的关系,以陈列式的形状(树)来定义。
核心:对同类事物进行再分类,逻辑性很强
3.分类法的应用
初中已经学习的四大基本反应类型,初步把化学反应进行了分类,物质又如何分类呢?
① 推断物质性质
同类物质常常具有许多共性.因此可以通过物质所属类别,推测其具有的性质。
② 确定转化关系
以钙为例,用化学方程式表示钙及其化合物之间的转化关系并指明反应类型.
例如:CO2+H2O=H2CO3,那么SO2、SO3能否与水反应生成相应的酸呢?
【典例精讲】
4.分类法是一种行之有效,简单易行的科学方法,人们在认识事物时可以采取多种分类方法,下列关于“Na2CO3”的分类不正确的是( )
5.一带一路是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称。古丝绸之路贸易中的下列商品,其主要化学成分属于无机物的是( )
A.化合物 B.氧化物 C.碳酸盐 D.钠盐
A.陶瓷 B.中草药 C.香料 D.丝绸
B
A
三、物质分类与物质性质
1.根据物质的组成
2.根据组成特点和所具有的性质
CH4、NH3、PH3、H2O、HF——H的价态为+1;
NaH、CaH2——H的价态为-1
(1)氢化物
(2)氧化物
① 酸性氧化物:一类能与水作用生成酸或与碱作用只生成盐和水的氧化物
七氧化二锰 Mn2O7——Mn2O7+H2O=2HMnO4(高锰酸)
Mn2O7 +2KOH =2KMnO4 +H2O
三氧化硫 SO3、二氧化碳CO2、五氧化二磷 P2O5
三氧化铬 CrO3——2CrO3+H2O= H2Cr2O7(重铬酸)
注意:NO2、H2O、CO、NO不是酸性氧化物。
非金属氢化物
金属氢化物
2.根据组成特点和所具有的性质
③两性氧化物:Al2O3
②碱性氧化物:一类能与水作用生成碱或与酸作用只生成盐和水的氧化物
④不成盐氧化物:既不能跟酸起反应,又不能跟碱反应只生成盐和水——NO、CO、H2O
注意:Na2O2、Fe3O4不是碱性氧化物
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3+2NaOH+3H2O=2Na[Al(OH)4](鲁科版)
Na2O、BaO、CaO、Fe2O3、FeO
Ⅲ.酸性氧化物一定为酸酐;酸酐不一定为酸性氧化物,如乙酸酐[(CH3CO)2O]不属于氧化物;
Ⅳ.酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱,如SiO2、CuO
Ⅰ.金属氧化物
碱性氧化物
Ⅱ.非金属氧化物
酸性氧化物
不一定是
一定是
不一定是
不一定是
例如Fe3O4, Mn2O7,CrO3
例如Mn2O7,CrO3
例如CO,NO2
三非一定
③ 根据酸能电离出的氢离子数:一元酸、二元酸、多元酸
盐酸(HCl)、硝酸(HNO3)、硼酸 (H3BO3)、硫酸(H2SO4)、碳酸(H2CO3)、 磷酸(H3PO4)
(3)酸的分类
① 根据是否含氧:含氧酸、无氧酸
命名:含氧酸——某酸(注意:HNO3硝酸),无氧酸——氢某酸(例如盐酸是HCl气体水溶液)
② 根据酸的电离程度不同:强酸、弱酸
强酸制弱酸: 2HCl + CaCO3 =2H2O + CO2↑+ H2O
③ 按电离能力分:强碱、弱碱;
强碱:KOH、NaOH、Ca(OH)2、Ba(OH)2
弱碱:NH3·H2O+难溶性的碱
(4)碱的分类
① 按碱分子电离出氢氧根离子的个数分:
一元碱、二元碱、多元碱,NaOH、Ca(OH)2、Fe(OH)3;
② 按溶解性分:可溶性碱、难溶性碱;
可溶性碱:KOH、NaOH、Ca(OH)2、Ba(OH)2、NH3·H2O
难溶性碱:绝大部分的碱都难溶于水
(5)盐的分类
① 按是否含有氧元素:
② 按酸碱中和反应程度:
----某化某
含氧酸盐
无氧酸盐
Na2SO4
NaCl
命名
----某酸某
正盐
酸式盐
碱式盐
碳酸钠Na2CO3 硫酸钠Na2SO4
酸氢钠NaHCO3 硫酸氢钠NaHSO4
碱式碳酸铜Cu2(OH)2CO3 碱式氯化镁Mg(OH)Cl
③复盐:
硫酸铝钾:KAl(SO4)2·12H2O
硫酸亚铁铵:(NH4)2Fe(SO4)2
由两种阳离子金属离子(或铵根离子)和一种酸根离子构成的盐。
【典例精讲】
6.下列物质不属于酸性氧化物的是( )
7.下列关于氧化物的叙述正确的是( )
A.金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
B.碱性氧化物一定是金属氧化物
C.碱性氧化物都能与水化合生成碱
D.酸性氧化物一定是非金属氧化物
A.SO3 B.CO2 C.CO D.P2O5
B
C
8.下列各组物质,按混合物、酸、碱、盐、氧化物顺序排列的是( )
A.食用盐、硝酸、熟石灰、纯碱、四氧化三铁
B.盐酸、硫酸、纯碱、胆矾、一氧化氮
C.氨水、氯化氢、苛性钠、生石灰、干冰
D.碘酒、食用醋、烧碱、绿矾、石灰石
A
9.下列每组物质中都有一种物质与其他物质在分类上不同。试分析每组中物质的组成规律,将这种不同于其他物质的物质找出来填在横线上。
① NaCl、KCl、NaClO、BaCl2__________;
② HClO3、KClO3、Cl2、NaClO3___________;
③ H3PO4、H4SiO4、HCl、H2SO4________;
④ 铜、金、汞、钠_____________________;
⑤ 空气、N2、HCl气体、CuSO45H2O晶体_____________________。
NaClO
Cl2
HCl
汞
空气
