1.2 课时2 有机化合物分子式和分子结构的确定 课件 (共28张PPT) 2024-2025学年人教版(2019)高中化学选择性必修3
文档属性
| 名称 | 1.2 课时2 有机化合物分子式和分子结构的确定 课件 (共28张PPT) 2024-2025学年人教版(2019)高中化学选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-15 00:00:00 | ||
图片预览







文档简介
(共28张PPT)
有机化合物分子式和分子结构的确定
第一章 有机物的结构特点与研究方法
1.掌握李比希提出的燃烧有机物对产物的定量测定确定实验式;
2.了解质谱法确定分子式的原理与方法;
3.知道红外光谱、核磁共振等现代仪器分析方法在有机物分子结构测定中的应用。
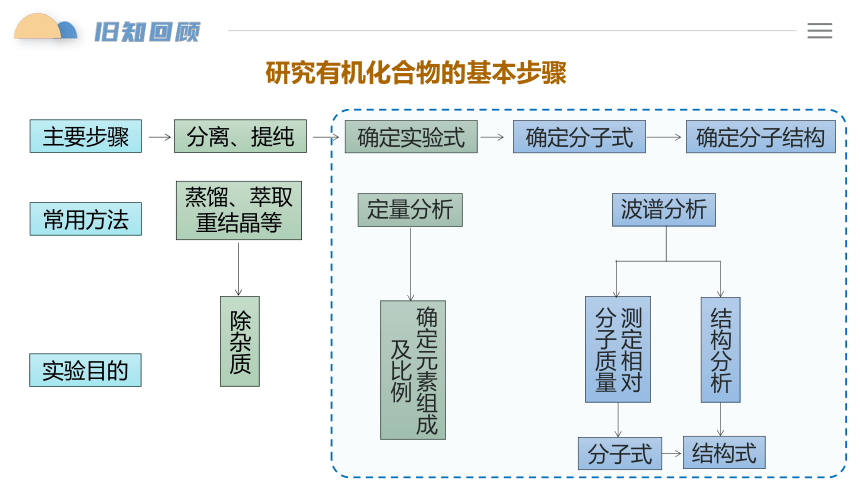
研究有机化合物的基本步骤
主要步骤
分离、提纯
波谱分析
除杂质
定量分析
确定元素组成及比例
测定相对
分子质量
分子式
结构分析
结构式
确定实验式
确定分子式
确定分子结构
常用方法
蒸馏、萃取
重结晶等
实验目的
元素分析
化学方法
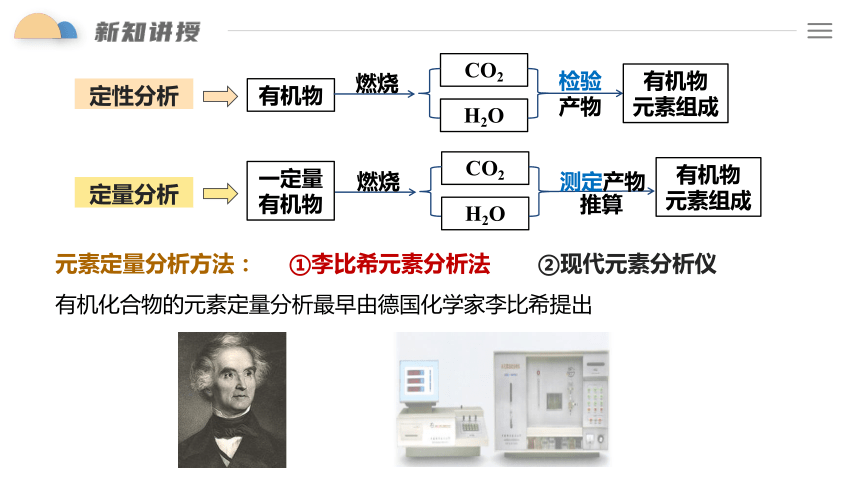
定量分析
定性分析
确定有机物的元素组成
一般是将一定量的有机物燃烧,转化为简单的无机物
原理:通过无机物的质量推算出该有机物所含各元素的质量分数,然后计算出该有机物分子内各元素原子的最简整数比,确定其实验式(也称最简式)。
有机物
燃烧
CO2
H2O
检验产物
有机物
元素组成
一定量
有机物
燃烧
CO2
H2O
测定产物
有机物
元素组成
推算
定性分析
定量分析
元素定量分析方法:
①李比希元素分析法
②现代元素分析仪
有机化合物的元素定量分析最早由德国化学家李比希提出
一 、确定实验式
1、李比希元素分析法
取一定量仅含C、H、O的有机物
加CuO
氧化
CO2
H2O
测得前后的质量差
用无水CaCl2
吸收
用KOH浓溶液吸收
计算C、H原子质量分数
剩余得为O原子的质量分数
测得前后的质量差
图1 李比希法设备图
吸收H2O
吸收CO2
根据吸收剂在吸收前后的质量差,计算出有机化合物中碳、氢元素的质量分数,剩余的就是氧元素的质量分数,据此计算可以得到有机化合物的实验式
若m(有机物) = m(C)+m(H),
则说明该有机物中只含C、H
若m(有机物)>m(C)+m(H)且完全燃烧只生成CO2和H2O,则说明有O。
C→CO2
H→H2O
N→N2
S→SO2
Cl→HCl
对李比希元素分析法的几点思考
(2)有人提出用CaCl2或浓硫酸替Mg(ClO4) 2,请说明替代Mg(ClO4) 2 物质的基本条件 。
(3)氧气的作用主要是 。
(4)为了提高实验的准确性,此装置还需要完善,请指出需要完善的地方
(1)氧化铜的作用主要是 。
只吸收水,不吸收CO2
氧化样品,将产物全部排入吸收装置
a.在吸收剂之间加一个检验水是否吸收完全的装置
b.在最后再加一个装有碱石灰的干燥管防止空气中的二氧化碳和水进入。
确保碳元素被氧化成CO 2
1.正误判断
(1)验证有机物属于烃时只需测定产物中的CO2和H2O的物质的量之比( )
(2)有机物燃烧后只生成CO2和H2O的物质不一定只含有碳、氢两种元素( )
(3)有机物的实验式、分子式一定不同( )
(4)元素分析法和质谱法能分别确定有机物的实验式和相对分子质量( )
(5)质谱图中最右边的谱线表示的数值为该有机物的相对分子质量( )
×
√
×
√
√
应用探究
【例1】含C、H、O三元素的未知物A,经燃烧分析实验测定该未知物中碳的质量分数为52.2%,氢的质量分数为13.1%。试求该未知物A的实验式。
(2)再求各元素原子的个数比:
(1)先确定该有机化合物中氧元素的质量分数:
ω(O)=100%-52.2%-13.1%=34.7%
N(C):N(H):N(O)=
52.2%
12.01
13.1%
1.008
34.7%
16.00
:
:
=2:6:1
【答】该未知物A的实验式为C2H6O。
思路点拨
不能提前四舍五入,会引起误差较大。
应用探究
【例2】某有机物5.8 g完全燃烧,生成CO2 13.2 g , H2O5.4 g 。含有哪些元素
n(C) =
= 0.3mol
n(H) =
= 0.6mol
m(O) =
= 1.6 g
5.8 – 3.6 – 0.6
n(O) =
= 0.1mol
N(C)∶N(H)∶N(O)=0.3:0.6:0.1
=3∶6∶1
∴实验式为 C3H6O
有机物的实验式:
有没有O元素?
现代元素分析仪
元素定量分析只能确定有机化合物分子中各组成原子的最简整数比,得到实验式。要确定它的分子式,还必须知道其相对分子质量。
目前有许多测定相对分子质量的方法,质谱法是其中最精确而快捷的方法。
可以直接测出有机物中各元素原子的质量分数
二、确定分子式
质谱法
元素定量分析
实验式
各组成原子的
最简整数比
分子式
其中最精确、快捷的方法
相对分子质量
质谱法
质谱仪
计算法
1.质谱法——相对分子质量的测定
有机物分子
确定相对分子质量
离子的质荷比
高能电子
流轰击
带正电荷的分子离子和碎片离子
磁场作用下先后到达检测仪
质谱图
质荷比=
电荷
相对分子质量
2. 应用:
已测得某未知物A的实验式为C2H6O,其质谱图如下图所示,
求A的相对分子质量?
未知物A的质谱图
质谱图中,读数方法:
相对分子质量=最大质荷比=最右边的分子离子峰
A的相对分子质量:46
思考:回顾所学知识,有哪些方法可以求相对分子质量?
(1)定义法:M = m / n
(6) 质谱法——测定相对分子质量的方法很多,质谱法是最精确、最快捷的方法。
(3)标准状况密度法:已知标准状况下气体的密度ρ,求算摩尔质量。
M=ρ×22.4 L·mol-1。
(2)根据有机物蒸气的相对密度 D
D =
=
(5)利用各类有机物的分子通式及相应的化学反应方程式
(4)混合气体平均摩尔质量:
依据质谱图:
未知物A的相对分子质量为46,实验式C2H6O的相对分子质量是46,
二甲醚
乙醇
写出C2H6O可能的结构:
怎样确定有机物A是二甲醚,还是乙醇?
M=[M (C2H6O)] ×n, n=1,所以未知物A的实验式 和分子式都是C2H6O 。
化学方法:看是否与Na反应
物理方法:红外光谱法等
红外光谱仪
核磁共振波谱仪
X射线衍射仪
确定比较复杂的有机化合物的分子结构,仅靠质谱法是很难完成的,需要借助其他现代分析仪器,进行红外光谱、核磁共振氢谱和X射线衍射等分析
波谱分析
三、确定分子结构
如分子式为C2H6O的有机物A有如下两种可能的结构,利用红外光谱来测定,分子中有O—H(或—OH)可确定A的结构简式为 。
1、红外光谱
(2)红外光谱图
(1)原理:不同官能团或化学键吸收频率不同,在红外光谱图上将处于不同的位置。
CH3CH2OH
未知物A的红外光谱图
——测定有机物分子中化学键或官能团。
2、核磁共振氢谱
——测定有机物分子中氢原子的种类和数目。
吸收峰面积比=氢原子数目比
吸收峰数目=氢原子种类
氢原子核具有磁性。处于不同化学环境中的氢原子因产生共振时吸收的频率不同,在谱图上出现的位置也不同。且吸收峰的面积与氢原子数成正比。
(1)原理:
(2)核磁共振氢谱:
2、核磁共振氢谱
——等效氢原子种类和数目
【例】有机物A的分子式为C2H6O,核磁共振氢谱如下:
吸收峰数目为3,说明有3种不同位置的氢原子
各吸收峰面积比为3∶2∶1
A为CH3CH2OH
吸收峰数目为1,说明有1种类型的氢原子
A为CH3OCH3
下列有机物中有几种H原子以及个数之比?
2种;9∶1
1种
3种;3∶2∶1
4种;
3∶2∶1∶6
CH3-CH-CH3
CH3
CH3-C-CH3
CH3
CH3
CH3-CH2-CH-CH3
CH3
CH3-CH2-OH
Br Br
CH2-CH2
化合物A和B的分子式都是C2H4Br2,A的NMR谱上只有1个峰,则A的结构简式为 .
3、X射线衍射
—有机化合物晶体结构的测定
(1) 原理:
X射线是一种波长很短的电磁波,它和晶体中的原子相互作用可以产生衍射图 。
X射线衍射仪
(2)衍射图:
根据原子坐标,可以计算原子间的距离,判断哪些原子之间存在化学键,确定键长和键角,得出分子的空间结构。
单晶衍射图
20世纪70年代初,我国屠呦呦等科学家使用乙醚从中药中提取并用柱色谱分离得到抗疟疾有效成分青蒿素。科学家们通过元素分析和质谱法分析,确定了青蒿素的相对分子质量为282,分子式为C15H22O5。经红外光谱和核磁共振谱分析,确定青蒿素分子结构中含有酯基和甲基等结构片段。通过化学反应证明其分子中含有过氧基团(—O—O—)。1975年底,中国科学院的科学家通过X射线衍射最终测定了青蒿素的分子结构。
【化学史话】
青蒿素结构的测定
青蒿素结构式
确定有机化合物结构的方法
1.正误判断
(1)核磁共振氢谱中有几组吸收峰就有几个氢原子( )
(2)质谱法、红外光谱法和核磁共振氢谱法均能确定有机化合物的分子结构 ( )
(3)CH3COOCH3在核磁共振氢谱图中只有一组吸收峰( )
(4)质谱图中,相对丰度数值最大的质荷比等于相对分子质量( )
(5)X射线衍射技术用于有机化合物晶体结构的测定,可以获得直接而详尽的结构信息( )
×
×
×
×
√
A.由红外光谱可知,该有机物分子中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子
C.仅由核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的分子式为C3H8O,则其结构简式可能为
2.已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法错误的是( )
D
3.有机物X是一种重要的有机合成中间体,用于制造塑料、涂料和黏合剂等高聚物。为研究X的组成与结构,进行如下实验:
(1)将10.0 g X在足量O2中充分燃烧,并将其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。有机物X的实验式为___________。
C5H8O2
n(H)=×2=0.8 mol
m(H2O)=7.2 g
m(CO2)=22.0 g
n(C)==0.5 mol
n(O)==0.2 mol
N(C):N(H):N(O)
= 0.5 mo:0.8 mol:0.2 mol
= 5:8:2
有机化合物分子式和分子结构的确定
第一章 有机物的结构特点与研究方法
1.掌握李比希提出的燃烧有机物对产物的定量测定确定实验式;
2.了解质谱法确定分子式的原理与方法;
3.知道红外光谱、核磁共振等现代仪器分析方法在有机物分子结构测定中的应用。
研究有机化合物的基本步骤
主要步骤
分离、提纯
波谱分析
除杂质
定量分析
确定元素组成及比例
测定相对
分子质量
分子式
结构分析
结构式
确定实验式
确定分子式
确定分子结构
常用方法
蒸馏、萃取
重结晶等
实验目的
元素分析
化学方法
定量分析
定性分析
确定有机物的元素组成
一般是将一定量的有机物燃烧,转化为简单的无机物
原理:通过无机物的质量推算出该有机物所含各元素的质量分数,然后计算出该有机物分子内各元素原子的最简整数比,确定其实验式(也称最简式)。
有机物
燃烧
CO2
H2O
检验产物
有机物
元素组成
一定量
有机物
燃烧
CO2
H2O
测定产物
有机物
元素组成
推算
定性分析
定量分析
元素定量分析方法:
①李比希元素分析法
②现代元素分析仪
有机化合物的元素定量分析最早由德国化学家李比希提出
一 、确定实验式
1、李比希元素分析法
取一定量仅含C、H、O的有机物
加CuO
氧化
CO2
H2O
测得前后的质量差
用无水CaCl2
吸收
用KOH浓溶液吸收
计算C、H原子质量分数
剩余得为O原子的质量分数
测得前后的质量差
图1 李比希法设备图
吸收H2O
吸收CO2
根据吸收剂在吸收前后的质量差,计算出有机化合物中碳、氢元素的质量分数,剩余的就是氧元素的质量分数,据此计算可以得到有机化合物的实验式
若m(有机物) = m(C)+m(H),
则说明该有机物中只含C、H
若m(有机物)>m(C)+m(H)且完全燃烧只生成CO2和H2O,则说明有O。
C→CO2
H→H2O
N→N2
S→SO2
Cl→HCl
对李比希元素分析法的几点思考
(2)有人提出用CaCl2或浓硫酸替Mg(ClO4) 2,请说明替代Mg(ClO4) 2 物质的基本条件 。
(3)氧气的作用主要是 。
(4)为了提高实验的准确性,此装置还需要完善,请指出需要完善的地方
(1)氧化铜的作用主要是 。
只吸收水,不吸收CO2
氧化样品,将产物全部排入吸收装置
a.在吸收剂之间加一个检验水是否吸收完全的装置
b.在最后再加一个装有碱石灰的干燥管防止空气中的二氧化碳和水进入。
确保碳元素被氧化成CO 2
1.正误判断
(1)验证有机物属于烃时只需测定产物中的CO2和H2O的物质的量之比( )
(2)有机物燃烧后只生成CO2和H2O的物质不一定只含有碳、氢两种元素( )
(3)有机物的实验式、分子式一定不同( )
(4)元素分析法和质谱法能分别确定有机物的实验式和相对分子质量( )
(5)质谱图中最右边的谱线表示的数值为该有机物的相对分子质量( )
×
√
×
√
√
应用探究
【例1】含C、H、O三元素的未知物A,经燃烧分析实验测定该未知物中碳的质量分数为52.2%,氢的质量分数为13.1%。试求该未知物A的实验式。
(2)再求各元素原子的个数比:
(1)先确定该有机化合物中氧元素的质量分数:
ω(O)=100%-52.2%-13.1%=34.7%
N(C):N(H):N(O)=
52.2%
12.01
13.1%
1.008
34.7%
16.00
:
:
=2:6:1
【答】该未知物A的实验式为C2H6O。
思路点拨
不能提前四舍五入,会引起误差较大。
应用探究
【例2】某有机物5.8 g完全燃烧,生成CO2 13.2 g , H2O5.4 g 。含有哪些元素
n(C) =
= 0.3mol
n(H) =
= 0.6mol
m(O) =
= 1.6 g
5.8 – 3.6 – 0.6
n(O) =
= 0.1mol
N(C)∶N(H)∶N(O)=0.3:0.6:0.1
=3∶6∶1
∴实验式为 C3H6O
有机物的实验式:
有没有O元素?
现代元素分析仪
元素定量分析只能确定有机化合物分子中各组成原子的最简整数比,得到实验式。要确定它的分子式,还必须知道其相对分子质量。
目前有许多测定相对分子质量的方法,质谱法是其中最精确而快捷的方法。
可以直接测出有机物中各元素原子的质量分数
二、确定分子式
质谱法
元素定量分析
实验式
各组成原子的
最简整数比
分子式
其中最精确、快捷的方法
相对分子质量
质谱法
质谱仪
计算法
1.质谱法——相对分子质量的测定
有机物分子
确定相对分子质量
离子的质荷比
高能电子
流轰击
带正电荷的分子离子和碎片离子
磁场作用下先后到达检测仪
质谱图
质荷比=
电荷
相对分子质量
2. 应用:
已测得某未知物A的实验式为C2H6O,其质谱图如下图所示,
求A的相对分子质量?
未知物A的质谱图
质谱图中,读数方法:
相对分子质量=最大质荷比=最右边的分子离子峰
A的相对分子质量:46
思考:回顾所学知识,有哪些方法可以求相对分子质量?
(1)定义法:M = m / n
(6) 质谱法——测定相对分子质量的方法很多,质谱法是最精确、最快捷的方法。
(3)标准状况密度法:已知标准状况下气体的密度ρ,求算摩尔质量。
M=ρ×22.4 L·mol-1。
(2)根据有机物蒸气的相对密度 D
D =
=
(5)利用各类有机物的分子通式及相应的化学反应方程式
(4)混合气体平均摩尔质量:
依据质谱图:
未知物A的相对分子质量为46,实验式C2H6O的相对分子质量是46,
二甲醚
乙醇
写出C2H6O可能的结构:
怎样确定有机物A是二甲醚,还是乙醇?
M=[M (C2H6O)] ×n, n=1,所以未知物A的实验式 和分子式都是C2H6O 。
化学方法:看是否与Na反应
物理方法:红外光谱法等
红外光谱仪
核磁共振波谱仪
X射线衍射仪
确定比较复杂的有机化合物的分子结构,仅靠质谱法是很难完成的,需要借助其他现代分析仪器,进行红外光谱、核磁共振氢谱和X射线衍射等分析
波谱分析
三、确定分子结构
如分子式为C2H6O的有机物A有如下两种可能的结构,利用红外光谱来测定,分子中有O—H(或—OH)可确定A的结构简式为 。
1、红外光谱
(2)红外光谱图
(1)原理:不同官能团或化学键吸收频率不同,在红外光谱图上将处于不同的位置。
CH3CH2OH
未知物A的红外光谱图
——测定有机物分子中化学键或官能团。
2、核磁共振氢谱
——测定有机物分子中氢原子的种类和数目。
吸收峰面积比=氢原子数目比
吸收峰数目=氢原子种类
氢原子核具有磁性。处于不同化学环境中的氢原子因产生共振时吸收的频率不同,在谱图上出现的位置也不同。且吸收峰的面积与氢原子数成正比。
(1)原理:
(2)核磁共振氢谱:
2、核磁共振氢谱
——等效氢原子种类和数目
【例】有机物A的分子式为C2H6O,核磁共振氢谱如下:
吸收峰数目为3,说明有3种不同位置的氢原子
各吸收峰面积比为3∶2∶1
A为CH3CH2OH
吸收峰数目为1,说明有1种类型的氢原子
A为CH3OCH3
下列有机物中有几种H原子以及个数之比?
2种;9∶1
1种
3种;3∶2∶1
4种;
3∶2∶1∶6
CH3-CH-CH3
CH3
CH3-C-CH3
CH3
CH3
CH3-CH2-CH-CH3
CH3
CH3-CH2-OH
Br Br
CH2-CH2
化合物A和B的分子式都是C2H4Br2,A的NMR谱上只有1个峰,则A的结构简式为 .
3、X射线衍射
—有机化合物晶体结构的测定
(1) 原理:
X射线是一种波长很短的电磁波,它和晶体中的原子相互作用可以产生衍射图 。
X射线衍射仪
(2)衍射图:
根据原子坐标,可以计算原子间的距离,判断哪些原子之间存在化学键,确定键长和键角,得出分子的空间结构。
单晶衍射图
20世纪70年代初,我国屠呦呦等科学家使用乙醚从中药中提取并用柱色谱分离得到抗疟疾有效成分青蒿素。科学家们通过元素分析和质谱法分析,确定了青蒿素的相对分子质量为282,分子式为C15H22O5。经红外光谱和核磁共振谱分析,确定青蒿素分子结构中含有酯基和甲基等结构片段。通过化学反应证明其分子中含有过氧基团(—O—O—)。1975年底,中国科学院的科学家通过X射线衍射最终测定了青蒿素的分子结构。
【化学史话】
青蒿素结构的测定
青蒿素结构式
确定有机化合物结构的方法
1.正误判断
(1)核磁共振氢谱中有几组吸收峰就有几个氢原子( )
(2)质谱法、红外光谱法和核磁共振氢谱法均能确定有机化合物的分子结构 ( )
(3)CH3COOCH3在核磁共振氢谱图中只有一组吸收峰( )
(4)质谱图中,相对丰度数值最大的质荷比等于相对分子质量( )
(5)X射线衍射技术用于有机化合物晶体结构的测定,可以获得直接而详尽的结构信息( )
×
×
×
×
√
A.由红外光谱可知,该有机物分子中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子
C.仅由核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的分子式为C3H8O,则其结构简式可能为
2.已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法错误的是( )
D
3.有机物X是一种重要的有机合成中间体,用于制造塑料、涂料和黏合剂等高聚物。为研究X的组成与结构,进行如下实验:
(1)将10.0 g X在足量O2中充分燃烧,并将其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。有机物X的实验式为___________。
C5H8O2
n(H)=×2=0.8 mol
m(H2O)=7.2 g
m(CO2)=22.0 g
n(C)==0.5 mol
n(O)==0.2 mol
N(C):N(H):N(O)
= 0.5 mo:0.8 mol:0.2 mol
= 5:8:2
