1.1 课时2 有机化合物中的共价键 课件 (共22张PPT) 2024-2025学年人教版(2019)高中化学选择性必修3
文档属性
| 名称 | 1.1 课时2 有机化合物中的共价键 课件 (共22张PPT) 2024-2025学年人教版(2019)高中化学选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 47.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-15 00:00:00 | ||
图片预览







文档简介
(共22张PPT)
有机化合物中的共价键
第一章 有机物的结构特点与研究方法
1.认识有机化合物分子结构中碳原子的成键和杂化类型,共价键 的类型及其分子的空间构型。
2.了解共价键极性及其与有机反应的关系。知道有机化合物分子中基团之间的相互影响会导致键的极性发生改变。
3.熟悉有机物结构的各种表示方法(2模6式)。
共价键的类型
σ键
π键
可绕键轴旋转
不能绕键轴旋转
有机化合物的共价键
双键中含有一个σ键和一个π键
单键是σ键
三键中含有一个σ键和两个π键
重叠程度较大,比较牢固
重叠程度较小,较易断裂
小技巧:任意两个成键原子之间有且只有一个σ键。
H
Cl
H
Cl
H
Cl
H H H H H2
Cl
Cl
Cl
Cl
Cl2
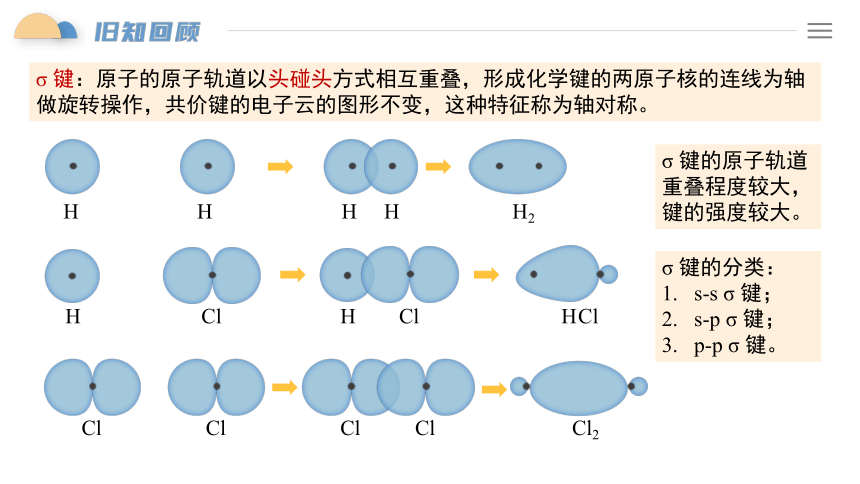
σ 键:原子的原子轨道以头碰头方式相互重叠,形成化学键的两原子核的连线为轴做旋转操作,共价键的电子云的图形不变,这种特征称为轴对称。
σ 键的原子轨道重叠程度较大,键的强度较大。
σ 键的分类:
s-s σ 键;
s-p σ 键;
p-p σ 键。
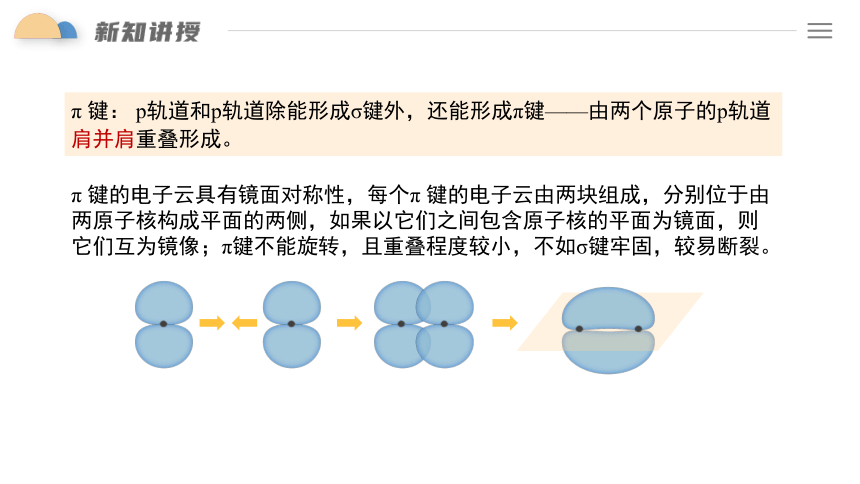
π 键: p轨道和p轨道除能形成σ键外,还能形成π键——由两个原子的p轨道肩并肩重叠形成。
π 键的电子云具有镜面对称性,每个π 键的电子云由两块组成,分别位于由两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,则它们互为镜像;π键不能旋转,且重叠程度较小,不如σ键牢固,较易断裂。
一、有机化合物中的共价键
1.共价键的类型
(1)σ键
甲烷分子中的C—H和乙烷分子中的C—C都是σ键。
在甲烷分子中,氢原子的1s轨道与碳原子的一个sp3杂化轨道沿着两个原子核间的键轴,以“头碰头”的形式相互重叠,形成σ键。
通过σ键连接的原子或原子团可绕键轴旋转而不会导致化学键的破坏。
4 + →
H C CH4
一、有机化合物中的共价键
1.共价键的类型
(2)π键
在乙烯分子中,两个碳原子均以sp2杂化轨道与氢原子的1s轨道及另一个碳原子的sp2杂化轨道进行重叠,形成4个C—H σ键与一个C—C σ键;两个碳原子未参与杂化的p轨道以“肩并肩”的形式从侧面重叠,形成了π键。
π键的轨道重叠程度比σ键的小,所以不如σ键牢固,比较容易断裂而发生化学反应。通过π键连接的原子或原子团不能绕键轴旋转。
σ键
π键
乙烯分子中的σ键和π键
二、共价键极性与有机反应
由于不同的成键原子间电负性的差异,共用电子对会发生偏移。偏移的程度越大,共价键极性越强,在反应中越容易发生断裂。因此有机化合物的官能团及其邻近的化学键往往是发生化学反应的活性部位。
水和钠 无水乙醇和钠
实验原理
实验现象
剧烈程度 2Na+2H2O=2NaOH+H2↑
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
浮、熔、游、响、红
剧烈程度:H2O>CH3CH2OH
受乙基的影响,乙醇分子中氢氧键的极性比水分子氢氧键的极性弱,乙醇比水更难电离出氢离子
共价键极性越强,有机反应越容易发生。
【实验1—1】
“沉、气、静”
二、共价键极性与有机反应
除此之外,由于羟基中氧原子的电负性较大,乙醇分子中的碳氧键极性也较强,也可断裂,如乙醇与氢溴酸的反应。
共价键的断裂需要吸收能量,而且有机化合物分子中共价键断裂的位置存在多种可能。相对无机反应,有机反应一般反应速率较小,副反应较多,产物比较复杂,因此有机反应一般不书写 = ,而使用 → 。
二、共价键极性与有机反应
化学性质 与共价键极性的关系
乙醇能与钠反应 乙醇分子中的氢氧键极性较强,能够发生断裂
乙醇能与氢溴酸反应 羟基中氧原子的电负性较大,乙醇分子中的碳氧键极性也较强,反应中,碳氧键发生了断裂
原子间电负性的差异越大→共用电子对偏移的程度越大→共价键极性越强,在反应中越容易发生断裂→官能团及其邻近的化学键往往是发生化学反应的活性部位
乙醇、水与钠反应的剧烈程度不同
乙醇分子中氢氧键的极性比水分子中氢氧键的极性弱
拓展延伸
1.同样条件下,乙酸、无水乙醇、水分别与钠的反应剧烈程度比较?
乙酸 > 水 >乙醇
【解释】由于乙酸中羰基的吸电子效应,使其分子中H-O的极性比水中H-O的强,故乙酸具有弱酸性。
2.试从键的极性强弱角度比较甲酸、乙酸、丙酸的酸性强弱?
甲酸>乙酸>丙酸
结论:乙酸分子中的H-O的极性 > 水中的H-O的极性 >乙醇中的H-O的极性
【解释】烃基为推电子基团,烃基越长推电子效应越大,使羧基中的羟基极性越小,羧酸的酸性越弱。
请从化学键和官能团的角度分析下列反应中有机化合物的变化。
思考与讨论
化学键:甲烷分子中的C—H σ键能发生取代反应;
在乙烯分子中,碳碳双键含有π键能发生加成反应。
官能团:甲烷无官能团,一氯甲烷的官能团是碳氯键;
乙烯的官能团是碳碳双键,加成反应产物的官能团是碳溴键。
三、有机化合物的表示方法
两“模”
1.球棍模型
用球和棍表示原子间的结合方式
2.空间填充模型
用大小不同的小球表示原子间的空间连接方式
以乙烷(C2H6)为例
“六式”(以丙烯为例)
(4)结构式:
CH3 CH = CH2
(5)结构简式:
(6)键线式:
(1)分子式:
C3H6
C C =C H
H
H
H
H
H
C C C H
H
H
H
H
H
::
:
×·
×·
×·
×·
×·
×·
(3)电子式:
用元素符号和数字表示分子的原子构成的式子。
用·或×表示原子最外层电子的式子。
用“-” 表示一对共用电子对的式子。
省略部分或全部“-”的结构式。
省略碳和氢,只表示分子中键的连接方式和官能团,每个拐点和终点表示一个碳原子的式子。
CH2
(2)最简式(实验式):
表示分子式最简整数比的式子。
CH3CH2CH2OH
OH
有趣的化学
有机物分子组成和结构的表示方法
分子式
最简式
电子式
结构式
结构简式
键线式
碳骨架式
球棍模型
空间填充模型
只表示分子的组成,不能反映物质的结构.
只表示分子的部分组成,不能反映物质的结构.
既能表示分子的组成,
又能反映物质的结构.
但书写麻烦!
既能表示分子的组成,又能反映物质的结构.
只能表示碳原子的连接方式,不能表示分子组成!
既能表示分子的组成,又能反映物质的结构.
一般只用于题目分析,正规的书写表达时不用!
常用
有机化合物中的共价键
共价键的类型
共价键的极性和有机反应
σ键和π键
共价键的极性越强,
在反应中越易发生断裂
有机物结构的表示方法
两“模”
六“式”
2.关于乙醇结构方面的说法中正确的是( )
A.乙醇结构中有-OH,所以乙醇溶解于水,可以电离出OH-而显碱性
B.乙醇与乙酸反应生成乙酸乙酯,所以乙醇显碱性
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼
1.下列说法正确的是( )
A.π键是由两个原子的p轨道“头碰头”重叠形成的
B.σ键是镜面对称,而π键是轴对称
C.乙烷分子中的共价键全为σ键,而乙烯分子中含σ键和π键
D.H2分子中只含σ键,而Cl2分子中还含π键
C
D
(2)
CH3 – CH – C = CH – CHO
OH
CH2CH3
(3)
CH3 – CH – C ≡ C – CH3
CH3
(4) CH3CH2COOH
(5) CH3COOCH2CH3
3.写出下列有机物的键线式:
(1)
CH3 – CH –CH2 – CH = CH – CH3
CH3
Cl
O
O
=
4.写出下列有机物的结构简式:
(1)上述表示方法中,属于结构式的为 ,属于键线式的为 ,属于空间填充模型的为 ,属于球棍模型的为 。
(2)写出⑨的分子式: 。
(3)写出⑩中官能团的结构简式: 、 。
(4)②的分子式为 ,最简式为 。
⑩
②⑥⑨
⑤
⑧
C11H18O2
—OH
—CHO
C6H12
CH2
5.有机化合物的表示方法多种多样,下面是常用的几种表示方法:
有机化合物中的共价键
第一章 有机物的结构特点与研究方法
1.认识有机化合物分子结构中碳原子的成键和杂化类型,共价键 的类型及其分子的空间构型。
2.了解共价键极性及其与有机反应的关系。知道有机化合物分子中基团之间的相互影响会导致键的极性发生改变。
3.熟悉有机物结构的各种表示方法(2模6式)。
共价键的类型
σ键
π键
可绕键轴旋转
不能绕键轴旋转
有机化合物的共价键
双键中含有一个σ键和一个π键
单键是σ键
三键中含有一个σ键和两个π键
重叠程度较大,比较牢固
重叠程度较小,较易断裂
小技巧:任意两个成键原子之间有且只有一个σ键。
H
Cl
H
Cl
H
Cl
H H H H H2
Cl
Cl
Cl
Cl
Cl2
σ 键:原子的原子轨道以头碰头方式相互重叠,形成化学键的两原子核的连线为轴做旋转操作,共价键的电子云的图形不变,这种特征称为轴对称。
σ 键的原子轨道重叠程度较大,键的强度较大。
σ 键的分类:
s-s σ 键;
s-p σ 键;
p-p σ 键。
π 键: p轨道和p轨道除能形成σ键外,还能形成π键——由两个原子的p轨道肩并肩重叠形成。
π 键的电子云具有镜面对称性,每个π 键的电子云由两块组成,分别位于由两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,则它们互为镜像;π键不能旋转,且重叠程度较小,不如σ键牢固,较易断裂。
一、有机化合物中的共价键
1.共价键的类型
(1)σ键
甲烷分子中的C—H和乙烷分子中的C—C都是σ键。
在甲烷分子中,氢原子的1s轨道与碳原子的一个sp3杂化轨道沿着两个原子核间的键轴,以“头碰头”的形式相互重叠,形成σ键。
通过σ键连接的原子或原子团可绕键轴旋转而不会导致化学键的破坏。
4 + →
H C CH4
一、有机化合物中的共价键
1.共价键的类型
(2)π键
在乙烯分子中,两个碳原子均以sp2杂化轨道与氢原子的1s轨道及另一个碳原子的sp2杂化轨道进行重叠,形成4个C—H σ键与一个C—C σ键;两个碳原子未参与杂化的p轨道以“肩并肩”的形式从侧面重叠,形成了π键。
π键的轨道重叠程度比σ键的小,所以不如σ键牢固,比较容易断裂而发生化学反应。通过π键连接的原子或原子团不能绕键轴旋转。
σ键
π键
乙烯分子中的σ键和π键
二、共价键极性与有机反应
由于不同的成键原子间电负性的差异,共用电子对会发生偏移。偏移的程度越大,共价键极性越强,在反应中越容易发生断裂。因此有机化合物的官能团及其邻近的化学键往往是发生化学反应的活性部位。
水和钠 无水乙醇和钠
实验原理
实验现象
剧烈程度 2Na+2H2O=2NaOH+H2↑
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
浮、熔、游、响、红
剧烈程度:H2O>CH3CH2OH
受乙基的影响,乙醇分子中氢氧键的极性比水分子氢氧键的极性弱,乙醇比水更难电离出氢离子
共价键极性越强,有机反应越容易发生。
【实验1—1】
“沉、气、静”
二、共价键极性与有机反应
除此之外,由于羟基中氧原子的电负性较大,乙醇分子中的碳氧键极性也较强,也可断裂,如乙醇与氢溴酸的反应。
共价键的断裂需要吸收能量,而且有机化合物分子中共价键断裂的位置存在多种可能。相对无机反应,有机反应一般反应速率较小,副反应较多,产物比较复杂,因此有机反应一般不书写 = ,而使用 → 。
二、共价键极性与有机反应
化学性质 与共价键极性的关系
乙醇能与钠反应 乙醇分子中的氢氧键极性较强,能够发生断裂
乙醇能与氢溴酸反应 羟基中氧原子的电负性较大,乙醇分子中的碳氧键极性也较强,反应中,碳氧键发生了断裂
原子间电负性的差异越大→共用电子对偏移的程度越大→共价键极性越强,在反应中越容易发生断裂→官能团及其邻近的化学键往往是发生化学反应的活性部位
乙醇、水与钠反应的剧烈程度不同
乙醇分子中氢氧键的极性比水分子中氢氧键的极性弱
拓展延伸
1.同样条件下,乙酸、无水乙醇、水分别与钠的反应剧烈程度比较?
乙酸 > 水 >乙醇
【解释】由于乙酸中羰基的吸电子效应,使其分子中H-O的极性比水中H-O的强,故乙酸具有弱酸性。
2.试从键的极性强弱角度比较甲酸、乙酸、丙酸的酸性强弱?
甲酸>乙酸>丙酸
结论:乙酸分子中的H-O的极性 > 水中的H-O的极性 >乙醇中的H-O的极性
【解释】烃基为推电子基团,烃基越长推电子效应越大,使羧基中的羟基极性越小,羧酸的酸性越弱。
请从化学键和官能团的角度分析下列反应中有机化合物的变化。
思考与讨论
化学键:甲烷分子中的C—H σ键能发生取代反应;
在乙烯分子中,碳碳双键含有π键能发生加成反应。
官能团:甲烷无官能团,一氯甲烷的官能团是碳氯键;
乙烯的官能团是碳碳双键,加成反应产物的官能团是碳溴键。
三、有机化合物的表示方法
两“模”
1.球棍模型
用球和棍表示原子间的结合方式
2.空间填充模型
用大小不同的小球表示原子间的空间连接方式
以乙烷(C2H6)为例
“六式”(以丙烯为例)
(4)结构式:
CH3 CH = CH2
(5)结构简式:
(6)键线式:
(1)分子式:
C3H6
C C =C H
H
H
H
H
H
C C C H
H
H
H
H
H
::
:
×·
×·
×·
×·
×·
×·
(3)电子式:
用元素符号和数字表示分子的原子构成的式子。
用·或×表示原子最外层电子的式子。
用“-” 表示一对共用电子对的式子。
省略部分或全部“-”的结构式。
省略碳和氢,只表示分子中键的连接方式和官能团,每个拐点和终点表示一个碳原子的式子。
CH2
(2)最简式(实验式):
表示分子式最简整数比的式子。
CH3CH2CH2OH
OH
有趣的化学
有机物分子组成和结构的表示方法
分子式
最简式
电子式
结构式
结构简式
键线式
碳骨架式
球棍模型
空间填充模型
只表示分子的组成,不能反映物质的结构.
只表示分子的部分组成,不能反映物质的结构.
既能表示分子的组成,
又能反映物质的结构.
但书写麻烦!
既能表示分子的组成,又能反映物质的结构.
只能表示碳原子的连接方式,不能表示分子组成!
既能表示分子的组成,又能反映物质的结构.
一般只用于题目分析,正规的书写表达时不用!
常用
有机化合物中的共价键
共价键的类型
共价键的极性和有机反应
σ键和π键
共价键的极性越强,
在反应中越易发生断裂
有机物结构的表示方法
两“模”
六“式”
2.关于乙醇结构方面的说法中正确的是( )
A.乙醇结构中有-OH,所以乙醇溶解于水,可以电离出OH-而显碱性
B.乙醇与乙酸反应生成乙酸乙酯,所以乙醇显碱性
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼
1.下列说法正确的是( )
A.π键是由两个原子的p轨道“头碰头”重叠形成的
B.σ键是镜面对称,而π键是轴对称
C.乙烷分子中的共价键全为σ键,而乙烯分子中含σ键和π键
D.H2分子中只含σ键,而Cl2分子中还含π键
C
D
(2)
CH3 – CH – C = CH – CHO
OH
CH2CH3
(3)
CH3 – CH – C ≡ C – CH3
CH3
(4) CH3CH2COOH
(5) CH3COOCH2CH3
3.写出下列有机物的键线式:
(1)
CH3 – CH –CH2 – CH = CH – CH3
CH3
Cl
O
O
=
4.写出下列有机物的结构简式:
(1)上述表示方法中,属于结构式的为 ,属于键线式的为 ,属于空间填充模型的为 ,属于球棍模型的为 。
(2)写出⑨的分子式: 。
(3)写出⑩中官能团的结构简式: 、 。
(4)②的分子式为 ,最简式为 。
⑩
②⑥⑨
⑤
⑧
C11H18O2
—OH
—CHO
C6H12
CH2
5.有机化合物的表示方法多种多样,下面是常用的几种表示方法:
