1.2 课时1 分离、提纯 课件 (共26张PPT) 2024-2025学年人教版(2019)高中化学选择性必修3
文档属性
| 名称 | 1.2 课时1 分离、提纯 课件 (共26张PPT) 2024-2025学年人教版(2019)高中化学选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 19.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-15 00:00:00 | ||
图片预览






文档简介
(共26张PPT)
分离、提纯
第一章 有机物的结构特点与研究方法
1.了解研究有机化合物的一般方法,能说出研究有
机化合物的主要步骤。
2.熟记蒸馏法、萃取法的实验原理和基本操作。
青蒿
乙醚提取
如何从青蒿素提取物中分离乙醚和青蒿素呢?
物质 熔点/℃ 沸点/℃
乙醚 -166.2 34.5
青蒿素 156-157 389.9
分离、提纯
确定实验式
确定分子式
确定分子结构
蒸馏、
萃取、
重结晶等
元素定量分析
质谱法
波谱分析:
质谱、红外光谱、
核磁共振氢谱、
X射线衍射等
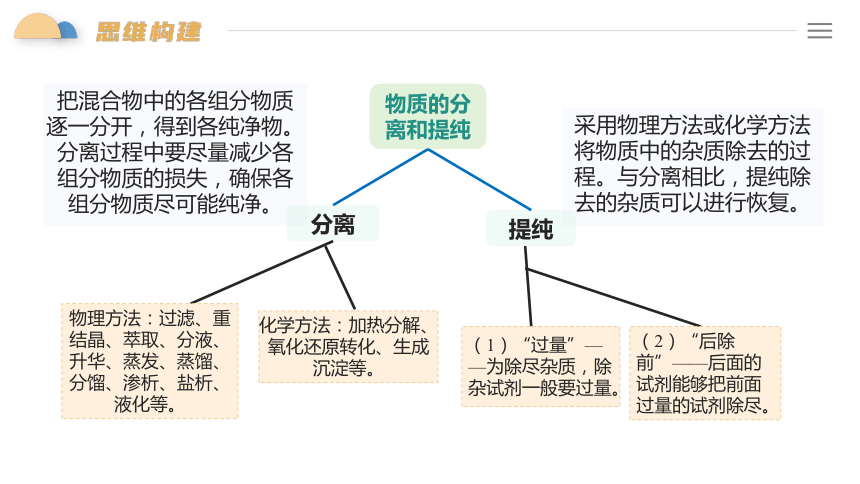
采用物理方法或化学方法将物质中的杂质除去的过程。与分离相比,提纯除去的杂质可以进行恢复。
把混合物中的各组分物质逐一分开,得到各纯净物。分离过程中要尽量减少各组分物质的损失,确保各组分物质尽可能纯净。
物质的分离和提纯
分离
提纯
物理方法:过滤、重结晶、萃取、分液、升华、蒸发、蒸馏、分馏、渗析、盐析、液化等。
化学方法:加热分解、氧化还原转化、生成沉淀等。
(1)“过量”——为除尽杂质,除杂试剂一般要过量。
(2)“后除前”——后面的试剂能够把前面过量的试剂除尽。
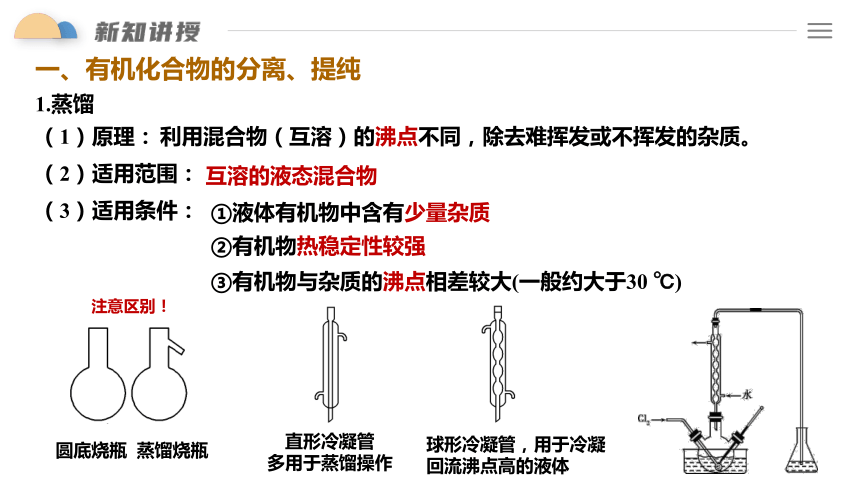
一、有机化合物的分离、提纯
(2)适用范围:
互溶的液态混合物
③有机物与杂质的沸点相差较大(一般约大于30 ℃)
(3)适用条件:
①液体有机物中含有少量杂质
②有机物热稳定性较强
(1)原理:
利用混合物(互溶)的沸点不同,除去难挥发或不挥发的杂质。
直形冷凝管
多用于蒸馏操作
球形冷凝管,用于冷凝回流沸点高的液体
圆底烧瓶
蒸馏烧瓶
注意区别!
1.蒸馏
(4)蒸馏装置
牛角管
气化
冷凝
接收
测量蒸汽的温度,温度计水银球的位置在蒸馏烧瓶支管口处
冷凝管中水的流向:
下口流入,上口流出
(5)注意事项
蒸馏烧瓶中液体量不得超过容积的2/3
投放沸石或碎瓷片防暴沸
烧瓶底
垫陶土网
蒸馏烧瓶
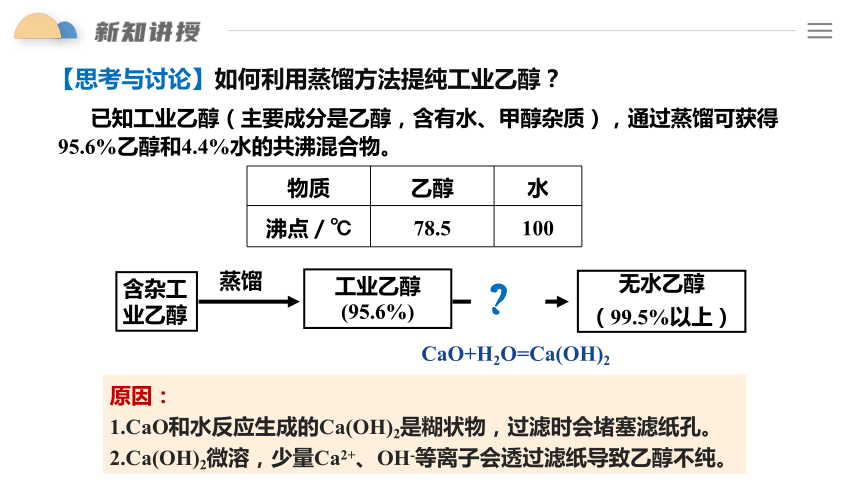
【思考与讨论】如何利用蒸馏方法提纯工业乙醇?
物质 乙醇 水
沸点/℃ 78.5 100
含杂工业乙醇
工业乙醇(95.6%)
无水乙醇
(99.5%以上)
蒸馏
加CaO
蒸馏
?
已知工业乙醇(主要成分是乙醇,含有水、甲醇杂质),通过蒸馏可获得95.6%乙醇和4.4%水的共沸混合物。
固液混合物分离为什么不用过滤而用蒸馏呢?
原因:
1.CaO和水反应生成的Ca(OH)2是糊状物,过滤时会堵塞滤纸孔。
2.Ca(OH)2微溶,少量Ca2+、OH-等离子会透过滤纸导致乙醇不纯。
CaO+H2O=Ca(OH)2
下列关于蒸馏的实验操作说法正确的是( )
A.蒸馏的原理是利用混合物中各组分的沸点不同实现分离
B.蒸馏烧瓶可以用酒精灯直接加热
C.开始蒸馏时,应该先加热,再通冷凝水;蒸馏完毕,应该先关冷
凝水,再撤酒精灯
D.甲烷与氯气发生取代反应得到的液态混合物可以用蒸馏法分离
AD
产物 二氯甲烷 三氯甲烷 四氯化碳
沸点 40℃ 62℃ 77℃
东晋葛洪的《肘后备急方》记载了“青蒿一握,以水二升渍,绞取汁,尽服之”,屠呦呦受其启发,利用乙醚提炼出抗疟有效成分青蒿素。开创了疟疾治疗新方法,全球数亿人因这种“中国神药”而受益,她因此荣获2015年诺贝尔生理学或医学奖。
萃取
固-液萃取
利用溶剂从固体物质中溶解出待分离组分的过程
液-液萃取
有机物在两种互不相溶溶剂中的溶解性不同,将有机物从一种溶剂转移到另一种溶剂中的过程。
一、有机化合物的分离、提纯
2.液-液萃取
可使用有机溶剂从水中萃取有机化合物。
萃取用的溶剂
(1)萃取剂:
选择条件
①萃取剂与原溶剂互不相溶、不发生化学反应
②溶质在两溶剂中的溶解度有较大差别
(在萃取剂中的溶解度大)
③溶质不与萃取剂发生任何反应
常用萃取剂:
乙醇不可做萃取剂!!!
:将萃取后两种互不相溶的液体分开的操作
(2)分液
密度小于水的:苯、乙醚、乙酸乙酯;
密度大于水的:二氯甲烷、四氯化碳等。
检漏
装液
振荡(注意放气)
静置分层
分液
萃取步骤 【例】用CCl4从碘水中提取I2
注意事项:
①分液漏斗通过打开上方的玻璃塞和下方的活塞(或:使玻璃塞上的凹槽与玻璃塞上的小孔相对)可将两层液体分离。
②分液漏斗下端尖嘴部分紧靠烧杯内壁。
③分液漏斗内液体的总体积不超过容积的2/3。
④分液漏斗使用前需检漏。
⑤分液时下层液体从下口放出,上层液体从上口倒出。
溶解、蒸发浓缩、冷却结晶、过滤
3.结晶和重结晶
如何除KNO3固体中少量NaCl固体
重结晶
状态变化 操作
结晶 aq→ s 蒸发结晶/冷却结晶
重结晶 s →aq→s 溶解、蒸发浓缩、冷却结晶
3.重结晶
(2)适用范围:
(3)溶剂选择:
②被提纯的有机化合物在此溶剂中的溶解度受温度影响较大,能够冷却结晶
①杂质在此溶剂中溶解度很小或者很大,易于除去。
如果重结晶所得的晶体纯度不能达到要求,可以再次进行重结晶以提高产物的纯度。
利用被提纯物质与杂质在同一溶剂中的溶解度不同而将其杂质除去的方法。
(1)原理:
固态有机混合物
【资料卡】苯甲酸可用作食品防腐剂,纯净的苯甲酸为无色结晶,其结构可表示为 ,熔点122℃,沸点249℃,苯甲酸微溶于水,易溶于乙醇等有机溶剂。苯甲酸、氯化钠在水中的溶解度如下:
温度 25℃ 50℃ 95℃
苯甲酸 0.34g 0.85g 6.8g
NaCl 36.0 37.0 39.1
【思考讨论】——结合课本P15实验操作步骤
1、某粗苯甲酸样品含有少量氯化钠和泥沙,应如何提纯?
2、选择该方法的依据是什么?
3.重结晶—提纯苯甲酸
称量
加热溶解
趁热过滤
冷却结晶
过滤洗涤、
干燥、称量
为了减少趁热过滤过程中损失的苯甲酸
实验操作中多次使用了玻璃棒,分别起到了哪些作用?
加热溶解——搅拌,加速苯甲酸溶解;
趁热过滤——引流;
冷却结晶后过滤——引流
实验记录与数据处理
项目 现象和数据 (1)对比提纯前后苯甲酸的状态 苯甲酸粗品
苯甲酸晶体
(2)对比过滤前后液体的状态 溶解苯甲酸粗品后的液体
趁热过滤后的滤液
(3)计算重结晶收率 苯甲酸粗品的质量/g
苯甲酸晶体的质量/g
重结晶收率=
晶体质量
粗品质量
×100%
白色粉末状(含难溶泥沙)
白色针状晶体
含泥沙的浑浊液体
澄清液体
1g
0.54g
54%
重结晶法提纯苯甲酸
苯甲酸、泥沙和食盐
滤液
滤渣
滤液
苯甲酸晶体
加水,加热,趁热过滤
苯甲酸、氯化钠
泥沙
氯化钠
冷却,结晶,
过滤,洗涤
不纯固体物质
残渣
(不溶性杂质)
母液
(可溶性杂质和部分被提纯物)
晶体
(产品)
溶于溶剂,制成饱和溶液,趁热过滤
思维建模
滤液
思考与讨论
加热:加快苯甲酸溶解。
趁热过滤:除去泥沙,并防止苯甲酸晶体低温析出。
(1)重结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?
泥沙难溶于水,氯化钠易溶于水,苯甲酸的溶解度受温度影响比较大。
步骤:加热溶解→趁热过滤→冷却结晶→过滤、洗涤→干燥→称重
(2)溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
(3)实验操作中多次使用了玻璃棒,分别起到了哪些作用?
玻璃棒:溶解时搅拌,加快溶解速度;过滤、洗涤时引流;
干燥时用于转移晶体
思考与讨论
取一烧杯收集n次洗涤后的滤液,滴加几滴硝酸银溶液,观察是否有沉淀产生。若无,则氯化钠被除尽。
(4)如何检验提纯后的苯甲酸中氯化钠已经被除净?
(5)温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好?
不是。若温度过低,杂质的溶解度也会降低而析出杂质;另外温度低于0℃,水结冰,给实验带来麻烦。
拓展应用
洗涤沉淀或晶体的方法:
检验洗涤效果:
用胶头滴管往晶体上加蒸馏水至晶体被浸没,待水完全流出后,重复2—3次,直到晶体被洗净。
结论(说明沉淀已经洗涤干净)
取样(取最后一次洗涤液少许于试管)
↓
加试剂【滴加××试剂(有必要时加热,如检验NH4+)】
↓
现象(不产生沉淀、溶液不变××色或不产生××气体)
↓
拓展延伸
色谱法
当样品随着流动相经过固定相时,因样品中不同组分在两相间的分配不同而实现分离的一类分离分析方法被称为色谱法。
让溶有绿色植物叶子色素的石油醚溶液自上而下地通过吸附剂。因吸附剂对不同色素吸附能力不同,所以分成三段不同颜色:绿色、黄色、黄绿色
色谱法成为分离、提纯有机物必不可少的方法。并发展出了纸上色谱法、薄层色谱法、气相色谱法和液相色谱法等。
分离提纯方法的选择:
液体混合物
蒸馏(沸点相差较大,30℃左右)
互溶
分液
不互溶
萃取
其中一种易溶于另一种溶剂
固体混合物
过滤
一种易溶于水,一种难溶于水
重结晶
(能溶于同一溶剂,但两种物质的溶解性有所差异)
1.下列物质中的杂质(括号中是杂质)分别可以用什么方法除去。
(1)酒精(水)
(2)KNO3 (NaCl)
(3)甲烷(乙烯)
(4)CO2(HCl)
(5)苯(水)
(6)NaCl(泥沙)
蒸馏
重结晶
溴水,洗气
分液
饱和NaHCO3溶液,洗气
过滤
2.现有一瓶A和B的混合液,已知A和B的某些性质如下表:
由此,分离A和B的最佳方法是( )
C
A.萃取 B.升华 C.蒸馏 D.分液
物质 分子式 熔点/℃ 沸点/℃ 密度/g·cm-3 水溶性
A C3H6O2 -98 57.5 0.93 可溶
B C4H8O2 -84 77 0.90 可溶
分离、提纯
第一章 有机物的结构特点与研究方法
1.了解研究有机化合物的一般方法,能说出研究有
机化合物的主要步骤。
2.熟记蒸馏法、萃取法的实验原理和基本操作。
青蒿
乙醚提取
如何从青蒿素提取物中分离乙醚和青蒿素呢?
物质 熔点/℃ 沸点/℃
乙醚 -166.2 34.5
青蒿素 156-157 389.9
分离、提纯
确定实验式
确定分子式
确定分子结构
蒸馏、
萃取、
重结晶等
元素定量分析
质谱法
波谱分析:
质谱、红外光谱、
核磁共振氢谱、
X射线衍射等
采用物理方法或化学方法将物质中的杂质除去的过程。与分离相比,提纯除去的杂质可以进行恢复。
把混合物中的各组分物质逐一分开,得到各纯净物。分离过程中要尽量减少各组分物质的损失,确保各组分物质尽可能纯净。
物质的分离和提纯
分离
提纯
物理方法:过滤、重结晶、萃取、分液、升华、蒸发、蒸馏、分馏、渗析、盐析、液化等。
化学方法:加热分解、氧化还原转化、生成沉淀等。
(1)“过量”——为除尽杂质,除杂试剂一般要过量。
(2)“后除前”——后面的试剂能够把前面过量的试剂除尽。
一、有机化合物的分离、提纯
(2)适用范围:
互溶的液态混合物
③有机物与杂质的沸点相差较大(一般约大于30 ℃)
(3)适用条件:
①液体有机物中含有少量杂质
②有机物热稳定性较强
(1)原理:
利用混合物(互溶)的沸点不同,除去难挥发或不挥发的杂质。
直形冷凝管
多用于蒸馏操作
球形冷凝管,用于冷凝回流沸点高的液体
圆底烧瓶
蒸馏烧瓶
注意区别!
1.蒸馏
(4)蒸馏装置
牛角管
气化
冷凝
接收
测量蒸汽的温度,温度计水银球的位置在蒸馏烧瓶支管口处
冷凝管中水的流向:
下口流入,上口流出
(5)注意事项
蒸馏烧瓶中液体量不得超过容积的2/3
投放沸石或碎瓷片防暴沸
烧瓶底
垫陶土网
蒸馏烧瓶
【思考与讨论】如何利用蒸馏方法提纯工业乙醇?
物质 乙醇 水
沸点/℃ 78.5 100
含杂工业乙醇
工业乙醇(95.6%)
无水乙醇
(99.5%以上)
蒸馏
加CaO
蒸馏
?
已知工业乙醇(主要成分是乙醇,含有水、甲醇杂质),通过蒸馏可获得95.6%乙醇和4.4%水的共沸混合物。
固液混合物分离为什么不用过滤而用蒸馏呢?
原因:
1.CaO和水反应生成的Ca(OH)2是糊状物,过滤时会堵塞滤纸孔。
2.Ca(OH)2微溶,少量Ca2+、OH-等离子会透过滤纸导致乙醇不纯。
CaO+H2O=Ca(OH)2
下列关于蒸馏的实验操作说法正确的是( )
A.蒸馏的原理是利用混合物中各组分的沸点不同实现分离
B.蒸馏烧瓶可以用酒精灯直接加热
C.开始蒸馏时,应该先加热,再通冷凝水;蒸馏完毕,应该先关冷
凝水,再撤酒精灯
D.甲烷与氯气发生取代反应得到的液态混合物可以用蒸馏法分离
AD
产物 二氯甲烷 三氯甲烷 四氯化碳
沸点 40℃ 62℃ 77℃
东晋葛洪的《肘后备急方》记载了“青蒿一握,以水二升渍,绞取汁,尽服之”,屠呦呦受其启发,利用乙醚提炼出抗疟有效成分青蒿素。开创了疟疾治疗新方法,全球数亿人因这种“中国神药”而受益,她因此荣获2015年诺贝尔生理学或医学奖。
萃取
固-液萃取
利用溶剂从固体物质中溶解出待分离组分的过程
液-液萃取
有机物在两种互不相溶溶剂中的溶解性不同,将有机物从一种溶剂转移到另一种溶剂中的过程。
一、有机化合物的分离、提纯
2.液-液萃取
可使用有机溶剂从水中萃取有机化合物。
萃取用的溶剂
(1)萃取剂:
选择条件
①萃取剂与原溶剂互不相溶、不发生化学反应
②溶质在两溶剂中的溶解度有较大差别
(在萃取剂中的溶解度大)
③溶质不与萃取剂发生任何反应
常用萃取剂:
乙醇不可做萃取剂!!!
:将萃取后两种互不相溶的液体分开的操作
(2)分液
密度小于水的:苯、乙醚、乙酸乙酯;
密度大于水的:二氯甲烷、四氯化碳等。
检漏
装液
振荡(注意放气)
静置分层
分液
萃取步骤 【例】用CCl4从碘水中提取I2
注意事项:
①分液漏斗通过打开上方的玻璃塞和下方的活塞(或:使玻璃塞上的凹槽与玻璃塞上的小孔相对)可将两层液体分离。
②分液漏斗下端尖嘴部分紧靠烧杯内壁。
③分液漏斗内液体的总体积不超过容积的2/3。
④分液漏斗使用前需检漏。
⑤分液时下层液体从下口放出,上层液体从上口倒出。
溶解、蒸发浓缩、冷却结晶、过滤
3.结晶和重结晶
如何除KNO3固体中少量NaCl固体
重结晶
状态变化 操作
结晶 aq→ s 蒸发结晶/冷却结晶
重结晶 s →aq→s 溶解、蒸发浓缩、冷却结晶
3.重结晶
(2)适用范围:
(3)溶剂选择:
②被提纯的有机化合物在此溶剂中的溶解度受温度影响较大,能够冷却结晶
①杂质在此溶剂中溶解度很小或者很大,易于除去。
如果重结晶所得的晶体纯度不能达到要求,可以再次进行重结晶以提高产物的纯度。
利用被提纯物质与杂质在同一溶剂中的溶解度不同而将其杂质除去的方法。
(1)原理:
固态有机混合物
【资料卡】苯甲酸可用作食品防腐剂,纯净的苯甲酸为无色结晶,其结构可表示为 ,熔点122℃,沸点249℃,苯甲酸微溶于水,易溶于乙醇等有机溶剂。苯甲酸、氯化钠在水中的溶解度如下:
温度 25℃ 50℃ 95℃
苯甲酸 0.34g 0.85g 6.8g
NaCl 36.0 37.0 39.1
【思考讨论】——结合课本P15实验操作步骤
1、某粗苯甲酸样品含有少量氯化钠和泥沙,应如何提纯?
2、选择该方法的依据是什么?
3.重结晶—提纯苯甲酸
称量
加热溶解
趁热过滤
冷却结晶
过滤洗涤、
干燥、称量
为了减少趁热过滤过程中损失的苯甲酸
实验操作中多次使用了玻璃棒,分别起到了哪些作用?
加热溶解——搅拌,加速苯甲酸溶解;
趁热过滤——引流;
冷却结晶后过滤——引流
实验记录与数据处理
项目 现象和数据 (1)对比提纯前后苯甲酸的状态 苯甲酸粗品
苯甲酸晶体
(2)对比过滤前后液体的状态 溶解苯甲酸粗品后的液体
趁热过滤后的滤液
(3)计算重结晶收率 苯甲酸粗品的质量/g
苯甲酸晶体的质量/g
重结晶收率=
晶体质量
粗品质量
×100%
白色粉末状(含难溶泥沙)
白色针状晶体
含泥沙的浑浊液体
澄清液体
1g
0.54g
54%
重结晶法提纯苯甲酸
苯甲酸、泥沙和食盐
滤液
滤渣
滤液
苯甲酸晶体
加水,加热,趁热过滤
苯甲酸、氯化钠
泥沙
氯化钠
冷却,结晶,
过滤,洗涤
不纯固体物质
残渣
(不溶性杂质)
母液
(可溶性杂质和部分被提纯物)
晶体
(产品)
溶于溶剂,制成饱和溶液,趁热过滤
思维建模
滤液
思考与讨论
加热:加快苯甲酸溶解。
趁热过滤:除去泥沙,并防止苯甲酸晶体低温析出。
(1)重结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?
泥沙难溶于水,氯化钠易溶于水,苯甲酸的溶解度受温度影响比较大。
步骤:加热溶解→趁热过滤→冷却结晶→过滤、洗涤→干燥→称重
(2)溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
(3)实验操作中多次使用了玻璃棒,分别起到了哪些作用?
玻璃棒:溶解时搅拌,加快溶解速度;过滤、洗涤时引流;
干燥时用于转移晶体
思考与讨论
取一烧杯收集n次洗涤后的滤液,滴加几滴硝酸银溶液,观察是否有沉淀产生。若无,则氯化钠被除尽。
(4)如何检验提纯后的苯甲酸中氯化钠已经被除净?
(5)温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好?
不是。若温度过低,杂质的溶解度也会降低而析出杂质;另外温度低于0℃,水结冰,给实验带来麻烦。
拓展应用
洗涤沉淀或晶体的方法:
检验洗涤效果:
用胶头滴管往晶体上加蒸馏水至晶体被浸没,待水完全流出后,重复2—3次,直到晶体被洗净。
结论(说明沉淀已经洗涤干净)
取样(取最后一次洗涤液少许于试管)
↓
加试剂【滴加××试剂(有必要时加热,如检验NH4+)】
↓
现象(不产生沉淀、溶液不变××色或不产生××气体)
↓
拓展延伸
色谱法
当样品随着流动相经过固定相时,因样品中不同组分在两相间的分配不同而实现分离的一类分离分析方法被称为色谱法。
让溶有绿色植物叶子色素的石油醚溶液自上而下地通过吸附剂。因吸附剂对不同色素吸附能力不同,所以分成三段不同颜色:绿色、黄色、黄绿色
色谱法成为分离、提纯有机物必不可少的方法。并发展出了纸上色谱法、薄层色谱法、气相色谱法和液相色谱法等。
分离提纯方法的选择:
液体混合物
蒸馏(沸点相差较大,30℃左右)
互溶
分液
不互溶
萃取
其中一种易溶于另一种溶剂
固体混合物
过滤
一种易溶于水,一种难溶于水
重结晶
(能溶于同一溶剂,但两种物质的溶解性有所差异)
1.下列物质中的杂质(括号中是杂质)分别可以用什么方法除去。
(1)酒精(水)
(2)KNO3 (NaCl)
(3)甲烷(乙烯)
(4)CO2(HCl)
(5)苯(水)
(6)NaCl(泥沙)
蒸馏
重结晶
溴水,洗气
分液
饱和NaHCO3溶液,洗气
过滤
2.现有一瓶A和B的混合液,已知A和B的某些性质如下表:
由此,分离A和B的最佳方法是( )
C
A.萃取 B.升华 C.蒸馏 D.分液
物质 分子式 熔点/℃ 沸点/℃ 密度/g·cm-3 水溶性
A C3H6O2 -98 57.5 0.93 可溶
B C4H8O2 -84 77 0.90 可溶
