10.2 第1课时 几种常见的酸 课件(共24张PPT内嵌视频) 2024-2025学年化学人教版九年级下册
文档属性
| 名称 | 10.2 第1课时 几种常见的酸 课件(共24张PPT内嵌视频) 2024-2025学年化学人教版九年级下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 21.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-15 21:57:05 | ||
图片预览







文档简介
(共24张PPT)
人教版九年级下册
化学
第十单元 常见的酸、碱、盐
课题2 常见的酸和碱
第1课时 几种常见的酸
学习目标
1.通过观察实验认识盐酸和硫酸的物理性质,掌握浓盐酸和浓硫酸的特性。
2.通过浓硫酸的强腐蚀性和稀释实验,学会稀释浓硫酸的方法,强化实验及生活中的安全意识。
3.通过观察浓硫酸和浓盐酸的物理性质及稀释浓硫酸实验,培养善于观察、总结、勤于思考的科学精神,逐步树立认识来源于实践的观点。
任务一 初识常见的酸
任务
请观察并叙述浓硫酸和浓盐酸的物理性质。
摇一摇这两瓶液体,观察有何区别,比较两瓶液体的质量,并确定其体积。
实验室制取二氧化碳时常用稀盐酸,为何不用浓盐酸
浓硫酸也有挥发性吗 打开盛有浓硫酸、浓盐酸的试剂瓶的瓶盖,可观察到什么现象
浓盐酸瓶口出现的白雾是什么?你能用实验证明吗?
问题
白雾的产生与挥发出的氯化氢有关,白雾可能是盐酸的小液滴,可用pH试纸检测。
如果检测前先将pH试纸用蒸馏水润湿,对检测结果有影响吗 为什么
此处是判断白雾显酸性,而不是判断酸性的强弱,所以用蒸馏水先润湿pH试纸,对检测结果没有影响。
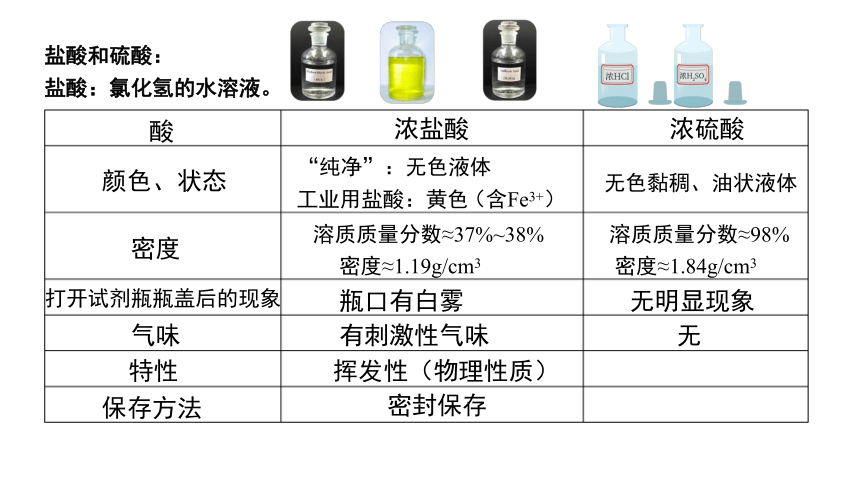
盐酸和硫酸:
盐酸:氯化氢的水溶液。
浓盐酸
浓硫酸
颜色、状态
“纯净”:无色液体
无色黏稠、油状液体
密度
溶质质量分数≈37%~38%
溶质质量分数≈98%
打开试剂瓶瓶盖后的现象
瓶口有白雾
无明显现象
气味
特性
保存方法
有刺激性气味
挥发性(物理性质)
密封保存
工业用盐酸:黄色
(含Fe3+)
密度≈1.19g/cm3
密度≈1.84g/cm3
无
酸
任务二 再识硫酸
问题
硫酸和盐酸的用途广泛,使用时需注意什么呢
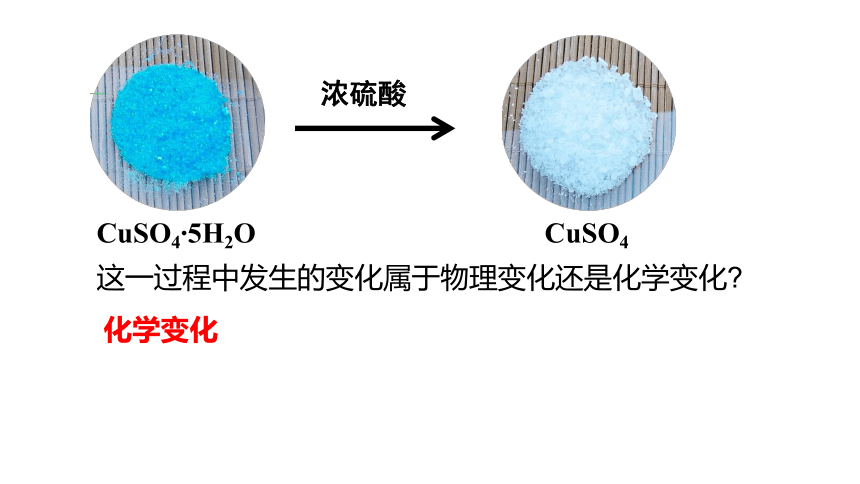
硫酸铜晶体,蓝色,带结晶水,其化学式可表示为CuSO4 5H2O,无水硫酸铜是白色固体。
资料
CuSO4 5H2O
将一小粒硫酸铜晶体投入
浓硫酸中,观察现象。
浓硫酸
CuSO4
CuSO4 5H2O
浓硫酸
CuSO4
这一过程中发生的变化属于物理变化还是化学变化
化学变化
浓硫酸具有吸水性,不仅能吸收硫酸铜晶体中的水,还能吸收空气中的水蒸气。
如果取两个规格相同的烧杯,分别加入等质量的浓硫酸、浓盐酸,分别放在托盘天平的两个托盘上,请你预测一段时间后可观察到的现象,并说明原因。
浓盐酸具有挥发性,由于挥发,其质量减少,浓硫酸具有吸水性,由于吸收空气中的水蒸气,质量增加,因此可观察到盛有浓盐酸的烧杯口有白雾,托盘天平由平衡变成不平衡。
两个烧杯中的酸,从溶液组成角度分析,什么量变了,什么量没有变?
溶剂的质量 溶质的质量 溶液的质量 溶质质量分数
浓盐酸
浓硫酸
不变
减小
减小
减小
增大
不变
增大
减小
实验
将白纸、小木条、棉布放在玻璃片上,用胶头滴管分别滴数滴浓硫酸于白纸、小木条和棉布上,放置一会儿,观察现象。
实验操作 实验现象
浓硫酸滴于白纸上
浓硫酸滴于小木条上
浓硫酸滴于棉布上
滴有浓硫酸的地方变成黑色
小木条接触浓硫酸的部位变黑
滴有浓硫酸的部位变黑,甚至烧成洞
纸张、木条、棉布的主要成分都是纤维素,纤维素由碳、氢、氧三种元素组成,浓硫酸接触到这些物质时,将其中的氢、氧按水的组成比脱去,生成黑色的炭。
浓硫酸具有很强的腐蚀性,使用浓硫酸时应十分小心。如果皮肤或衣服上不慎沾上浓硫酸,应该立即用大量的水冲洗,然后涂上质量分数为3%~5%的碳酸氢钠溶液。使用稀硫酸时,如果手上沾到稀硫酸,也应该及时用水冲洗。
浓硫酸具有吸水性,浓硫酸的这一性质有何应用呢?
问题
实验室用于干燥某些气体。
能用浓硫酸作食品干燥剂吗?
从状态分析,浓硫酸是液体,不适合;从性质考虑,浓硫酸具有强腐蚀性,不安全。
小结
浓硫酸能吸收空气中的水蒸气
浓硫酸能夺取结晶水合物中的结晶水
浓硫酸可将含碳、氢、氧元素的化合物中的氢、氧按水的组成比脱去
问题
化学实验经常用到稀硫酸,但一般买回来的都是浓硫酸,我们如何把浓硫酸变成稀硫酸
信息梳理
浓硫酸遇水放出大量的热;浓硫酸的密度比水大得多;硫酸具有腐蚀性;水的沸点为100 ℃,浓硫酸的沸点为338 ℃。
稀释浓硫酸时,需防止液体沸腾产生液滴飞溅,可采取的措施:一是稀释时进行搅拌,加快热量散失;二是操作宜慢不宜快,便于热量及时散失;三是将浓硫酸加入水中,而不是将水加入浓硫酸中。
任务三 深识硫酸
稀释浓硫酸的正确方法:将浓硫酸沿着烧杯内壁缓慢注入水中,并不断搅拌。
认识生活中的酸
食醋中含有醋酸,水果中含有柠檬酸,
蓄电池中含有硫酸。
浓盐酸
浓硫酸
颜色、状态
“纯净”:无色液体
无色黏稠、油状液体
密度
溶质质量分数≈37%~38%
溶质质量分数≈98%
打开试剂瓶瓶盖后的现象
瓶口有白雾
无明显现象
气味
特性
保存方法
有刺激性气味
挥发性(物理性质)
密封保存
吸水性等
密封保存
工业用盐酸:黄色
(含Fe3+)
密度≈1.19g/cm3
密度≈1.84g/cm3
无
吸收游离水(物理性质)
课堂小结
1.浓盐酸和浓硫酸
酸
2.盐酸和硫酸的用途:
(1)金属除锈
①除锈不可以用浓溶液,一定不能使用浓硫酸。
(2)工业生产的原料
盐酸:制造药物,如盐酸麻黄素、氯化锌等。
(3)人体胃液中含有盐酸(胃酸),可以帮助消化
(4)作气体干燥剂(浓硫酸)
注意:浓硫酸不可以用来干燥NH3,可以用来干燥O2、H2、CO2等气体。
处理前
处理后
(稀盐酸或稀硫酸)
②除完金属表面的锈斑,及时将金属从稀酸溶液中捞出。
注意:
硫酸:生产化肥、农药、火药、燃料以及冶炼金属、精制石油等。
3.浓硫酸的稀释
1.有关如图所示试剂的描述正确的是 ( )
A.该试剂可使纸张炭化
B.该试剂可用作干燥剂
C.溶质与溶剂的质量比是37∶100
D.打开该试剂瓶,瓶口会出现白雾
D
课堂作业
2.若将一瓶浓盐酸和一瓶浓硫酸都敞口放置在空气中,则可以肯定它们 ( )
A.质量都增加
B.溶质的质量分数都减小
C.溶液的酸性都增强
D.溶液的腐蚀性都增强
B
3.下列有关浓盐酸和浓硫酸的叙述正确的是 ( )
A.浓盐酸和浓硫酸都有挥发性
B.浓盐酸和浓硫酸都有吸水性
C.浓盐酸和浓硫酸敞口放置后溶质质量分数都变小
D.浓盐酸和浓硫酸都能作干燥剂
4.下列关于常见酸的说法中,错误的是 ( )
A.稀盐酸和稀硫酸都可以用来除铁锈
B.浓硫酸需要密封保存是为了防止其吸收空气中的水蒸气
C.浓盐酸敞口放置一段时间后,其溶液质量减小
D.浓硫酸敞口放置一段时间后,其溶质的质量分数变大
C
D
谢 谢 观 看
人教版九年级下册
化学
第十单元 常见的酸、碱、盐
课题2 常见的酸和碱
第1课时 几种常见的酸
学习目标
1.通过观察实验认识盐酸和硫酸的物理性质,掌握浓盐酸和浓硫酸的特性。
2.通过浓硫酸的强腐蚀性和稀释实验,学会稀释浓硫酸的方法,强化实验及生活中的安全意识。
3.通过观察浓硫酸和浓盐酸的物理性质及稀释浓硫酸实验,培养善于观察、总结、勤于思考的科学精神,逐步树立认识来源于实践的观点。
任务一 初识常见的酸
任务
请观察并叙述浓硫酸和浓盐酸的物理性质。
摇一摇这两瓶液体,观察有何区别,比较两瓶液体的质量,并确定其体积。
实验室制取二氧化碳时常用稀盐酸,为何不用浓盐酸
浓硫酸也有挥发性吗 打开盛有浓硫酸、浓盐酸的试剂瓶的瓶盖,可观察到什么现象
浓盐酸瓶口出现的白雾是什么?你能用实验证明吗?
问题
白雾的产生与挥发出的氯化氢有关,白雾可能是盐酸的小液滴,可用pH试纸检测。
如果检测前先将pH试纸用蒸馏水润湿,对检测结果有影响吗 为什么
此处是判断白雾显酸性,而不是判断酸性的强弱,所以用蒸馏水先润湿pH试纸,对检测结果没有影响。
盐酸和硫酸:
盐酸:氯化氢的水溶液。
浓盐酸
浓硫酸
颜色、状态
“纯净”:无色液体
无色黏稠、油状液体
密度
溶质质量分数≈37%~38%
溶质质量分数≈98%
打开试剂瓶瓶盖后的现象
瓶口有白雾
无明显现象
气味
特性
保存方法
有刺激性气味
挥发性(物理性质)
密封保存
工业用盐酸:黄色
(含Fe3+)
密度≈1.19g/cm3
密度≈1.84g/cm3
无
酸
任务二 再识硫酸
问题
硫酸和盐酸的用途广泛,使用时需注意什么呢
硫酸铜晶体,蓝色,带结晶水,其化学式可表示为CuSO4 5H2O,无水硫酸铜是白色固体。
资料
CuSO4 5H2O
将一小粒硫酸铜晶体投入
浓硫酸中,观察现象。
浓硫酸
CuSO4
CuSO4 5H2O
浓硫酸
CuSO4
这一过程中发生的变化属于物理变化还是化学变化
化学变化
浓硫酸具有吸水性,不仅能吸收硫酸铜晶体中的水,还能吸收空气中的水蒸气。
如果取两个规格相同的烧杯,分别加入等质量的浓硫酸、浓盐酸,分别放在托盘天平的两个托盘上,请你预测一段时间后可观察到的现象,并说明原因。
浓盐酸具有挥发性,由于挥发,其质量减少,浓硫酸具有吸水性,由于吸收空气中的水蒸气,质量增加,因此可观察到盛有浓盐酸的烧杯口有白雾,托盘天平由平衡变成不平衡。
两个烧杯中的酸,从溶液组成角度分析,什么量变了,什么量没有变?
溶剂的质量 溶质的质量 溶液的质量 溶质质量分数
浓盐酸
浓硫酸
不变
减小
减小
减小
增大
不变
增大
减小
实验
将白纸、小木条、棉布放在玻璃片上,用胶头滴管分别滴数滴浓硫酸于白纸、小木条和棉布上,放置一会儿,观察现象。
实验操作 实验现象
浓硫酸滴于白纸上
浓硫酸滴于小木条上
浓硫酸滴于棉布上
滴有浓硫酸的地方变成黑色
小木条接触浓硫酸的部位变黑
滴有浓硫酸的部位变黑,甚至烧成洞
纸张、木条、棉布的主要成分都是纤维素,纤维素由碳、氢、氧三种元素组成,浓硫酸接触到这些物质时,将其中的氢、氧按水的组成比脱去,生成黑色的炭。
浓硫酸具有很强的腐蚀性,使用浓硫酸时应十分小心。如果皮肤或衣服上不慎沾上浓硫酸,应该立即用大量的水冲洗,然后涂上质量分数为3%~5%的碳酸氢钠溶液。使用稀硫酸时,如果手上沾到稀硫酸,也应该及时用水冲洗。
浓硫酸具有吸水性,浓硫酸的这一性质有何应用呢?
问题
实验室用于干燥某些气体。
能用浓硫酸作食品干燥剂吗?
从状态分析,浓硫酸是液体,不适合;从性质考虑,浓硫酸具有强腐蚀性,不安全。
小结
浓硫酸能吸收空气中的水蒸气
浓硫酸能夺取结晶水合物中的结晶水
浓硫酸可将含碳、氢、氧元素的化合物中的氢、氧按水的组成比脱去
问题
化学实验经常用到稀硫酸,但一般买回来的都是浓硫酸,我们如何把浓硫酸变成稀硫酸
信息梳理
浓硫酸遇水放出大量的热;浓硫酸的密度比水大得多;硫酸具有腐蚀性;水的沸点为100 ℃,浓硫酸的沸点为338 ℃。
稀释浓硫酸时,需防止液体沸腾产生液滴飞溅,可采取的措施:一是稀释时进行搅拌,加快热量散失;二是操作宜慢不宜快,便于热量及时散失;三是将浓硫酸加入水中,而不是将水加入浓硫酸中。
任务三 深识硫酸
稀释浓硫酸的正确方法:将浓硫酸沿着烧杯内壁缓慢注入水中,并不断搅拌。
认识生活中的酸
食醋中含有醋酸,水果中含有柠檬酸,
蓄电池中含有硫酸。
浓盐酸
浓硫酸
颜色、状态
“纯净”:无色液体
无色黏稠、油状液体
密度
溶质质量分数≈37%~38%
溶质质量分数≈98%
打开试剂瓶瓶盖后的现象
瓶口有白雾
无明显现象
气味
特性
保存方法
有刺激性气味
挥发性(物理性质)
密封保存
吸水性等
密封保存
工业用盐酸:黄色
(含Fe3+)
密度≈1.19g/cm3
密度≈1.84g/cm3
无
吸收游离水(物理性质)
课堂小结
1.浓盐酸和浓硫酸
酸
2.盐酸和硫酸的用途:
(1)金属除锈
①除锈不可以用浓溶液,一定不能使用浓硫酸。
(2)工业生产的原料
盐酸:制造药物,如盐酸麻黄素、氯化锌等。
(3)人体胃液中含有盐酸(胃酸),可以帮助消化
(4)作气体干燥剂(浓硫酸)
注意:浓硫酸不可以用来干燥NH3,可以用来干燥O2、H2、CO2等气体。
处理前
处理后
(稀盐酸或稀硫酸)
②除完金属表面的锈斑,及时将金属从稀酸溶液中捞出。
注意:
硫酸:生产化肥、农药、火药、燃料以及冶炼金属、精制石油等。
3.浓硫酸的稀释
1.有关如图所示试剂的描述正确的是 ( )
A.该试剂可使纸张炭化
B.该试剂可用作干燥剂
C.溶质与溶剂的质量比是37∶100
D.打开该试剂瓶,瓶口会出现白雾
D
课堂作业
2.若将一瓶浓盐酸和一瓶浓硫酸都敞口放置在空气中,则可以肯定它们 ( )
A.质量都增加
B.溶质的质量分数都减小
C.溶液的酸性都增强
D.溶液的腐蚀性都增强
B
3.下列有关浓盐酸和浓硫酸的叙述正确的是 ( )
A.浓盐酸和浓硫酸都有挥发性
B.浓盐酸和浓硫酸都有吸水性
C.浓盐酸和浓硫酸敞口放置后溶质质量分数都变小
D.浓盐酸和浓硫酸都能作干燥剂
4.下列关于常见酸的说法中,错误的是 ( )
A.稀盐酸和稀硫酸都可以用来除铁锈
B.浓硫酸需要密封保存是为了防止其吸收空气中的水蒸气
C.浓盐酸敞口放置一段时间后,其溶液质量减小
D.浓硫酸敞口放置一段时间后,其溶质的质量分数变大
C
D
谢 谢 观 看
同课章节目录
