6.3 课时1 化学能转化为电能(共18张PPT) 课时练 2024-2025学年苏教版高中化学必修第二册
文档属性
| 名称 | 6.3 课时1 化学能转化为电能(共18张PPT) 课时练 2024-2025学年苏教版高中化学必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 8.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-16 18:12:26 | ||
图片预览






文档简介
(共18张PPT)
化学能转化为电能
1.通过实验探究认识化学能可以转化为电能。
2.从电子转移的角度理解化学能向电能转化的本质及原电池的构成条件。
3.形成化学有助于提高人类生活质量的观念。
化学能除了可以转化热能以外,还可以转化为光能、机械能、电能等其他形式的能量。各种各样的电池就是化学能与电能转化的最好体现。
那么,化学电源是如何对外提供电能的呢?
电池研究和发明历程
1780年,意大利生物学家伽伏尼通过实验宣称动物组织能产生电。
1800年,意大利物理学家、化学家伏特发明了世界上第一块电池——“伏打电池”。
把一块锌板和一块铜板浸在盐水里,发现连接两块金属的导线中有电流通过
1836年,英国电化学家丹尼尔利用铜、锌、稀硫酸等,制作出了第一个能保持平稳电流的电池。
1887年,英国发明家赫勒森发明了最早的锌锰干电池,这是当今社会广泛使用的干电池的雏形。
实验现象:
实验结论:
锌片逐渐溶解,有气泡产生,
铜片无变化。
实验探究1:把一块锌片和一块铜片分别插入盛有稀硫酸的烧杯里,观察实验现象。
锌与稀硫酸反应生成氢气;
铜与稀硫酸不反应。
Zn+2H+=Zn2++H2↑
任务一:实验探究原电池的形成
实验现象:
实验结论:
锌片逐渐溶解,有气泡产生,铜片无变化。
锌与稀硫酸反应生成氢气;铜与稀硫酸不反应。
实验探究2: 把一块锌片和一块铜片同时插入盛有稀硫酸的烧杯里,观察实验现象。
Zn+2H+=Zn2++H2↑
任务一:实验探究原电池的形成
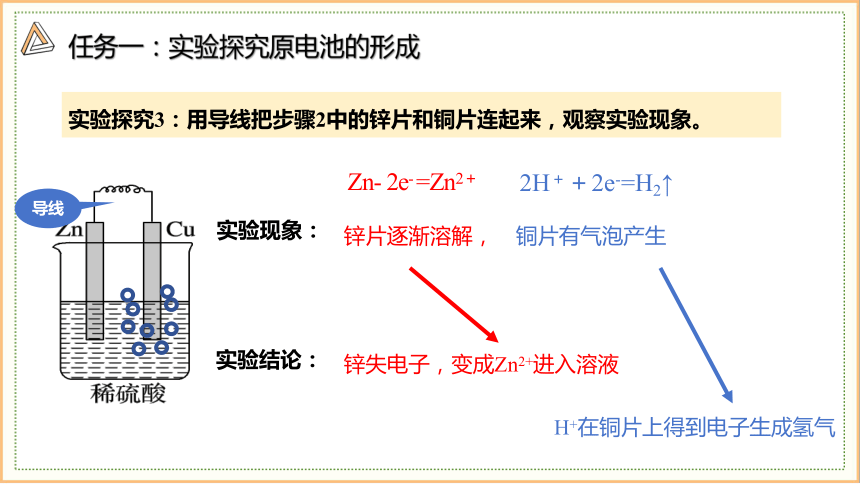
实验现象:
实验结论:
锌片逐渐溶解, 铜片有气泡产生
锌失电子,变成Zn2+进入溶液
导线
H+在铜片上得到电子生成氢气
实验探究3:用导线把步骤2中的锌片和铜片连起来,观察实验现象。
Zn- 2e- =Zn2+
2H++2e-=H2↑
任务一:实验探究原电池的形成
实验现象:
实验结论:
锌片逐渐溶解,铜片有气泡产生,灵敏电流计指针发生偏转
锌失电子,变成Zn2+进入溶液,H+在铜片上得到电子生成氢气,反应过程中产生了电能。
灵敏电流计是用来检测微小电流的电流表,指针可以左右偏转一定角度,电流方向都是规定的正电荷移动的方向,与电子流动方向是相反的。
实验探究4:在步骤3的导线中间连接一个灵敏电流计(图 6-23),观察实验现象。
任务一:实验探究原电池的形成
任务二:探究原电池电流形成的原因
1、概念:
2、工作原理:
原电池是把化学能转化为电能的装置。
Zn- 2e- =Zn2+
氧化反应
负极
2H++2e-=H2↑
还原反应
正极
电子经导线通过电流计流入铜电极
溶液H+移向铜片, SO42-移向锌片,使电极和溶液形成电流回路
“电子不下水,离子不上岸”
总反应:Zn+2H+=Zn2++H2↑
结合以上分析建构原电池模型
1、下列设备工作时,将化学能转化为电能的是( )
A B C D
锂离子电池 太阳能集热器 燃气灶 硅太阳能电池
A
2、下列化学反应中,不能设计为原电池的是( )
A.Zn+CuSO4=ZnSO4+Cu
B.Fe+H2SO4(稀)=FeSO4+H2↑
C.CuO+H2SO4(稀)=CuSO4+H2O
D.Cu+2AgNO3=2Ag+Cu(NO3)2
能设计成原电池的化学反应是氧化还原反应
C
任务三:探究原电池的构成条件
认真观察以下装置中电流计是否发生偏转,并分析其原因。
偏转
不偏转
形成条件一:必须形成闭合回路
偏转
不偏转
形成条件二:电极需插进电解质溶液中
认真观察以下装置中电流计是否发生偏转,并分析其原因。
偏转
偏转
不偏转
形成条件三:活泼性不同的两个电极(或另一种为非金属导体)
任务三:探究原电池的构成条件
3、原电池的构成条件:
3、形成闭合回路
4、氧化还原反应能自发进行
2、两电极插入电解质溶液中
1、两种活泼性不同的金属(或另一种为非金属导体)构成电极
原电池
两极一液成回路
1、如图所示的装置,能够构成成原电池的是_______,不符合的请说明理由。
E、F
2、判断下列原电池的负极材料是什么?
a极 b极 电解质溶液 负极
Fe C CuSO4溶液
Al Mg 稀盐酸
Al Mg 浓HNO3
Al Cu 浓HNO3
Al Mg NaOH溶液
Mg
Cu
Al
Fe
Mg
关键:发生氧化反应的一极
2Al-6e-+8OH-=2AlO2-+4H2O
原电池正负极的判断
负极
电极名称
正极
活泼性较强的金属
电极材料
活泼性较弱的金属
流出电子的一极
电子流向
发生氧化反应
反应类型
流入电子的一极
发生还原反应
阴离子移向的一极
离子流向
阳离子移向的一极
溶解的一极
实验现象
增重或有气泡放出
多数情况下
化学能转化为电能
1.通过实验探究认识化学能可以转化为电能。
2.从电子转移的角度理解化学能向电能转化的本质及原电池的构成条件。
3.形成化学有助于提高人类生活质量的观念。
化学能除了可以转化热能以外,还可以转化为光能、机械能、电能等其他形式的能量。各种各样的电池就是化学能与电能转化的最好体现。
那么,化学电源是如何对外提供电能的呢?
电池研究和发明历程
1780年,意大利生物学家伽伏尼通过实验宣称动物组织能产生电。
1800年,意大利物理学家、化学家伏特发明了世界上第一块电池——“伏打电池”。
把一块锌板和一块铜板浸在盐水里,发现连接两块金属的导线中有电流通过
1836年,英国电化学家丹尼尔利用铜、锌、稀硫酸等,制作出了第一个能保持平稳电流的电池。
1887年,英国发明家赫勒森发明了最早的锌锰干电池,这是当今社会广泛使用的干电池的雏形。
实验现象:
实验结论:
锌片逐渐溶解,有气泡产生,
铜片无变化。
实验探究1:把一块锌片和一块铜片分别插入盛有稀硫酸的烧杯里,观察实验现象。
锌与稀硫酸反应生成氢气;
铜与稀硫酸不反应。
Zn+2H+=Zn2++H2↑
任务一:实验探究原电池的形成
实验现象:
实验结论:
锌片逐渐溶解,有气泡产生,铜片无变化。
锌与稀硫酸反应生成氢气;铜与稀硫酸不反应。
实验探究2: 把一块锌片和一块铜片同时插入盛有稀硫酸的烧杯里,观察实验现象。
Zn+2H+=Zn2++H2↑
任务一:实验探究原电池的形成
实验现象:
实验结论:
锌片逐渐溶解, 铜片有气泡产生
锌失电子,变成Zn2+进入溶液
导线
H+在铜片上得到电子生成氢气
实验探究3:用导线把步骤2中的锌片和铜片连起来,观察实验现象。
Zn- 2e- =Zn2+
2H++2e-=H2↑
任务一:实验探究原电池的形成
实验现象:
实验结论:
锌片逐渐溶解,铜片有气泡产生,灵敏电流计指针发生偏转
锌失电子,变成Zn2+进入溶液,H+在铜片上得到电子生成氢气,反应过程中产生了电能。
灵敏电流计是用来检测微小电流的电流表,指针可以左右偏转一定角度,电流方向都是规定的正电荷移动的方向,与电子流动方向是相反的。
实验探究4:在步骤3的导线中间连接一个灵敏电流计(图 6-23),观察实验现象。
任务一:实验探究原电池的形成
任务二:探究原电池电流形成的原因
1、概念:
2、工作原理:
原电池是把化学能转化为电能的装置。
Zn- 2e- =Zn2+
氧化反应
负极
2H++2e-=H2↑
还原反应
正极
电子经导线通过电流计流入铜电极
溶液H+移向铜片, SO42-移向锌片,使电极和溶液形成电流回路
“电子不下水,离子不上岸”
总反应:Zn+2H+=Zn2++H2↑
结合以上分析建构原电池模型
1、下列设备工作时,将化学能转化为电能的是( )
A B C D
锂离子电池 太阳能集热器 燃气灶 硅太阳能电池
A
2、下列化学反应中,不能设计为原电池的是( )
A.Zn+CuSO4=ZnSO4+Cu
B.Fe+H2SO4(稀)=FeSO4+H2↑
C.CuO+H2SO4(稀)=CuSO4+H2O
D.Cu+2AgNO3=2Ag+Cu(NO3)2
能设计成原电池的化学反应是氧化还原反应
C
任务三:探究原电池的构成条件
认真观察以下装置中电流计是否发生偏转,并分析其原因。
偏转
不偏转
形成条件一:必须形成闭合回路
偏转
不偏转
形成条件二:电极需插进电解质溶液中
认真观察以下装置中电流计是否发生偏转,并分析其原因。
偏转
偏转
不偏转
形成条件三:活泼性不同的两个电极(或另一种为非金属导体)
任务三:探究原电池的构成条件
3、原电池的构成条件:
3、形成闭合回路
4、氧化还原反应能自发进行
2、两电极插入电解质溶液中
1、两种活泼性不同的金属(或另一种为非金属导体)构成电极
原电池
两极一液成回路
1、如图所示的装置,能够构成成原电池的是_______,不符合的请说明理由。
E、F
2、判断下列原电池的负极材料是什么?
a极 b极 电解质溶液 负极
Fe C CuSO4溶液
Al Mg 稀盐酸
Al Mg 浓HNO3
Al Cu 浓HNO3
Al Mg NaOH溶液
Mg
Cu
Al
Fe
Mg
关键:发生氧化反应的一极
2Al-6e-+8OH-=2AlO2-+4H2O
原电池正负极的判断
负极
电极名称
正极
活泼性较强的金属
电极材料
活泼性较弱的金属
流出电子的一极
电子流向
发生氧化反应
反应类型
流入电子的一极
发生还原反应
阴离子移向的一极
离子流向
阳离子移向的一极
溶解的一极
实验现象
增重或有气泡放出
多数情况下
