6.3 课时2 化学电源(共15张PPT) 课时练 2024-2025学年苏教版高中化学必修第二册
文档属性
| 名称 | 6.3 课时2 化学电源(共15张PPT) 课时练 2024-2025学年苏教版高中化学必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 19.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-16 18:14:57 | ||
图片预览




文档简介
(共15张PPT)
化学电源
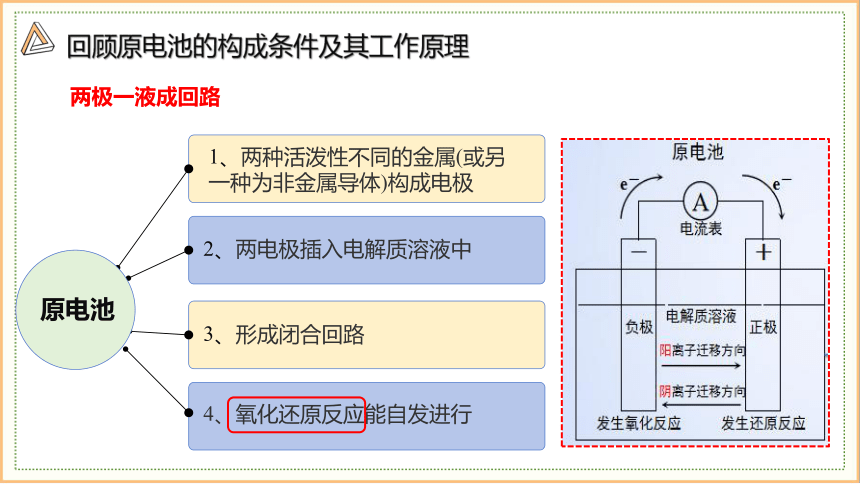
回顾原电池的构成条件及其工作原理
两极一液成回路
3、形成闭合回路
4、氧化还原反应能自发进行
2、两电极插入电解质溶液中
1、两种活泼性不同的金属(或另一种为非金属导体)构成电极
原电池
依据原电池反应的原理,我们可以设计一个装置,通过氧化还原反应即可实现化学能向电能的转化。
实验探究
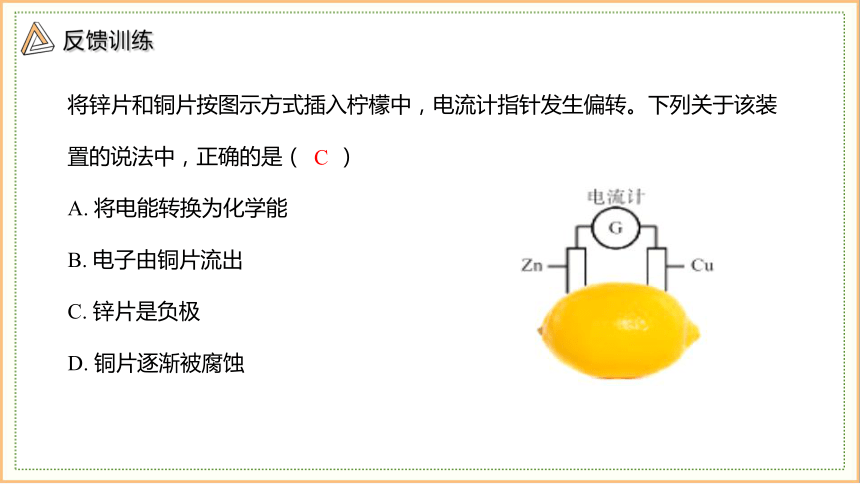
利用铜片、锌片(可从废旧干电池中拆取)或铝片、纯碱溶液、白醋(或橙子、橘子)等日常生活中的材料即可制作简易电池。
将锌片和铜片按图示方式插入柠檬中,电流计指针发生偏转。下列关于该装置的说法中,正确的是( )
A. 将电能转换为化学能
B. 电子由铜片流出
C. 锌片是负极
D. 铜片逐渐被腐蚀
C
简易电池无法长久稳定地使用,于是人们发明并制造了多种多样的能够较长时间稳定持续供电的化学电源 。化学电源的能量转化率比燃料燃烧高得多。
一次电池
一次电池用过之后不能复原
耗电完后需要更换电池
二次电池
二次电池充电后能继续使用
耗电完后连
接电源充电
锌锰干电池
银锌纽扣电池
铅蓄电池
一、化学电源
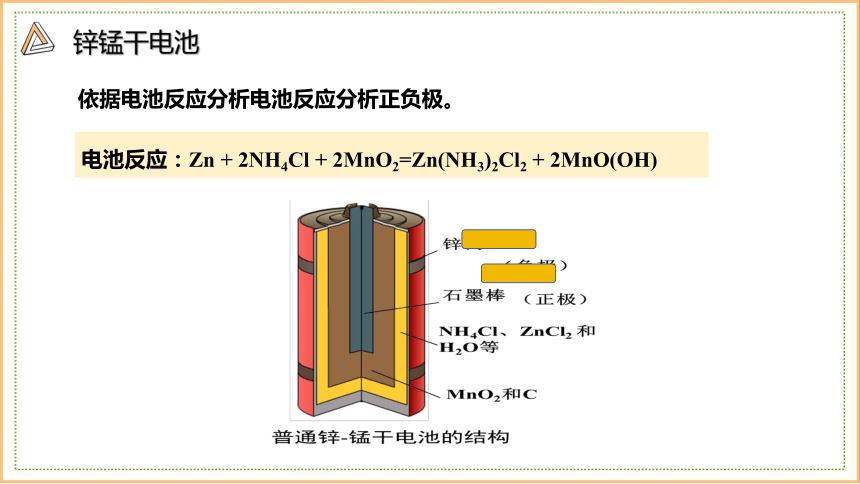
锌锰干电池
电池反应:Zn + 2NH4Cl + 2MnO2=Zn(NH3)2Cl2 + 2MnO(OH)
依据电池反应分析电池反应分析正负极。
铅蓄电池
放电过程
负极:
正极:
Pb+SO42--2e-=PbSO4
Pb
PbO2
硫酸溶液
电解质:
PbO2+SO42-+4H++2e- =PbSO4+ 2H2O
总反应:Pb+PbO2+2H2SO4 2PbSO4 +2H2O
1、银锌纽扣电池放电时的反应为Zn + Ag2O + H2O=Zn(OH)2 + 2Ag,下列有关说法中错误的是( )
A. Zn是电池的负极
B. Ag2O为正极反应物,发生还原反应
C. 电解质溶液可能是稀盐酸
D. 银锌电池具有体积小、质量轻的优点
C
负极Zn:
正极Ag2O:
Zn-2e-+ 2OH-=Zn(OH)2
Ag2O + H2O +2e-=2Ag + 2OH-
2、某锌-空气电池反应为2Zn + O2=2ZnO,电解质溶液为NaOH溶液。下列说法中错误的是( )
A. 锌片作电池的负极
B. 氧气在正极发生还原反应
C. 理论上每转移1 mol 电子消耗标准状况下氧气的体积为5.6 L
D. 电池工作时,电解质溶液中OH-向正极移动
D
3、“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg + O2 + 2H2O=2Mg (OH)2 。下列关于该电池的说法中,错误的是( )
A. 镁片作为正极
B. 食盐水作为电解质溶液
C. 电池工作时镁片逐渐被消耗
D. 电池工作时实现了化学能向电能的转化
A
燃料电池
电池总反应:2H2 + O2=2H2O
氢氧燃料电池
发展中的燃料电池
锂离子电池
(1)优点:供电稳定、可反复充放电、使用寿命长、便携、无污染。
(2)用途:广泛用于笔记本电脑、手机等数码产品
二、电解池
将电能转化为化学能的装置
利用电解我们可以获得普通化学方法难以制备的物质
应用:
二次电池的充电,冶炼活泼金属钠、镁、铝等
应用:
电解水制得氢气和氧气;电解饱和食盐水制备烧碱、氯气和氢气。
电解
电解池
右图是一种航天器能量储存系统原理示意图。下列说法中正确的是( )
A. 该系统中只存在3种形式的能量转化
B. 装置Y中在负极发生反应的物质是O2
C. 装置X能实现燃料电池的燃料和氧化剂再生
D. 装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
C
化学电源
回顾原电池的构成条件及其工作原理
两极一液成回路
3、形成闭合回路
4、氧化还原反应能自发进行
2、两电极插入电解质溶液中
1、两种活泼性不同的金属(或另一种为非金属导体)构成电极
原电池
依据原电池反应的原理,我们可以设计一个装置,通过氧化还原反应即可实现化学能向电能的转化。
实验探究
利用铜片、锌片(可从废旧干电池中拆取)或铝片、纯碱溶液、白醋(或橙子、橘子)等日常生活中的材料即可制作简易电池。
将锌片和铜片按图示方式插入柠檬中,电流计指针发生偏转。下列关于该装置的说法中,正确的是( )
A. 将电能转换为化学能
B. 电子由铜片流出
C. 锌片是负极
D. 铜片逐渐被腐蚀
C
简易电池无法长久稳定地使用,于是人们发明并制造了多种多样的能够较长时间稳定持续供电的化学电源 。化学电源的能量转化率比燃料燃烧高得多。
一次电池
一次电池用过之后不能复原
耗电完后需要更换电池
二次电池
二次电池充电后能继续使用
耗电完后连
接电源充电
锌锰干电池
银锌纽扣电池
铅蓄电池
一、化学电源
锌锰干电池
电池反应:Zn + 2NH4Cl + 2MnO2=Zn(NH3)2Cl2 + 2MnO(OH)
依据电池反应分析电池反应分析正负极。
铅蓄电池
放电过程
负极:
正极:
Pb+SO42--2e-=PbSO4
Pb
PbO2
硫酸溶液
电解质:
PbO2+SO42-+4H++2e- =PbSO4+ 2H2O
总反应:Pb+PbO2+2H2SO4 2PbSO4 +2H2O
1、银锌纽扣电池放电时的反应为Zn + Ag2O + H2O=Zn(OH)2 + 2Ag,下列有关说法中错误的是( )
A. Zn是电池的负极
B. Ag2O为正极反应物,发生还原反应
C. 电解质溶液可能是稀盐酸
D. 银锌电池具有体积小、质量轻的优点
C
负极Zn:
正极Ag2O:
Zn-2e-+ 2OH-=Zn(OH)2
Ag2O + H2O +2e-=2Ag + 2OH-
2、某锌-空气电池反应为2Zn + O2=2ZnO,电解质溶液为NaOH溶液。下列说法中错误的是( )
A. 锌片作电池的负极
B. 氧气在正极发生还原反应
C. 理论上每转移1 mol 电子消耗标准状况下氧气的体积为5.6 L
D. 电池工作时,电解质溶液中OH-向正极移动
D
3、“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg + O2 + 2H2O=2Mg (OH)2 。下列关于该电池的说法中,错误的是( )
A. 镁片作为正极
B. 食盐水作为电解质溶液
C. 电池工作时镁片逐渐被消耗
D. 电池工作时实现了化学能向电能的转化
A
燃料电池
电池总反应:2H2 + O2=2H2O
氢氧燃料电池
发展中的燃料电池
锂离子电池
(1)优点:供电稳定、可反复充放电、使用寿命长、便携、无污染。
(2)用途:广泛用于笔记本电脑、手机等数码产品
二、电解池
将电能转化为化学能的装置
利用电解我们可以获得普通化学方法难以制备的物质
应用:
二次电池的充电,冶炼活泼金属钠、镁、铝等
应用:
电解水制得氢气和氧气;电解饱和食盐水制备烧碱、氯气和氢气。
电解
电解池
右图是一种航天器能量储存系统原理示意图。下列说法中正确的是( )
A. 该系统中只存在3种形式的能量转化
B. 装置Y中在负极发生反应的物质是O2
C. 装置X能实现燃料电池的燃料和氧化剂再生
D. 装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
C
