贵州省黔东南州从江县2024-2025学年度九年级下学期开学考试化学试题(含答案)
文档属性
| 名称 | 贵州省黔东南州从江县2024-2025学年度九年级下学期开学考试化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 600.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-16 13:08:19 | ||
图片预览

文档简介
贵州省黔东南州从江县2024-2025学年度九年级下学期开学考试
化学试题
一、选择题(本题共7小题,每小题2分,共14分,每小题只有一个选项符合题意)
1.近几年,世界自然基金会在中国发起“绿V客行动”,邀请公众小事做起,践行环保。下列行为中不符合“绿V客”环保主题的是( )
A.骑“共享单车”出行 B.就地焚烧垃圾
C.尽量使用环保购物袋 D.周末走出户外,亲近大自然
2.安全警钟应时刻长鸣,下列意外事故的处理方法错误的是( )
A.实验时,应穿好实验服,戴好防护眼镜
B.煤气中毒后立即抬到空气新鲜的地方或进入高压氧仓
C.浓氢氧化钠溶液溅到衣服上,先涂上硫酸溶液中和,再用大量水立即冲洗
D.遭遇火灾险情时,用湿毛巾捂住口鼻,蹲下身子靠近地面跑离着火区域
3.归纳整理是常用的学习方法,下列归纳整理正确的是( )
A.硫在空气、氧气中燃烧都产生明亮的蓝紫色火焰
B.洗洁精、汽油除去油污的原理都是乳化
C.金刚石和石墨都是碳的单质,它们的性质完全相同
D.砍掉部分林木形成隔离带灭火与“釜底抽薪”的灭火原理相同
4.如图是实验室制取气体的部分装置示意图,下列说法正确的是( )
A.用过氧化氢溶液制取 O2,可选用装置②④组合
B.用装置①制取 CO2,分液漏斗中应装稀硫酸
C.用装置③收集 CO2,气体应从管口 c 通入
D.要做铁丝燃烧实验,用④收集 O2时建议留部分水
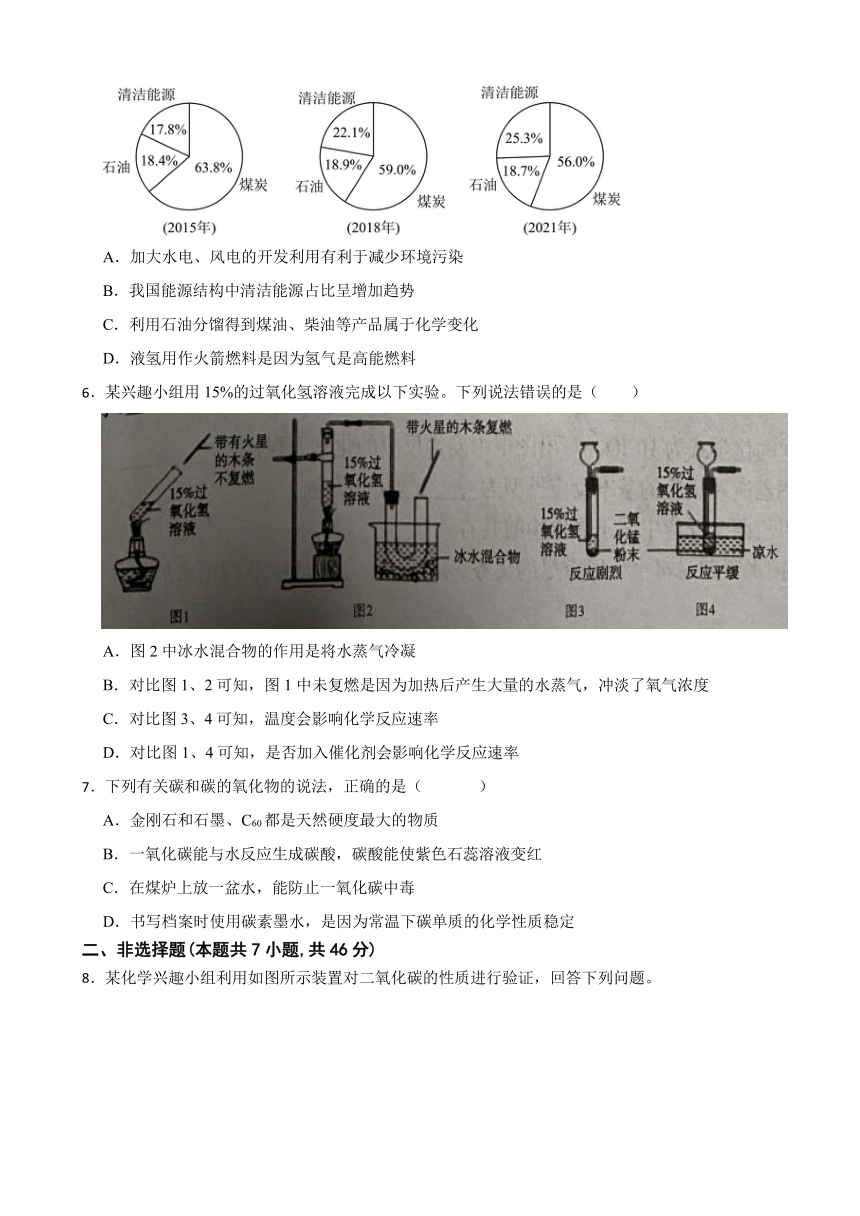
5.下图为我国不同年份的能源结构图,下列说法不正确的是( )
A.加大水电、风电的开发利用有利于减少环境污染
B.我国能源结构中清洁能源占比呈增加趋势
C.利用石油分馏得到煤油、柴油等产品属于化学变化
D.液氢用作火箭燃料是因为氢气是高能燃料
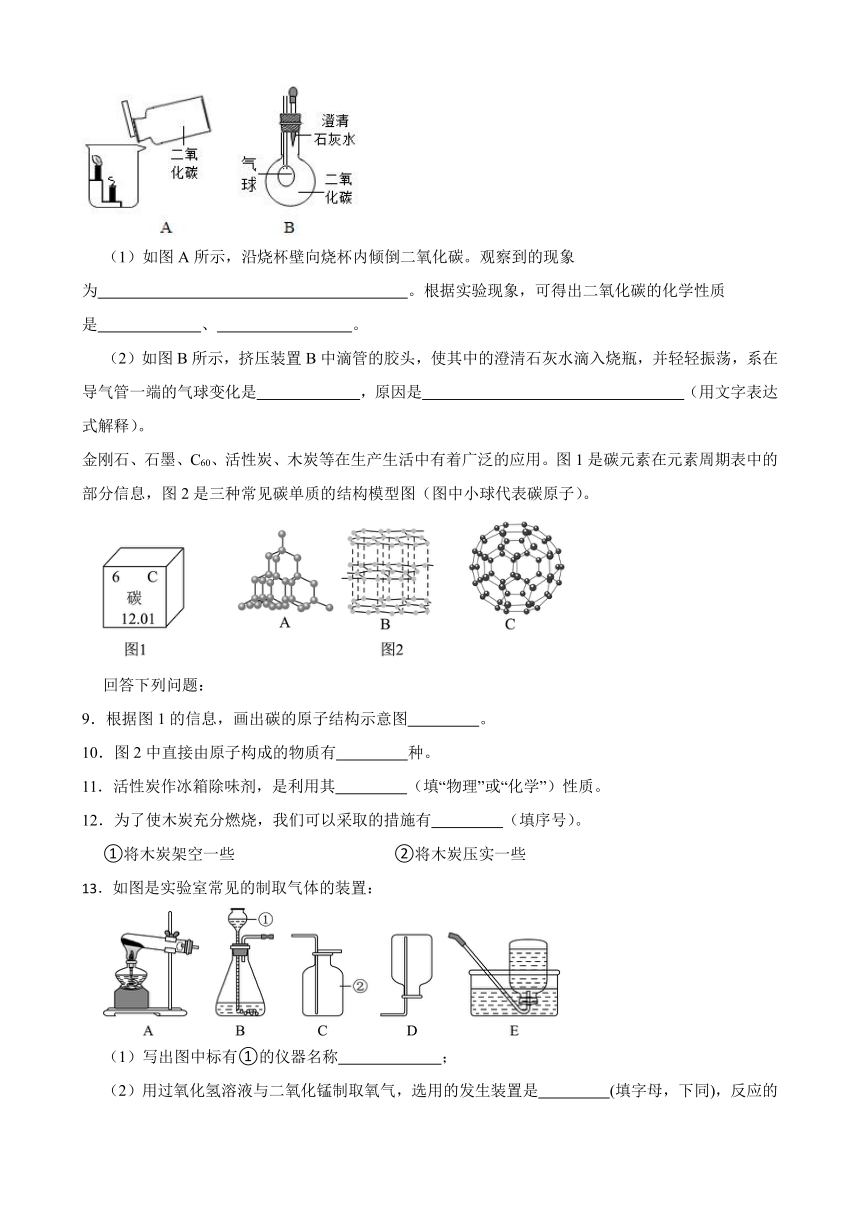
6.某兴趣小组用15%的过氧化氢溶液完成以下实验。下列说法错误的是( )
A.图2中冰水混合物的作用是将水蒸气冷凝
B.对比图1、2可知,图1中未复燃是因为加热后产生大量的水蒸气,冲淡了氧气浓度
C.对比图3、4可知,温度会影响化学反应速率
D.对比图1、4可知,是否加入催化剂会影响化学反应速率
7.下列有关碳和碳的氧化物的说法,正确的是( )
A.金刚石和石墨、C60都是天然硬度最大的物质
B.一氧化碳能与水反应生成碳酸,碳酸能使紫色石蕊溶液变红
C.在煤炉上放一盆水,能防止一氧化碳中毒
D.书写档案时使用碳素墨水,是因为常温下碳单质的化学性质稳定
二、非选择题(本题共7小题,共46分)
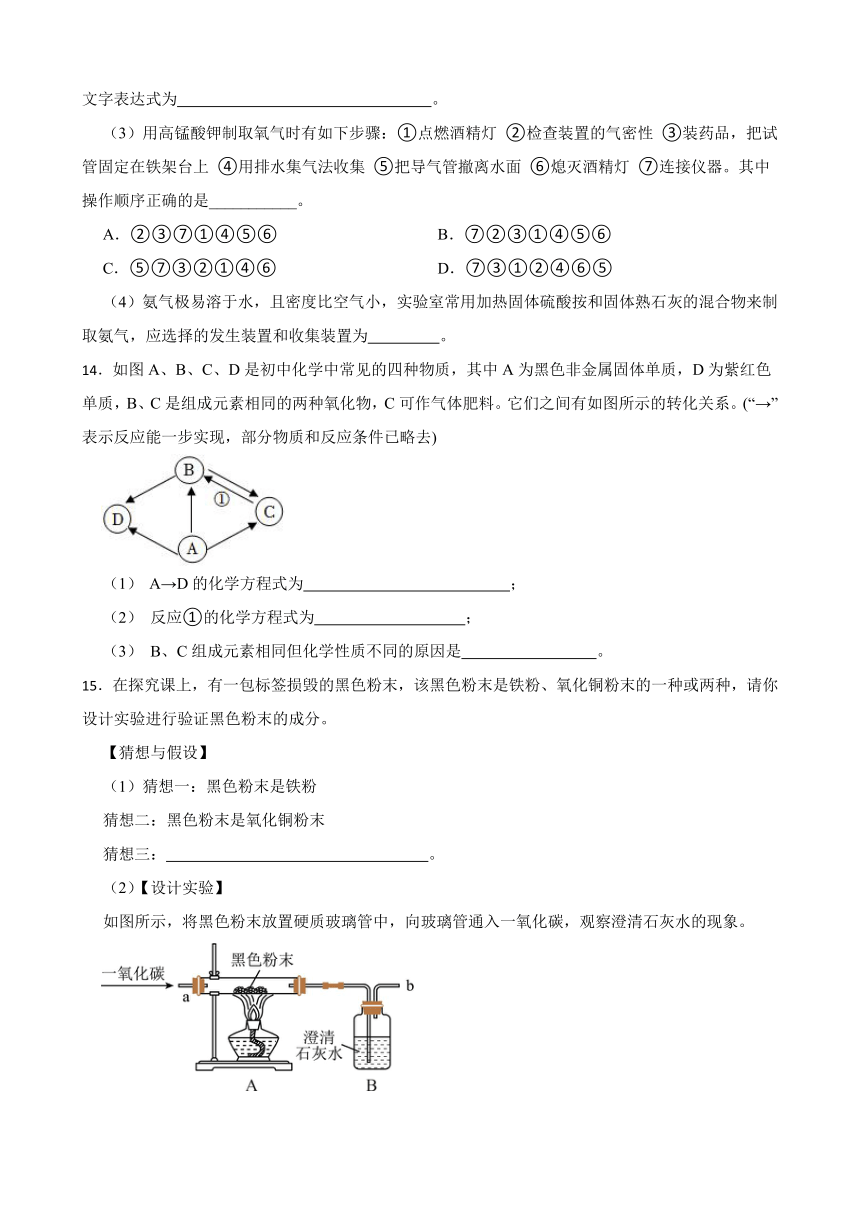
8.某化学兴趣小组利用如图所示装置对二氧化碳的性质进行验证,回答下列问题。
(1)如图A所示,沿烧杯壁向烧杯内倾倒二氧化碳。观察到的现象为 。根据实验现象,可得出二氧化碳的化学性质是 、 。
(2)如图B所示,挤压装置B中滴管的胶头,使其中的澄清石灰水滴入烧瓶,并轻轻振荡,系在导气管一端的气球变化是 ,原因是 (用文字表达式解释)。
金刚石、石墨、C60、活性炭、木炭等在生产生活中有着广泛的应用。图1是碳元素在元素周期表中的部分信息,图2是三种常见碳单质的结构模型图(图中小球代表碳原子)。
回答下列问题:
9.根据图1的信息,画出碳的原子结构示意图 。
10.图2中直接由原子构成的物质有 种。
11.活性炭作冰箱除味剂,是利用其 (填“物理”或“化学”)性质。
12.为了使木炭充分燃烧,我们可以采取的措施有 (填序号)。
①将木炭架空一些 ②将木炭压实一些
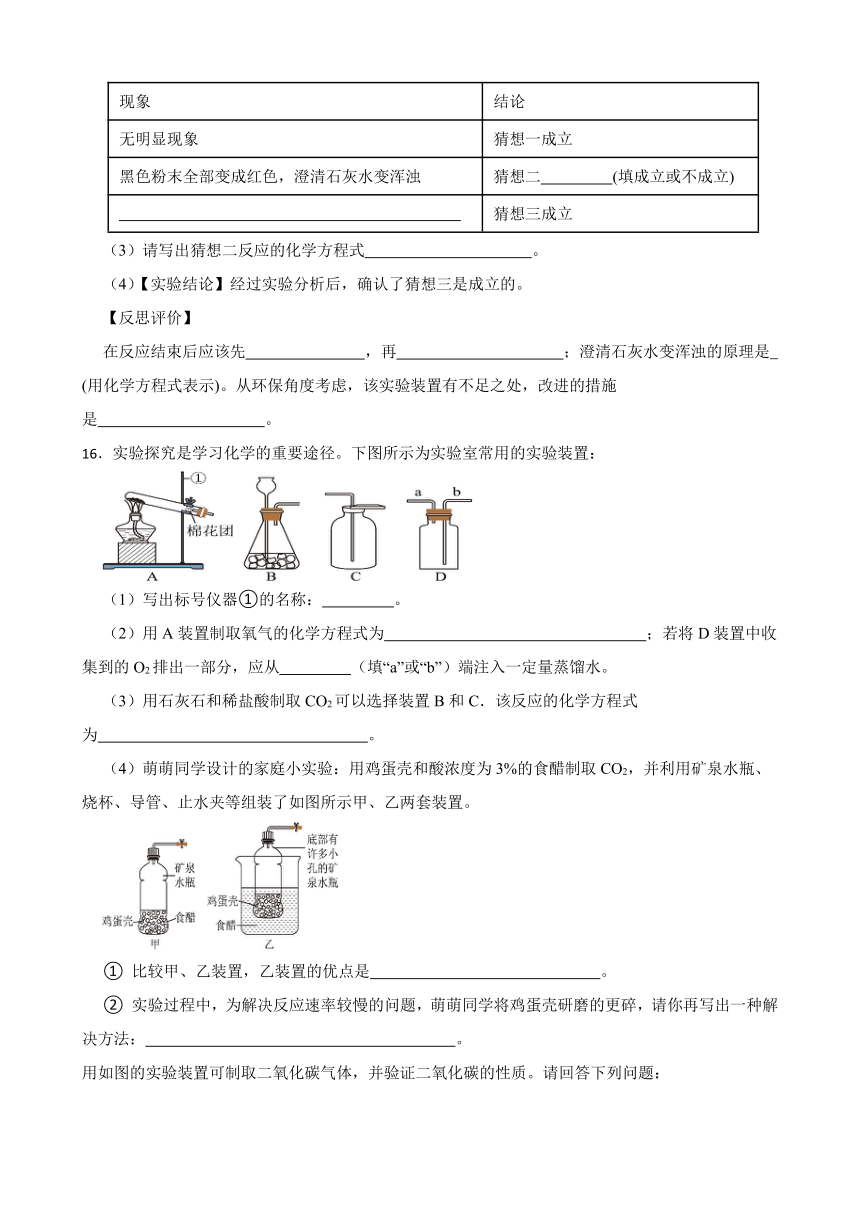
13.如图是实验室常见的制取气体的装置:
(1)写出图中标有①的仪器名称 ;
(2)用过氧化氢溶液与二氧化锰制取氧气,选用的发生装置是 (填字母,下同),反应的文字表达式为 。
(3)用高锰酸钾制取氧气时有如下步骤:①点燃酒精灯 ②检查装置的气密性 ③装药品,把试管固定在铁架台上 ④用排水集气法收集 ⑤把导气管撤离水面 ⑥熄灭酒精灯 ⑦连接仪器。其中操作顺序正确的是___________。
A.②③⑦①④⑤⑥ B.⑦②③①④⑤⑥
C.⑤⑦③②①④⑥ D.⑦③①②④⑥⑤
(4)氨气极易溶于水,且密度比空气小,实验室常用加热固体硫酸按和固体熟石灰的混合物来制取氨气,应选择的发生装置和收集装置为 。
14.如图A、B、C、D是初中化学中常见的四种物质,其中A为黑色非金属固体单质,D为紫红色单质,B、C是组成元素相同的两种氧化物,C可作气体肥料。它们之间有如图所示的转化关系。(“→”表示反应能一步实现,部分物质和反应条件已略去)
(1) A→D的化学方程式为 ;
(2) 反应①的化学方程式为 ;
(3) B、C组成元素相同但化学性质不同的原因是 。
15.在探究课上,有一包标签损毁的黑色粉末,该黑色粉末是铁粉、氧化铜粉末的一种或两种,请你设计实验进行验证黑色粉末的成分。
【猜想与假设】
(1)猜想一:黑色粉末是铁粉
猜想二:黑色粉末是氧化铜粉末
猜想三: 。
(2)【设计实验】
如图所示,将黑色粉末放置硬质玻璃管中,向玻璃管通入一氧化碳,观察澄清石灰水的现象。
现象 结论
无明显现象 猜想一成立
黑色粉末全部变成红色,澄清石灰水变浑浊 猜想二 (填成立或不成立)
猜想三成立
(3)请写出猜想二反应的化学方程式 。
(4)【实验结论】经过实验分析后,确认了猜想三是成立的。
【反思评价】
在反应结束后应该先 ,再 ;澄清石灰水变浑浊的原理是 (用化学方程式表示)。从环保角度考虑,该实验装置有不足之处,改进的措施是 。
16.实验探究是学习化学的重要途径。下图所示为实验室常用的实验装置:
(1)写出标号仪器①的名称: 。
(2)用A装置制取氧气的化学方程式为 ;若将D装置中收集到的O2排出一部分,应从 (填“a”或“b”)端注入一定量蒸馏水。
(3)用石灰石和稀盐酸制取CO2可以选择装置B和C.该反应的化学方程式为 。
(4)萌萌同学设计的家庭小实验:用鸡蛋壳和酸浓度为3%的食醋制取CO2,并利用矿泉水瓶、烧杯、导管、止水夹等组装了如图所示甲、乙两套装置。
① 比较甲、乙装置,乙装置的优点是 。
② 实验过程中,为解决反应速率较慢的问题,萌萌同学将鸡蛋壳研磨的更碎,请你再写出一种解决方法: 。
用如图的实验装置可制取二氧化碳气体,并验证二氧化碳的性质。请回答下列问题:
17.指出装置A中的错误之处 。
18.纠正错误后,完成以下实验内容:
①实验室制取二氧化碳的化学方程式是 。
②实验开始前应检查装置A的 。
③若要检验二氧化碳气体,装置A与装置C中的导管连接顺序是a→ 。
④装置A与装置B连接,观察到装置B中的现象是 ,说明二氧化碳具有 的性质。
19.将12g大理石分别放入不同质量的稀盐酸中(杂质不反应也不溶于水),每次记录结果如下:
实验次数 第1次 第2次 第3次
稀盐酸 50g 100g 150g
剩余固体 4g 2g 2g
求:大理石完全反应后生成二氧化碳多少克
答案解析部分
1.C
A. 骑“共享单车”出行,可减少私家车的使用,可以节约能源,减少污染,故不符合题意;
B. 就地焚烧垃圾,会产生大量烟尘和污染物,不利于环境保护,故符合题意;
C. 尽量使用环保购物袋,可以减少白色污染,故不符合题意;
D. 周末走出户外,亲近大自然,树立节约资源,保护生态环境的理念,故不符合题意;
故答案为:C。
根据保护环境的措施、方法,减少污染环境看的措施分析。
2.C
3.D
4.D
5.C
6.D
A、 图2中冰水混合物的作用是将水蒸气冷凝 ,不符合题意;
B、 过氧化氢受热时会产生大量水蒸气,对比图1、2可知,图1中未复燃是因为加热后产生大量的水蒸气,冲淡了氧气浓度 ,不符合题意;
C、图3、4中温度不同, 对比图3、4可知,温度会影响化学反应速率 ,不符合题意;
D、 1、4实验中温度不同,1中未加催化剂,4中加了催化剂,变量不唯一,对比图1、4可知,不能得出是否加入催化剂会影响化学反应速率 ,符合题意;
故选D
A、根据实验中冰水混合物可降温分析;
B、根据过氧化氢溶液受热会产生大量水蒸气分析;
C、根据3、4、实验的变量及现象分析;
D、根据1、4实验变量不唯一分析。
7.D
A. 金刚石是天然硬度最大的物质,石墨、C60不是,故错误;
B. 二氧化碳能与水反应生成碳酸,碳酸能使紫色石蕊溶液变红,一氧化碳不与水反应,故错误;
C. 一氧化碳难溶于水,不与水反应,在煤炉上放一盆水,不能防止一氧化碳中毒,故错误;
D. 常温下碳单质的化学性质稳定,因此书写档案时使用碳素墨水,这样能长时间保存,故正确。
故答案为:D。
A、根据金刚石是天然硬度最大的物质分析。
B、二氧化碳能与水反应生成碳酸,碳酸能使紫色石蕊溶液变红,一氧化碳不与水反应。
C、根据一氧化碳难溶于水分析。
D、根据常温下碳单质的化学性质稳定分析。
8.(1)下层的蜡烛先熄灭,上层的蜡烛后熄灭;不能燃烧;不能支持燃烧
(2)气球变大;二氧化碳+氢氧化钙→碳酸钙+水
(1)沿烧杯壁向烧杯内倾倒二氧化碳,会观察到下层的蜡烛先熄灭,上层的蜡烛后熄灭;下层的蜡烛先熄灭,上层的蜡烛后熄灭,说明了的密度比空气的大;蜡烛熄灭,说明二氧化碳不能燃烧,也不能支持燃烧;
故答案为:下层的蜡烛先熄灭,上层的蜡烛后熄灭;不能燃烧;也不能支持燃烧;
(2)二氧化碳能与石灰水反应生成碳酸钙沉淀和水,故该反应的化学方程式为:,使烧瓶内压强减小,系在导气管一端的气球变化是气球变大;
故答案为:气球变大;。
(1)根据二氧化碳的性质进行分析解答;
(2)根据二氧化碳与氢氧化钙的反应原理进行分析解答。
9.
10.两
11.物理
12.①
13.(1)长颈漏斗
(2)B;过氧化氢水+氧气
(3)B
(4)AD
(1)由图可知,仪器①为长颈漏斗。
(2)过氧化氢制取氧气的反应为固液常温反应,发生装置选B;过氧化氢在二氧化锰催化作用下生成水和氧气,反应的文字表达式为:。
(3)高锰酸钾制取氧气的步骤简记为“查装定点收离熄”,即组装仪器后,先检查装置气密性,再装入药品,固体仪器,开始收集,待收集满后,先将导管移出水面,再熄灭酒精灯,顺序为⑦②③①④⑤⑥,故选B。
(4)实验室制取氨气的反应为加热固体的反应,发生装置选A,氨气密度比空气小,极易溶于水,收集装置选D。
(1)根据常用仪器名称分析;
(2)根据反应物状态及反应条件选择发生装置,过氧化氢在二氧化锰催化作用下生成水和氧气分析;
(3)根据高锰酸钾是氧气操作步骤及注意事项分析;
(4)根据反应物状态及反应条件选择发生装置,由气体密度和溶解性选择收集装置分析。
(1)由图可知,仪器①为长颈漏斗。
(2)过氧化氢制取氧气的反应为固液常温反应,发生装置选B;
过氧化氢在二氧化锰催化作用下生成水和氧气,反应的文字表达式为:。
(3)高锰酸钾制取氧气的步骤简记为“查装定点收离熄”,即组装仪器后,先检查装置气密性,再装入药品,固体仪器,开始收集,待收集满后,先将导管移出水面,再熄灭酒精灯,顺序为⑦②③①④⑤⑥,故选B。
(4)实验室制取氨气的反应为加热固体的反应,发生装置选A,氨气密度比空气小,极易溶于水,收集装置选D。
14.(1)
(2)
(3)分子构成不同
(1)A到D的反应为碳生成铜的反应,故答案为:;
(2)反应①为二氧化碳生成一氧化碳,故答案为:;
(3)虽然B、C的元素组成是相同的,但是两者物质组成的分子不同,故答案为:分子构成不同 。
根据D为紫红色单质,所以D为铜,再根据A为黑色非金属单质,并且B、C是组成元素相同的两种氧化物,C可作气体肥料,可以推出A为碳,C为二氧化碳,B为一氧化碳;
15.(1)黑色粉末是铁粉和氧化铜混合物
(2)成立;黑色粉末部分变成红色,澄清石灰水变浑浊
(3)
(4)熄灭酒精灯;停止通入一氧化碳;;末端导管系上气球
(1)根据题目信息“ 该黑色粉末是铁粉、氧化铜粉末的一种或两种 ”,猜想一黑色粉末是铁粉,猜想二黑色粉末是氧化铜粉末,所以猜想三黑色粉末是铁粉和氧化铜的混合物;
故答案为:黑色粉末是铁粉和氧化铜混合物;
(2)一氧化碳和铁粉不能反应,一氧化碳在加热的条件下与氧化铜反应生成铜和二氧化碳,铜是红色固体,二氧化碳能使澄清石灰水变浑浊,若黑色粉末全部变成红色,澄清石灰水变浑浊,说明黑色粉末全部是氧化铜,所以猜想二成立,若猜想三成立的话,实验现象应该是黑色粉末部分变红,澄清石灰水变浑浊;
故答案为:成立; 黑色粉末部分变成红色,澄清石灰水变浑浊 ;
(3)猜想二成立,黑色粉末全部是氧化铜,一氧化碳和氧化铜在加热的条件下反应生成铜和二氧化碳,其反应的化学方程式为: ;
故答案为:
(4)在反应结束后应该先熄灭酒精灯,再停止通一氧化碳,防止石灰水倒吸和高温下还原出来的铜又被氧化;二氧化碳和石灰水中的氢氧化钙反应生成碳酸钙沉淀和水,其反应的化学方程式为 。由于一氧化碳有毒,直接排放到空气中会造成空气污染,所以该实验装置不足之处是没有进行尾气处理,改进的措施为在b导管口系上气球或放一盏燃着的酒精灯;
故答案为:熄灭酒精灯;停止通入一氧化碳; ; 末端导管系上气球 。
(1)根据黑色粉末也可能是氧化铜和铁粉的混合物进行分析解答;
(2)根据铁粉不能与一氧化碳反应,一氧化碳与氧化铜反应生成铜和二氧化碳,铜呈红色,二氧化碳能使澄清石灰水变浑浊进行分析解答;
(3)根据一氧化碳和氧化铜在加热条件下的反应原理进行分析解答;
(4)根据实验完毕先熄灭酒精灯,再停止通一氧化碳以防石灰水倒吸和高温下还原出来的铜又被氧化;二氧化碳和石灰水反应的原理,一氧化碳的毒性进行分析解答。
16.(1)铁架台
(2)2KMnO4K2MnO4+MnO2+O2↑;b
(3)CaCO3+2HCl=CaCl2+H2O+CO2↑
(4)可以控制反应的发生和停止;加热(增加食醋的浓度)(合理即可)
(1)仪器①为铁架台;
故填:铁架台;
(2)A装置为固体加热型,且试管口有一团棉花,则为高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,化学方程式为:2KMnO4K2MnO4+MnO2+O2↑;
若将D装置中收集到的O2排出一部分,氧气密度比水小,氧气不易溶于水,则应从b端注入一定量蒸馏水;
故填: 2KMnO4K2MnO4+MnO2+O2↑;b;
(3)石灰石的主要成分是碳酸钙,碳酸钙和盐酸反应生成氯化钙、二氧化碳和水,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑ ;
故填: CaCO3+2HCl=CaCl2+H2O+CO2↑ ;
(4)① 比较甲、乙装置,乙装置可以通过关闭止水夹,实现固体和液体的分离,此时反应停止;打开止水夹,固体和液体接触,反应发生,所以C装置的优点是可以控制反应的发生和停止;
②加热或增加食醋的浓度都可以加快反应速率。
故填: 可以控制反应的发生和停止 ; 加热(增加食醋的浓度)(合理即可) ;
(1)常见仪器的名称和使用;
(2)根据制氧气的原理,高锰酸钾制氧气的装置为固固加热型;根据氧气的性质来分析;
(3)根据实验室制取二氧化碳的原理分析;
(4)①根据乙装置可以通过关闭止水夹来控制反应的进行;
②加快反应速率:加热,增加食醋的浓度,增大接触面积等.
17.药品使用稀硫酸、长颈漏斗下端未插入液体中
18.CaCO3+2HCl=CaCl2+H2O+CO2↑;气密性;d;下层的蜡烛先熄灭,上层的蜡烛后熄灭;不能燃烧也不支持燃烧,密度比空气大
19.解:12g大理石中碳酸钙的质量为
设反应后生成二氧化碳的质量为
答:大理石完全反应后生成二氧化碳的质量为4.4g。
化学试题
一、选择题(本题共7小题,每小题2分,共14分,每小题只有一个选项符合题意)
1.近几年,世界自然基金会在中国发起“绿V客行动”,邀请公众小事做起,践行环保。下列行为中不符合“绿V客”环保主题的是( )
A.骑“共享单车”出行 B.就地焚烧垃圾
C.尽量使用环保购物袋 D.周末走出户外,亲近大自然
2.安全警钟应时刻长鸣,下列意外事故的处理方法错误的是( )
A.实验时,应穿好实验服,戴好防护眼镜
B.煤气中毒后立即抬到空气新鲜的地方或进入高压氧仓
C.浓氢氧化钠溶液溅到衣服上,先涂上硫酸溶液中和,再用大量水立即冲洗
D.遭遇火灾险情时,用湿毛巾捂住口鼻,蹲下身子靠近地面跑离着火区域
3.归纳整理是常用的学习方法,下列归纳整理正确的是( )
A.硫在空气、氧气中燃烧都产生明亮的蓝紫色火焰
B.洗洁精、汽油除去油污的原理都是乳化
C.金刚石和石墨都是碳的单质,它们的性质完全相同
D.砍掉部分林木形成隔离带灭火与“釜底抽薪”的灭火原理相同
4.如图是实验室制取气体的部分装置示意图,下列说法正确的是( )
A.用过氧化氢溶液制取 O2,可选用装置②④组合
B.用装置①制取 CO2,分液漏斗中应装稀硫酸
C.用装置③收集 CO2,气体应从管口 c 通入
D.要做铁丝燃烧实验,用④收集 O2时建议留部分水
5.下图为我国不同年份的能源结构图,下列说法不正确的是( )
A.加大水电、风电的开发利用有利于减少环境污染
B.我国能源结构中清洁能源占比呈增加趋势
C.利用石油分馏得到煤油、柴油等产品属于化学变化
D.液氢用作火箭燃料是因为氢气是高能燃料
6.某兴趣小组用15%的过氧化氢溶液完成以下实验。下列说法错误的是( )
A.图2中冰水混合物的作用是将水蒸气冷凝
B.对比图1、2可知,图1中未复燃是因为加热后产生大量的水蒸气,冲淡了氧气浓度
C.对比图3、4可知,温度会影响化学反应速率
D.对比图1、4可知,是否加入催化剂会影响化学反应速率
7.下列有关碳和碳的氧化物的说法,正确的是( )
A.金刚石和石墨、C60都是天然硬度最大的物质
B.一氧化碳能与水反应生成碳酸,碳酸能使紫色石蕊溶液变红
C.在煤炉上放一盆水,能防止一氧化碳中毒
D.书写档案时使用碳素墨水,是因为常温下碳单质的化学性质稳定
二、非选择题(本题共7小题,共46分)
8.某化学兴趣小组利用如图所示装置对二氧化碳的性质进行验证,回答下列问题。
(1)如图A所示,沿烧杯壁向烧杯内倾倒二氧化碳。观察到的现象为 。根据实验现象,可得出二氧化碳的化学性质是 、 。
(2)如图B所示,挤压装置B中滴管的胶头,使其中的澄清石灰水滴入烧瓶,并轻轻振荡,系在导气管一端的气球变化是 ,原因是 (用文字表达式解释)。
金刚石、石墨、C60、活性炭、木炭等在生产生活中有着广泛的应用。图1是碳元素在元素周期表中的部分信息,图2是三种常见碳单质的结构模型图(图中小球代表碳原子)。
回答下列问题:
9.根据图1的信息,画出碳的原子结构示意图 。
10.图2中直接由原子构成的物质有 种。
11.活性炭作冰箱除味剂,是利用其 (填“物理”或“化学”)性质。
12.为了使木炭充分燃烧,我们可以采取的措施有 (填序号)。
①将木炭架空一些 ②将木炭压实一些
13.如图是实验室常见的制取气体的装置:
(1)写出图中标有①的仪器名称 ;
(2)用过氧化氢溶液与二氧化锰制取氧气,选用的发生装置是 (填字母,下同),反应的文字表达式为 。
(3)用高锰酸钾制取氧气时有如下步骤:①点燃酒精灯 ②检查装置的气密性 ③装药品,把试管固定在铁架台上 ④用排水集气法收集 ⑤把导气管撤离水面 ⑥熄灭酒精灯 ⑦连接仪器。其中操作顺序正确的是___________。
A.②③⑦①④⑤⑥ B.⑦②③①④⑤⑥
C.⑤⑦③②①④⑥ D.⑦③①②④⑥⑤
(4)氨气极易溶于水,且密度比空气小,实验室常用加热固体硫酸按和固体熟石灰的混合物来制取氨气,应选择的发生装置和收集装置为 。
14.如图A、B、C、D是初中化学中常见的四种物质,其中A为黑色非金属固体单质,D为紫红色单质,B、C是组成元素相同的两种氧化物,C可作气体肥料。它们之间有如图所示的转化关系。(“→”表示反应能一步实现,部分物质和反应条件已略去)
(1) A→D的化学方程式为 ;
(2) 反应①的化学方程式为 ;
(3) B、C组成元素相同但化学性质不同的原因是 。
15.在探究课上,有一包标签损毁的黑色粉末,该黑色粉末是铁粉、氧化铜粉末的一种或两种,请你设计实验进行验证黑色粉末的成分。
【猜想与假设】
(1)猜想一:黑色粉末是铁粉
猜想二:黑色粉末是氧化铜粉末
猜想三: 。
(2)【设计实验】
如图所示,将黑色粉末放置硬质玻璃管中,向玻璃管通入一氧化碳,观察澄清石灰水的现象。
现象 结论
无明显现象 猜想一成立
黑色粉末全部变成红色,澄清石灰水变浑浊 猜想二 (填成立或不成立)
猜想三成立
(3)请写出猜想二反应的化学方程式 。
(4)【实验结论】经过实验分析后,确认了猜想三是成立的。
【反思评价】
在反应结束后应该先 ,再 ;澄清石灰水变浑浊的原理是 (用化学方程式表示)。从环保角度考虑,该实验装置有不足之处,改进的措施是 。
16.实验探究是学习化学的重要途径。下图所示为实验室常用的实验装置:
(1)写出标号仪器①的名称: 。
(2)用A装置制取氧气的化学方程式为 ;若将D装置中收集到的O2排出一部分,应从 (填“a”或“b”)端注入一定量蒸馏水。
(3)用石灰石和稀盐酸制取CO2可以选择装置B和C.该反应的化学方程式为 。
(4)萌萌同学设计的家庭小实验:用鸡蛋壳和酸浓度为3%的食醋制取CO2,并利用矿泉水瓶、烧杯、导管、止水夹等组装了如图所示甲、乙两套装置。
① 比较甲、乙装置,乙装置的优点是 。
② 实验过程中,为解决反应速率较慢的问题,萌萌同学将鸡蛋壳研磨的更碎,请你再写出一种解决方法: 。
用如图的实验装置可制取二氧化碳气体,并验证二氧化碳的性质。请回答下列问题:
17.指出装置A中的错误之处 。
18.纠正错误后,完成以下实验内容:
①实验室制取二氧化碳的化学方程式是 。
②实验开始前应检查装置A的 。
③若要检验二氧化碳气体,装置A与装置C中的导管连接顺序是a→ 。
④装置A与装置B连接,观察到装置B中的现象是 ,说明二氧化碳具有 的性质。
19.将12g大理石分别放入不同质量的稀盐酸中(杂质不反应也不溶于水),每次记录结果如下:
实验次数 第1次 第2次 第3次
稀盐酸 50g 100g 150g
剩余固体 4g 2g 2g
求:大理石完全反应后生成二氧化碳多少克
答案解析部分
1.C
A. 骑“共享单车”出行,可减少私家车的使用,可以节约能源,减少污染,故不符合题意;
B. 就地焚烧垃圾,会产生大量烟尘和污染物,不利于环境保护,故符合题意;
C. 尽量使用环保购物袋,可以减少白色污染,故不符合题意;
D. 周末走出户外,亲近大自然,树立节约资源,保护生态环境的理念,故不符合题意;
故答案为:C。
根据保护环境的措施、方法,减少污染环境看的措施分析。
2.C
3.D
4.D
5.C
6.D
A、 图2中冰水混合物的作用是将水蒸气冷凝 ,不符合题意;
B、 过氧化氢受热时会产生大量水蒸气,对比图1、2可知,图1中未复燃是因为加热后产生大量的水蒸气,冲淡了氧气浓度 ,不符合题意;
C、图3、4中温度不同, 对比图3、4可知,温度会影响化学反应速率 ,不符合题意;
D、 1、4实验中温度不同,1中未加催化剂,4中加了催化剂,变量不唯一,对比图1、4可知,不能得出是否加入催化剂会影响化学反应速率 ,符合题意;
故选D
A、根据实验中冰水混合物可降温分析;
B、根据过氧化氢溶液受热会产生大量水蒸气分析;
C、根据3、4、实验的变量及现象分析;
D、根据1、4实验变量不唯一分析。
7.D
A. 金刚石是天然硬度最大的物质,石墨、C60不是,故错误;
B. 二氧化碳能与水反应生成碳酸,碳酸能使紫色石蕊溶液变红,一氧化碳不与水反应,故错误;
C. 一氧化碳难溶于水,不与水反应,在煤炉上放一盆水,不能防止一氧化碳中毒,故错误;
D. 常温下碳单质的化学性质稳定,因此书写档案时使用碳素墨水,这样能长时间保存,故正确。
故答案为:D。
A、根据金刚石是天然硬度最大的物质分析。
B、二氧化碳能与水反应生成碳酸,碳酸能使紫色石蕊溶液变红,一氧化碳不与水反应。
C、根据一氧化碳难溶于水分析。
D、根据常温下碳单质的化学性质稳定分析。
8.(1)下层的蜡烛先熄灭,上层的蜡烛后熄灭;不能燃烧;不能支持燃烧
(2)气球变大;二氧化碳+氢氧化钙→碳酸钙+水
(1)沿烧杯壁向烧杯内倾倒二氧化碳,会观察到下层的蜡烛先熄灭,上层的蜡烛后熄灭;下层的蜡烛先熄灭,上层的蜡烛后熄灭,说明了的密度比空气的大;蜡烛熄灭,说明二氧化碳不能燃烧,也不能支持燃烧;
故答案为:下层的蜡烛先熄灭,上层的蜡烛后熄灭;不能燃烧;也不能支持燃烧;
(2)二氧化碳能与石灰水反应生成碳酸钙沉淀和水,故该反应的化学方程式为:,使烧瓶内压强减小,系在导气管一端的气球变化是气球变大;
故答案为:气球变大;。
(1)根据二氧化碳的性质进行分析解答;
(2)根据二氧化碳与氢氧化钙的反应原理进行分析解答。
9.
10.两
11.物理
12.①
13.(1)长颈漏斗
(2)B;过氧化氢水+氧气
(3)B
(4)AD
(1)由图可知,仪器①为长颈漏斗。
(2)过氧化氢制取氧气的反应为固液常温反应,发生装置选B;过氧化氢在二氧化锰催化作用下生成水和氧气,反应的文字表达式为:。
(3)高锰酸钾制取氧气的步骤简记为“查装定点收离熄”,即组装仪器后,先检查装置气密性,再装入药品,固体仪器,开始收集,待收集满后,先将导管移出水面,再熄灭酒精灯,顺序为⑦②③①④⑤⑥,故选B。
(4)实验室制取氨气的反应为加热固体的反应,发生装置选A,氨气密度比空气小,极易溶于水,收集装置选D。
(1)根据常用仪器名称分析;
(2)根据反应物状态及反应条件选择发生装置,过氧化氢在二氧化锰催化作用下生成水和氧气分析;
(3)根据高锰酸钾是氧气操作步骤及注意事项分析;
(4)根据反应物状态及反应条件选择发生装置,由气体密度和溶解性选择收集装置分析。
(1)由图可知,仪器①为长颈漏斗。
(2)过氧化氢制取氧气的反应为固液常温反应,发生装置选B;
过氧化氢在二氧化锰催化作用下生成水和氧气,反应的文字表达式为:。
(3)高锰酸钾制取氧气的步骤简记为“查装定点收离熄”,即组装仪器后,先检查装置气密性,再装入药品,固体仪器,开始收集,待收集满后,先将导管移出水面,再熄灭酒精灯,顺序为⑦②③①④⑤⑥,故选B。
(4)实验室制取氨气的反应为加热固体的反应,发生装置选A,氨气密度比空气小,极易溶于水,收集装置选D。
14.(1)
(2)
(3)分子构成不同
(1)A到D的反应为碳生成铜的反应,故答案为:;
(2)反应①为二氧化碳生成一氧化碳,故答案为:;
(3)虽然B、C的元素组成是相同的,但是两者物质组成的分子不同,故答案为:分子构成不同 。
根据D为紫红色单质,所以D为铜,再根据A为黑色非金属单质,并且B、C是组成元素相同的两种氧化物,C可作气体肥料,可以推出A为碳,C为二氧化碳,B为一氧化碳;
15.(1)黑色粉末是铁粉和氧化铜混合物
(2)成立;黑色粉末部分变成红色,澄清石灰水变浑浊
(3)
(4)熄灭酒精灯;停止通入一氧化碳;;末端导管系上气球
(1)根据题目信息“ 该黑色粉末是铁粉、氧化铜粉末的一种或两种 ”,猜想一黑色粉末是铁粉,猜想二黑色粉末是氧化铜粉末,所以猜想三黑色粉末是铁粉和氧化铜的混合物;
故答案为:黑色粉末是铁粉和氧化铜混合物;
(2)一氧化碳和铁粉不能反应,一氧化碳在加热的条件下与氧化铜反应生成铜和二氧化碳,铜是红色固体,二氧化碳能使澄清石灰水变浑浊,若黑色粉末全部变成红色,澄清石灰水变浑浊,说明黑色粉末全部是氧化铜,所以猜想二成立,若猜想三成立的话,实验现象应该是黑色粉末部分变红,澄清石灰水变浑浊;
故答案为:成立; 黑色粉末部分变成红色,澄清石灰水变浑浊 ;
(3)猜想二成立,黑色粉末全部是氧化铜,一氧化碳和氧化铜在加热的条件下反应生成铜和二氧化碳,其反应的化学方程式为: ;
故答案为:
(4)在反应结束后应该先熄灭酒精灯,再停止通一氧化碳,防止石灰水倒吸和高温下还原出来的铜又被氧化;二氧化碳和石灰水中的氢氧化钙反应生成碳酸钙沉淀和水,其反应的化学方程式为 。由于一氧化碳有毒,直接排放到空气中会造成空气污染,所以该实验装置不足之处是没有进行尾气处理,改进的措施为在b导管口系上气球或放一盏燃着的酒精灯;
故答案为:熄灭酒精灯;停止通入一氧化碳; ; 末端导管系上气球 。
(1)根据黑色粉末也可能是氧化铜和铁粉的混合物进行分析解答;
(2)根据铁粉不能与一氧化碳反应,一氧化碳与氧化铜反应生成铜和二氧化碳,铜呈红色,二氧化碳能使澄清石灰水变浑浊进行分析解答;
(3)根据一氧化碳和氧化铜在加热条件下的反应原理进行分析解答;
(4)根据实验完毕先熄灭酒精灯,再停止通一氧化碳以防石灰水倒吸和高温下还原出来的铜又被氧化;二氧化碳和石灰水反应的原理,一氧化碳的毒性进行分析解答。
16.(1)铁架台
(2)2KMnO4K2MnO4+MnO2+O2↑;b
(3)CaCO3+2HCl=CaCl2+H2O+CO2↑
(4)可以控制反应的发生和停止;加热(增加食醋的浓度)(合理即可)
(1)仪器①为铁架台;
故填:铁架台;
(2)A装置为固体加热型,且试管口有一团棉花,则为高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,化学方程式为:2KMnO4K2MnO4+MnO2+O2↑;
若将D装置中收集到的O2排出一部分,氧气密度比水小,氧气不易溶于水,则应从b端注入一定量蒸馏水;
故填: 2KMnO4K2MnO4+MnO2+O2↑;b;
(3)石灰石的主要成分是碳酸钙,碳酸钙和盐酸反应生成氯化钙、二氧化碳和水,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑ ;
故填: CaCO3+2HCl=CaCl2+H2O+CO2↑ ;
(4)① 比较甲、乙装置,乙装置可以通过关闭止水夹,实现固体和液体的分离,此时反应停止;打开止水夹,固体和液体接触,反应发生,所以C装置的优点是可以控制反应的发生和停止;
②加热或增加食醋的浓度都可以加快反应速率。
故填: 可以控制反应的发生和停止 ; 加热(增加食醋的浓度)(合理即可) ;
(1)常见仪器的名称和使用;
(2)根据制氧气的原理,高锰酸钾制氧气的装置为固固加热型;根据氧气的性质来分析;
(3)根据实验室制取二氧化碳的原理分析;
(4)①根据乙装置可以通过关闭止水夹来控制反应的进行;
②加快反应速率:加热,增加食醋的浓度,增大接触面积等.
17.药品使用稀硫酸、长颈漏斗下端未插入液体中
18.CaCO3+2HCl=CaCl2+H2O+CO2↑;气密性;d;下层的蜡烛先熄灭,上层的蜡烛后熄灭;不能燃烧也不支持燃烧,密度比空气大
19.解:12g大理石中碳酸钙的质量为
设反应后生成二氧化碳的质量为
答:大理石完全反应后生成二氧化碳的质量为4.4g。
同课章节目录
