2025年九年级中考化学一轮专题复习 第九单元 溶液(共36张PPT)
文档属性
| 名称 | 2025年九年级中考化学一轮专题复习 第九单元 溶液(共36张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-17 10:43:29 | ||
图片预览









文档简介
(共36张PPT)
第九单元 溶 液
概念 一种或几种物质分散到另一种物质里,形成的 、______ 的混合物
组成 溶质 被溶解的物质,可以是固体,也可以是液体或气体
溶剂 能溶解其他物质的物质,水是最常见的溶剂
特征 均一性 溶液各部分的组成和性质完全相同
稳定性 外界条件不变时,溶质和溶剂不会分离
微观形成过程 溶质在溶液中以分子或离子的形式均一地分散在溶剂分子中
稳定
均一
考点扫描
考点1溶液的形成(5年1考)
※2022年版课标:①认识溶解现象;②知道溶液是由溶质和溶剂组成的,具有均一性和稳定性。
1.溶液(2022.11B)
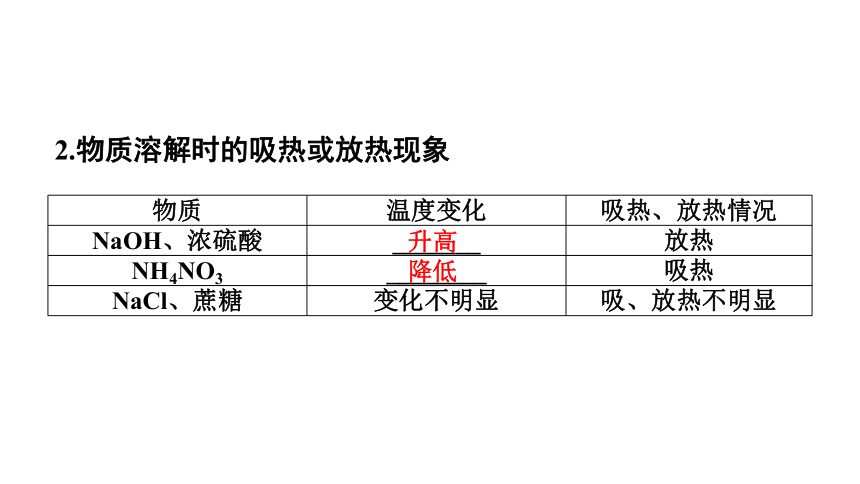
物质 温度变化 吸热、放热情况
NaOH、浓硫酸 _______ 放热
NH4NO3 ________ 吸热
NaCl、蔗糖 变化不明显 吸、放热不明显
降低
升高
2.物质溶解时的吸热或放热现象
微判断
(1)均一、稳定的液体一定是溶液。( )
(2)溶液都是无色透明的。( )
提分1 向试管中加入下列某种物质,观察到红墨水向左移动的是( )
A.NaOH
B.蔗糖
C.NH4NO3
D.生石灰
C
×
×
考点2饱和溶液与不饱和溶液(5年4考)
※2022年版课标:①能从定性和定量的视角,说明饱和溶液的含义;②认识结晶现象。
1.概念
在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫作这种溶质的 ;
还能继续溶解溶质的溶液,叫作这种溶质的 。
不饱和溶液
饱和溶液
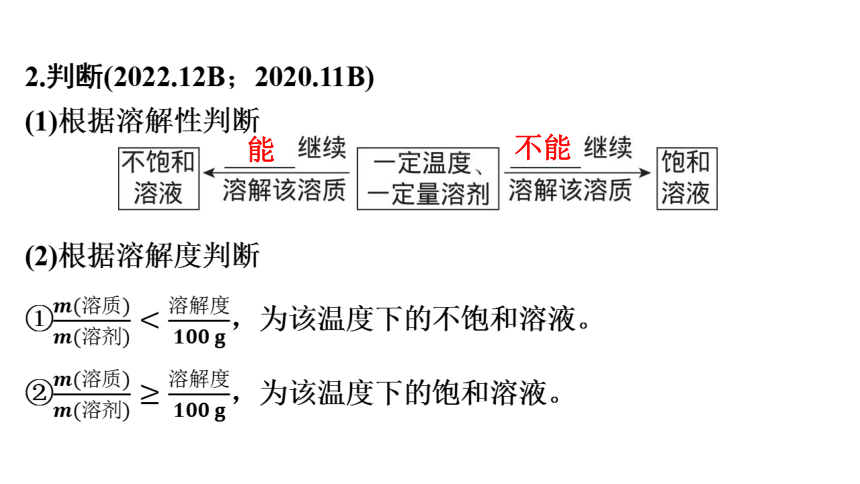
2.判断(2022.12B;2020.11B)
(1)根据溶解性判断
(2)根据溶解度判断
①,为该温度下的不饱和溶液。
②,为该温度下的饱和溶液。
能
不能
3.不饱和溶液与饱和溶液的相互转化(2023.12D)
(1)对于大多数固体(溶解度随温度升高而增大的物质)
(2)对于极少数固体(溶解度随温度升高而减小的物质)
降低温度
升高温度
升高温度
降低温度
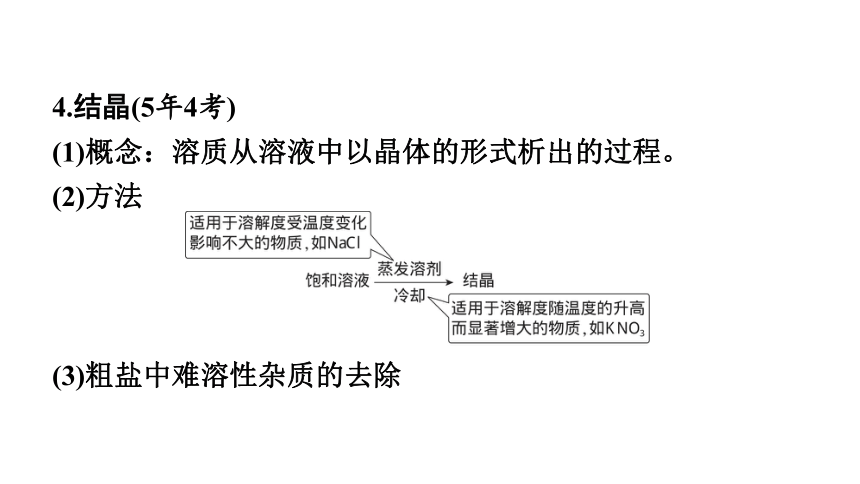
4.结晶(5年4考)
(1)概念:溶质从溶液中以晶体的形式析出的过程。
(2)方法
(3)粗盐中难溶性杂质的去除
微判断
(1)氯化钠的饱和溶液不能再溶解其他物质。( )
(2)析出晶体后的溶液一定是该物质在该温度下的饱和溶液。( )
提分2 1 向一接近饱和的NaCl溶液中逐渐加入NaCl固体,请在图中画出溶质质量随加入NaCl质量的变化曲线。
√
×
答案:如图所示
提分2 2 下列关于溶液的说法正确的是( )
A.饱和溶液升高温度一定变为不饱和溶液
B.同一溶质的饱和溶液一定比不饱和溶液浓
C.将硝酸钾的热饱和溶液降低温度后可得硝酸钾晶体
D.不饱和溶液转化为饱和溶液,溶质质量一定改变
C
概念 在一定温度下,某固态物质在 g溶剂里达到 状态时所溶解的质量
影响 因素 内因 溶质和溶剂的性质
外因 温度
与溶解性 的关系
饱和
100
考点3溶解度(5年5考)
※2022年版课标:能从定性和定量的视角,说明溶解度的含义。
1.固体溶解度[2024.16(1);2021.13(3)]
2.气体溶解度
概念 该气体的压强为101 kPa和一定温度时,在1体积水里溶解达到饱和状态时的气体体积
影响 因素 内因 气体和溶剂本身的性质
外因 ①温度:压强一定时,温度越高,气体的溶解度越小
②压强:温度一定时,压强越大,气体的溶解度越大
3.溶解度的应用(近4年连续考查)
提分3 (2024·成都中考)将某碳酸饮料拧开,倒入装有冰块的杯中,如图所示。下列分析合理的是( )
A.拧开瓶盖后,二氧化碳的溶解度变大
B.产生气泡的原因是饮料与冰发生化学反应
C.冒泡刚结束时,饮料仍然是二氧化碳的饱和溶液
D.该现象能说明二氧化碳溶解度与压强、温度的关系
C
考点4溶质的质量分数(5年4考)
※2022年版课标:①能从定性和定量的视角,说明溶质质量分数的含义;②能进行溶质质量分数的简单计算
1.溶质的质量分数(2023.12B、C;2022.12A、C)
(1)概念: 与 之比叫作溶质质量分数。
(2)计算公式
①所有溶液:溶质质量分数=×100%。
②饱和溶液:溶质质量分数=×100%(S表示溶解度)。
溶液质量
溶质质量
2.溶液的稀释
(1)依据:溶液稀释前后, 的质量不会发生变化。
(2)计算公式:A×a%=B×b%(A、B分别为稀释前后溶液的质量,a%、b%分别为稀释前后溶质的质量分数)。
3.一定溶质质量分数的氯化钠溶液的配制(近5年连续考查)
溶质
提分4 (2024·重庆中考)KCl的溶解度随温度升高而增大,40 ℃时KCl的溶解度为40 g,在该温度下,依据下表数据进行KCl溶于水的实验。下列说法正确的是( )
A.在上述实验所得的溶液中,溶质质量分数:①>②
B.实验③所得溶液中,溶质与溶剂的质量比为3∶7
C.将实验②③的溶液分别降温,一定都有晶体析出
D.将实验①③的溶液按一定比例混合可得到与②浓度相等的溶液
D
实验编号 ① ② ③
KCl的质量/g 10 20 30
水的质量/g 50 60 70
重点实验突破
实验七 一定溶质质量分数的氯化钠溶液的配制
※2022年版课标:能根据需要配制一定溶质质量分数的溶液。
一、用固体试剂配制溶液(以配制50 g质量分数为6%的氯化钠溶液为例)
实验用品 托盘天平(带砝码)、称量纸、药匙、量筒、胶头滴管、烧杯、玻璃棒、空试剂瓶、空白标签
氯化钠、蒸馏水
实验过程
实验 步骤 计算 所需氯化钠的质量为50 g×6 %=3 g;所需水的质量为50 g-3 g=47 g,体积约为47 mL(选用50 mL量筒量取)
称量 遵循“左物右码”的原则,且左右两盘需垫相同质量的称量纸
量取 ①液面接近所需体积时改用胶头滴管滴加;
②读数时量筒需放平,且视线要与量筒内液体凹液面的最低处保持水平
溶解 ①溶解过程中玻璃棒的作用是搅拌,加快溶解速率;
②溶解不能在量筒中进行
装瓶贴 标签 将配制好的溶液装入试剂瓶中,盖好瓶塞并贴上标签
二、用浓溶液配制稀溶液
实验仪器 量筒、胶头滴管、烧杯、玻璃棒、空试剂瓶、空白标签
实验 步骤 计算 浓溶液的质量=
加入水的质量=稀溶液的质量-浓溶液的质量
量取 用量筒量取所需体积的浓溶液和水,倒入烧杯中
溶解 用玻璃棒搅拌,使液体混合均匀
装瓶贴标签 将配制好的溶液装入试剂瓶中,盖好瓶塞并贴上标签
三、误差分析
误差 原因 举例
结果 偏小 溶质的量偏少 ①溶质本身不纯;②“左码右物”称量,且用到游码;③称量好的固体试剂有撒落;④固体试剂倒入烧杯时,称量纸上残留了少量固体试剂
溶剂的量偏多 ①量取水时仰视读数;②烧杯中原来有少量水
结果 偏大 溶质的量偏多 ①所用砝码生锈;②量取浓溶液时仰视读数
溶剂的量偏少 ①量取水时俯视读数;②量取的水没有完全转移到烧杯中
无影响 — 配好的溶液转移过程中部分洒出
针对训练
1.在实验操作考试中,小明的题目是配制60 g溶质质量分数为5%的氯化钠溶液。
【基础设问】
(1)请用图中序号表示配制该溶液的正确操作顺序:
。
②⑤①④③
(2)小明应称取NaCl固体 g 。在称量的过程中,发现托盘天平的指针向右偏转,此时小明应该 (填字母序号)。
A.增加适量NaCl
B.减少适量NaCl
C.增加砝码
D.调节平衡螺母
(3)操作③中玻璃棒的作用是 。
搅拌,加快溶解速率
A
3.0
答案:如图所示
(4)将配制好的氯化钠溶液装入 (填“广口瓶”或“细口瓶”)中,密封好并贴上标签,请填写如图标签的有关内容。
细口瓶
【偏差分析】
(5) 实验结束后,小组同学对实验过程进行分析并构建了如图造成误差的思维模型,请补全模型并分析误差产生的原因(从下列选项中选择)。
大
小
b
de
小
大
ac
f
a.用托盘天平称NaCl固体时,砝码放在左盘
(使用了游码)
b.砝码生锈或沾有污渍
c.将称量好的NaCl固体转移至烧杯时,
部分NaCl撒落
d.量取蒸馏水时俯视液面
e.量取好的水倒入烧杯中时有水溅出
f.烧杯中原来有少量水
2.(2024·乐山中考)实验室现有质量分数为8%的氯化钠溶液,但在实验中需要50 g质量分数为4%的氯化钠溶液,某同学准备用8%的氯化钠溶液和蒸馏水(密度为1.0 g·cm-3)进行配制。
(1)计算配制时需要8%的氯化钠溶液的质量为 g。
(2)量取蒸馏水时应选择量程为 (填“10”“20”或“50”)mL的量筒。
50
25
(3)如图所示的仪器中,本实验不会使用到的是_________
(填仪器名称)。
(4)将配制好的氯化钠溶液装入试剂瓶时有少量溶液洒出,对所配制氯化钠溶液质量分数的影响是 (填“偏大”“偏小”或“不影响”)。
不影响
酒精灯
(5)如图甲为50 mL溶质质量分数为10%的蔗糖溶液模型,其中5个“ ”代表所有的蔗糖分子。往该溶液中加水使其溶质质量分数稀释为5%(不考虑溶液密度变化)。在图乙中,补充完成稀释后的蔗糖溶液模型(要求画出液面和蔗糖分子分布)。
答案:如图所示(蔗糖分子均匀分布)
实验八 粗盐中难溶性杂质的去除
※2022年版课标:能利用物质的溶解性,设计粗盐提纯等物质分离的方案。
1.实验步骤及操作
实验步骤 实验操作
溶解 ①用天平称取一定量粗盐;②用药匙将该粗盐逐渐加入盛有水的烧杯,并用玻璃棒不断搅拌,加快溶解,直至粗盐不再溶解;③称量剩余粗盐的质量
过滤 将粗盐水用玻璃棒引流进入漏斗中过滤。若滤液仍浑浊,应再过滤一次
蒸发 加热时,用玻璃棒不断搅拌,防止因局部温度过高,造成液滴飞溅。当蒸发皿中出现较多固体时,停止加热。利用蒸发皿的余热使滤液蒸干
计算产率 用玻璃棒把固体转移到称量纸上,称量并计算精盐产率;产率=×100%
2.误差分析
结果 原因
产率偏低 ①粗盐未充分溶解就过滤;②过滤时有滤液损失;③蒸发时有液体溅出;④转移固体时有部分精盐粘在蒸发皿上
产率偏高 ①过滤时液面高于滤纸边缘、滤纸破损;②蒸发时未完全蒸干
针对训练
化学兴趣小组为了除去粗盐中的难溶性杂质,进行了如图操作。
【基础设问】
(1)上述操作中错误的一处是 ,改正后该实验的正确操作顺序是 (填序号)。
②⑤①④③
操作④没有使用玻璃棒引流
(2)操作③中用玻璃棒搅拌的目的是 _
,当蒸发皿中出现 时停止加热。
(3)经过操作④后,滤液仍然浑浊,可能的原因是 _
(写出1点即可),此时可采取的措施是 。
(4)经过上述实验操作后,所得精盐属于 (填“混合物”或“纯净物”)。
(5)除去粗盐中的泥沙是利用氯化钠和泥沙的 不同。若提纯含少量泥沙的粗盐样品10 g,实验结束后称量得到7.25 g固体,计算精盐的产率为 。
72.5%
溶解性
混合物
重新过滤
面高于滤纸边缘或承接滤液的烧杯不干净)
滤纸破损(或液
较多固体
液滴飞溅
防止因局部温度过高,造成
【偏差分析】
(6) 小组同学在计算产率时发现计算结果与理论值不符,对实验过程进行分析并构建了如图造成误差的思维模型,请补全模型并分析误差产生的原因(从下列选项中选择)。
小
abdeg
大
cf
a.粗盐未完全溶解就过滤
b.过滤时有液体溅出
c.过滤时漏斗内液面超过滤纸边缘
d.溶液转移至蒸发皿中时有液体洒落
e.蒸发时没有搅拌,液滴飞溅
f.精盐未完全干燥就称量
g.从蒸发皿中转移精盐时有撒落
【实验拓展】
(7)老师建议在溶解和过滤之间增加“溶液静置”的步骤,其目的是 。
(8)如图为NaCl的溶解度曲线。
使较多难溶性杂质充分沉降,加快过滤速度
①从节约能源和提高产率的角度分析,20 ℃时溶解5 g粗盐样品时所需水的最佳体积是 (填“5”“15”或“30”)mL。
②从NaCl的溶解度曲线分析,实验中用蒸发结晶而不用降温结晶的方法提纯粗盐的原因是 _
。
的升高变化不大
氯化钠的溶解度随温度
15
小组同学建构了“物质除杂”的思维模型(如图)来解决从粗盐中提取氯化钠的问题,已知粗盐中还含有氯化镁、氯化钙、硫酸钠和泥沙。
(9)粗盐中混有少量的泥沙,用过滤的方法除去。该方法属于上述模型中的 (填“分离转移”或“反应转化”)。
(10)根据“性质差异”,为除去粗盐中的可溶性杂质,可加入 (填字母序号)。
A.NaOH溶液 B.BaCl2溶液 C.Ba(NO3)2溶液 D.Na2CO3溶液
ABD
分离转移
第九单元 溶 液
概念 一种或几种物质分散到另一种物质里,形成的 、______ 的混合物
组成 溶质 被溶解的物质,可以是固体,也可以是液体或气体
溶剂 能溶解其他物质的物质,水是最常见的溶剂
特征 均一性 溶液各部分的组成和性质完全相同
稳定性 外界条件不变时,溶质和溶剂不会分离
微观形成过程 溶质在溶液中以分子或离子的形式均一地分散在溶剂分子中
稳定
均一
考点扫描
考点1溶液的形成(5年1考)
※2022年版课标:①认识溶解现象;②知道溶液是由溶质和溶剂组成的,具有均一性和稳定性。
1.溶液(2022.11B)
物质 温度变化 吸热、放热情况
NaOH、浓硫酸 _______ 放热
NH4NO3 ________ 吸热
NaCl、蔗糖 变化不明显 吸、放热不明显
降低
升高
2.物质溶解时的吸热或放热现象
微判断
(1)均一、稳定的液体一定是溶液。( )
(2)溶液都是无色透明的。( )
提分1 向试管中加入下列某种物质,观察到红墨水向左移动的是( )
A.NaOH
B.蔗糖
C.NH4NO3
D.生石灰
C
×
×
考点2饱和溶液与不饱和溶液(5年4考)
※2022年版课标:①能从定性和定量的视角,说明饱和溶液的含义;②认识结晶现象。
1.概念
在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫作这种溶质的 ;
还能继续溶解溶质的溶液,叫作这种溶质的 。
不饱和溶液
饱和溶液
2.判断(2022.12B;2020.11B)
(1)根据溶解性判断
(2)根据溶解度判断
①,为该温度下的不饱和溶液。
②,为该温度下的饱和溶液。
能
不能
3.不饱和溶液与饱和溶液的相互转化(2023.12D)
(1)对于大多数固体(溶解度随温度升高而增大的物质)
(2)对于极少数固体(溶解度随温度升高而减小的物质)
降低温度
升高温度
升高温度
降低温度
4.结晶(5年4考)
(1)概念:溶质从溶液中以晶体的形式析出的过程。
(2)方法
(3)粗盐中难溶性杂质的去除
微判断
(1)氯化钠的饱和溶液不能再溶解其他物质。( )
(2)析出晶体后的溶液一定是该物质在该温度下的饱和溶液。( )
提分2 1 向一接近饱和的NaCl溶液中逐渐加入NaCl固体,请在图中画出溶质质量随加入NaCl质量的变化曲线。
√
×
答案:如图所示
提分2 2 下列关于溶液的说法正确的是( )
A.饱和溶液升高温度一定变为不饱和溶液
B.同一溶质的饱和溶液一定比不饱和溶液浓
C.将硝酸钾的热饱和溶液降低温度后可得硝酸钾晶体
D.不饱和溶液转化为饱和溶液,溶质质量一定改变
C
概念 在一定温度下,某固态物质在 g溶剂里达到 状态时所溶解的质量
影响 因素 内因 溶质和溶剂的性质
外因 温度
与溶解性 的关系
饱和
100
考点3溶解度(5年5考)
※2022年版课标:能从定性和定量的视角,说明溶解度的含义。
1.固体溶解度[2024.16(1);2021.13(3)]
2.气体溶解度
概念 该气体的压强为101 kPa和一定温度时,在1体积水里溶解达到饱和状态时的气体体积
影响 因素 内因 气体和溶剂本身的性质
外因 ①温度:压强一定时,温度越高,气体的溶解度越小
②压强:温度一定时,压强越大,气体的溶解度越大
3.溶解度的应用(近4年连续考查)
提分3 (2024·成都中考)将某碳酸饮料拧开,倒入装有冰块的杯中,如图所示。下列分析合理的是( )
A.拧开瓶盖后,二氧化碳的溶解度变大
B.产生气泡的原因是饮料与冰发生化学反应
C.冒泡刚结束时,饮料仍然是二氧化碳的饱和溶液
D.该现象能说明二氧化碳溶解度与压强、温度的关系
C
考点4溶质的质量分数(5年4考)
※2022年版课标:①能从定性和定量的视角,说明溶质质量分数的含义;②能进行溶质质量分数的简单计算
1.溶质的质量分数(2023.12B、C;2022.12A、C)
(1)概念: 与 之比叫作溶质质量分数。
(2)计算公式
①所有溶液:溶质质量分数=×100%。
②饱和溶液:溶质质量分数=×100%(S表示溶解度)。
溶液质量
溶质质量
2.溶液的稀释
(1)依据:溶液稀释前后, 的质量不会发生变化。
(2)计算公式:A×a%=B×b%(A、B分别为稀释前后溶液的质量,a%、b%分别为稀释前后溶质的质量分数)。
3.一定溶质质量分数的氯化钠溶液的配制(近5年连续考查)
溶质
提分4 (2024·重庆中考)KCl的溶解度随温度升高而增大,40 ℃时KCl的溶解度为40 g,在该温度下,依据下表数据进行KCl溶于水的实验。下列说法正确的是( )
A.在上述实验所得的溶液中,溶质质量分数:①>②
B.实验③所得溶液中,溶质与溶剂的质量比为3∶7
C.将实验②③的溶液分别降温,一定都有晶体析出
D.将实验①③的溶液按一定比例混合可得到与②浓度相等的溶液
D
实验编号 ① ② ③
KCl的质量/g 10 20 30
水的质量/g 50 60 70
重点实验突破
实验七 一定溶质质量分数的氯化钠溶液的配制
※2022年版课标:能根据需要配制一定溶质质量分数的溶液。
一、用固体试剂配制溶液(以配制50 g质量分数为6%的氯化钠溶液为例)
实验用品 托盘天平(带砝码)、称量纸、药匙、量筒、胶头滴管、烧杯、玻璃棒、空试剂瓶、空白标签
氯化钠、蒸馏水
实验过程
实验 步骤 计算 所需氯化钠的质量为50 g×6 %=3 g;所需水的质量为50 g-3 g=47 g,体积约为47 mL(选用50 mL量筒量取)
称量 遵循“左物右码”的原则,且左右两盘需垫相同质量的称量纸
量取 ①液面接近所需体积时改用胶头滴管滴加;
②读数时量筒需放平,且视线要与量筒内液体凹液面的最低处保持水平
溶解 ①溶解过程中玻璃棒的作用是搅拌,加快溶解速率;
②溶解不能在量筒中进行
装瓶贴 标签 将配制好的溶液装入试剂瓶中,盖好瓶塞并贴上标签
二、用浓溶液配制稀溶液
实验仪器 量筒、胶头滴管、烧杯、玻璃棒、空试剂瓶、空白标签
实验 步骤 计算 浓溶液的质量=
加入水的质量=稀溶液的质量-浓溶液的质量
量取 用量筒量取所需体积的浓溶液和水,倒入烧杯中
溶解 用玻璃棒搅拌,使液体混合均匀
装瓶贴标签 将配制好的溶液装入试剂瓶中,盖好瓶塞并贴上标签
三、误差分析
误差 原因 举例
结果 偏小 溶质的量偏少 ①溶质本身不纯;②“左码右物”称量,且用到游码;③称量好的固体试剂有撒落;④固体试剂倒入烧杯时,称量纸上残留了少量固体试剂
溶剂的量偏多 ①量取水时仰视读数;②烧杯中原来有少量水
结果 偏大 溶质的量偏多 ①所用砝码生锈;②量取浓溶液时仰视读数
溶剂的量偏少 ①量取水时俯视读数;②量取的水没有完全转移到烧杯中
无影响 — 配好的溶液转移过程中部分洒出
针对训练
1.在实验操作考试中,小明的题目是配制60 g溶质质量分数为5%的氯化钠溶液。
【基础设问】
(1)请用图中序号表示配制该溶液的正确操作顺序:
。
②⑤①④③
(2)小明应称取NaCl固体 g 。在称量的过程中,发现托盘天平的指针向右偏转,此时小明应该 (填字母序号)。
A.增加适量NaCl
B.减少适量NaCl
C.增加砝码
D.调节平衡螺母
(3)操作③中玻璃棒的作用是 。
搅拌,加快溶解速率
A
3.0
答案:如图所示
(4)将配制好的氯化钠溶液装入 (填“广口瓶”或“细口瓶”)中,密封好并贴上标签,请填写如图标签的有关内容。
细口瓶
【偏差分析】
(5) 实验结束后,小组同学对实验过程进行分析并构建了如图造成误差的思维模型,请补全模型并分析误差产生的原因(从下列选项中选择)。
大
小
b
de
小
大
ac
f
a.用托盘天平称NaCl固体时,砝码放在左盘
(使用了游码)
b.砝码生锈或沾有污渍
c.将称量好的NaCl固体转移至烧杯时,
部分NaCl撒落
d.量取蒸馏水时俯视液面
e.量取好的水倒入烧杯中时有水溅出
f.烧杯中原来有少量水
2.(2024·乐山中考)实验室现有质量分数为8%的氯化钠溶液,但在实验中需要50 g质量分数为4%的氯化钠溶液,某同学准备用8%的氯化钠溶液和蒸馏水(密度为1.0 g·cm-3)进行配制。
(1)计算配制时需要8%的氯化钠溶液的质量为 g。
(2)量取蒸馏水时应选择量程为 (填“10”“20”或“50”)mL的量筒。
50
25
(3)如图所示的仪器中,本实验不会使用到的是_________
(填仪器名称)。
(4)将配制好的氯化钠溶液装入试剂瓶时有少量溶液洒出,对所配制氯化钠溶液质量分数的影响是 (填“偏大”“偏小”或“不影响”)。
不影响
酒精灯
(5)如图甲为50 mL溶质质量分数为10%的蔗糖溶液模型,其中5个“ ”代表所有的蔗糖分子。往该溶液中加水使其溶质质量分数稀释为5%(不考虑溶液密度变化)。在图乙中,补充完成稀释后的蔗糖溶液模型(要求画出液面和蔗糖分子分布)。
答案:如图所示(蔗糖分子均匀分布)
实验八 粗盐中难溶性杂质的去除
※2022年版课标:能利用物质的溶解性,设计粗盐提纯等物质分离的方案。
1.实验步骤及操作
实验步骤 实验操作
溶解 ①用天平称取一定量粗盐;②用药匙将该粗盐逐渐加入盛有水的烧杯,并用玻璃棒不断搅拌,加快溶解,直至粗盐不再溶解;③称量剩余粗盐的质量
过滤 将粗盐水用玻璃棒引流进入漏斗中过滤。若滤液仍浑浊,应再过滤一次
蒸发 加热时,用玻璃棒不断搅拌,防止因局部温度过高,造成液滴飞溅。当蒸发皿中出现较多固体时,停止加热。利用蒸发皿的余热使滤液蒸干
计算产率 用玻璃棒把固体转移到称量纸上,称量并计算精盐产率;产率=×100%
2.误差分析
结果 原因
产率偏低 ①粗盐未充分溶解就过滤;②过滤时有滤液损失;③蒸发时有液体溅出;④转移固体时有部分精盐粘在蒸发皿上
产率偏高 ①过滤时液面高于滤纸边缘、滤纸破损;②蒸发时未完全蒸干
针对训练
化学兴趣小组为了除去粗盐中的难溶性杂质,进行了如图操作。
【基础设问】
(1)上述操作中错误的一处是 ,改正后该实验的正确操作顺序是 (填序号)。
②⑤①④③
操作④没有使用玻璃棒引流
(2)操作③中用玻璃棒搅拌的目的是 _
,当蒸发皿中出现 时停止加热。
(3)经过操作④后,滤液仍然浑浊,可能的原因是 _
(写出1点即可),此时可采取的措施是 。
(4)经过上述实验操作后,所得精盐属于 (填“混合物”或“纯净物”)。
(5)除去粗盐中的泥沙是利用氯化钠和泥沙的 不同。若提纯含少量泥沙的粗盐样品10 g,实验结束后称量得到7.25 g固体,计算精盐的产率为 。
72.5%
溶解性
混合物
重新过滤
面高于滤纸边缘或承接滤液的烧杯不干净)
滤纸破损(或液
较多固体
液滴飞溅
防止因局部温度过高,造成
【偏差分析】
(6) 小组同学在计算产率时发现计算结果与理论值不符,对实验过程进行分析并构建了如图造成误差的思维模型,请补全模型并分析误差产生的原因(从下列选项中选择)。
小
abdeg
大
cf
a.粗盐未完全溶解就过滤
b.过滤时有液体溅出
c.过滤时漏斗内液面超过滤纸边缘
d.溶液转移至蒸发皿中时有液体洒落
e.蒸发时没有搅拌,液滴飞溅
f.精盐未完全干燥就称量
g.从蒸发皿中转移精盐时有撒落
【实验拓展】
(7)老师建议在溶解和过滤之间增加“溶液静置”的步骤,其目的是 。
(8)如图为NaCl的溶解度曲线。
使较多难溶性杂质充分沉降,加快过滤速度
①从节约能源和提高产率的角度分析,20 ℃时溶解5 g粗盐样品时所需水的最佳体积是 (填“5”“15”或“30”)mL。
②从NaCl的溶解度曲线分析,实验中用蒸发结晶而不用降温结晶的方法提纯粗盐的原因是 _
。
的升高变化不大
氯化钠的溶解度随温度
15
小组同学建构了“物质除杂”的思维模型(如图)来解决从粗盐中提取氯化钠的问题,已知粗盐中还含有氯化镁、氯化钙、硫酸钠和泥沙。
(9)粗盐中混有少量的泥沙,用过滤的方法除去。该方法属于上述模型中的 (填“分离转移”或“反应转化”)。
(10)根据“性质差异”,为除去粗盐中的可溶性杂质,可加入 (填字母序号)。
A.NaOH溶液 B.BaCl2溶液 C.Ba(NO3)2溶液 D.Na2CO3溶液
ABD
分离转移
同课章节目录
