四川省内江市2024-2025学年高二上学期期末检测化学试题(PDF版,含答案)
文档属性
| 名称 | 四川省内江市2024-2025学年高二上学期期末检测化学试题(PDF版,含答案) |

|
|
| 格式 | |||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-17 00:00:00 | ||
图片预览

文档简介
内江市2024-2025学年度第一学期高二期末检测题
化学
本试卷共6页。全卷满分100分,考试时间为75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考号、班级用签字笔填写在答题卡相应位置。
2.选择题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦
千净后,再选涂其它答案。不能答在试题卷上。
3.非选择题用签字笔将答案直接答在答题卡相应位置上。
4,考试结束后,监考人员将答题卡收回。
可能用到的相对原子质量:H一1N一140一16Na一23S—32Cu64
一、选择题(本大题包括14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1.化学与生产、生活密切相关。下列说法错误的是
A.“暖宝宝贴”利用了原电池原理加快铁的腐蚀放热
B.将铁门上的铁钉替换为铜钉,可以延缓铁门的锈蚀
C.食盐溶解、花香四溢均是由于熵增而得以自发进行的过程
D.合成氨工业中采用循环操作,主要是为了提高原料利用率
2.下列措施对增大化学反应速率有明显效果的是
A.Fe与稀硫酸反应制取H2时,改用98%浓硫酸
B.Na与水反应时,增加水的用量
C.Na,SO,溶液与BaCL2溶液反应时,增大压强
D.黄铁矿燃烧时,将矿石预先粉碎
3.下列事实不能用勒夏特列原理解释的是
A.硫酸工业中使SO,转化为S0,实际生产时采用的压强为常压
B.夏天打开啤酒瓶时,会在瓶口逸出气体
C.光照新制氯水时,溶液的颜色逐渐变浅
D.由NO2(g)和N2O,(g)组成的平衡体系,加压后分子数减少
4.室温下,欲配制1mol/LA1Cl3溶液并测其pH。下列说法正确的是
A.该溶液pH>7
B.实验室配制ACL3溶液时,常常要加适量盐酸
C.若加水稀释,溶液pH减小
D.测pH时,将AICl,溶液直接滴在润湿的pH试纸上,然后与标准比色卡比较
5.下列事实对应的离子方程式或电极反应式书写正确的是
A.NaS03溶液呈碱性:S0+2H20一H,S03+20H
B.H,S在水中电离:H,S+H20=H,O+HS
C.铁在潮湿空气中生成红褐色的铁锈,其负极的电极反应式:Fe-3e一Fe3+
D.碱性锌锰干电池的负极反应式:Zn-2eˉ=Zn2+
高二化学试卷第1页(共6页)
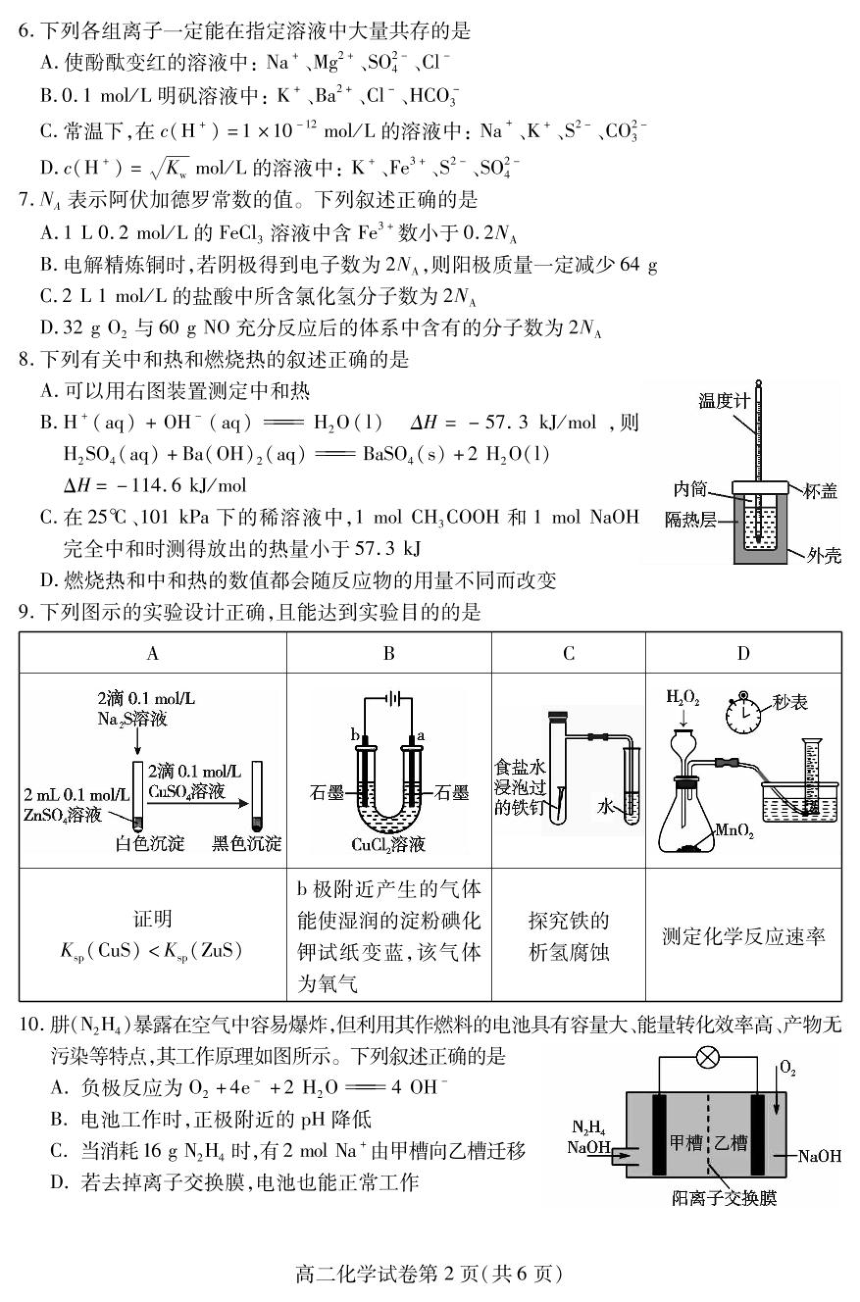
6.下列各组离子一定能在指定溶液中大量共存的是
A.使酚酞变红的溶液中:Na、Mg2+、S0子、C
B.0.1mol/L明矾溶液中:K+、Ba2+、C1、HCO
C.常温下,在c(H*)=1×10-2mol/L的溶液中:Na、K+、S2-、CO
D.c(H)=√Kmol/L的溶液中:K+、Fe3+、S2-、S0好
7.N,表示阿伏加德罗常数的值。下列叙述正确的是
A.1L0.2mol/L的FeCl,溶液中含Fe3+数小于0.2W
B.电解精炼铜时,若阴极得到电子数为2W、,则阳极质量一定减少64g
C.2L1mo/L的盐酸中所含氯化氢分子数为2NA
D.32g02与60gN0充分反应后的体系中含有的分子数为2N
8.下列有关中和热和燃烧热的叙述正确的是
A.可以用右图装置测定中和热
温度计
B.H*(aq)+0H(aq)一H,0(1)△H=-57.3kJ/mol,则
H,S04(ag)+Ba(OH)2(aq)=BaS04(s)+2H20(1)
△H=-114.6kJ/mol
内简
杯盖
C.在25℃、101kPa下的稀溶液中,1 mol CH3COOH和1 mol NaOH
隔热层
完全中和时测得放出的热量小于57.3kJ
外壳
D.燃烧热和中和热的数值都会随反应物的用量不同而改变
9.下列图示的实验设计正确,且能达到实验目的的是
A
B
C
D
2滴0.1mo/L
H,O:
NaS溶液
8秒表
2滴0.1moL
食盐水
2 mL 0.1 mol/L
GnS0溶液
石
石
没泡过
ZnS0,溶液
的铁钉
白色沉淀
黑色沉淀
CuCL,溶液
b极附近产生的气体
证明
能使湿润的淀粉碘化
探究铁的
测定化学反应速率
K.(CuS)钾试纸变蓝,该气体
析氢腐蚀
为氧气
10.肼(N,H,)暴露在空气中容易爆炸,但利用其作燃料的电池具有容量大、能量转化效率高、产物无
污染等特点,其工作原理如图所示。下列叙述正确的是
8
A.负极反应为02+4e+2H,0=40H
B.电池工作时,正极附近的pH降低
N,H.
C.当消耗16gN,H4时,有2 mol Na由甲槽向乙槽迁移
NaOH
甲槽!乙槽
-NaOH
D.若去掉离子交换膜,电池也能正常工作
阳离子交换腆
高二化学试卷第2页(共6页)
化学
本试卷共6页。全卷满分100分,考试时间为75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考号、班级用签字笔填写在答题卡相应位置。
2.选择题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦
千净后,再选涂其它答案。不能答在试题卷上。
3.非选择题用签字笔将答案直接答在答题卡相应位置上。
4,考试结束后,监考人员将答题卡收回。
可能用到的相对原子质量:H一1N一140一16Na一23S—32Cu64
一、选择题(本大题包括14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1.化学与生产、生活密切相关。下列说法错误的是
A.“暖宝宝贴”利用了原电池原理加快铁的腐蚀放热
B.将铁门上的铁钉替换为铜钉,可以延缓铁门的锈蚀
C.食盐溶解、花香四溢均是由于熵增而得以自发进行的过程
D.合成氨工业中采用循环操作,主要是为了提高原料利用率
2.下列措施对增大化学反应速率有明显效果的是
A.Fe与稀硫酸反应制取H2时,改用98%浓硫酸
B.Na与水反应时,增加水的用量
C.Na,SO,溶液与BaCL2溶液反应时,增大压强
D.黄铁矿燃烧时,将矿石预先粉碎
3.下列事实不能用勒夏特列原理解释的是
A.硫酸工业中使SO,转化为S0,实际生产时采用的压强为常压
B.夏天打开啤酒瓶时,会在瓶口逸出气体
C.光照新制氯水时,溶液的颜色逐渐变浅
D.由NO2(g)和N2O,(g)组成的平衡体系,加压后分子数减少
4.室温下,欲配制1mol/LA1Cl3溶液并测其pH。下列说法正确的是
A.该溶液pH>7
B.实验室配制ACL3溶液时,常常要加适量盐酸
C.若加水稀释,溶液pH减小
D.测pH时,将AICl,溶液直接滴在润湿的pH试纸上,然后与标准比色卡比较
5.下列事实对应的离子方程式或电极反应式书写正确的是
A.NaS03溶液呈碱性:S0+2H20一H,S03+20H
B.H,S在水中电离:H,S+H20=H,O+HS
C.铁在潮湿空气中生成红褐色的铁锈,其负极的电极反应式:Fe-3e一Fe3+
D.碱性锌锰干电池的负极反应式:Zn-2eˉ=Zn2+
高二化学试卷第1页(共6页)
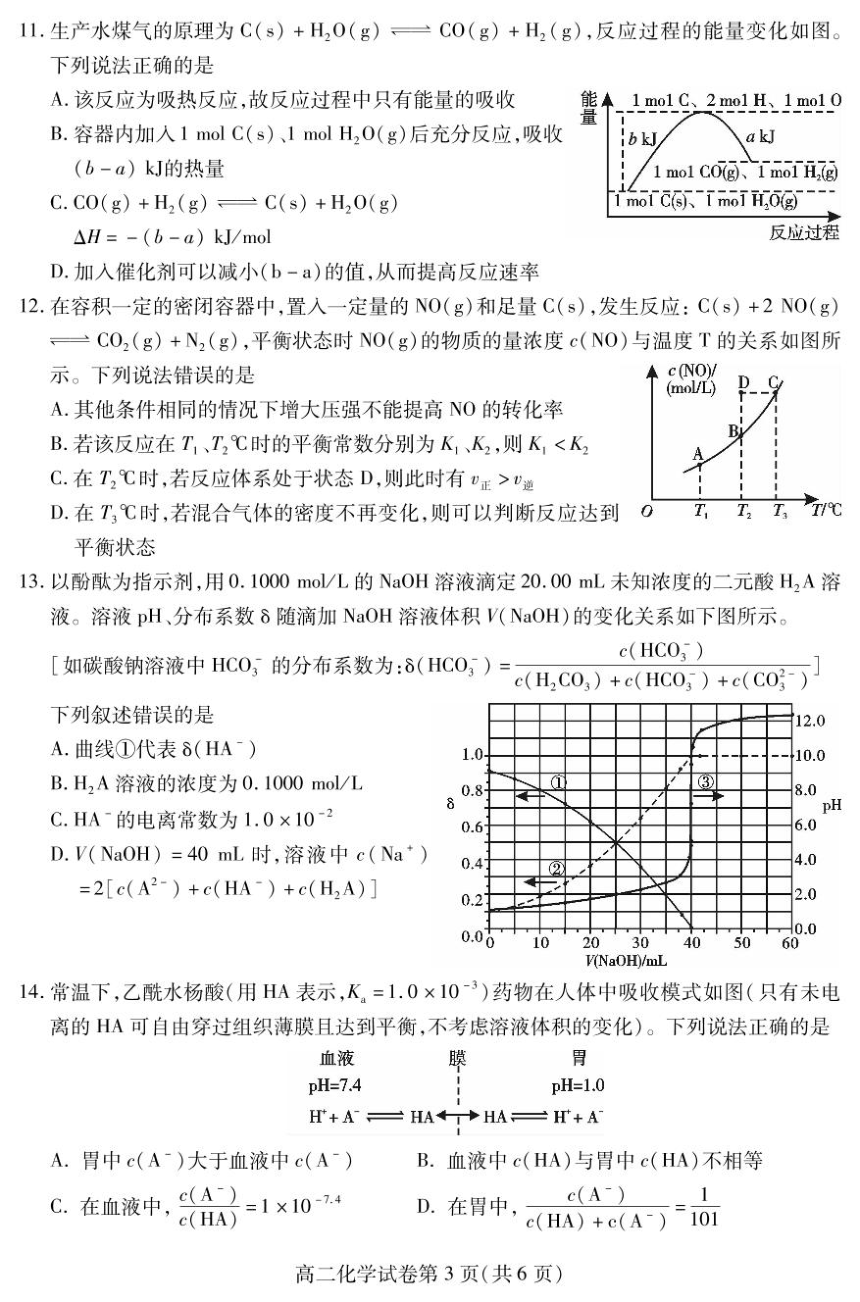
6.下列各组离子一定能在指定溶液中大量共存的是
A.使酚酞变红的溶液中:Na、Mg2+、S0子、C
B.0.1mol/L明矾溶液中:K+、Ba2+、C1、HCO
C.常温下,在c(H*)=1×10-2mol/L的溶液中:Na、K+、S2-、CO
D.c(H)=√Kmol/L的溶液中:K+、Fe3+、S2-、S0好
7.N,表示阿伏加德罗常数的值。下列叙述正确的是
A.1L0.2mol/L的FeCl,溶液中含Fe3+数小于0.2W
B.电解精炼铜时,若阴极得到电子数为2W、,则阳极质量一定减少64g
C.2L1mo/L的盐酸中所含氯化氢分子数为2NA
D.32g02与60gN0充分反应后的体系中含有的分子数为2N
8.下列有关中和热和燃烧热的叙述正确的是
A.可以用右图装置测定中和热
温度计
B.H*(aq)+0H(aq)一H,0(1)△H=-57.3kJ/mol,则
H,S04(ag)+Ba(OH)2(aq)=BaS04(s)+2H20(1)
△H=-114.6kJ/mol
内简
杯盖
C.在25℃、101kPa下的稀溶液中,1 mol CH3COOH和1 mol NaOH
隔热层
完全中和时测得放出的热量小于57.3kJ
外壳
D.燃烧热和中和热的数值都会随反应物的用量不同而改变
9.下列图示的实验设计正确,且能达到实验目的的是
A
B
C
D
2滴0.1mo/L
H,O:
NaS溶液
8秒表
2滴0.1moL
食盐水
2 mL 0.1 mol/L
GnS0溶液
石
石
没泡过
ZnS0,溶液
的铁钉
白色沉淀
黑色沉淀
CuCL,溶液
b极附近产生的气体
证明
能使湿润的淀粉碘化
探究铁的
测定化学反应速率
K.(CuS)
析氢腐蚀
为氧气
10.肼(N,H,)暴露在空气中容易爆炸,但利用其作燃料的电池具有容量大、能量转化效率高、产物无
污染等特点,其工作原理如图所示。下列叙述正确的是
8
A.负极反应为02+4e+2H,0=40H
B.电池工作时,正极附近的pH降低
N,H.
C.当消耗16gN,H4时,有2 mol Na由甲槽向乙槽迁移
NaOH
甲槽!乙槽
-NaOH
D.若去掉离子交换膜,电池也能正常工作
阳离子交换腆
高二化学试卷第2页(共6页)
同课章节目录
