《几种常见的酸》ppt课件 (共30张PPT)
文档属性
| 名称 | 《几种常见的酸》ppt课件 (共30张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-05-03 00:00:00 | ||
图片预览




文档简介
课件29张PPT。柠檬山楂酸桔子生活中“尝起来酸酸的”酸“摸起来滑滑的”生活中碱 酸和碱的探究之旅
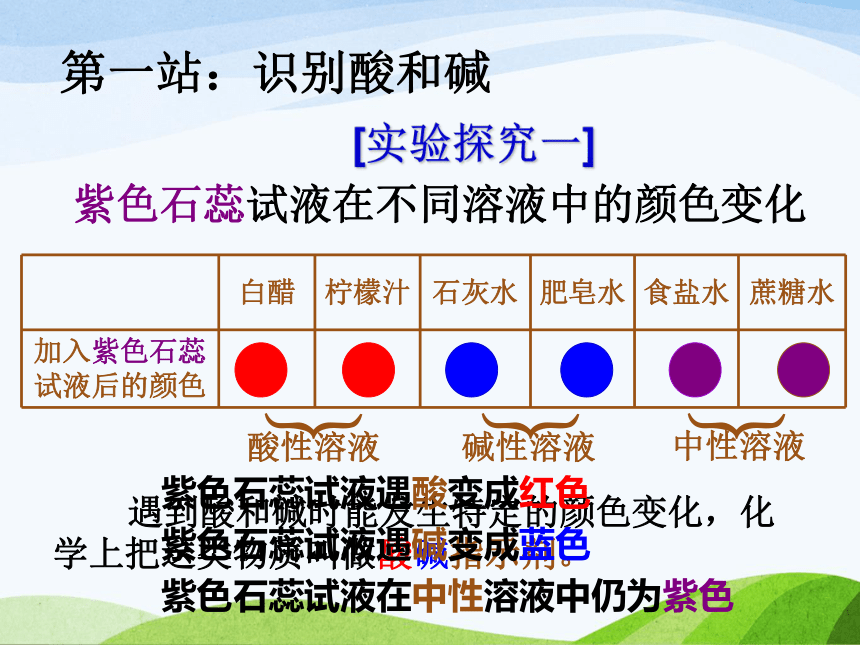
……第一站:识别酸和碱[实验探究一]紫色石蕊试液在不同溶液中的颜色变化︸︸︸酸性溶液中性溶液碱性溶液 遇到酸和碱时能发生特定的颜色变化,化学上把这类物质叫做酸碱指示剂。紫色石蕊试液遇酸变成红色
紫色石蕊试液遇碱变成蓝色
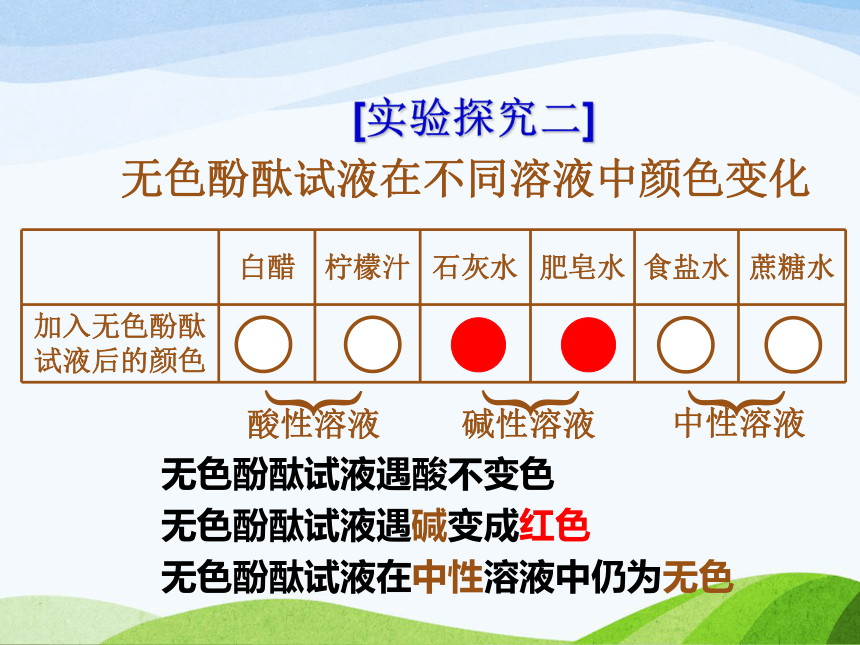
紫色石蕊试液在中性溶液中仍为紫色 一天清晨,波义耳偶然将浓盐酸溅到了紫罗兰花瓣儿上。喜爱鲜花的他急忙用水把花冲洗了一下。过了一会儿,他惊奇的发现紫罗兰花瓣儿颜色变红了!波义耳没有放弃这一奇怪的现象,提出了许多猜想和假设并做了大量的实验来验证猜想,由此他发现大部分花草受酸性或碱性物质作用都能改变颜色。其中一种叫做石蕊地衣的植物效果最明显,它的紫色浸液遇酸溶液变红,遇碱溶液变蓝。这就是最早使用的紫色石蕊试液。小资料[实验探究二]无色酚酞试液在不同溶液中颜色变化︸︸︸酸性溶液中性溶液碱性溶液无色酚酞试液遇酸不变色
无色酚酞试液遇碱变成红色
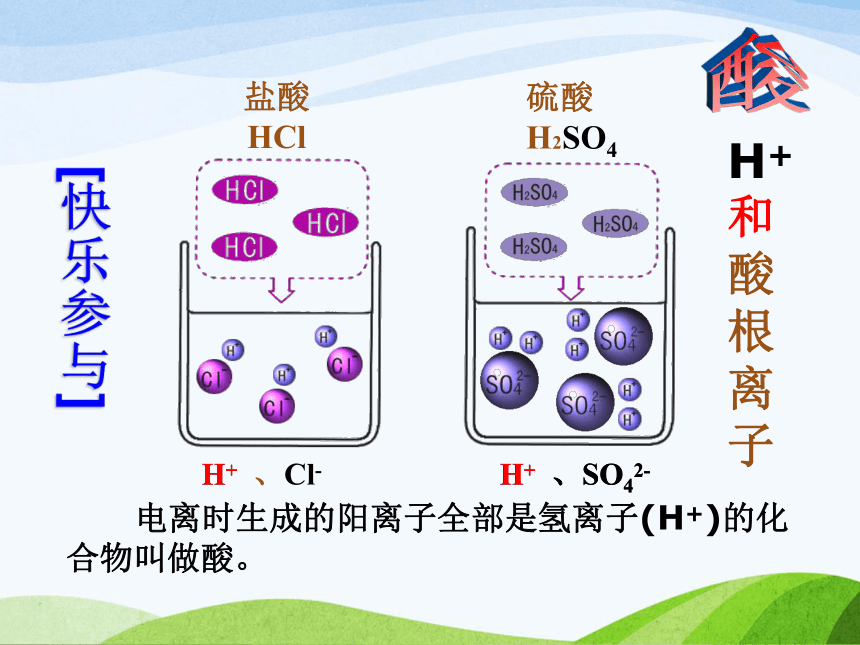
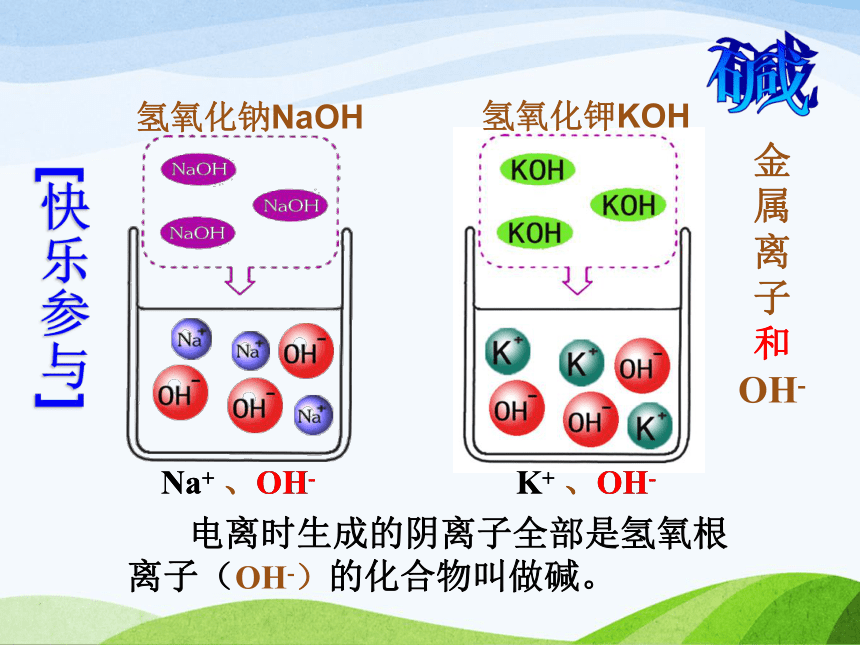
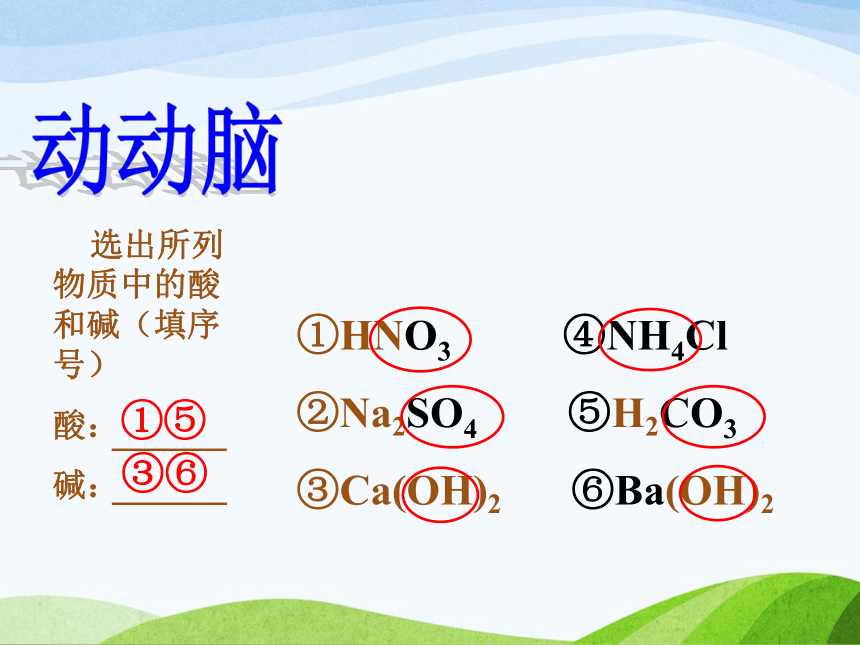
无色酚酞试液在中性溶液中仍为无色[快乐参与]H+ 、Cl- H+ 、SO42-H+ H+ 、SO42- 电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。 酸H+和酸根离子 电离时生成的阴离子全部是氢氧根离子(OH-)的化合物叫做碱。 氢氧化钾KOH[快乐参与]氢氧化钠NaOHNa+ 、OH- K+ 、OH- Na+ 、OH- K+ 、OH- 碱金属离子和OH- 动动脑 选出所列物质中的酸和碱(填序号)
酸:
碱:①HNO3 ④NH4Cl
②Na2SO4 ⑤H2CO3
③Ca(OH)2 ⑥Ba(OH)2①⑤③⑥旅途拾趣原子团氢氧根 OH-硫酸根 SO42-硝酸根 NO3-碳酸根 CO32-铵根 NH4+第二站:溶液酸碱性的强弱程度我的课堂·我做主1.溶液酸碱性强弱程度用pH表示溶液酸碱性的强弱程度跟什么有关?
pH的范围如何规定?
pH的大小与溶液酸碱性有什么关系?
pH如何测定?一定量的水溶液中H+的数量越多,酸性越强。
一定量的水溶液中OH-的数量越多,碱性越强。pH的范围通常在0~14之间中性pH<7 溶液显酸性pH=7 溶液显中性pH>7 溶液显碱性第二站:溶液酸碱性的强弱程度1.溶液酸碱性强弱程度用pH表示(pH的范围通常在0~14之间)中性2.pH的测定——pH试纸 在玻璃片或白瓷板上放一片pH 试纸,用玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH 。第二站:溶液酸碱性的强弱程度动手实验 快乐无限用pH试纸测定生活中常见物质的pH。生活中常见物质的pH第二站:溶液酸碱性的强弱程度一、浓盐酸和浓硫酸无色液体无色、粘稠、
油状的液体瓶口有白雾无现象有刺激性气味无气味浓盐酸具有很强的挥发性,挥发出来的HCl气体溶解在空气中的水蒸气中,形成盐酸小液滴。1.19g/mL1.84g/mL浓盐酸(1)盐酸是HCl气体的水溶液
(2) 浓盐酸具有很强的挥发性,挥发出来的HCl气体溶解在空气中的水蒸气中,形成
盐酸小液滴——白雾?敞口放置在空气中的浓盐酸质量将如何变?
溶质的质量分数将如何变?浓硫酸(1)吸水性:
浓硫酸可吸收空气中、溶液中的水。
用途:作干燥剂
【例如】实验室要想得到干燥的二氧化碳气体可将气体通过浓硫酸
?敞口放置在空气中的浓硫酸质量将如何变?
溶质的质量分数将如何变?问:如果不小心将浓硫酸和浓盐酸露置于空气中很长的时间,请同学们从溶液组成上(溶质、溶剂、溶质的质量分数)分析它们发生了哪些变化?不变变小变大不变变小变小变大变小(2)脱水性滴有浓硫酸的部位
变黑,甚至烧成洞纸上显出黑色字迹蘸有浓硫酸的部位变黑浓硫酸有强烈的腐蚀性:
浓硫酸能将纸张、木材、布料、皮肤中的
氢、氧元素按水的组成比脱去,生成黑色的
炭。 这种作用叫做脱水作用。)(3)浓硫酸的稀释:浓硫酸稀释的错误操作水的密度较小,
浮在浓硫酸上
面,溶解时放出
的热会使水立
刻沸腾,使硫酸
液滴向四周飞
溅,这是非常危
险的.浓硫酸稀释的正确操作在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌.切不可将水倒进浓硫酸里.如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水
冲洗,然后涂上3%---5%的碳酸氢钠溶液.注意:二、稀盐酸、稀硫酸的化学性质1、与酸碱指示剂反应
① 酸溶液能使紫色石蕊试液变成红色,
② 酸溶液不能使无色酚酞试液变色。2、与某些金属反应
金属 + 酸 → 盐 + 氢气
金属活动顺序表Mg+2HCl=MgCl2+H2↑Zn+2HCl=ZnCl2+H2↑Fe+2HCl=FeCl2+H2↑Mg+H2SO4=MgSO4+H2↑Zn +H2SO4=ZnSO4+H2↑Fe +H2SO4=FeSO4+H2↑酸:盐酸、稀硫酸3、与某些金属氧化物反应
金属氧化物 + 酸 → 盐 + 水Fe2O3+6HCl
=2FeCl3+3H2OFe2O3+3H2SO4
=Fe2(SO4)3+3H2OCuO+2HCl
=CuCl2+H2OCuO+H2SO4
=CuSO4+H2O 利用上面的反应可以清除金属制品表面的锈,除锈时能否将金属制品长时间浸在酸中?为什么?4、跟碱反应生成盐和水 中和反应5、跟盐反应生成另一种盐和另一种酸 反应生成不溶于稀硝酸的白色氯化银沉淀。这个反应用于检验盐酸和其他电离时能产生氯离子的化合物。 反应生成不溶于稀硝酸的白色硫酸钡沉淀。这个反应用于检验硫酸和其他电离时能产生硫酸根离子的化合物。 该反应可用于检验CO32-,其方法是:在物质中先滴加稀盐酸,有大量气泡产生,再用澄清石灰水检验生成的气体,澄清石灰水变浑浊,则气体为CO2,原物质中一定含有CO32- 。复分解反应复分解反应
由两种化合物相互交换成分,分别生成两种新的
化合物的反应,叫复分解反应。 复分解反应可用这个式子表示:AB+CD=AD+CB
复分解反应发生的条件:
①有沉淀生成
②生成气体
③生成水三个条件满足
其一即可
……第一站:识别酸和碱[实验探究一]紫色石蕊试液在不同溶液中的颜色变化︸︸︸酸性溶液中性溶液碱性溶液 遇到酸和碱时能发生特定的颜色变化,化学上把这类物质叫做酸碱指示剂。紫色石蕊试液遇酸变成红色
紫色石蕊试液遇碱变成蓝色
紫色石蕊试液在中性溶液中仍为紫色 一天清晨,波义耳偶然将浓盐酸溅到了紫罗兰花瓣儿上。喜爱鲜花的他急忙用水把花冲洗了一下。过了一会儿,他惊奇的发现紫罗兰花瓣儿颜色变红了!波义耳没有放弃这一奇怪的现象,提出了许多猜想和假设并做了大量的实验来验证猜想,由此他发现大部分花草受酸性或碱性物质作用都能改变颜色。其中一种叫做石蕊地衣的植物效果最明显,它的紫色浸液遇酸溶液变红,遇碱溶液变蓝。这就是最早使用的紫色石蕊试液。小资料[实验探究二]无色酚酞试液在不同溶液中颜色变化︸︸︸酸性溶液中性溶液碱性溶液无色酚酞试液遇酸不变色
无色酚酞试液遇碱变成红色
无色酚酞试液在中性溶液中仍为无色[快乐参与]H+ 、Cl- H+ 、SO42-H+ H+ 、SO42- 电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。 酸H+和酸根离子 电离时生成的阴离子全部是氢氧根离子(OH-)的化合物叫做碱。 氢氧化钾KOH[快乐参与]氢氧化钠NaOHNa+ 、OH- K+ 、OH- Na+ 、OH- K+ 、OH- 碱金属离子和OH- 动动脑 选出所列物质中的酸和碱(填序号)
酸:
碱:①HNO3 ④NH4Cl
②Na2SO4 ⑤H2CO3
③Ca(OH)2 ⑥Ba(OH)2①⑤③⑥旅途拾趣原子团氢氧根 OH-硫酸根 SO42-硝酸根 NO3-碳酸根 CO32-铵根 NH4+第二站:溶液酸碱性的强弱程度我的课堂·我做主1.溶液酸碱性强弱程度用pH表示溶液酸碱性的强弱程度跟什么有关?
pH的范围如何规定?
pH的大小与溶液酸碱性有什么关系?
pH如何测定?一定量的水溶液中H+的数量越多,酸性越强。
一定量的水溶液中OH-的数量越多,碱性越强。pH的范围通常在0~14之间中性pH<7 溶液显酸性pH=7 溶液显中性pH>7 溶液显碱性第二站:溶液酸碱性的强弱程度1.溶液酸碱性强弱程度用pH表示(pH的范围通常在0~14之间)中性2.pH的测定——pH试纸 在玻璃片或白瓷板上放一片pH 试纸,用玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH 。第二站:溶液酸碱性的强弱程度动手实验 快乐无限用pH试纸测定生活中常见物质的pH。生活中常见物质的pH第二站:溶液酸碱性的强弱程度一、浓盐酸和浓硫酸无色液体无色、粘稠、
油状的液体瓶口有白雾无现象有刺激性气味无气味浓盐酸具有很强的挥发性,挥发出来的HCl气体溶解在空气中的水蒸气中,形成盐酸小液滴。1.19g/mL1.84g/mL浓盐酸(1)盐酸是HCl气体的水溶液
(2) 浓盐酸具有很强的挥发性,挥发出来的HCl气体溶解在空气中的水蒸气中,形成
盐酸小液滴——白雾?敞口放置在空气中的浓盐酸质量将如何变?
溶质的质量分数将如何变?浓硫酸(1)吸水性:
浓硫酸可吸收空气中、溶液中的水。
用途:作干燥剂
【例如】实验室要想得到干燥的二氧化碳气体可将气体通过浓硫酸
?敞口放置在空气中的浓硫酸质量将如何变?
溶质的质量分数将如何变?问:如果不小心将浓硫酸和浓盐酸露置于空气中很长的时间,请同学们从溶液组成上(溶质、溶剂、溶质的质量分数)分析它们发生了哪些变化?不变变小变大不变变小变小变大变小(2)脱水性滴有浓硫酸的部位
变黑,甚至烧成洞纸上显出黑色字迹蘸有浓硫酸的部位变黑浓硫酸有强烈的腐蚀性:
浓硫酸能将纸张、木材、布料、皮肤中的
氢、氧元素按水的组成比脱去,生成黑色的
炭。 这种作用叫做脱水作用。)(3)浓硫酸的稀释:浓硫酸稀释的错误操作水的密度较小,
浮在浓硫酸上
面,溶解时放出
的热会使水立
刻沸腾,使硫酸
液滴向四周飞
溅,这是非常危
险的.浓硫酸稀释的正确操作在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌.切不可将水倒进浓硫酸里.如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水
冲洗,然后涂上3%---5%的碳酸氢钠溶液.注意:二、稀盐酸、稀硫酸的化学性质1、与酸碱指示剂反应
① 酸溶液能使紫色石蕊试液变成红色,
② 酸溶液不能使无色酚酞试液变色。2、与某些金属反应
金属 + 酸 → 盐 + 氢气
金属活动顺序表Mg+2HCl=MgCl2+H2↑Zn+2HCl=ZnCl2+H2↑Fe+2HCl=FeCl2+H2↑Mg+H2SO4=MgSO4+H2↑Zn +H2SO4=ZnSO4+H2↑Fe +H2SO4=FeSO4+H2↑酸:盐酸、稀硫酸3、与某些金属氧化物反应
金属氧化物 + 酸 → 盐 + 水Fe2O3+6HCl
=2FeCl3+3H2OFe2O3+3H2SO4
=Fe2(SO4)3+3H2OCuO+2HCl
=CuCl2+H2OCuO+H2SO4
=CuSO4+H2O 利用上面的反应可以清除金属制品表面的锈,除锈时能否将金属制品长时间浸在酸中?为什么?4、跟碱反应生成盐和水 中和反应5、跟盐反应生成另一种盐和另一种酸 反应生成不溶于稀硝酸的白色氯化银沉淀。这个反应用于检验盐酸和其他电离时能产生氯离子的化合物。 反应生成不溶于稀硝酸的白色硫酸钡沉淀。这个反应用于检验硫酸和其他电离时能产生硫酸根离子的化合物。 该反应可用于检验CO32-,其方法是:在物质中先滴加稀盐酸,有大量气泡产生,再用澄清石灰水检验生成的气体,澄清石灰水变浑浊,则气体为CO2,原物质中一定含有CO32- 。复分解反应复分解反应
由两种化合物相互交换成分,分别生成两种新的
化合物的反应,叫复分解反应。 复分解反应可用这个式子表示:AB+CD=AD+CB
复分解反应发生的条件:
①有沉淀生成
②生成气体
③生成水三个条件满足
其一即可
