2025届新高考化学综合课堂限时练习卷2(含解析)
文档属性
| 名称 | 2025届新高考化学综合课堂限时练习卷2(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-19 00:00:00 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
高考化学综合练习卷1-2
1.下列说法不正确的是
A.碳酸钠和碳酸氢钠的溶液均显碱性,两者均可作食用碱
B.具有还原性,故少量添加于葡萄酒中能防止部分成分被氧化
C.铵盐都易溶于水,受热分解均生成氨气,故储存时需考虑避光、防潮
D.硬铝的密度小、强度高、抗腐蚀能力强,故可用作制造宇宙飞船的材料
2.设为阿伏加德罗常数的值。下列说法错误的是
A.1mol甲基正离子的质子数为
B.中配位原子的个数为
C.的溶液中O原子数为
D.0.1mol氧气与足量的Na反应,转移的电子数为
3.下列离子方程式书写正确的是
A.向饱和纯碱溶液中通入过量二氧化碳气体:
B.少量SO2通入NaClO溶液中:
C.Ba(OH)2溶液滴加到NaHSO4溶液中至恰好完全沉淀:
D.强碱性溶液中NaClO将Mn2+氧化成MnO2:
4.物质M是合成多种阻燃剂、耐高温材料的中间体原料,M的化学式可表示为。一种制备M的反应为,其中X、Y、Z、W分别代表原子序数依次增大的短周期主族元素,Y、Z同主族,为10电子微粒。下列有关说法正确的是
A.简单氢化物的沸点: B.的模型名称为三角锥形
C.基态Z、W原子核外电子的空间运动状态均为9种
D.实验室常用固体与烧碱加热反应制备
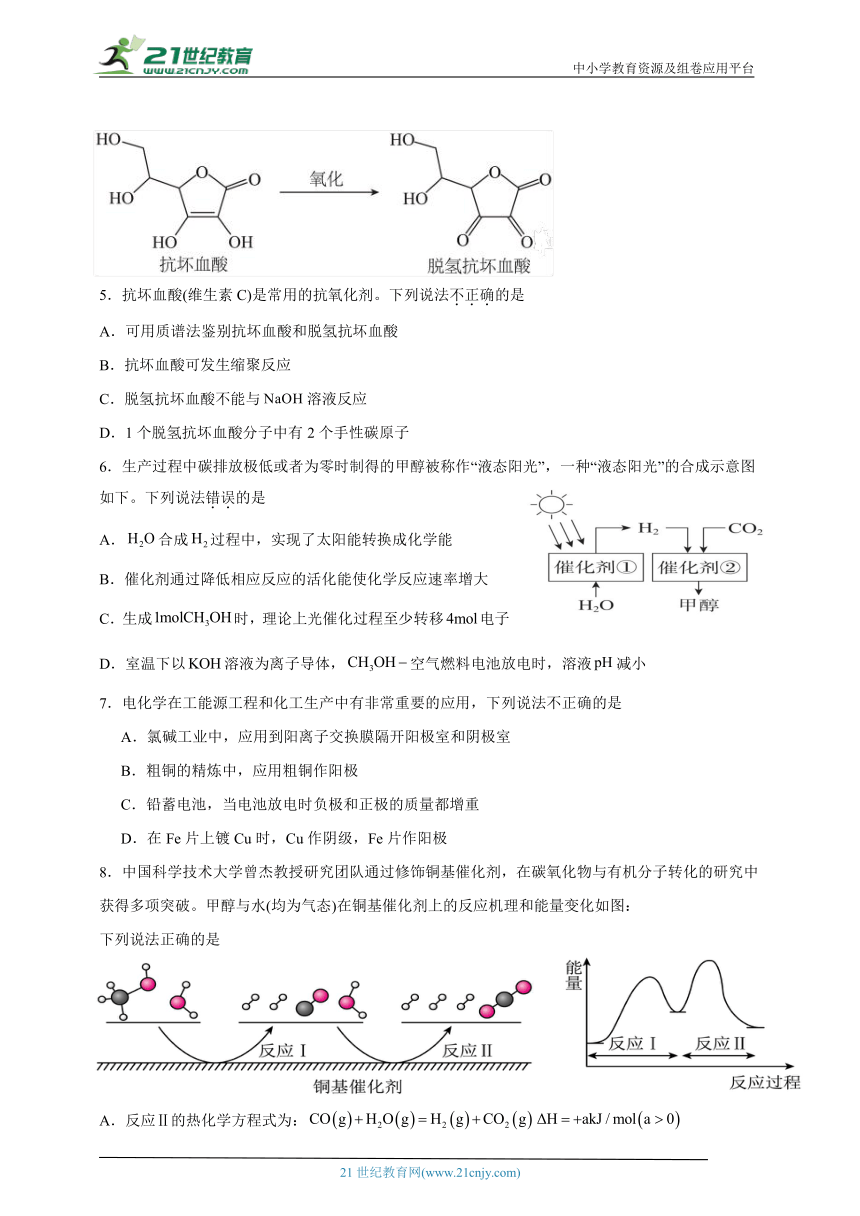
5.抗坏血酸(维生素C)是常用的抗氧化剂。下列说法不正确的是
可用质谱法鉴别抗坏血酸和脱氢抗坏血酸
抗坏血酸可发生缩聚反应
脱氢抗坏血酸不能与溶液反应
1个脱氢抗坏血酸分子中有2个手性碳原子
6.生产过程中碳排放极低或者为零时制得的甲醇被称作“液态阳光”,一种“液态阳光”的合成示意图如下。下列说法错误的是
A.合成过程中,实现了太阳能转换成化学能
B.催化剂通过降低相应反应的活化能使化学反应速率增大
C.生成时,理论上光催化过程至少转移电子
D.室温下以溶液为离子导体,空气燃料电池放电时,溶液减小
7.电化学在工能源工程和化工生产中有非常重要的应用,下列说法不正确的是
A.氯碱工业中,应用到阳离子交换膜隔开阳极室和阴极室
B.粗铜的精炼中,应用粗铜作阳极
C.铅蓄电池,当电池放电时负极和正极的质量都增重
D.在Fe片上镀Cu时,Cu作阴级,Fe片作阳极
8.中国科学技术大学曾杰教授研究团队通过修饰铜基催化剂,在碳氧化物与有机分子转化的研究中获得多项突破。甲醇与水(均为气态)在铜基催化剂上的反应机理和能量变化如图:
下列说法正确的是
A.反应Ⅱ的热化学方程式为:
B.总反应的快慢由反应I决定,是因为反应I吸热、反应Ⅱ放热
C.选择优良的催化剂可以降低反应I和Ⅱ的活化能,从而减少反应过程中的能耗
D.反应过程涉及极性共价键、非极性共价键的断裂和形成
9.常用作微量分析试剂、媒染剂和油漆干燥剂。以天然二氧化锰粉与硫化锰矿(还含、、、、、等元素)为原料制备的工艺流程如图所示。回答下列问题:
已知:常温下,部分金属离子形成氢氧化物沉淀的范围如下。
金属离子
开始沉淀的 1.3 3.2 6.2 6.9 7.6 8.1 8.9
沉淀完全的 2.8 4.7 8.2 8.9 9.6 10.1 10.9
(1)元素位于元素周期表 区。
(2)“氧化”工序中发生反应的离子方程式为 。
(3)加入氨水调节溶液的的最大值约为 ;溶于强碱可生成配离子,中的配位数为 。
(4)“滤渣”的主要成分是 (填化学式)。
(5)硫化锰()是一种P型半导体,它具有三种形态,其中呈绿色。将水溶液煮沸,加入稍过量的氨水,趁热通入,加热至沉淀呈暗绿色,过滤,依次用饱和水溶液、乙醇、乙醚洗涤,最后在真空中于120℃下干燥。
①用饱和水溶液洗涤的目的是 。
②最后在真空中于120℃下干燥的目的是 。
③晶胞与晶胞属于同种类型,晶胞结构如图所示,晶胞边长为。位于围成的 空隙中,该晶体的密度为 (用含的代数式表示)。
10.硫代尿素俗称硫脲[],是一种白色晶体,熔点,易溶于水和乙醇,受热时部分转化为硫氰化铵()。可用石灰氮()与在时反应制备硫脲,同时产生石灰乳,其步骤如下:
I.按下图连接好装置,并检验装置的气密性;
Ⅱ.打开通入一段时间,然后关闭;
Ⅲ.将C中的石灰氮溶液加热到,然后打开,慢慢加入液体,并不断搅拌C中溶液;反应结束后,打开再次通入;
Ⅳ.将C中溶液过滤,减压条件下蒸发浓缩,冷却结晶,过滤、洗涤、干燥即得产品。请回答下列问题:
(1)硫脲[]分子的中心C原子的杂化方式为 。
(2)A中试剂的最佳组合为 (填序号)。
①浓硫酸固体 ②浓盐酸固体 ③稀硝酸+FeS固体 ④稀硫酸+FeS固体
(3)B瓶的作用是 。
(4)C中发生反应的化学方程式为 。
(5)实验结束时仍需要向装置中通入,其作用是 。
(6)产品溶液蒸发浓缩时,采用减压条件的目的是 。
(7)测定制得产品的纯度。已知硫脲能与酸性溶液发生反应:。每次均称取产品于锥形瓶中,加入适量蒸馏水溶解,滴加稀硫酸酸化,用的溶液滴定至终点。平行测定三次,平均每次消耗溶液的体积为,则产品中硫脲的质量分数为 (用含a、c、V的代数式表示)。
11.回答下列问题(1)在催化剂作用下,用还原剂[如肼()]选择性地与反应生成和。已知200℃时:ⅰ. kJ·mol ;
ⅱ. kJ·mol 。
①写出肼的电子式: 。
②200℃时,肼分解成氮气和氢气的热化学方程式为 。
(2)工业上,裂解正丁烷可以获得乙烯、丙烯等化工原料。
反应1:(g,正丁烷)
反应2:(g,正丁烷)
某温度下,向2L恒容密闭容器中投入2mol正丁烷,假设控制反应条件,只发生反应1,达到平衡时测得的体积分数为。下列情况表明上述反应达到平衡的是___________(填字母,下同)。
A.混合气体的密度保持不变 B.甲烷、丙烯的生成速率相等
C.混合气体压强保持不变 D.丙烯的体积分数保持不变
(3)亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO和反应得到,化学方程式为。在1L恒容密闭容器中充入2mol和1mol,在不同温度下测得与时间t的关系如图A所示:
①反应开始到10min时NO的平均反应速率 mol·L-1·min-1。
②时该反应的平衡常数 。
12.药物Cinanserin对冠状病毒3CL水解酶具有抑制作用,其合成路线如图:
(1)D物质中含有的官能团名称为: 。(2)B→C的反应类型: 。
(3)反应III分两步进行:第一步反应为加成反应,则X的结构简式为: 。
(4)反应IV需要控制反应温度,否则可能得到的副产物为(写一种即可): 。
(5)写出F生成Cinanserin的化学方程式: 。
(6)化合物M是E的同分异构体,分子中只含有苯环一种环状结构,苯环上有3个取代基,可发生银镜反应,但不能发生水解反应,遇FeCl3溶液不显紫色,则符合条件的M有 种。
《高考化学综合练习卷1-2》参考答案
题号 1 2 3 4 5 6 7 8
答案 C D B C C C D C
9.(1)d
(2)
(3) 6.2 4
(4)
(5) 降低的溶解度,防止溶解损失 防止被氧化 正八面体
10.(1)杂化
(2)④
(3)作安全瓶,防倒吸
(4)
(5)将未反应完的排出,被E中溶液吸收
(6)降低水的沸点,防止受热温度过高转化为硫氰化铵
(7)
11.(1) kJ·mol-1
(2)CD
(3) 0.1 2mol·L-1
12.(1)羟基、羧基
(2)氧化反应
(3)
(4)、、或等任写一种
(5)
(6)6
1.C
【详解】A.碳酸钠和碳酸氢钠都是强酸弱碱盐,在溶液中均能水解使溶液呈碱性,所以两者均可作食用碱,故A正确;
B.二氧化硫具有还原性,少量添加于葡萄酒中能防止部分成分被氧化而延长红酒的保质期,故B正确;
C.硝酸铵一定温度下受热分解生成一氧化二氮和水,不能分解生成氨气,故C错误;
D.硬铝具有密度小、强度高、抗腐蚀能力强的优良性能,所以可用作制造宇宙飞船的材料,故D正确;
故选C。
2.D
【详解】A.1个甲基正离子()的质子数为9个,则1mol甲基正离子()的质子数为9NA,故A正确;
B.中配体为NH3,配位原子为N,中配位原子的个数为4NA,故B正确;
C.乙醇和H2O中都含有氧原子,在100g 46%的乙醇溶液中,CH3CH2OH含有的氧原子物质的量为(100g×46%)÷46g/mol=1mol,H2O中含有氧原子的物质的量为(100g×54%)÷18g/mol=3mol,氧原子总物质的量为4mol,个数为4NA,故C正确;
D.氧气与钠反应可能生成氧化钠也可能生成过氧化钠,在题目中无法判断氧元素是被还原为-1价还是-2价,故无法计算转移的电子数,故D错误;
故选D。
3.B
【详解】A.向饱和纯碱溶液中通入过量二氧化碳气体,析出碳酸氢钠晶体,离子方程式为:,A错误;
B.少量SO2通入NaClO溶液中发生氧化还原反应,生成硫酸根和氢离子,氢离子要继续与过量的次氯酸根结合生成次氯酸,离子方程式为:,B正确;
C.Ba(OH)2溶液滴加到NaHSO4溶液中至恰好完全沉淀,此时氢离子与硫酸根遵循1:1关系,离子方程式为:,C错误;
D.强碱性溶液中NaClO将Mn2+氧化成MnO2,配平时左边加氢氧根,右边生成水,离子方程式为:,D错误;
答案选B。
4.C
【分析】X、Y、Z、W分别代表原子序数依次增大的短周期主族元素,Y、Z同主族,由分子式和为10电子微粒可知推知为,则Y为N,X为H,Z为P,W为,以此解答。
【详解】A.分子间存在氢键,沸点较高,HCl的相对分子质量大于PH3,则HCl分子间作用力比PH3强,沸点比PH3高,则简单氢化物的沸点:,A错误;
B.中心原子价层电子对数为3+=4,模型名称为四面体形,B错误;
C.基态P、原子核外电子排布式分别为1s22s22p63s23p3、1s22s22p63s23p5,含有电子的轨道数均为9,核外电子的空间运动状态均为9种,C正确;
D.NaOH在加热条件下对玻璃仪器有强烈的腐蚀作用且成本相对较高,实验室常用和加热反应制备,D错误;
故选C。
5.C
【详解】A.已知质谱法可以测量有机物的相对分子质量,抗坏血酸和脱氢抗坏血酸的相对分子质量不同,故可用质谱法鉴别抗坏血酸和脱氢抗坏血酸,A正确;
B.由题干抗坏血酸的结构简式可知,抗坏血酸中含有4个羟基,故抗坏血酸可发生缩聚反应,B正确;
C.由题干脱氢抗坏血酸的结构简式可知,脱氢抗坏血酸中含有酯基,故能与溶液反应,C错误;
D.由题干脱氢抗坏血酸的结构简式可知,1个脱氢抗坏血酸分子中有2个手性碳原子,如图所示:,D正确;
故答案为:C。
6.C
【分析】由合成示意图可知H2O在催化剂①和光照条件下生成H2,然后H2和CO2在催化剂②催化下生成甲醇。
【详解】A.合成过程中,该过程吸收太阳能生成H2,将太阳能转化为化学能,A正确;
B.催化剂可以降低相应反应的活化能,使化学反应速率加快,B正确;
C.由示意图可知H2和CO2在催化剂②催化下生成甲醇,方程式为,CO2的化合价由+4价降低到甲醇的-2价,H2由0价升高为+1价,1molH2转移2mol电子,故理论上生成时,需要消耗3molH2,光催化过程至少转移6mol电子,C错误;
D.碱性环境中,甲醇-空气燃料电池总反应为,反应消耗KOH、生成水,溶液的pH降低,D正确;
答案选C。
7.D
【详解】A.氯碱工业中,阳极氯离子失电子产生氯气,阴极水得电子生成氢气和氢氧根,应用到阳离子交换膜隔开阳极室和阴极室,使钠离子移动到阴极室,从而产生NaOH,A正确;
B.粗铜的精炼中,应用粗铜作阳极,纯铜作阴极,B正确;
C.铅蓄电池,当电池放电时负极Pb和正极PbO2均转化为PbSO4,质量都增重,C正确;
D.在Fe片上镀Cu时,Cu作阳级,Fe片作阴极,D错误;
故选D。
8.C
【详解】A.由图可知,反应Ⅱ反应物总能量大于生成物总能量,为放热反应,则反应Ⅱ的热化学方程式为:CO(g)+H2O(g)=H2(g)+CO2(g) ΔH= - akJ/mol(a>0),A错误;
B.反应Ⅰ活化能比反应Ⅱ高,因此反应Ⅰ为慢反应,总反应的反应速率由慢反应决定,总反应的快慢由反应I决定,B错误;
C.选择优良的催化剂可以降低反应I和Ⅱ的活化能,催化剂加快化学反应速率,减少过程中的能耗,C正确;
D.反应过程涉及C-H、O-H断裂,H-H、C=O形成,故涉及极性共价键的断裂与形成,非极性共价键的形成,无非极性键的断裂,D错误;
故选C。
9.(1)d
(2)
(3) 6.2 4
(4)
(5) 降低的溶解度,防止溶解损失 防止被氧化 正八面体
【分析】二氧化锰粉与硫化锰矿中加硫酸溶解,硫离子被二氧化锰氧化为硫单质,且二氧化硅不溶于酸均可过滤除去,金属离子进入滤液中,继续加二氧化锰将二价铁氧化为三价铁,再加氨水调节pH生成氢氧化铁、氢氧化铝沉淀,除去Fe3+、Al3+,再加入Na2S使Ni2+、Zn2+生成对应硫化物沉淀除去,加入氟化锰沉淀镁离子,此时溶液中为硫酸锰、硫酸铵、硫酸钠等溶质,加入碳酸氢铵沉淀提纯锰离子,最后再加入硫酸可得到纯净的硫酸锰。
【详解】(1)锰元素是第四周期第ⅦB族元素,位于元素周期表得d区;
(2)加入二氧化锰是为了将二价铁氧化为三价铁便于沉淀除去,离子方程式为:
(3)从流程图中看加入氨水只生成了氢氧化铁、氢氧化铝沉淀,其他离子未达到沉淀的pH,则加入氨水调节溶液的的最大值为:6.2;配离子中配体为OH-,所以中的配位数为4;
(4)加氨水调节pH除去了Fe3+、Al3+,再加入Na2S,使Ni2+,Zn2+生成对应硫化物沉淀除去,此时只剩余镁离子,加入氟化锰沉淀镁离子生成氟化镁沉淀,所以滤渣主要成分为:;
(5)洗涤除去沉淀表面附着的可溶性杂质,用饱和水溶液可降低的溶解度,防止溶解损失;洗涤之后要进行干燥,硫离子为最低价态容易被空气中氧气氧化,所以在真空中于120℃下干燥可防止被氧化;由晶胞结构图可知硫离子构成的空隙为正八面体空隙,位于围成的正八面体空隙中;根据均摊法可知一个晶胞中有4个MnS,则晶胞密度为:。
10.(1)杂化
(2)④
(3)作安全瓶,防倒吸
(4)
(5)将未反应完的排出,被E中溶液吸收
(6)降低水的沸点,防止受热温度过高转化为硫氰化铵
(7)
【分析】由石灰氮()与在时反应制备硫脲,同时产生石灰乳可知:装置A的作用是生成气体,稀硫酸+FeS固体是生成的最好组合。安全瓶和尾气处理事化学实验必不可少的装置。
【详解】(1)分子的中心C原子的价层有3个键没有孤电子对,故采用杂化;
(2)A中要生成的具有还原性,强氧化性的硝酸和浓硫酸不适合,挥发性的盐酸也会引入杂质,故试剂的最佳组合是稀硫酸+FeS固体,答案为④;
(3)B瓶可防止在C中吸收太快造成倒吸现象,B瓶的作用是:作安全瓶,防倒吸;
(4)石灰氮()与在时反应制备硫脲,同时产生石灰乳,C中发生反应的化学方程式为:;
(5)实验结束时仍需要向装置中通入,其作用是:将未反应完的排出,被E中溶液吸收;
(6)产品溶液蒸发浓缩时,采用减压条件可使水的沸点降低,防止受热温度过高转化为硫氰化铵
(7)根据反应方程式,可得关系式:~,则产品中硫脲的物质的量,产品中硫脲的质量分数为。
11.(1) kJ·mol-1
(2)CD
(3) 0.1 2mol·L-1
【详解】(1)①肼为共价化合物,电子式为;
故答案为:;
②肼分解成氮气和氢气的热化学方程式为i-2ii,;
故答案为:;
(2)A.反应前后均为气体,质量不变,在恒容下,密度始终不变,A不符合题意;
B.当正逆反应速率相等,反应达到平衡,B不符合题意;
C.反应前后系数不相等,则当气体压强不变,反应达到平衡,C符合题意;
D.当各个物质体积分数不变,反应达到平衡,D符合题意;
故答案为:CD;
(3)①10min时,mol·L ,则转化的NO的物质的量为1mol,则;
②平衡常数mol-1·Lmol1·L;
故答案为:0.1;2mol·L 。
12.(1)羟基、羧基
(2)氧化反应
(3)
(4)、、或等任写一种
(5)
(6)6
【分析】
根据合成路线图可知,A→B发生取代反应,B→C发生氧化反应,从D与F的结构可以判断,反应Ⅳ应该是分子内脱水,E的结构为,F→Cinanserin为取代反应,据此分析解答。
【详解】(1)根据D结构简式可知,D中官能团有羟基和羧基,故该空填羟基、羧基;
(2)B→C发生氧化反应,将醇羟基氧化成醛基,该空填氧化反应;
(3)
已知C通过加成得到X,C中醛基和苯环都能发生加成反应,结合产物D的结构可以推出,第一步加成反应发生在-CHO上,X结构为,该空填;
(4)
D在浓硫酸作用下,通过分子内脱水形成E,该条件下可能发生分子间脱水,其脱水方式有多种如醇羟基间脱水或羧基间脱水,故产物可能为、,也可能发生酯化反应脱水,产物可能为、,故该空填如下任一种均可:、、、;
(5)
对比F和Cinanserin结构可知,F通过取代反应生成Cinanserin,其化学方程式为,该空填;
(6)
化合物M分子式为C9H8O2,含有一个苯环,且苯环上有3个取代基,可发生银镜反应但不能发生水解反应,即包含醛基,不含酯基,遇FeCl3溶液不显紫色则不含酚羟基,综合看M的3个取代基为2个-CHO、1个-CH3,根据“定二移一”方法可知,符合条件的M一共有6种:,该空填6。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
高考化学综合练习卷1-2
1.下列说法不正确的是
A.碳酸钠和碳酸氢钠的溶液均显碱性,两者均可作食用碱
B.具有还原性,故少量添加于葡萄酒中能防止部分成分被氧化
C.铵盐都易溶于水,受热分解均生成氨气,故储存时需考虑避光、防潮
D.硬铝的密度小、强度高、抗腐蚀能力强,故可用作制造宇宙飞船的材料
2.设为阿伏加德罗常数的值。下列说法错误的是
A.1mol甲基正离子的质子数为
B.中配位原子的个数为
C.的溶液中O原子数为
D.0.1mol氧气与足量的Na反应,转移的电子数为
3.下列离子方程式书写正确的是
A.向饱和纯碱溶液中通入过量二氧化碳气体:
B.少量SO2通入NaClO溶液中:
C.Ba(OH)2溶液滴加到NaHSO4溶液中至恰好完全沉淀:
D.强碱性溶液中NaClO将Mn2+氧化成MnO2:
4.物质M是合成多种阻燃剂、耐高温材料的中间体原料,M的化学式可表示为。一种制备M的反应为,其中X、Y、Z、W分别代表原子序数依次增大的短周期主族元素,Y、Z同主族,为10电子微粒。下列有关说法正确的是
A.简单氢化物的沸点: B.的模型名称为三角锥形
C.基态Z、W原子核外电子的空间运动状态均为9种
D.实验室常用固体与烧碱加热反应制备
5.抗坏血酸(维生素C)是常用的抗氧化剂。下列说法不正确的是
可用质谱法鉴别抗坏血酸和脱氢抗坏血酸
抗坏血酸可发生缩聚反应
脱氢抗坏血酸不能与溶液反应
1个脱氢抗坏血酸分子中有2个手性碳原子
6.生产过程中碳排放极低或者为零时制得的甲醇被称作“液态阳光”,一种“液态阳光”的合成示意图如下。下列说法错误的是
A.合成过程中,实现了太阳能转换成化学能
B.催化剂通过降低相应反应的活化能使化学反应速率增大
C.生成时,理论上光催化过程至少转移电子
D.室温下以溶液为离子导体,空气燃料电池放电时,溶液减小
7.电化学在工能源工程和化工生产中有非常重要的应用,下列说法不正确的是
A.氯碱工业中,应用到阳离子交换膜隔开阳极室和阴极室
B.粗铜的精炼中,应用粗铜作阳极
C.铅蓄电池,当电池放电时负极和正极的质量都增重
D.在Fe片上镀Cu时,Cu作阴级,Fe片作阳极
8.中国科学技术大学曾杰教授研究团队通过修饰铜基催化剂,在碳氧化物与有机分子转化的研究中获得多项突破。甲醇与水(均为气态)在铜基催化剂上的反应机理和能量变化如图:
下列说法正确的是
A.反应Ⅱ的热化学方程式为:
B.总反应的快慢由反应I决定,是因为反应I吸热、反应Ⅱ放热
C.选择优良的催化剂可以降低反应I和Ⅱ的活化能,从而减少反应过程中的能耗
D.反应过程涉及极性共价键、非极性共价键的断裂和形成
9.常用作微量分析试剂、媒染剂和油漆干燥剂。以天然二氧化锰粉与硫化锰矿(还含、、、、、等元素)为原料制备的工艺流程如图所示。回答下列问题:
已知:常温下,部分金属离子形成氢氧化物沉淀的范围如下。
金属离子
开始沉淀的 1.3 3.2 6.2 6.9 7.6 8.1 8.9
沉淀完全的 2.8 4.7 8.2 8.9 9.6 10.1 10.9
(1)元素位于元素周期表 区。
(2)“氧化”工序中发生反应的离子方程式为 。
(3)加入氨水调节溶液的的最大值约为 ;溶于强碱可生成配离子,中的配位数为 。
(4)“滤渣”的主要成分是 (填化学式)。
(5)硫化锰()是一种P型半导体,它具有三种形态,其中呈绿色。将水溶液煮沸,加入稍过量的氨水,趁热通入,加热至沉淀呈暗绿色,过滤,依次用饱和水溶液、乙醇、乙醚洗涤,最后在真空中于120℃下干燥。
①用饱和水溶液洗涤的目的是 。
②最后在真空中于120℃下干燥的目的是 。
③晶胞与晶胞属于同种类型,晶胞结构如图所示,晶胞边长为。位于围成的 空隙中,该晶体的密度为 (用含的代数式表示)。
10.硫代尿素俗称硫脲[],是一种白色晶体,熔点,易溶于水和乙醇,受热时部分转化为硫氰化铵()。可用石灰氮()与在时反应制备硫脲,同时产生石灰乳,其步骤如下:
I.按下图连接好装置,并检验装置的气密性;
Ⅱ.打开通入一段时间,然后关闭;
Ⅲ.将C中的石灰氮溶液加热到,然后打开,慢慢加入液体,并不断搅拌C中溶液;反应结束后,打开再次通入;
Ⅳ.将C中溶液过滤,减压条件下蒸发浓缩,冷却结晶,过滤、洗涤、干燥即得产品。请回答下列问题:
(1)硫脲[]分子的中心C原子的杂化方式为 。
(2)A中试剂的最佳组合为 (填序号)。
①浓硫酸固体 ②浓盐酸固体 ③稀硝酸+FeS固体 ④稀硫酸+FeS固体
(3)B瓶的作用是 。
(4)C中发生反应的化学方程式为 。
(5)实验结束时仍需要向装置中通入,其作用是 。
(6)产品溶液蒸发浓缩时,采用减压条件的目的是 。
(7)测定制得产品的纯度。已知硫脲能与酸性溶液发生反应:。每次均称取产品于锥形瓶中,加入适量蒸馏水溶解,滴加稀硫酸酸化,用的溶液滴定至终点。平行测定三次,平均每次消耗溶液的体积为,则产品中硫脲的质量分数为 (用含a、c、V的代数式表示)。
11.回答下列问题(1)在催化剂作用下,用还原剂[如肼()]选择性地与反应生成和。已知200℃时:ⅰ. kJ·mol ;
ⅱ. kJ·mol 。
①写出肼的电子式: 。
②200℃时,肼分解成氮气和氢气的热化学方程式为 。
(2)工业上,裂解正丁烷可以获得乙烯、丙烯等化工原料。
反应1:(g,正丁烷)
反应2:(g,正丁烷)
某温度下,向2L恒容密闭容器中投入2mol正丁烷,假设控制反应条件,只发生反应1,达到平衡时测得的体积分数为。下列情况表明上述反应达到平衡的是___________(填字母,下同)。
A.混合气体的密度保持不变 B.甲烷、丙烯的生成速率相等
C.混合气体压强保持不变 D.丙烯的体积分数保持不变
(3)亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO和反应得到,化学方程式为。在1L恒容密闭容器中充入2mol和1mol,在不同温度下测得与时间t的关系如图A所示:
①反应开始到10min时NO的平均反应速率 mol·L-1·min-1。
②时该反应的平衡常数 。
12.药物Cinanserin对冠状病毒3CL水解酶具有抑制作用,其合成路线如图:
(1)D物质中含有的官能团名称为: 。(2)B→C的反应类型: 。
(3)反应III分两步进行:第一步反应为加成反应,则X的结构简式为: 。
(4)反应IV需要控制反应温度,否则可能得到的副产物为(写一种即可): 。
(5)写出F生成Cinanserin的化学方程式: 。
(6)化合物M是E的同分异构体,分子中只含有苯环一种环状结构,苯环上有3个取代基,可发生银镜反应,但不能发生水解反应,遇FeCl3溶液不显紫色,则符合条件的M有 种。
《高考化学综合练习卷1-2》参考答案
题号 1 2 3 4 5 6 7 8
答案 C D B C C C D C
9.(1)d
(2)
(3) 6.2 4
(4)
(5) 降低的溶解度,防止溶解损失 防止被氧化 正八面体
10.(1)杂化
(2)④
(3)作安全瓶,防倒吸
(4)
(5)将未反应完的排出,被E中溶液吸收
(6)降低水的沸点,防止受热温度过高转化为硫氰化铵
(7)
11.(1) kJ·mol-1
(2)CD
(3) 0.1 2mol·L-1
12.(1)羟基、羧基
(2)氧化反应
(3)
(4)、、或等任写一种
(5)
(6)6
1.C
【详解】A.碳酸钠和碳酸氢钠都是强酸弱碱盐,在溶液中均能水解使溶液呈碱性,所以两者均可作食用碱,故A正确;
B.二氧化硫具有还原性,少量添加于葡萄酒中能防止部分成分被氧化而延长红酒的保质期,故B正确;
C.硝酸铵一定温度下受热分解生成一氧化二氮和水,不能分解生成氨气,故C错误;
D.硬铝具有密度小、强度高、抗腐蚀能力强的优良性能,所以可用作制造宇宙飞船的材料,故D正确;
故选C。
2.D
【详解】A.1个甲基正离子()的质子数为9个,则1mol甲基正离子()的质子数为9NA,故A正确;
B.中配体为NH3,配位原子为N,中配位原子的个数为4NA,故B正确;
C.乙醇和H2O中都含有氧原子,在100g 46%的乙醇溶液中,CH3CH2OH含有的氧原子物质的量为(100g×46%)÷46g/mol=1mol,H2O中含有氧原子的物质的量为(100g×54%)÷18g/mol=3mol,氧原子总物质的量为4mol,个数为4NA,故C正确;
D.氧气与钠反应可能生成氧化钠也可能生成过氧化钠,在题目中无法判断氧元素是被还原为-1价还是-2价,故无法计算转移的电子数,故D错误;
故选D。
3.B
【详解】A.向饱和纯碱溶液中通入过量二氧化碳气体,析出碳酸氢钠晶体,离子方程式为:,A错误;
B.少量SO2通入NaClO溶液中发生氧化还原反应,生成硫酸根和氢离子,氢离子要继续与过量的次氯酸根结合生成次氯酸,离子方程式为:,B正确;
C.Ba(OH)2溶液滴加到NaHSO4溶液中至恰好完全沉淀,此时氢离子与硫酸根遵循1:1关系,离子方程式为:,C错误;
D.强碱性溶液中NaClO将Mn2+氧化成MnO2,配平时左边加氢氧根,右边生成水,离子方程式为:,D错误;
答案选B。
4.C
【分析】X、Y、Z、W分别代表原子序数依次增大的短周期主族元素,Y、Z同主族,由分子式和为10电子微粒可知推知为,则Y为N,X为H,Z为P,W为,以此解答。
【详解】A.分子间存在氢键,沸点较高,HCl的相对分子质量大于PH3,则HCl分子间作用力比PH3强,沸点比PH3高,则简单氢化物的沸点:,A错误;
B.中心原子价层电子对数为3+=4,模型名称为四面体形,B错误;
C.基态P、原子核外电子排布式分别为1s22s22p63s23p3、1s22s22p63s23p5,含有电子的轨道数均为9,核外电子的空间运动状态均为9种,C正确;
D.NaOH在加热条件下对玻璃仪器有强烈的腐蚀作用且成本相对较高,实验室常用和加热反应制备,D错误;
故选C。
5.C
【详解】A.已知质谱法可以测量有机物的相对分子质量,抗坏血酸和脱氢抗坏血酸的相对分子质量不同,故可用质谱法鉴别抗坏血酸和脱氢抗坏血酸,A正确;
B.由题干抗坏血酸的结构简式可知,抗坏血酸中含有4个羟基,故抗坏血酸可发生缩聚反应,B正确;
C.由题干脱氢抗坏血酸的结构简式可知,脱氢抗坏血酸中含有酯基,故能与溶液反应,C错误;
D.由题干脱氢抗坏血酸的结构简式可知,1个脱氢抗坏血酸分子中有2个手性碳原子,如图所示:,D正确;
故答案为:C。
6.C
【分析】由合成示意图可知H2O在催化剂①和光照条件下生成H2,然后H2和CO2在催化剂②催化下生成甲醇。
【详解】A.合成过程中,该过程吸收太阳能生成H2,将太阳能转化为化学能,A正确;
B.催化剂可以降低相应反应的活化能,使化学反应速率加快,B正确;
C.由示意图可知H2和CO2在催化剂②催化下生成甲醇,方程式为,CO2的化合价由+4价降低到甲醇的-2价,H2由0价升高为+1价,1molH2转移2mol电子,故理论上生成时,需要消耗3molH2,光催化过程至少转移6mol电子,C错误;
D.碱性环境中,甲醇-空气燃料电池总反应为,反应消耗KOH、生成水,溶液的pH降低,D正确;
答案选C。
7.D
【详解】A.氯碱工业中,阳极氯离子失电子产生氯气,阴极水得电子生成氢气和氢氧根,应用到阳离子交换膜隔开阳极室和阴极室,使钠离子移动到阴极室,从而产生NaOH,A正确;
B.粗铜的精炼中,应用粗铜作阳极,纯铜作阴极,B正确;
C.铅蓄电池,当电池放电时负极Pb和正极PbO2均转化为PbSO4,质量都增重,C正确;
D.在Fe片上镀Cu时,Cu作阳级,Fe片作阴极,D错误;
故选D。
8.C
【详解】A.由图可知,反应Ⅱ反应物总能量大于生成物总能量,为放热反应,则反应Ⅱ的热化学方程式为:CO(g)+H2O(g)=H2(g)+CO2(g) ΔH= - akJ/mol(a>0),A错误;
B.反应Ⅰ活化能比反应Ⅱ高,因此反应Ⅰ为慢反应,总反应的反应速率由慢反应决定,总反应的快慢由反应I决定,B错误;
C.选择优良的催化剂可以降低反应I和Ⅱ的活化能,催化剂加快化学反应速率,减少过程中的能耗,C正确;
D.反应过程涉及C-H、O-H断裂,H-H、C=O形成,故涉及极性共价键的断裂与形成,非极性共价键的形成,无非极性键的断裂,D错误;
故选C。
9.(1)d
(2)
(3) 6.2 4
(4)
(5) 降低的溶解度,防止溶解损失 防止被氧化 正八面体
【分析】二氧化锰粉与硫化锰矿中加硫酸溶解,硫离子被二氧化锰氧化为硫单质,且二氧化硅不溶于酸均可过滤除去,金属离子进入滤液中,继续加二氧化锰将二价铁氧化为三价铁,再加氨水调节pH生成氢氧化铁、氢氧化铝沉淀,除去Fe3+、Al3+,再加入Na2S使Ni2+、Zn2+生成对应硫化物沉淀除去,加入氟化锰沉淀镁离子,此时溶液中为硫酸锰、硫酸铵、硫酸钠等溶质,加入碳酸氢铵沉淀提纯锰离子,最后再加入硫酸可得到纯净的硫酸锰。
【详解】(1)锰元素是第四周期第ⅦB族元素,位于元素周期表得d区;
(2)加入二氧化锰是为了将二价铁氧化为三价铁便于沉淀除去,离子方程式为:
(3)从流程图中看加入氨水只生成了氢氧化铁、氢氧化铝沉淀,其他离子未达到沉淀的pH,则加入氨水调节溶液的的最大值为:6.2;配离子中配体为OH-,所以中的配位数为4;
(4)加氨水调节pH除去了Fe3+、Al3+,再加入Na2S,使Ni2+,Zn2+生成对应硫化物沉淀除去,此时只剩余镁离子,加入氟化锰沉淀镁离子生成氟化镁沉淀,所以滤渣主要成分为:;
(5)洗涤除去沉淀表面附着的可溶性杂质,用饱和水溶液可降低的溶解度,防止溶解损失;洗涤之后要进行干燥,硫离子为最低价态容易被空气中氧气氧化,所以在真空中于120℃下干燥可防止被氧化;由晶胞结构图可知硫离子构成的空隙为正八面体空隙,位于围成的正八面体空隙中;根据均摊法可知一个晶胞中有4个MnS,则晶胞密度为:。
10.(1)杂化
(2)④
(3)作安全瓶,防倒吸
(4)
(5)将未反应完的排出,被E中溶液吸收
(6)降低水的沸点,防止受热温度过高转化为硫氰化铵
(7)
【分析】由石灰氮()与在时反应制备硫脲,同时产生石灰乳可知:装置A的作用是生成气体,稀硫酸+FeS固体是生成的最好组合。安全瓶和尾气处理事化学实验必不可少的装置。
【详解】(1)分子的中心C原子的价层有3个键没有孤电子对,故采用杂化;
(2)A中要生成的具有还原性,强氧化性的硝酸和浓硫酸不适合,挥发性的盐酸也会引入杂质,故试剂的最佳组合是稀硫酸+FeS固体,答案为④;
(3)B瓶可防止在C中吸收太快造成倒吸现象,B瓶的作用是:作安全瓶,防倒吸;
(4)石灰氮()与在时反应制备硫脲,同时产生石灰乳,C中发生反应的化学方程式为:;
(5)实验结束时仍需要向装置中通入,其作用是:将未反应完的排出,被E中溶液吸收;
(6)产品溶液蒸发浓缩时,采用减压条件可使水的沸点降低,防止受热温度过高转化为硫氰化铵
(7)根据反应方程式,可得关系式:~,则产品中硫脲的物质的量,产品中硫脲的质量分数为。
11.(1) kJ·mol-1
(2)CD
(3) 0.1 2mol·L-1
【详解】(1)①肼为共价化合物,电子式为;
故答案为:;
②肼分解成氮气和氢气的热化学方程式为i-2ii,;
故答案为:;
(2)A.反应前后均为气体,质量不变,在恒容下,密度始终不变,A不符合题意;
B.当正逆反应速率相等,反应达到平衡,B不符合题意;
C.反应前后系数不相等,则当气体压强不变,反应达到平衡,C符合题意;
D.当各个物质体积分数不变,反应达到平衡,D符合题意;
故答案为:CD;
(3)①10min时,mol·L ,则转化的NO的物质的量为1mol,则;
②平衡常数mol-1·Lmol1·L;
故答案为:0.1;2mol·L 。
12.(1)羟基、羧基
(2)氧化反应
(3)
(4)、、或等任写一种
(5)
(6)6
【分析】
根据合成路线图可知,A→B发生取代反应,B→C发生氧化反应,从D与F的结构可以判断,反应Ⅳ应该是分子内脱水,E的结构为,F→Cinanserin为取代反应,据此分析解答。
【详解】(1)根据D结构简式可知,D中官能团有羟基和羧基,故该空填羟基、羧基;
(2)B→C发生氧化反应,将醇羟基氧化成醛基,该空填氧化反应;
(3)
已知C通过加成得到X,C中醛基和苯环都能发生加成反应,结合产物D的结构可以推出,第一步加成反应发生在-CHO上,X结构为,该空填;
(4)
D在浓硫酸作用下,通过分子内脱水形成E,该条件下可能发生分子间脱水,其脱水方式有多种如醇羟基间脱水或羧基间脱水,故产物可能为、,也可能发生酯化反应脱水,产物可能为、,故该空填如下任一种均可:、、、;
(5)
对比F和Cinanserin结构可知,F通过取代反应生成Cinanserin,其化学方程式为,该空填;
(6)
化合物M分子式为C9H8O2,含有一个苯环,且苯环上有3个取代基,可发生银镜反应但不能发生水解反应,即包含醛基,不含酯基,遇FeCl3溶液不显紫色则不含酚羟基,综合看M的3个取代基为2个-CHO、1个-CH3,根据“定二移一”方法可知,符合条件的M一共有6种:,该空填6。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
