广东省惠州市博罗县杨村中学2024-2025学年九年级下学期开学考试化学试题(含答案)
文档属性
| 名称 | 广东省惠州市博罗县杨村中学2024-2025学年九年级下学期开学考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 823.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-20 21:02:15 | ||
图片预览



文档简介
广东省惠州市博罗县杨村中学2024-2025学年九年级下学期开学考试
化学试题
一、选择题:本大题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
“小饼如嚼月,中有酥和饴。”中秋节是中华民族的传统节日,今年秋季,学校开展了自制月饼的实践活动。完成下面小题。
1.下列月饼制作过程中包含化学变化的是( )
A.擀面皮 B.铺果馅 C.烤月饼 D.切月饼
2.我们能闻到水果馅月饼的香味,从微观的角度解释,是因为( )
A.分子很小 B.分子在不停地运动
C.分子间存在间隔 D.分子能保持物质的化学性质
3.月饼中的水果富含维生素。下列关于维生素C的说法中,正确的是( )
A.相对分子质量为 B.由3种元素组成
C.碳、氢原子的个数比为 D.含有20个原子
4.《东周列国志》曰“木无本必枯,水无源必竭”。下列标志属于节约用水标志的是( )
A. B.
C. D.
5.下列化学用语表示错误的是( )
A.2个氮原子:2N
B.氧元素:O
C.硫离子的结构示意图:
D.3个氯离子:3Cl-
6.基于“宏观—微观—符号”建立联系是化学重要的思维方法。下列有关事实中,用“微粒观”解释错误的是( )
A.水通电生成氢气和氧气——化学反应中分子发生了改变
B.压瘪的乒乓球在热水中能鼓起来——温度升高,分子变大
C.墙内开花墙外香——分子不断运动
D.水和过氧化氢的化学性质不同——不同种分子的性质不同
7.化学的发展推动了社会的进步。下列科学家及成就对应不正确的是( )
A.门捷列夫:提出原子学说 B.拉瓦锡:验证质量守恒定律
C.屠呦呦:研制出青蒿素 D.徐寿:参与翻译《化学鉴原》
8.人类利用金属的历史经历了从青铜器时代到铁器时代,再到铝合金大量使用的过程。这一事实与下列因素有关的是( )
A.金属冶炼的水平 B.金属的导电性、延展性
C.金属的物理性质 D.地壳种金属元素的含量
9.规范的操作是实验成功的保障。下列实验操作正确的是( )
A.点燃酒精灯
B.取用粉末状试剂
C.读取液体体积
D.倾倒液体
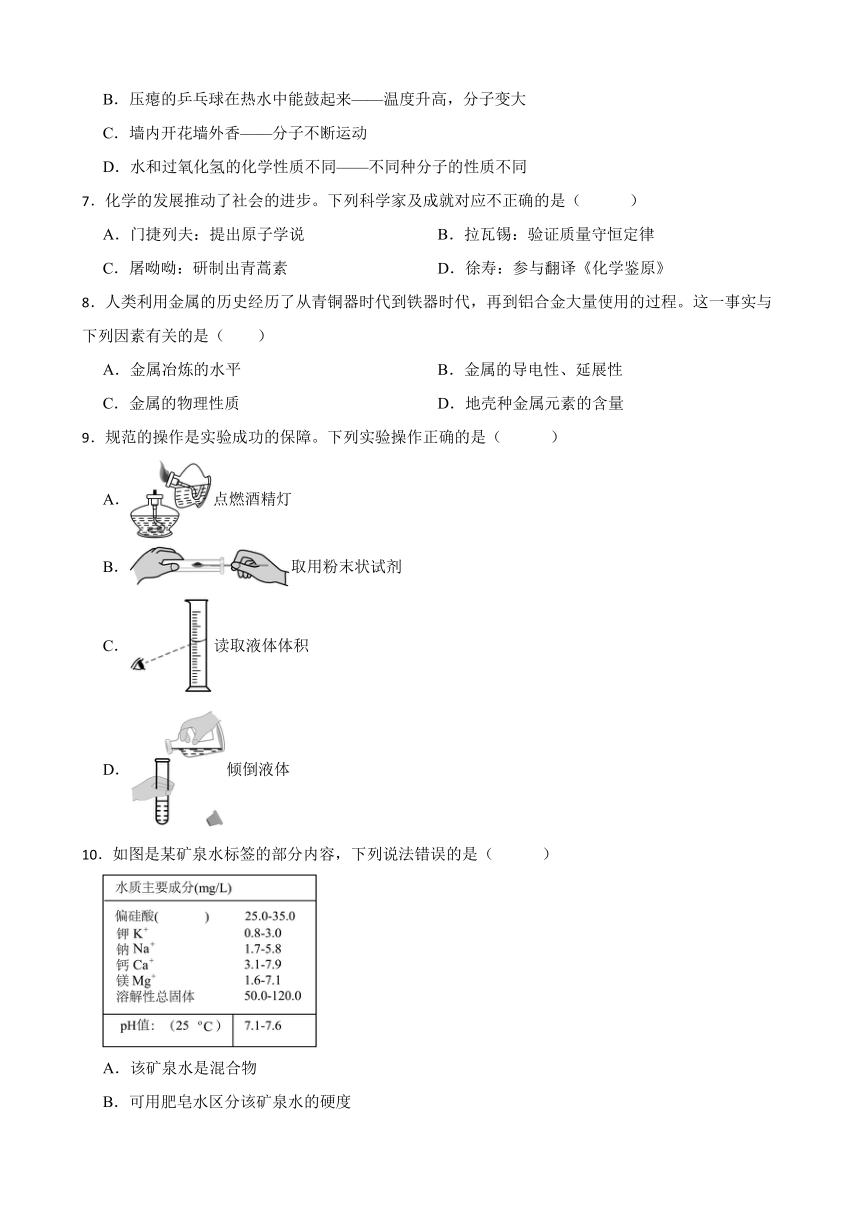
10.如图是某矿泉水标签的部分内容,下列说法错误的是( )
A.该矿泉水是混合物
B.可用肥皂水区分该矿泉水的硬度
C.该矿泉水镁离子可以形成MgCl
D.中Si的化合价为+4价
11.如图是家用燃料变迁过程的示意团。
下列说法中错误的是( )
A.秸秆燃烧用水浇灭是降低了秸秆的着火点
B.将煤块变成蜂窝煤增大了接触面积,使燃烧更充分
C.煤、石油、天然气都属于不可再生能源
D.天然气泄漏应立即关闭阀门,开窗通风
12.下列实验设计能达到实验目的的是( )
选项 A B C D
实验设计
实验目的 收集二氧化碳 验证质量守恒定律 探究温度对分子运动速率的影响 证明的金属活动性比强
A.A B.B C.C D.D
13.在下列劳动项目中,涉及的化学知识解释错误的是( )
选项 生活场景 化学解释
A 将湿衣物放于阳光下晾晒 温度升高使分子运动加快
B 采用真空包装生鲜食品 隔绝化学性质比较活泼的氧气
C 用活性炭去除冰箱中异味 活性炭具有吸附性
D 用明矾处理浑浊的河水 明矾有消毒杀菌的作用
A.A B.B C.C D.D
14.杭州亚运会的主火炬采用甲醇作为燃料。如图为催化二氧化碳合成甲醇()的微观示意图。下列说法不正确的是( )
A.该反应属于置换反应
B.丁的化学式为
C.该反应有利于实现“碳中和”
D.反应前后的化学性质保持不变
15.下图所示实验方案能达到实验目的的是( )
A.探究催化剂的种类
B.探究铝、铜、银的金属活动性
C.鉴别氢气和甲烷
D. 测定空气中氧气的含量
二、非选择题:本大题共6小题,共55分。
16.2023全球6G技术大会3月22日在南京召开。硅(Si)是制作芯片不可缺少的材料,在元素周期表中的信息及原子结构示意图如图1所示,请结合图2回答下列问题
(1)硅原子的相对原子质量是 。
(2)C粒子属于 (填“原子”、“阳离子”或“阴离子”)。
(3)图2中与硅元素化学性质相似的是 (填字母序号)。
(4)硅元素与B所对应的元素形成化合物的化学式是 。
17.科学家预测,到2050年实现碳中和的4种主要途径的贡献率如图1所示。
(1)碳循环:转化成有机清洁燃料的反应原理如图2所示。该反应中,参加反应的和生成的的分子个数比为 。
(2)碳替代:用清洁能源替代传统的化石能源,写出一种清洁能源 。
(3)碳封存:
①地质封存:将由气态压缩成超临界液体,注入油气层、煤井、咸水层等密闭地质构造中。从微观角度解释能够压缩成液态的原因是 ;如果被封存在含的地下咸水层中,会转化为固态碳酸盐,该反应的化学方程式是 。
②海洋封存:将二氧化碳在深海中“封存”。但过多的会导致海水酸化,殃及海洋生物,要真正实现“海洋封存”,还任重而道远。导致海水酸化的物质是 (填化学式)。
(4)碳减排:写出一条日常生活中能减少排放的措施 。
18.根据如图所示装置,结合所学知识回答下列问题。
(1)写出图中仪器①的名称 ;
(2)实验室用A装置制取氧气,反应的化学方程式为 ;在试管口放一团棉花的作用是 ;
(3)装置E有多种用途,若用E装置收集氢气,则应将气体从 (选填“a”或“b”)端通入;若用E装置来干燥CO2,则E中应装的试剂名称是 ;
(4)装置F也可作制取CO2气体的发生装置,则装置中X内应盛放的药品是 ,若在反应进行中关闭止水夹,则可能观察到的现象是 。
19.化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在陶土网上得到一些白色固体。
(1)请写出镁条燃烧的化学方程式: 。
(2)同学们通过称量发现:在陶土网上收集到产物的质量小于镁条的质量。有人认为这个反应不遵循质量守恒定律。你认为出现这样实验结果的原因可能是 。
(3)小红按如图装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
【提出问题】黄色固体是什么?
【查阅资料】
a.镁能与二氧化碳反应生成碳和氧化镁;
b.镁能与氮气剧烈反应产生黄色的氮化镁()固体:
c.氮化镁可与水反应产生氨气(有刺激性气味),该气体能使湿润的红色石蕊试纸变蓝。
【作出猜想】黄色固体是。
【实验探究】请设计实验,验证猜想:
实验操作 实验现象 结论
取少量黄色固体于试管中,加适量水,将湿润的红色石蕊试纸放在试管口 该固体是
【反思与交流】
(4)氮化镁中氮元素的化合价是 。
(5)空气中的含量远大于的含量,而镁条在空气中燃烧产物MgO却远多于,合理的解释是 。
(6)同学们又联想到氢气在氯气中能够燃烧,于是对燃烧条件又有了新的认识: 。
20.金属材料在人类社会中有非常广泛的应用。合理开发、利用、回收金属资源对我国的可持续发展起到重要意义。
(1)Ⅰ.我国用长征三号乙运载火箭成功发射第55颗北斗导航卫星,金属材料在其中起到了重要作用。
铝合金和钛合金被广泛用于航天工业。一般情况下,铝合金的强度和硬度比纯铝的 (填“高”或“低”)。
(2) 写出铝与稀盐酸反应的化学方程式 ,其反应类型是 。
(3) 室温下,钛与水、稀盐酸和稀硫酸均不反应, 可判断钛的金属活动性比铝的. (填“强”或“弱”)。
(4)Ⅱ.某金属板中含 Fe、Cu、Ni(镍,银白色金属) 等金属。如图是回收金属的流程。
已知:
①②③的操作需用玻璃仪器有:烧杯、 、玻璃棒。
(5) 在滤渣①中加入稀硫酸,观察到 ,则证明金属板中所加稀硫酸已过量。
(6) 滤液③中加铁粉的反应化学方程式为 (写其中1个)。
(7) Cu、Fe、Ni的活动性由强到弱顺序是 。
21.为测定某碳酸钠溶液中溶质的质量分数,取200g碳酸钠溶液,平均分为四份,每份样品均按如图所示进行实验,实验数据如表。
实验1 实验2 实验3 实验4
样品质量/g 50 50 50 50
氯化钙溶液质量/g 10 20 30 40
烧杯和沉淀的总质量/g 42 44 45 45
请计算:
(1)当50g碳酸钠溶液样品中的溶质完全反应时,生成沉淀的质量为 g;
(2)计算该样品中碳酸钠的质量分数(写出计算过程,计算结果精确至0.1%)。
答案解析部分
1.C
2.B
3.B
4.D
A、该图标表示剧毒品,不符合题意;
B、该图标表示禁止放置易燃物,不符合题意;
C、该图标表示禁止烟火,不符合题意;
D、该图标表示节约用水,符合题意。
故答案为:D.
根据化学中常见的图标有节约用水、循环使用、禁止烟火、禁止吸烟、禁止放易燃物,禁止放烟花爆竹,当心剧毒等图标来解答。
5.C
6.B
7.A
8.A
解:根据金属的使用历史是经历了从青铜器时代到铁器时代,再到铝合金大量使用的过程。该事实说明金属的冶炼水平不断提高。与金属的物理性质和地壳中的含量无关,故符合题意的是A,不符合题意的是BCD。
故答案为:A.
根据金属的冶炼水平不断提高,金属经历了从青铜时代到铁器时代,再到铝合金的使用时代来解答。
9.B
10.C
11.A
A、 物质的着火点是固定不变的,秸秆燃烧用水浇灭是降低温度至秸秆的着火点以下,故A错误;
B、将煤块变成蜂窝煤增大了接触面积,使燃烧更充分,故B正确;
C、 煤、石油、天然气都是古代生物遗骸埋藏在地下经过漫长的一系列复杂的变化而形成,都属于不可再生能源,故C正确;
D、天然气泄漏应立即关闭阀门,隔绝可燃物,并开窗通风,稀释空气中天然气的浓度,故D正确;
故答案为:A。
A、根据物质着火点是固定不变的和灭火的原理进行分析解答;
B、根据燃料充分燃烧需要考虑的因素进行分析解答;
C、根据煤、石油、天然气的形成原因进行分析解答;
D、根据易燃、易爆安全知识进行分析解答。
12.D
13.D
14.A
15.B
16.(1)28.09
(2)阴离子
(3)A
(4)
(1) 硅原子的相对原子质量是28.09;
(2)C粒子质子数为17,电子数为18,为阴离子;
(3)硅原子最外层电子数为4,与A最外层电子数相同,化学性质相似;
(4)B对应元素为氧元素,形成化合物时呈-2价,硅元素形成化合物时呈+4价,硅元素与氧元素形成的化合物为二氧化硅,化学式为 。
(1)根据元素周期表小格信息中最下面数字为相对原子质量分析;
(2)根据质子数小于电子数的粒子为阴离子分析;
(3)根据化学性质由最外层电子数决定分析;
(4)根据化合物化学式书写遵循化合价代数和为0的原则分析。
17.(1)1:1
(2)太阳能
(3)二氧化碳分子之间的间隙变小;;
(4)减少燃油车的使用
(1)由图2可知CO2和H2在催化剂的条件下反应生成H2O和CH3OH,根据质量守恒定律,化学反应前后元素的种类、原子的种类和数目不变,CH3OH中碳元素全部来自CO2中的碳元素,一个CO2分子中含有1个碳原子,一个CH3OH分子中也只含1个碳原子,所以参加反应的CO2和生成的CH3OH分子个数比为1;1;
故答案为1:1;
(2)目前人类正在开发利用的新能源有太阳能、风能、地热能、潮汐能、核能等;
故答案为:太阳能;
(3)①由于分子之间有间隔,同一种物质不同状态其分子的间隔不同,固体分子间隔<液体分子间隔<气体分子间隔,CO2能够压缩成液态的原因是二氧化碳分子之间的间隔变小;CO2和Ca(OH)2反应生成CaCO3沉淀和H2O,其反应的化学方程式为: ;
②二氧化碳溶于水,会和水反应生成H2CO3,所以过多的二氧化碳在深海中“封存”会使海水酸化;
故答案为:(3)①二氧化碳分子之间的间隙变小;
②H2CO3;
(4)生活中能够减少CO2排放的措施很多,如减少化石燃料的使用,提倡绿色出行,减少燃油车的使用,更多使用新能源汽车,开发使用太阳能、风能等新能源;
故答案为: 减少燃油车的使用 。
(1)根据质量守恒定律,化学反应前后元素的种类,原子的种类和数目不变进行分析解答;
(2)根据人类正在开发使用的清洁能源进行分析解答;
(3)根据分子的基本性质,二氧化碳与氢氧化钙反应的原理,二氧化碳和水反应的原理进行分析解答;
(4)根据减少化石燃料的使用即是减少二氧化碳排放进行分析解答。
18.(1)锥形瓶
(2);防止加热时固体粉末进入导管,堵塞导管
(3)b;浓硫酸
(4)大理石;当固液分离时反应停止
(1)图中仪器①的名称锥形瓶;
(2)高锰酸钾受热分解生成锰酸钾,二氧化锰和氧气,反应的化学方程式为,试管口塞一团棉花的作用是:防止加热时固体粉末进入导管,堵塞导管;
(3)氢气的密度比空气的密度小,若用E装置收集氢气,则应将气体从短管b端通入,浓硫酸具有吸水性,若用E装置干燥二氧化碳,E中应该存放的试剂是浓硫酸;
(4)实验室制二氧化碳所用的药品是石灰石和稀盐酸,装置中X内应盛放的药品是石灰石,若在反应中关闭止水夹产生的二氧化碳不能逸散,则观察到的现象是固体液体分离反应停止。
(1)根据实验室常用仪器及用途分析;
(2)根据高锰酸钾受热分解生成锰酸钾,二氧化锰和氧气,试管口塞一团棉花的作用是:防止加热时固体粉末进入导管,堵塞导管分析;
(3)根据氢气的密度比空气的密度小,浓硫酸具有吸水性分析;
(4)根据实验室制二氧化碳所用的药品是石灰石和稀盐酸分析。
19.2Mg+O22MgO;大量的白烟弥漫到空气中,使得生成物收集不全;有刺激性气味的气体生成,且试纸由红色变蓝色;-3;氮气化学性质不如氧气活泼;燃烧不一定需要有氧气参加
(1)镁燃烧是镁与氧气在点燃条件下反应生成氧化镁,化学方程式为2Mg+O22MgO;
(2)化学变化一定遵循质量守恒定律,该反应过程中有大量的白烟弥漫到空气中,使得生成物收集不全,所以会使收集的产物质量小于镁条的质量;
(3)由查阅资料可知,氮化镁与水反应能产生氨气,氨气有刺激性气味,且可利用湿润的红色石蕊试纸检验,所以证明黄色固体为氮化镁的方法为收集产物中的黄色固体放入试管中,加入适量的水,在试管口放置湿润的红色石蕊试纸,若有刺激性气味的气体生成,且试纸由红色变蓝色,则可证明黄色固体是Mg3N2;
(4)氮化镁中镁元素化合价为+2价,设氮元素化合价为x,根据化合物中各元素化合价的代数和为0可得,(+2)×3+2x=0,解得x=-3;
(5)氮气化学性质不如氧气活泼,所以空气中虽然氮气的含量高,但镁仍主要与氧气发生反应;
(6)由镁与氮气反应和氢气在氯气中燃烧可知,燃烧不一定需要有氧气参加。
(1)根据镁与氧气在点燃条件下反应生成氧化镁分析;
(2)根据化学变化都遵循质量守恒定律分析;
(3)根据氮化镁与水反应能产生氨气,氨气有刺激性气味,能使湿润的红色石蕊试纸变蓝分析;
(4)根据化合物中各元素化合价的代数和为0分析;
(5)根据氮气化学性质不如氧气活泼分析;
(6)根据该实验证明燃烧不一定需要氧气分析。
20.(1)高
(2);置换反应
(3)弱
(4)漏斗
(5)不再产生气泡或无明显现象
(6)
(7)Fe、Ni、Cu
(1)铝合金和钛合金被广泛用于航天工业,一般情况下,铝合金的强度和硬度比纯铝的高;
(2)铝与稀盐酸反应生成氯化铝和氢气,反应的化学方程式为:;其反应是单质和化合物反应生成另一种单质和化合物,反应类型是置换反应;
(3)室温下,钛与水、稀盐酸和稀硫酸均不反应,铝可以与稀盐酸和稀硫酸反应,可判断钛的金属活动性比铝的弱;
(4)操作①②③的名称为过滤,此操作需用玻璃仪器有:烧杯、漏斗、玻璃棒;
(5)在滤渣①中加入稀硫酸,观察到无明显现象,则证明金属板中所加稀硫酸已过量;
(6)滤液③中含有稀硫酸、和硫酸铜,加铁粉,铁和稀硫酸反应生成硫酸亚铁和氢气,和硫酸铜反应生成硫酸亚铁和铜,反应化学方程式为:或;
(7)操作②得到滤渣中含有镍和铁,说明铁能和硫酸镍反应生成硫酸亚铁和镍,即铁比镍活泼,同时说明镍能和稀硫酸反应生成硫酸镍和氢气,即在金属活动性顺序中镍排在氢前面,而铜排在氢后面,Cu、Fe、Ni的活动性由强到弱顺序是Fe、Ni、Cu。
根据金属活动性顺序中,排在氢前面的金属,能和稀盐酸或稀硫酸反应生成盐和氢气,排在前面的金属,能把排在后面的金属从它的盐溶液中置换出来,并且金属越活泼,越容易先和盐溶液反应进行分析。
21.(1)5
(2)解:50g碳酸钠溶液样品中碳酸钠的质量为x。
x=5.3g
则该样品中碳酸钠的质量分数为
答:该样品中碳酸钠的质量分数为10.6%。
(1)实验3、4样品质量相等,加入氯化钙溶液的质量不相等,但烧杯和沉淀的总质量相等,可知实验3、4中碳酸钠已完全反应,则当50g碳酸钠溶液样品中的溶质完全反应时,生成沉淀的质量=。
(1)根据实验3、4样品质量相等,加入氯化钙溶液的质量不相等,但烧杯和沉淀的总质量相等,可知实验3、4中碳酸钠已完全反应,再根据质量守恒定律分析。
(2) 先设未知数,正确写出氯化钙与碳酸钠反应的化学方程式;再找准有关物质,已知量是碳酸钙的质量,未知量是参加反应碳酸钠的质量;列比例式计算。
(1)实验3、4样品质量相等,加入氯化钙溶液的质量不相等,但烧杯和沉淀的总质量相等,可知实验3、4中碳酸钠已完全反应,则当50g碳酸钠溶液样品中的溶质完全反应时,生成沉淀的质量为;
(2)见答案。
化学试题
一、选择题:本大题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
“小饼如嚼月,中有酥和饴。”中秋节是中华民族的传统节日,今年秋季,学校开展了自制月饼的实践活动。完成下面小题。
1.下列月饼制作过程中包含化学变化的是( )
A.擀面皮 B.铺果馅 C.烤月饼 D.切月饼
2.我们能闻到水果馅月饼的香味,从微观的角度解释,是因为( )
A.分子很小 B.分子在不停地运动
C.分子间存在间隔 D.分子能保持物质的化学性质
3.月饼中的水果富含维生素。下列关于维生素C的说法中,正确的是( )
A.相对分子质量为 B.由3种元素组成
C.碳、氢原子的个数比为 D.含有20个原子
4.《东周列国志》曰“木无本必枯,水无源必竭”。下列标志属于节约用水标志的是( )
A. B.
C. D.
5.下列化学用语表示错误的是( )
A.2个氮原子:2N
B.氧元素:O
C.硫离子的结构示意图:
D.3个氯离子:3Cl-
6.基于“宏观—微观—符号”建立联系是化学重要的思维方法。下列有关事实中,用“微粒观”解释错误的是( )
A.水通电生成氢气和氧气——化学反应中分子发生了改变
B.压瘪的乒乓球在热水中能鼓起来——温度升高,分子变大
C.墙内开花墙外香——分子不断运动
D.水和过氧化氢的化学性质不同——不同种分子的性质不同
7.化学的发展推动了社会的进步。下列科学家及成就对应不正确的是( )
A.门捷列夫:提出原子学说 B.拉瓦锡:验证质量守恒定律
C.屠呦呦:研制出青蒿素 D.徐寿:参与翻译《化学鉴原》
8.人类利用金属的历史经历了从青铜器时代到铁器时代,再到铝合金大量使用的过程。这一事实与下列因素有关的是( )
A.金属冶炼的水平 B.金属的导电性、延展性
C.金属的物理性质 D.地壳种金属元素的含量
9.规范的操作是实验成功的保障。下列实验操作正确的是( )
A.点燃酒精灯
B.取用粉末状试剂
C.读取液体体积
D.倾倒液体
10.如图是某矿泉水标签的部分内容,下列说法错误的是( )
A.该矿泉水是混合物
B.可用肥皂水区分该矿泉水的硬度
C.该矿泉水镁离子可以形成MgCl
D.中Si的化合价为+4价
11.如图是家用燃料变迁过程的示意团。
下列说法中错误的是( )
A.秸秆燃烧用水浇灭是降低了秸秆的着火点
B.将煤块变成蜂窝煤增大了接触面积,使燃烧更充分
C.煤、石油、天然气都属于不可再生能源
D.天然气泄漏应立即关闭阀门,开窗通风
12.下列实验设计能达到实验目的的是( )
选项 A B C D
实验设计
实验目的 收集二氧化碳 验证质量守恒定律 探究温度对分子运动速率的影响 证明的金属活动性比强
A.A B.B C.C D.D
13.在下列劳动项目中,涉及的化学知识解释错误的是( )
选项 生活场景 化学解释
A 将湿衣物放于阳光下晾晒 温度升高使分子运动加快
B 采用真空包装生鲜食品 隔绝化学性质比较活泼的氧气
C 用活性炭去除冰箱中异味 活性炭具有吸附性
D 用明矾处理浑浊的河水 明矾有消毒杀菌的作用
A.A B.B C.C D.D
14.杭州亚运会的主火炬采用甲醇作为燃料。如图为催化二氧化碳合成甲醇()的微观示意图。下列说法不正确的是( )
A.该反应属于置换反应
B.丁的化学式为
C.该反应有利于实现“碳中和”
D.反应前后的化学性质保持不变
15.下图所示实验方案能达到实验目的的是( )
A.探究催化剂的种类
B.探究铝、铜、银的金属活动性
C.鉴别氢气和甲烷
D. 测定空气中氧气的含量
二、非选择题:本大题共6小题,共55分。
16.2023全球6G技术大会3月22日在南京召开。硅(Si)是制作芯片不可缺少的材料,在元素周期表中的信息及原子结构示意图如图1所示,请结合图2回答下列问题
(1)硅原子的相对原子质量是 。
(2)C粒子属于 (填“原子”、“阳离子”或“阴离子”)。
(3)图2中与硅元素化学性质相似的是 (填字母序号)。
(4)硅元素与B所对应的元素形成化合物的化学式是 。
17.科学家预测,到2050年实现碳中和的4种主要途径的贡献率如图1所示。
(1)碳循环:转化成有机清洁燃料的反应原理如图2所示。该反应中,参加反应的和生成的的分子个数比为 。
(2)碳替代:用清洁能源替代传统的化石能源,写出一种清洁能源 。
(3)碳封存:
①地质封存:将由气态压缩成超临界液体,注入油气层、煤井、咸水层等密闭地质构造中。从微观角度解释能够压缩成液态的原因是 ;如果被封存在含的地下咸水层中,会转化为固态碳酸盐,该反应的化学方程式是 。
②海洋封存:将二氧化碳在深海中“封存”。但过多的会导致海水酸化,殃及海洋生物,要真正实现“海洋封存”,还任重而道远。导致海水酸化的物质是 (填化学式)。
(4)碳减排:写出一条日常生活中能减少排放的措施 。
18.根据如图所示装置,结合所学知识回答下列问题。
(1)写出图中仪器①的名称 ;
(2)实验室用A装置制取氧气,反应的化学方程式为 ;在试管口放一团棉花的作用是 ;
(3)装置E有多种用途,若用E装置收集氢气,则应将气体从 (选填“a”或“b”)端通入;若用E装置来干燥CO2,则E中应装的试剂名称是 ;
(4)装置F也可作制取CO2气体的发生装置,则装置中X内应盛放的药品是 ,若在反应进行中关闭止水夹,则可能观察到的现象是 。
19.化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在陶土网上得到一些白色固体。
(1)请写出镁条燃烧的化学方程式: 。
(2)同学们通过称量发现:在陶土网上收集到产物的质量小于镁条的质量。有人认为这个反应不遵循质量守恒定律。你认为出现这样实验结果的原因可能是 。
(3)小红按如图装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
【提出问题】黄色固体是什么?
【查阅资料】
a.镁能与二氧化碳反应生成碳和氧化镁;
b.镁能与氮气剧烈反应产生黄色的氮化镁()固体:
c.氮化镁可与水反应产生氨气(有刺激性气味),该气体能使湿润的红色石蕊试纸变蓝。
【作出猜想】黄色固体是。
【实验探究】请设计实验,验证猜想:
实验操作 实验现象 结论
取少量黄色固体于试管中,加适量水,将湿润的红色石蕊试纸放在试管口 该固体是
【反思与交流】
(4)氮化镁中氮元素的化合价是 。
(5)空气中的含量远大于的含量,而镁条在空气中燃烧产物MgO却远多于,合理的解释是 。
(6)同学们又联想到氢气在氯气中能够燃烧,于是对燃烧条件又有了新的认识: 。
20.金属材料在人类社会中有非常广泛的应用。合理开发、利用、回收金属资源对我国的可持续发展起到重要意义。
(1)Ⅰ.我国用长征三号乙运载火箭成功发射第55颗北斗导航卫星,金属材料在其中起到了重要作用。
铝合金和钛合金被广泛用于航天工业。一般情况下,铝合金的强度和硬度比纯铝的 (填“高”或“低”)。
(2) 写出铝与稀盐酸反应的化学方程式 ,其反应类型是 。
(3) 室温下,钛与水、稀盐酸和稀硫酸均不反应, 可判断钛的金属活动性比铝的. (填“强”或“弱”)。
(4)Ⅱ.某金属板中含 Fe、Cu、Ni(镍,银白色金属) 等金属。如图是回收金属的流程。
已知:
①②③的操作需用玻璃仪器有:烧杯、 、玻璃棒。
(5) 在滤渣①中加入稀硫酸,观察到 ,则证明金属板中所加稀硫酸已过量。
(6) 滤液③中加铁粉的反应化学方程式为 (写其中1个)。
(7) Cu、Fe、Ni的活动性由强到弱顺序是 。
21.为测定某碳酸钠溶液中溶质的质量分数,取200g碳酸钠溶液,平均分为四份,每份样品均按如图所示进行实验,实验数据如表。
实验1 实验2 实验3 实验4
样品质量/g 50 50 50 50
氯化钙溶液质量/g 10 20 30 40
烧杯和沉淀的总质量/g 42 44 45 45
请计算:
(1)当50g碳酸钠溶液样品中的溶质完全反应时,生成沉淀的质量为 g;
(2)计算该样品中碳酸钠的质量分数(写出计算过程,计算结果精确至0.1%)。
答案解析部分
1.C
2.B
3.B
4.D
A、该图标表示剧毒品,不符合题意;
B、该图标表示禁止放置易燃物,不符合题意;
C、该图标表示禁止烟火,不符合题意;
D、该图标表示节约用水,符合题意。
故答案为:D.
根据化学中常见的图标有节约用水、循环使用、禁止烟火、禁止吸烟、禁止放易燃物,禁止放烟花爆竹,当心剧毒等图标来解答。
5.C
6.B
7.A
8.A
解:根据金属的使用历史是经历了从青铜器时代到铁器时代,再到铝合金大量使用的过程。该事实说明金属的冶炼水平不断提高。与金属的物理性质和地壳中的含量无关,故符合题意的是A,不符合题意的是BCD。
故答案为:A.
根据金属的冶炼水平不断提高,金属经历了从青铜时代到铁器时代,再到铝合金的使用时代来解答。
9.B
10.C
11.A
A、 物质的着火点是固定不变的,秸秆燃烧用水浇灭是降低温度至秸秆的着火点以下,故A错误;
B、将煤块变成蜂窝煤增大了接触面积,使燃烧更充分,故B正确;
C、 煤、石油、天然气都是古代生物遗骸埋藏在地下经过漫长的一系列复杂的变化而形成,都属于不可再生能源,故C正确;
D、天然气泄漏应立即关闭阀门,隔绝可燃物,并开窗通风,稀释空气中天然气的浓度,故D正确;
故答案为:A。
A、根据物质着火点是固定不变的和灭火的原理进行分析解答;
B、根据燃料充分燃烧需要考虑的因素进行分析解答;
C、根据煤、石油、天然气的形成原因进行分析解答;
D、根据易燃、易爆安全知识进行分析解答。
12.D
13.D
14.A
15.B
16.(1)28.09
(2)阴离子
(3)A
(4)
(1) 硅原子的相对原子质量是28.09;
(2)C粒子质子数为17,电子数为18,为阴离子;
(3)硅原子最外层电子数为4,与A最外层电子数相同,化学性质相似;
(4)B对应元素为氧元素,形成化合物时呈-2价,硅元素形成化合物时呈+4价,硅元素与氧元素形成的化合物为二氧化硅,化学式为 。
(1)根据元素周期表小格信息中最下面数字为相对原子质量分析;
(2)根据质子数小于电子数的粒子为阴离子分析;
(3)根据化学性质由最外层电子数决定分析;
(4)根据化合物化学式书写遵循化合价代数和为0的原则分析。
17.(1)1:1
(2)太阳能
(3)二氧化碳分子之间的间隙变小;;
(4)减少燃油车的使用
(1)由图2可知CO2和H2在催化剂的条件下反应生成H2O和CH3OH,根据质量守恒定律,化学反应前后元素的种类、原子的种类和数目不变,CH3OH中碳元素全部来自CO2中的碳元素,一个CO2分子中含有1个碳原子,一个CH3OH分子中也只含1个碳原子,所以参加反应的CO2和生成的CH3OH分子个数比为1;1;
故答案为1:1;
(2)目前人类正在开发利用的新能源有太阳能、风能、地热能、潮汐能、核能等;
故答案为:太阳能;
(3)①由于分子之间有间隔,同一种物质不同状态其分子的间隔不同,固体分子间隔<液体分子间隔<气体分子间隔,CO2能够压缩成液态的原因是二氧化碳分子之间的间隔变小;CO2和Ca(OH)2反应生成CaCO3沉淀和H2O,其反应的化学方程式为: ;
②二氧化碳溶于水,会和水反应生成H2CO3,所以过多的二氧化碳在深海中“封存”会使海水酸化;
故答案为:(3)①二氧化碳分子之间的间隙变小;
②H2CO3;
(4)生活中能够减少CO2排放的措施很多,如减少化石燃料的使用,提倡绿色出行,减少燃油车的使用,更多使用新能源汽车,开发使用太阳能、风能等新能源;
故答案为: 减少燃油车的使用 。
(1)根据质量守恒定律,化学反应前后元素的种类,原子的种类和数目不变进行分析解答;
(2)根据人类正在开发使用的清洁能源进行分析解答;
(3)根据分子的基本性质,二氧化碳与氢氧化钙反应的原理,二氧化碳和水反应的原理进行分析解答;
(4)根据减少化石燃料的使用即是减少二氧化碳排放进行分析解答。
18.(1)锥形瓶
(2);防止加热时固体粉末进入导管,堵塞导管
(3)b;浓硫酸
(4)大理石;当固液分离时反应停止
(1)图中仪器①的名称锥形瓶;
(2)高锰酸钾受热分解生成锰酸钾,二氧化锰和氧气,反应的化学方程式为,试管口塞一团棉花的作用是:防止加热时固体粉末进入导管,堵塞导管;
(3)氢气的密度比空气的密度小,若用E装置收集氢气,则应将气体从短管b端通入,浓硫酸具有吸水性,若用E装置干燥二氧化碳,E中应该存放的试剂是浓硫酸;
(4)实验室制二氧化碳所用的药品是石灰石和稀盐酸,装置中X内应盛放的药品是石灰石,若在反应中关闭止水夹产生的二氧化碳不能逸散,则观察到的现象是固体液体分离反应停止。
(1)根据实验室常用仪器及用途分析;
(2)根据高锰酸钾受热分解生成锰酸钾,二氧化锰和氧气,试管口塞一团棉花的作用是:防止加热时固体粉末进入导管,堵塞导管分析;
(3)根据氢气的密度比空气的密度小,浓硫酸具有吸水性分析;
(4)根据实验室制二氧化碳所用的药品是石灰石和稀盐酸分析。
19.2Mg+O22MgO;大量的白烟弥漫到空气中,使得生成物收集不全;有刺激性气味的气体生成,且试纸由红色变蓝色;-3;氮气化学性质不如氧气活泼;燃烧不一定需要有氧气参加
(1)镁燃烧是镁与氧气在点燃条件下反应生成氧化镁,化学方程式为2Mg+O22MgO;
(2)化学变化一定遵循质量守恒定律,该反应过程中有大量的白烟弥漫到空气中,使得生成物收集不全,所以会使收集的产物质量小于镁条的质量;
(3)由查阅资料可知,氮化镁与水反应能产生氨气,氨气有刺激性气味,且可利用湿润的红色石蕊试纸检验,所以证明黄色固体为氮化镁的方法为收集产物中的黄色固体放入试管中,加入适量的水,在试管口放置湿润的红色石蕊试纸,若有刺激性气味的气体生成,且试纸由红色变蓝色,则可证明黄色固体是Mg3N2;
(4)氮化镁中镁元素化合价为+2价,设氮元素化合价为x,根据化合物中各元素化合价的代数和为0可得,(+2)×3+2x=0,解得x=-3;
(5)氮气化学性质不如氧气活泼,所以空气中虽然氮气的含量高,但镁仍主要与氧气发生反应;
(6)由镁与氮气反应和氢气在氯气中燃烧可知,燃烧不一定需要有氧气参加。
(1)根据镁与氧气在点燃条件下反应生成氧化镁分析;
(2)根据化学变化都遵循质量守恒定律分析;
(3)根据氮化镁与水反应能产生氨气,氨气有刺激性气味,能使湿润的红色石蕊试纸变蓝分析;
(4)根据化合物中各元素化合价的代数和为0分析;
(5)根据氮气化学性质不如氧气活泼分析;
(6)根据该实验证明燃烧不一定需要氧气分析。
20.(1)高
(2);置换反应
(3)弱
(4)漏斗
(5)不再产生气泡或无明显现象
(6)
(7)Fe、Ni、Cu
(1)铝合金和钛合金被广泛用于航天工业,一般情况下,铝合金的强度和硬度比纯铝的高;
(2)铝与稀盐酸反应生成氯化铝和氢气,反应的化学方程式为:;其反应是单质和化合物反应生成另一种单质和化合物,反应类型是置换反应;
(3)室温下,钛与水、稀盐酸和稀硫酸均不反应,铝可以与稀盐酸和稀硫酸反应,可判断钛的金属活动性比铝的弱;
(4)操作①②③的名称为过滤,此操作需用玻璃仪器有:烧杯、漏斗、玻璃棒;
(5)在滤渣①中加入稀硫酸,观察到无明显现象,则证明金属板中所加稀硫酸已过量;
(6)滤液③中含有稀硫酸、和硫酸铜,加铁粉,铁和稀硫酸反应生成硫酸亚铁和氢气,和硫酸铜反应生成硫酸亚铁和铜,反应化学方程式为:或;
(7)操作②得到滤渣中含有镍和铁,说明铁能和硫酸镍反应生成硫酸亚铁和镍,即铁比镍活泼,同时说明镍能和稀硫酸反应生成硫酸镍和氢气,即在金属活动性顺序中镍排在氢前面,而铜排在氢后面,Cu、Fe、Ni的活动性由强到弱顺序是Fe、Ni、Cu。
根据金属活动性顺序中,排在氢前面的金属,能和稀盐酸或稀硫酸反应生成盐和氢气,排在前面的金属,能把排在后面的金属从它的盐溶液中置换出来,并且金属越活泼,越容易先和盐溶液反应进行分析。
21.(1)5
(2)解:50g碳酸钠溶液样品中碳酸钠的质量为x。
x=5.3g
则该样品中碳酸钠的质量分数为
答:该样品中碳酸钠的质量分数为10.6%。
(1)实验3、4样品质量相等,加入氯化钙溶液的质量不相等,但烧杯和沉淀的总质量相等,可知实验3、4中碳酸钠已完全反应,则当50g碳酸钠溶液样品中的溶质完全反应时,生成沉淀的质量=。
(1)根据实验3、4样品质量相等,加入氯化钙溶液的质量不相等,但烧杯和沉淀的总质量相等,可知实验3、4中碳酸钠已完全反应,再根据质量守恒定律分析。
(2) 先设未知数,正确写出氯化钙与碳酸钠反应的化学方程式;再找准有关物质,已知量是碳酸钙的质量,未知量是参加反应碳酸钠的质量;列比例式计算。
(1)实验3、4样品质量相等,加入氯化钙溶液的质量不相等,但烧杯和沉淀的总质量相等,可知实验3、4中碳酸钠已完全反应,则当50g碳酸钠溶液样品中的溶质完全反应时,生成沉淀的质量为;
(2)见答案。
同课章节目录
