1.1.1物质的分类 课件(共25张PPT)
文档属性
| 名称 | 1.1.1物质的分类 课件(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-21 15:17:58 | ||
图片预览







文档简介
(共25张PPT)
第一章 物质及其变化
第一节 物质的分类及转化
物质的分类
课程标准 核心素养
认识元素可以组成不同种类的 物质,根据物质的组成和性质可以对物质进行分类。 宏观辨识与微观探析:能够从不同层次认识物质的多样性,并对物质进行分类,从微观上认识物质的结构,形成“结构决定性质”的观念
为什么在图书馆里你很快就能找到需要的书?
因为图书进行了分类
简单分类法及其应用
简单分类法及其应用
在超市,我们能很快找到所需物品,为什么?
因为商品进行了分类
2、意义:能提高人们工作、学习效率,使人们更快更便捷的达到目的。
1、分类:把某些特征相似的事物,按照一定标准归类到一起;
知识点1、分类及分类的意义
一、物质的分类
1、分类的方法
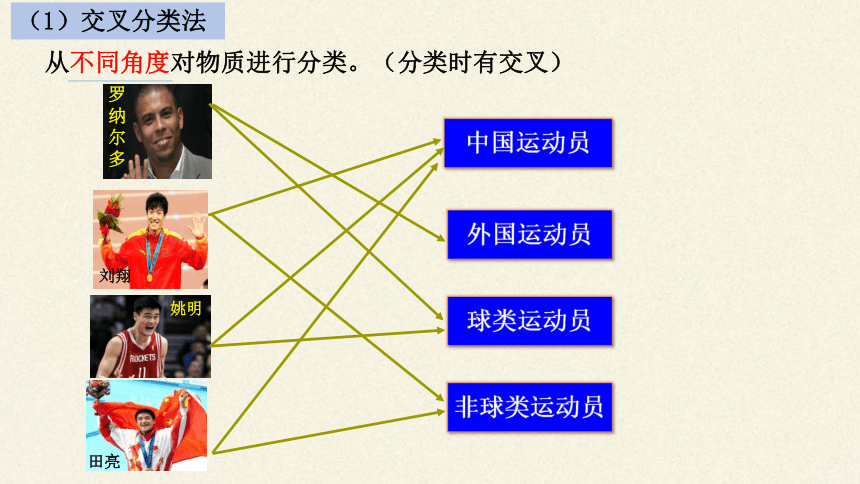
(1)交叉分类法
(2)树状分类法
(1)交叉分类法
从不同角度对物质进行分类。(分类时有交叉)
姚明
刘翔
田亮
罗纳尔多
中国运动员
外国运动员
球类运动员
非球类运动员
交叉分类法
(2)树状分类法
根据 物质的组成 对物质进行分类的一种方法。(对同类事物进行再分类)
物质
纯净物
混合物
单质
化合物
金属单质
非金属单质
氧化物
盐
碱
酸
无机化合物
有机化合物
……
(2)树状分类法
稀有气体
只由一种元素组成的物质一定是纯净物吗?
只由一种元素组成的物质不一定是纯净物
氧气(O2)
臭氧(O3)
金刚石
石墨
C60
由同一种元素形成的几种性质不同的单质
同素异形体
你还能想到其它同素异形体吗?
红磷、白磷
氧化物
依据性质
依据组成
酸性氧化物 CO2、SO2、Mn2O7
碱性氧化物 CaO、Fe2O3
金属氧化物 MgO、Fe2O3
非金属氧化物 CO2、H2O
不成盐氧化物 CO、NO
2、氧化物的分类
两性氧化物 Al2O3
过氧化物 Na2O2
其他氧化物 Fe3O4
(2)碱性氧化物:与酸反应只生成一种盐和水。
注意:碱性氧化物一定是金属氧化物,
金属氧化物不一定是碱性氧化物,如 Mn2O7
(1)酸性氧化物:与碱反应只生成一种盐和水。
注意:酸性氧化物不一定是非金属氧化物,如 Mn2O7
非金属氧化物也不一定是酸性氧化物,如 CO、NO。
※ 氧化物的类别辨析
包括大部分非金属氧化物和个别金属氧化物如Mn2O7
包括大部分金属氧化物
非金属氧化物
金属氧化物
酸性氧化物
碱性氧化物
一定是
一定是
一定是
一定是
只有碱性氧化物都是金属氧化物
CO2
SO3
CaO
Fe2O3
Mn2O7
非金属氧化物
金属氧化物
酸性氧化物
碱性氧化物
连一连
3、酸的分类
酸
按是否含氧
含氧酸:HNO3、H2SO4
无氧酸:HCl、H2S
按电离的H+数目
按酸性强弱
强酸:HNO3、H2SO4 、HCl
中强酸:H3PO4、H2SO3
弱酸:H2CO3、CH3COOH
一元酸:HCl、HNO3
二元酸:H2SO4
多元酸:H3PO4
4、碱的分类
碱
按溶解性
可溶性碱:KOH、NaOH、Ba(OH)2、Ca(OH)2
难溶性碱:Cu(OH)2、Mg(OH)2、Fe(OH)3
按碱性强弱
强碱:KOH、NaOH、Ba(OH)2、Ca(OH)2
弱碱:NH3 H2O、难溶性碱
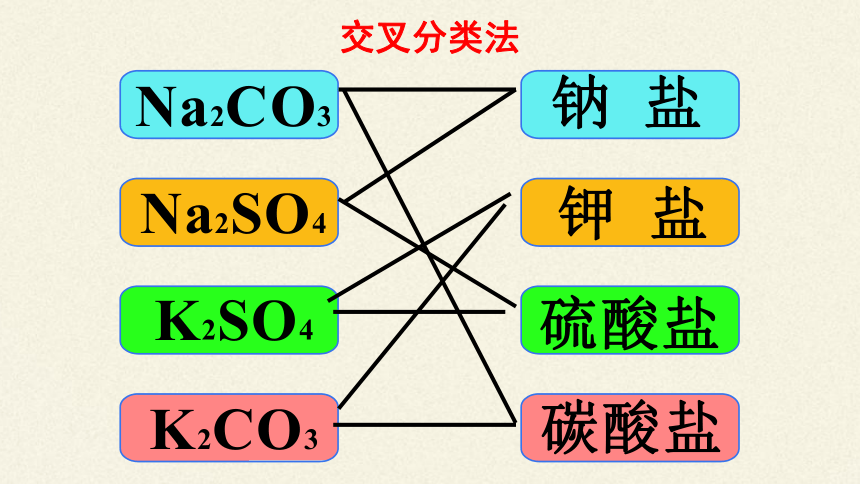
5、盐的分类
盐
按溶解性
可溶性盐:KCl、NaCl、NH4Cl
难溶性盐:AgCl、BaSO4、CaCO3
组成中是否含H+、OH-
正盐:KCl、NaCl
酸式盐:NaHCO3、NaHSO4
碱式盐:Cu2(OH)2CO3
由金属离子(或NH4)和酸根离子构成的化合物
+
树状分类法
树状分类法
分类法的应用
1、用树状分类法对下列物质进行分类:
HCl,CO2 ,CaO ,NaOH, Na2SO4 , NaHCO3 , CaCO3 , Ca(OH)2 ,H2SO4 。
化合物
酸
碱
盐
氧化物
HCl H2SO4
NaOH Ca(OH)2
Na2SO4 CaCO3
NaHCO3
CO2 CaO
C
3、下列分类正确的是( )
Na2O、MgO、CO均属于碱性氧化物
B. 烧碱、生石灰、纯碱均属于碱
C. 酸、碱、盐之间发生的反应均属于复分解反应
D. SO2、CO2、SO3、CaO均属于酸性氧化物
C
课后作业
课本P12 :1、2
课时对点练P128 :对点训练:题组一二
综合强化:11、12、13、15
第一章 物质及其变化
第一节 物质的分类及转化
物质的分类
课程标准 核心素养
认识元素可以组成不同种类的 物质,根据物质的组成和性质可以对物质进行分类。 宏观辨识与微观探析:能够从不同层次认识物质的多样性,并对物质进行分类,从微观上认识物质的结构,形成“结构决定性质”的观念
为什么在图书馆里你很快就能找到需要的书?
因为图书进行了分类
简单分类法及其应用
简单分类法及其应用
在超市,我们能很快找到所需物品,为什么?
因为商品进行了分类
2、意义:能提高人们工作、学习效率,使人们更快更便捷的达到目的。
1、分类:把某些特征相似的事物,按照一定标准归类到一起;
知识点1、分类及分类的意义
一、物质的分类
1、分类的方法
(1)交叉分类法
(2)树状分类法
(1)交叉分类法
从不同角度对物质进行分类。(分类时有交叉)
姚明
刘翔
田亮
罗纳尔多
中国运动员
外国运动员
球类运动员
非球类运动员
交叉分类法
(2)树状分类法
根据 物质的组成 对物质进行分类的一种方法。(对同类事物进行再分类)
物质
纯净物
混合物
单质
化合物
金属单质
非金属单质
氧化物
盐
碱
酸
无机化合物
有机化合物
……
(2)树状分类法
稀有气体
只由一种元素组成的物质一定是纯净物吗?
只由一种元素组成的物质不一定是纯净物
氧气(O2)
臭氧(O3)
金刚石
石墨
C60
由同一种元素形成的几种性质不同的单质
同素异形体
你还能想到其它同素异形体吗?
红磷、白磷
氧化物
依据性质
依据组成
酸性氧化物 CO2、SO2、Mn2O7
碱性氧化物 CaO、Fe2O3
金属氧化物 MgO、Fe2O3
非金属氧化物 CO2、H2O
不成盐氧化物 CO、NO
2、氧化物的分类
两性氧化物 Al2O3
过氧化物 Na2O2
其他氧化物 Fe3O4
(2)碱性氧化物:与酸反应只生成一种盐和水。
注意:碱性氧化物一定是金属氧化物,
金属氧化物不一定是碱性氧化物,如 Mn2O7
(1)酸性氧化物:与碱反应只生成一种盐和水。
注意:酸性氧化物不一定是非金属氧化物,如 Mn2O7
非金属氧化物也不一定是酸性氧化物,如 CO、NO。
※ 氧化物的类别辨析
包括大部分非金属氧化物和个别金属氧化物如Mn2O7
包括大部分金属氧化物
非金属氧化物
金属氧化物
酸性氧化物
碱性氧化物
一定是
一定是
一定是
一定是
只有碱性氧化物都是金属氧化物
CO2
SO3
CaO
Fe2O3
Mn2O7
非金属氧化物
金属氧化物
酸性氧化物
碱性氧化物
连一连
3、酸的分类
酸
按是否含氧
含氧酸:HNO3、H2SO4
无氧酸:HCl、H2S
按电离的H+数目
按酸性强弱
强酸:HNO3、H2SO4 、HCl
中强酸:H3PO4、H2SO3
弱酸:H2CO3、CH3COOH
一元酸:HCl、HNO3
二元酸:H2SO4
多元酸:H3PO4
4、碱的分类
碱
按溶解性
可溶性碱:KOH、NaOH、Ba(OH)2、Ca(OH)2
难溶性碱:Cu(OH)2、Mg(OH)2、Fe(OH)3
按碱性强弱
强碱:KOH、NaOH、Ba(OH)2、Ca(OH)2
弱碱:NH3 H2O、难溶性碱
5、盐的分类
盐
按溶解性
可溶性盐:KCl、NaCl、NH4Cl
难溶性盐:AgCl、BaSO4、CaCO3
组成中是否含H+、OH-
正盐:KCl、NaCl
酸式盐:NaHCO3、NaHSO4
碱式盐:Cu2(OH)2CO3
由金属离子(或NH4)和酸根离子构成的化合物
+
树状分类法
树状分类法
分类法的应用
1、用树状分类法对下列物质进行分类:
HCl,CO2 ,CaO ,NaOH, Na2SO4 , NaHCO3 , CaCO3 , Ca(OH)2 ,H2SO4 。
化合物
酸
碱
盐
氧化物
HCl H2SO4
NaOH Ca(OH)2
Na2SO4 CaCO3
NaHCO3
CO2 CaO
C
3、下列分类正确的是( )
Na2O、MgO、CO均属于碱性氧化物
B. 烧碱、生石灰、纯碱均属于碱
C. 酸、碱、盐之间发生的反应均属于复分解反应
D. SO2、CO2、SO3、CaO均属于酸性氧化物
C
课后作业
课本P12 :1、2
课时对点练P128 :对点训练:题组一二
综合强化:11、12、13、15
