2.1钠及其化合物(第二课时) 课件 (共25张PPT)
文档属性
| 名称 | 2.1钠及其化合物(第二课时) 课件 (共25张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-21 15:19:36 | ||
图片预览




文档简介
(共25张PPT)
2.1 钠及其化合物(第2课时)
学 科:化学 教 材:人教版 (2019)
第二章 海水中的重要元素 —— 钠和氯
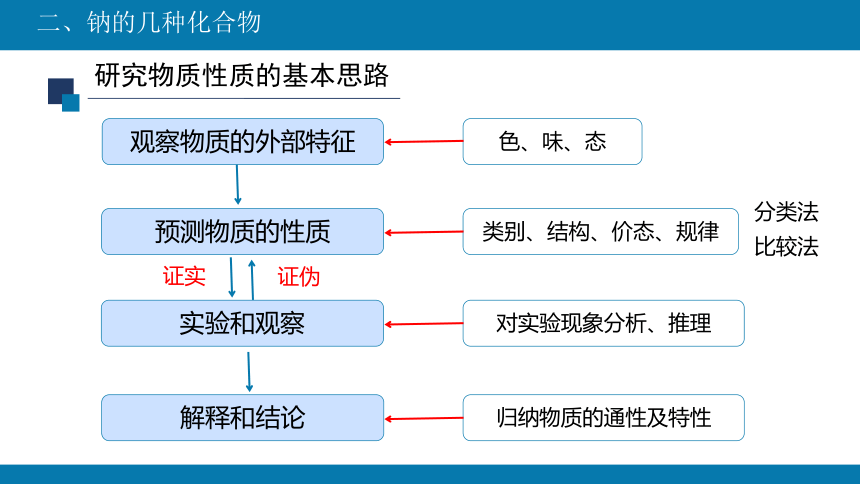
研究物质性质的基本思路
观察物质的外部特征
分类法
比较法
预测物质的性质
实验和观察
解释和结论
色、味、态
类别、结构、价态、规律
对实验现象分析、推理
归纳物质的通性及特性
证实
证伪
二、钠的几种化合物
二、钠的几种化合物
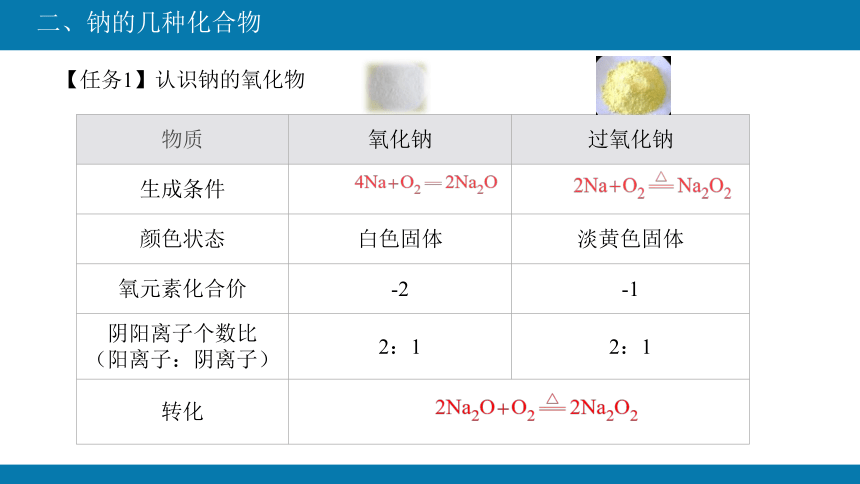
【任务1】认识钠的氧化物
物质 氧化钠 过氧化钠
生成条件
颜色状态 白色固体 淡黄色固体
氧元素化合价 -2 -1
阴阳离子个数比 (阳离子:阴离子) 2:1 2:1
转化
二、钠的几种化合物
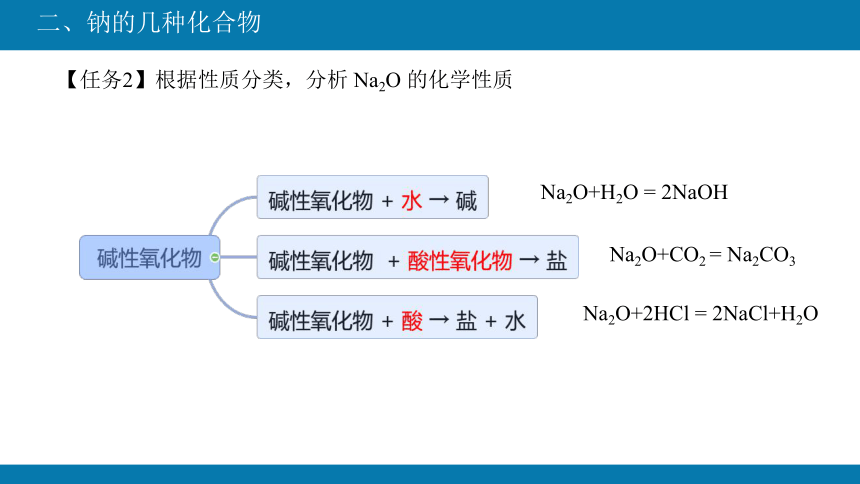
【任务2】根据性质分类,分析 Na2O 的化学性质
Na2O+H2O = 2NaOH
Na2O+CO2 = Na2CO3
Na2O+2HCl = 2NaCl+H2O
二、钠的几种化合物
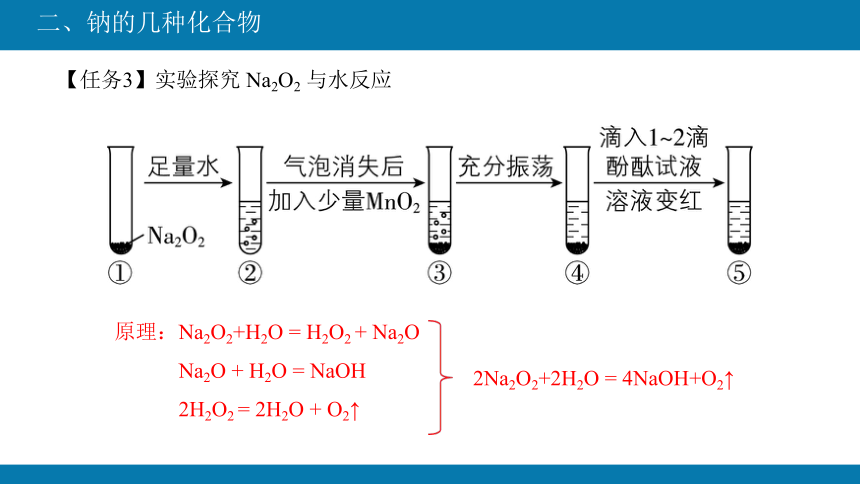
【任务3】实验探究 Na2O2 与水反应
pH试纸的使用:取一小片pH试纸在表面皿或玻璃片上,用洁净干燥的玻璃棒蘸取待测液点滴于试纸的中部,观察变化稳定后的颜色,与标准比色卡对比,判断溶液的性质
二、钠的几种化合物
【任务3】实验探究 Na2O2 与水反应
实验现象 分析和结论
有气泡产生,带火星的木条复燃 有氧气生成
试管壁微热 反应放热
试纸变蓝 有碱性物质生成
化学方程式:2Na2O2+2H2O = 4NaOH+O2↑
二、钠的几种化合物
【任务3】实验探究 Na2O2 与水反应
原理:Na2O2+H2O = H2O2 + Na2O
Na2O + H2O = NaOH
2H2O2 = 2H2O + O2↑
2Na2O2+2H2O = 4NaOH+O2↑
二、钠的几种化合物
【任务4】实验探究 Na2O2 与 CO2 反应
[实验] 向包着过氧化钠的脱脂棉通入CO2,观察现象
[现象] 脱脂棉燃烧
[结论] 过氧化钠与二氧化碳反应可以生成氧气
2Na2O2+2CO2 = 2Na2CO3+O2
[应用] 该原理可用作呼吸面罩中的供养剂
二、钠的几种化合物
【任务4】实验探究 Na2O2 与 CO2 反应
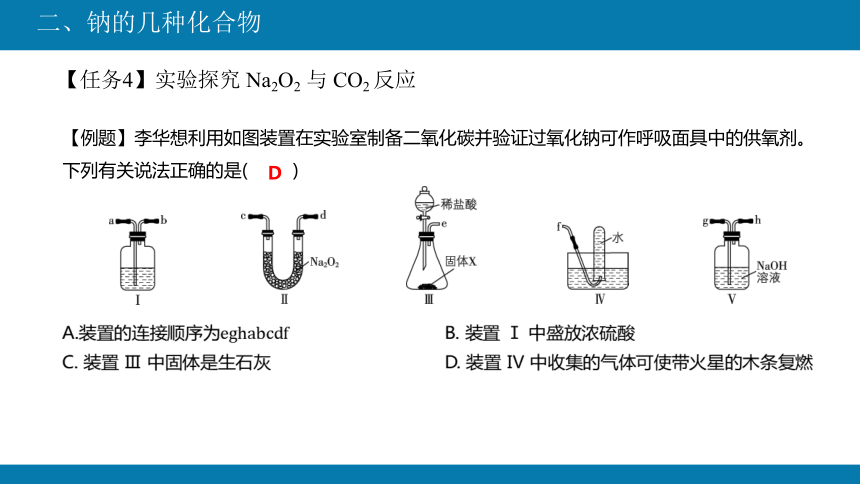
【例题】李华想利用如图装置在实验室制备二氧化碳并验证过氧化钠可作呼吸面具中的供氧剂。
下列有关说法正确的是( )
D
A.装置的连接顺序为 B. 装置 Ⅰ 中盛放浓硫酸
C. 装置 Ⅲ 中固体是生石灰 D. 装置 Ⅳ 中收集的气体可使带火星的木条复燃
二、钠的几种化合物
【任务4】实验探究 Na2O2 与 CO2 反应
【例题】许多非金属氧化物能与反应,且反应有规律,如 ,又
如 。据此,你认为下列化学方程式中正确的是( )
AD
A. B.
C. D.
思路导引 由题给信息可知, 可与某些元素的最高价氧化物反应,生成该元素的最高价态的
含氧酸盐和 ,反应中过氧化钠表现氧化性、还原性;当过氧化钠与较低价态的氧化物反应时,
生成该元素的最高价态的含氧酸盐,反应中过氧化钠表现强氧化性。
二、钠的几种化合物
【任务4】实验探究 Na2O2 与 CO2 反应
5.[广东深圳2023高一月考] 某兴趣小组欲验证:①干
燥的不与反应;②在有水条件下, 能与
反应。设计实验装置如图所示,实验过程中先滴
加稀盐酸,打开,关闭 ,一段时间后再加热铜丝;
充分反应后,再关闭,打开 ,观察整个过程中铜
丝的变化。
下列说法错误的是( )
D
A.先滴加稀盐酸,后加热的目的是排出装置内的空气
B.饱和溶液的作用是除去中的
C.试剂 可以是浓硫酸
D.反应过程中铜丝先变黑,后变红
二、钠的几种化合物
【任务4】实验探究 Na2O2 与 CO2 反应
解析 稀盐酸和石灰石反应生成的二氧化碳中含有水蒸气和氯化氢,通过饱和碳酸氢钠溶液除去
氯化氢,结合实验目的知,实验过程中需先用浓硫酸干燥二氧化碳验证①,在加热条件下铜丝可
以和氧气反应生成,故实验中通过铜丝的变化判断与 是否反应。装置内空气中的氧
气会干扰实验,所以先滴加稀盐酸,后加热的目的是利用生成的二氧化碳排出装置内的空气,A
正确;易挥发,生成的二氧化碳气体中含有氯化氢杂质,饱和溶液的作用是除去
中的,B正确;通过饱和溶液的中仍含水蒸气,故验证①时需干燥,即试剂
的作用是干燥二氧化碳,因此试剂 可以是浓硫酸,C正确;结合题意可知,在整个实验过程中先
验证干燥的与不反应,该过程铜丝无明显变化,后验证在有水条件下,与 反
应产生 ,该过程铜丝变黑,D错误。
二、钠的几种化合物
【任务5】 从三个角度认识与、 反应的规律
(1)质量角度
对于固体,在反应①中,增加的质量相当于水中“ ”的质量,
其结果可以看作:;
在反应②中,增加的质量相当于中“ ”的质量,
其结果可以看作: 。
二、钠的几种化合物
【任务5】 从三个角度认识与、 反应的规律
(2)气体分子数角度
(气体)
由化学方程式可以看出,将、(气体)与足量的 固体充分反应后,
气体分子数变为原来的一半。
(3)反应先后顺序关系
当、(气体)与同时反应时,由于与反应生成的
能与 反应,所以可以视为先与反应,待反应完全后,再与
(气体)反应。
二、钠的几种化合物
【任务5】 从三个角度认识与、 反应的规律
【例题】在一密闭容器中共有、和 的混合物,用电火花引燃,使其完全燃烧,
再将燃烧后的气体用充分吸收,固体增加的质量为 ,则原混合气体中 的质量为
( )
B
A. B. C. D.
解析 在一密闭容器中共有、和 的混合物,用电火花引燃,使其完全燃烧,发生反
应、,然后将燃烧产物用足量 充分吸收,发生反应
、 。通过化学方程式中物
质变化可知,、燃烧消耗的氧气的量,和反应生成的、与 反应释放的氧气的
量相等,则固体增加的质量就是混合气体中、的质量,所以原混合气体中 的质量
,选B。
二、钠的几种化合物
【任务5】分析 Na2O2 与 HCl 反应
[思考] 类比过氧化钠反应的规律,尝试写出过氧化钠与盐酸反应方程式
2Na2O2+4HCl = 4NaCl+2H2O+O2↑
二、钠的几种化合物
【任务6】归纳对比氧化钠与过氧化钠
物质 氧化钠(Na2O) 过氧化钠(Na2O2)
与水反应 Na2O+H2O = 2NaOH 2Na2O2+2H2O = 4NaOH+O2↑
与CO2反应 Na2O+CO2 = Na2CO3 2Na2O2+2CO2 = 2Na2CO3+O2
与盐酸反应 Na2O+2HCl = 2NaCl+H2O 2Na2O2+4HCl = 4NaCl+2H2O+O2↑
主要用途 可制烧碱 漂白剂、消毒剂、供氧剂
保存 密封 密封、远离易燃物
二、钠的几种化合物
【任务6】归纳对比氧化钠与过氧化钠
【例题】下列关于和 的对比,叙述不正确的是( )
A
A.均为碱性氧化物
B.阴、阳离子个数比均为
C.加入硫酸铜溶液,均有沉淀产生
D.将和 加入石蕊溶液中,现象不同
解析 为碱性氧化物, 与酸反应除生成盐和水外还有氧气,不是碱性氧化物,A错误;
1个中含2个和1个,1个中含2个和1个,B正确;和与
反应均会生成,与溶液反应产生蓝色的沉淀,C正确;和
均会与水反应生成,溶液显碱性,故开始时石蕊溶液均会变蓝,但由于 有强氧化性从
而表现出漂白性,故加入 的石蕊溶液先变蓝后褪色,现象不同,D正确。
二、钠的几种化合物
【任务7】过氧化钠性质深入理解
【例题】钠及其化合物的生产与应用,是化工生产与研究的重要组成部分。
(1)用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备
并检验其纯度的实验流程如图甲所示。
回答下列问题:
① 样品加水溶解的化学方程式为_________________________________。
解析 样品加水溶解的化学方程式: ;
二、钠的几种化合物
【任务7】过氧化钠性质深入理解
②样液中加入后产生能使带火星木条复燃的气体,说明 与水反应的过程中还生成了
______(填化学式)。
解析 样液中加入后产生能使带火星木条复燃的气体,说明 与水反应的过程中还生成
了,在 催化作用下分解生成氧气;
③滤液中加入溶液产生白色沉淀,说明 样品中含有_________杂质,生成白色沉淀的
离子方程式是_________________________。
解析 滤液中加入溶液产生白色沉淀,说明滤液中含有,即 样品中含有
;与反应生成白色沉淀碳酸钡,离子方程式为 。
二、钠的几种化合物
【任务7】过氧化钠性质深入理解
(2)工业上以侯氏制碱法为基础生产焦亚硫酸钠( ,能溶于水)的工艺流程如图乙:
①反应Ⅰ的化学方程式是_____________________________________________。
解析 由思路导引可知,反应Ⅰ的化学方程式: ;
二、钠的几种化合物
【任务7】过氧化钠性质深入理解
②关于该流程,下列说法正确的是___(填序号)。
c
a.反应Ⅰ中应先通入,再通入 b.反应Ⅱ属于氧化还原反应
c.该流程中, 可以循环使用 d.反应Ⅰ说明了碳酸氢钠的溶解度较大
解析 氨气在水中的溶解度较大,在碱性溶液中溶解度较大,故在反应Ⅰ中应先通入 ,
使溶液呈碱性,再通入, 错误;反应Ⅱ为碳酸氢钠的分解反应,该反应不是氧化还原反
应,错误;反应Ⅱ、Ⅲ生成二氧化碳,反应Ⅰ中需要消耗二氧化碳,因此该流程中 可以循
环使用,正确;反应Ⅰ中析出,说明碳酸氢钠的溶解度较小, 错误。
二、钠的几种化合物
【任务7】过氧化钠性质深入理解
③反应Ⅲ包含多步反应。
第一步:……
第二步:
为了减少产品 中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的数
目之比为_____。
解析 由第二步反应知,第一步需制得亚硫酸氢钠,即第一步反应是
,为了减少产品 中的杂质含量,应使第一步
反应中尽可能多地生成,而无其他副产物(如 ),结合第一步化学方程式知,理
论上需控制第一步反应中气体反应物与固体反应物的数目之比为 。
二、钠的几种化合物
【任务7】过氧化钠性质深入理解
思路导引(1)熔融的与空气反应产生,与空气中的反应产生、 ;
与水反应产生、,同时有少量未分解的中间产物,在 催化下分解
产生、,滤液中含、,向滤液中加入溶液,反应产生 沉淀。
(2)向饱和溶液中先后通入、,反应产生沉淀和,将 沉淀过
滤出来,然后加热,分解产生、、;在空气中灼烧,反应产生 、
,与反应产生,将 溶液蒸发浓缩、冷却结晶,获得胆矾晶体
;、、发生反应Ⅲ: ,
然后受热分解: 。
课后作业
1. 完成资料P29-34页选能写的写
2. 列表比较氧化钠与过氧化钠,写在作业本上
2.1 钠及其化合物(第2课时)
学 科:化学 教 材:人教版 (2019)
第二章 海水中的重要元素 —— 钠和氯
研究物质性质的基本思路
观察物质的外部特征
分类法
比较法
预测物质的性质
实验和观察
解释和结论
色、味、态
类别、结构、价态、规律
对实验现象分析、推理
归纳物质的通性及特性
证实
证伪
二、钠的几种化合物
二、钠的几种化合物
【任务1】认识钠的氧化物
物质 氧化钠 过氧化钠
生成条件
颜色状态 白色固体 淡黄色固体
氧元素化合价 -2 -1
阴阳离子个数比 (阳离子:阴离子) 2:1 2:1
转化
二、钠的几种化合物
【任务2】根据性质分类,分析 Na2O 的化学性质
Na2O+H2O = 2NaOH
Na2O+CO2 = Na2CO3
Na2O+2HCl = 2NaCl+H2O
二、钠的几种化合物
【任务3】实验探究 Na2O2 与水反应
pH试纸的使用:取一小片pH试纸在表面皿或玻璃片上,用洁净干燥的玻璃棒蘸取待测液点滴于试纸的中部,观察变化稳定后的颜色,与标准比色卡对比,判断溶液的性质
二、钠的几种化合物
【任务3】实验探究 Na2O2 与水反应
实验现象 分析和结论
有气泡产生,带火星的木条复燃 有氧气生成
试管壁微热 反应放热
试纸变蓝 有碱性物质生成
化学方程式:2Na2O2+2H2O = 4NaOH+O2↑
二、钠的几种化合物
【任务3】实验探究 Na2O2 与水反应
原理:Na2O2+H2O = H2O2 + Na2O
Na2O + H2O = NaOH
2H2O2 = 2H2O + O2↑
2Na2O2+2H2O = 4NaOH+O2↑
二、钠的几种化合物
【任务4】实验探究 Na2O2 与 CO2 反应
[实验] 向包着过氧化钠的脱脂棉通入CO2,观察现象
[现象] 脱脂棉燃烧
[结论] 过氧化钠与二氧化碳反应可以生成氧气
2Na2O2+2CO2 = 2Na2CO3+O2
[应用] 该原理可用作呼吸面罩中的供养剂
二、钠的几种化合物
【任务4】实验探究 Na2O2 与 CO2 反应
【例题】李华想利用如图装置在实验室制备二氧化碳并验证过氧化钠可作呼吸面具中的供氧剂。
下列有关说法正确的是( )
D
A.装置的连接顺序为 B. 装置 Ⅰ 中盛放浓硫酸
C. 装置 Ⅲ 中固体是生石灰 D. 装置 Ⅳ 中收集的气体可使带火星的木条复燃
二、钠的几种化合物
【任务4】实验探究 Na2O2 与 CO2 反应
【例题】许多非金属氧化物能与反应,且反应有规律,如 ,又
如 。据此,你认为下列化学方程式中正确的是( )
AD
A. B.
C. D.
思路导引 由题给信息可知, 可与某些元素的最高价氧化物反应,生成该元素的最高价态的
含氧酸盐和 ,反应中过氧化钠表现氧化性、还原性;当过氧化钠与较低价态的氧化物反应时,
生成该元素的最高价态的含氧酸盐,反应中过氧化钠表现强氧化性。
二、钠的几种化合物
【任务4】实验探究 Na2O2 与 CO2 反应
5.[广东深圳2023高一月考] 某兴趣小组欲验证:①干
燥的不与反应;②在有水条件下, 能与
反应。设计实验装置如图所示,实验过程中先滴
加稀盐酸,打开,关闭 ,一段时间后再加热铜丝;
充分反应后,再关闭,打开 ,观察整个过程中铜
丝的变化。
下列说法错误的是( )
D
A.先滴加稀盐酸,后加热的目的是排出装置内的空气
B.饱和溶液的作用是除去中的
C.试剂 可以是浓硫酸
D.反应过程中铜丝先变黑,后变红
二、钠的几种化合物
【任务4】实验探究 Na2O2 与 CO2 反应
解析 稀盐酸和石灰石反应生成的二氧化碳中含有水蒸气和氯化氢,通过饱和碳酸氢钠溶液除去
氯化氢,结合实验目的知,实验过程中需先用浓硫酸干燥二氧化碳验证①,在加热条件下铜丝可
以和氧气反应生成,故实验中通过铜丝的变化判断与 是否反应。装置内空气中的氧
气会干扰实验,所以先滴加稀盐酸,后加热的目的是利用生成的二氧化碳排出装置内的空气,A
正确;易挥发,生成的二氧化碳气体中含有氯化氢杂质,饱和溶液的作用是除去
中的,B正确;通过饱和溶液的中仍含水蒸气,故验证①时需干燥,即试剂
的作用是干燥二氧化碳,因此试剂 可以是浓硫酸,C正确;结合题意可知,在整个实验过程中先
验证干燥的与不反应,该过程铜丝无明显变化,后验证在有水条件下,与 反
应产生 ,该过程铜丝变黑,D错误。
二、钠的几种化合物
【任务5】 从三个角度认识与、 反应的规律
(1)质量角度
对于固体,在反应①中,增加的质量相当于水中“ ”的质量,
其结果可以看作:;
在反应②中,增加的质量相当于中“ ”的质量,
其结果可以看作: 。
二、钠的几种化合物
【任务5】 从三个角度认识与、 反应的规律
(2)气体分子数角度
(气体)
由化学方程式可以看出,将、(气体)与足量的 固体充分反应后,
气体分子数变为原来的一半。
(3)反应先后顺序关系
当、(气体)与同时反应时,由于与反应生成的
能与 反应,所以可以视为先与反应,待反应完全后,再与
(气体)反应。
二、钠的几种化合物
【任务5】 从三个角度认识与、 反应的规律
【例题】在一密闭容器中共有、和 的混合物,用电火花引燃,使其完全燃烧,
再将燃烧后的气体用充分吸收,固体增加的质量为 ,则原混合气体中 的质量为
( )
B
A. B. C. D.
解析 在一密闭容器中共有、和 的混合物,用电火花引燃,使其完全燃烧,发生反
应、,然后将燃烧产物用足量 充分吸收,发生反应
、 。通过化学方程式中物
质变化可知,、燃烧消耗的氧气的量,和反应生成的、与 反应释放的氧气的
量相等,则固体增加的质量就是混合气体中、的质量,所以原混合气体中 的质量
,选B。
二、钠的几种化合物
【任务5】分析 Na2O2 与 HCl 反应
[思考] 类比过氧化钠反应的规律,尝试写出过氧化钠与盐酸反应方程式
2Na2O2+4HCl = 4NaCl+2H2O+O2↑
二、钠的几种化合物
【任务6】归纳对比氧化钠与过氧化钠
物质 氧化钠(Na2O) 过氧化钠(Na2O2)
与水反应 Na2O+H2O = 2NaOH 2Na2O2+2H2O = 4NaOH+O2↑
与CO2反应 Na2O+CO2 = Na2CO3 2Na2O2+2CO2 = 2Na2CO3+O2
与盐酸反应 Na2O+2HCl = 2NaCl+H2O 2Na2O2+4HCl = 4NaCl+2H2O+O2↑
主要用途 可制烧碱 漂白剂、消毒剂、供氧剂
保存 密封 密封、远离易燃物
二、钠的几种化合物
【任务6】归纳对比氧化钠与过氧化钠
【例题】下列关于和 的对比,叙述不正确的是( )
A
A.均为碱性氧化物
B.阴、阳离子个数比均为
C.加入硫酸铜溶液,均有沉淀产生
D.将和 加入石蕊溶液中,现象不同
解析 为碱性氧化物, 与酸反应除生成盐和水外还有氧气,不是碱性氧化物,A错误;
1个中含2个和1个,1个中含2个和1个,B正确;和与
反应均会生成,与溶液反应产生蓝色的沉淀,C正确;和
均会与水反应生成,溶液显碱性,故开始时石蕊溶液均会变蓝,但由于 有强氧化性从
而表现出漂白性,故加入 的石蕊溶液先变蓝后褪色,现象不同,D正确。
二、钠的几种化合物
【任务7】过氧化钠性质深入理解
【例题】钠及其化合物的生产与应用,是化工生产与研究的重要组成部分。
(1)用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备
并检验其纯度的实验流程如图甲所示。
回答下列问题:
① 样品加水溶解的化学方程式为_________________________________。
解析 样品加水溶解的化学方程式: ;
二、钠的几种化合物
【任务7】过氧化钠性质深入理解
②样液中加入后产生能使带火星木条复燃的气体,说明 与水反应的过程中还生成了
______(填化学式)。
解析 样液中加入后产生能使带火星木条复燃的气体,说明 与水反应的过程中还生成
了,在 催化作用下分解生成氧气;
③滤液中加入溶液产生白色沉淀,说明 样品中含有_________杂质,生成白色沉淀的
离子方程式是_________________________。
解析 滤液中加入溶液产生白色沉淀,说明滤液中含有,即 样品中含有
;与反应生成白色沉淀碳酸钡,离子方程式为 。
二、钠的几种化合物
【任务7】过氧化钠性质深入理解
(2)工业上以侯氏制碱法为基础生产焦亚硫酸钠( ,能溶于水)的工艺流程如图乙:
①反应Ⅰ的化学方程式是_____________________________________________。
解析 由思路导引可知,反应Ⅰ的化学方程式: ;
二、钠的几种化合物
【任务7】过氧化钠性质深入理解
②关于该流程,下列说法正确的是___(填序号)。
c
a.反应Ⅰ中应先通入,再通入 b.反应Ⅱ属于氧化还原反应
c.该流程中, 可以循环使用 d.反应Ⅰ说明了碳酸氢钠的溶解度较大
解析 氨气在水中的溶解度较大,在碱性溶液中溶解度较大,故在反应Ⅰ中应先通入 ,
使溶液呈碱性,再通入, 错误;反应Ⅱ为碳酸氢钠的分解反应,该反应不是氧化还原反
应,错误;反应Ⅱ、Ⅲ生成二氧化碳,反应Ⅰ中需要消耗二氧化碳,因此该流程中 可以循
环使用,正确;反应Ⅰ中析出,说明碳酸氢钠的溶解度较小, 错误。
二、钠的几种化合物
【任务7】过氧化钠性质深入理解
③反应Ⅲ包含多步反应。
第一步:……
第二步:
为了减少产品 中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的数
目之比为_____。
解析 由第二步反应知,第一步需制得亚硫酸氢钠,即第一步反应是
,为了减少产品 中的杂质含量,应使第一步
反应中尽可能多地生成,而无其他副产物(如 ),结合第一步化学方程式知,理
论上需控制第一步反应中气体反应物与固体反应物的数目之比为 。
二、钠的几种化合物
【任务7】过氧化钠性质深入理解
思路导引(1)熔融的与空气反应产生,与空气中的反应产生、 ;
与水反应产生、,同时有少量未分解的中间产物,在 催化下分解
产生、,滤液中含、,向滤液中加入溶液,反应产生 沉淀。
(2)向饱和溶液中先后通入、,反应产生沉淀和,将 沉淀过
滤出来,然后加热,分解产生、、;在空气中灼烧,反应产生 、
,与反应产生,将 溶液蒸发浓缩、冷却结晶,获得胆矾晶体
;、、发生反应Ⅲ: ,
然后受热分解: 。
课后作业
1. 完成资料P29-34页选能写的写
2. 列表比较氧化钠与过氧化钠,写在作业本上
