2.3 物质的量 课件 (共40张PPT)
文档属性
| 名称 | 2.3 物质的量 课件 (共40张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 17.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-21 15:31:55 | ||
图片预览








文档简介
(共40张PPT)
第三节 物质的量
看不见的世界也精彩
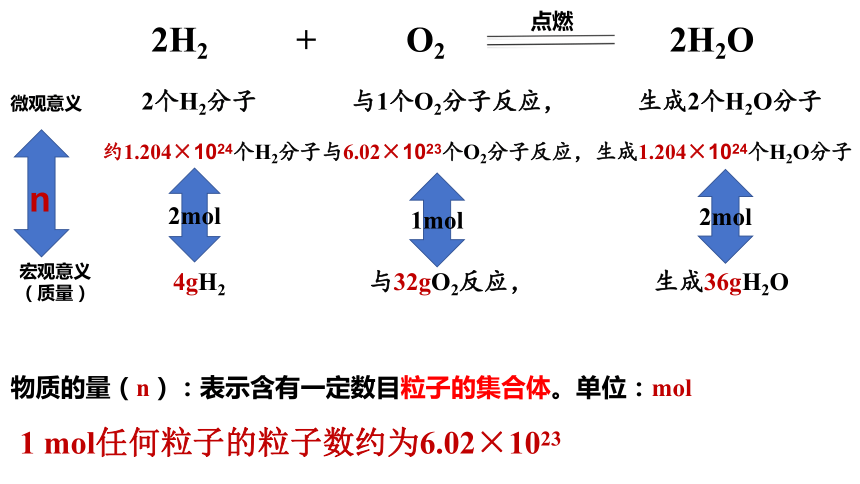
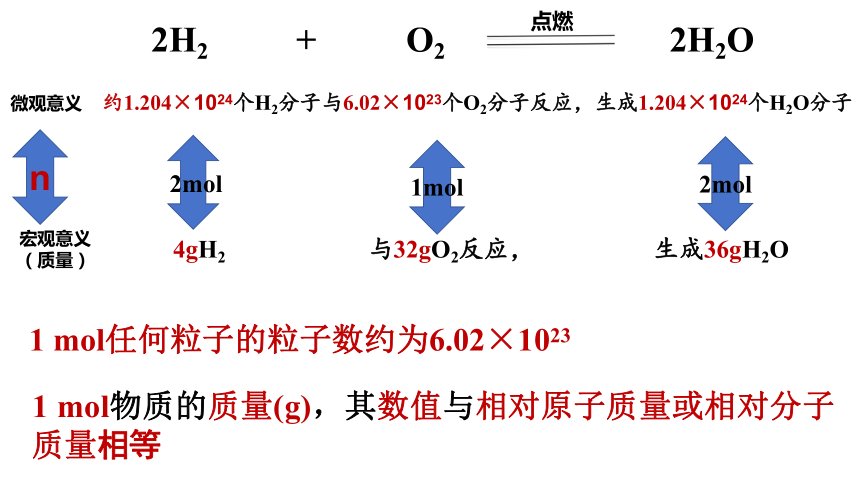
2H2 + O2 2H2O
点燃
微观意义
2个H2分子 与1个O2分子反应, 生成2个H2O分子
宏观意义
(质量)
4gH2 与32gO2反应, 生成36gH2O
约1.204×1024个H2分子与6.02×1023个O2分子反应,生成1.204×1024个H2O分子
n
物质的量(n):表示含有一定数目粒子的集合体。单位:mol
1 mol任何粒子的粒子数约为6.02×1023
2mol
1mol
2mol
一滴水中约含有1.67×1021个水分子,让10亿人数,每人每分钟数100个,要数3万年
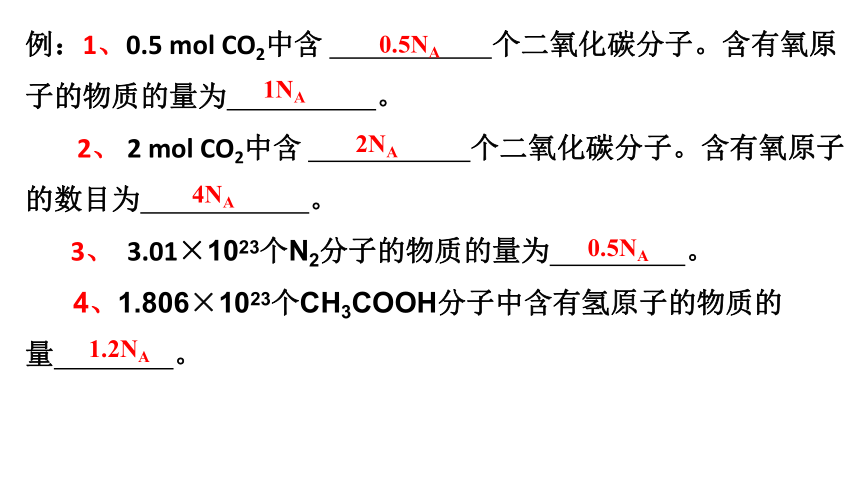
例:1、0.5 mol CO2中含 个二氧化碳分子。含有氧原子的物质的量为 。
2、 2 mol CO2中含 个二氧化碳分子。含有氧原子的数目为 。
3、 3.01×1023个N2分子的物质的量为 。
4、1.806×1023个CH3COOH分子中含有氢原子的物质的量 。
0.5NA
1NA
2NA
4NA
0.5NA
1.2NA
一、物质的量
①定义:
表示含有一定数目粒子的集合体的基本物理量。
②符号:
n
③单位:
摩尔,简称摩(mol)
注意:物质的量只适用微观粒子,如分子、原子、离子、原子团、电子、质子、中子等及这些粒子的特定组合。不能表示宏观的物质,如不能说1mol米、不能说1mol的氧、不能说1mol的铁元素。
二. 阿伏加德罗常数
①定义:
②符号:
③单位:
1 mol任何粒子的粒子数,数值 :约为6.02×1023
NA
mol-1
物质的量、阿伏伽德罗常数、微粒数三者之间的换算
微粒数= 物质的量×(6.02×1023)
NA
n
N
=
×
例:1 mol 碳原子约含_____个碳原子。
2 mol 碳原子约含_____个碳原子。
NA
N
n =
1NA
2NA
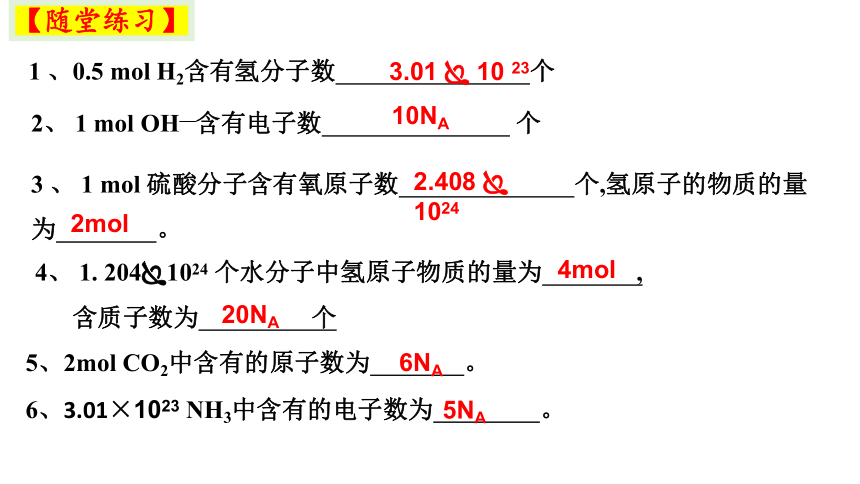
1 、0.5 mol H2含有氢分子数 个
2、 1 mol OH—含有电子数 个
3 、 1 mol 硫酸分子含有氧原子数 个,氢原子的物质的量为 。
4、 1. 204 1024 个水分子中氢原子物质的量为 ,
含质子数为 个
3.01 10 23
10NA
2.408 1024
4mol
5、2mol CO2中含有的原子数为 。
6、3.01×1023 NH3中含有的电子数为 。
20NA
6NA
【随堂练习】
5NA
2mol
1.2 mol (NH4)2SO4中含NH4+的数目为_______,含硫酸根离子的数目为 。
2、0.5molNH4+中含有原子数 ________个,含质子的物质的量为 ________,电子数________ 个。
3 、2molOH- 中含 ________mol原子, ________个质子,含电子的物质的量为________ 。
4、1.204×1023个NH3 中氢原子的物质的量________,质子数 ________,电子数________。
4NA
2NA
2.5NA
5.5NA
5NA
4NA
18NA
20NA
0.6NA
6NA
6NA
2H2 + O2 2H2O
点燃
微观意义
宏观意义
(质量)
4gH2 与32gO2反应, 生成36gH2O
约1.204×1024个H2分子与6.02×1023个O2分子反应,生成1.204×1024个H2O分子
n
1 mol任何粒子的粒子数约为6.02×1023
2mol
1mol
2mol
1 mol物质的质量(g),其数值与相对原子质量或相对分子质量相等
1、9.8gH2SO4的物质的量是
2、22gCO2的物质的量是
3、4molH2的质量是
4、NH3的摩尔质量是
5、0.1molOH—的质量是
0.1mol
0.5mol
8g
17g/mol
1.7g
练一练
三、摩尔质量
①定义:
②符号:
④单位:
1mol的物质所具有的质量。其数值与该粒子的相对分子质量或相对原子质量相等。
M
g/mol(或g·mol-1)
如:M(H) = 1g/mol M(O2) = 32g/mol
M(CO2) = ________ M(NaCl) = _________
③表达式:
m
—
M
n =
44g/mol
58.5g/mol
1、 90g H2O的物质的量为 ,含有氢原子个数为 。
2、0.5 mol Cu的质量是 。
3、H2SO4的摩尔质量为 ,4.9gH2SO4中氧原子数为 。
4、10.6 g Na2CO3的物质的量是______,氧原子的物质的量是_______ 。
5、3.01×1023个水分子的物质的量为_______,质量为_______。
6、 1.204×1023个NH3 的质量为______g,其中氢原子的物质的量为 。
7、3g He含有的中子数为 。
5mol
10NA
32g
98g/mol
0.2NA
0.1mol
0.3mol
0.5mol
9g
3.4
0.6mol
1.5NA
物质的量
概念:表示含有一定数目粒子的集合体,通常用字母“n”表示。
单位:摩尔,简称:摩,符号:mol
物质的量
阿伏加德罗常数
概念:1mol任何粒子的粒子数,符号NA。通常用6.02×1023 mol-1表示。
重要公式
摩尔质量
概念:单位物质的量的物质所具有的质量,通常用字母“M”表示。
单位:g/mol
1mol的物质所具有的质量。其数值与该粒子的相对分子质量或相对原子质量相等。
1mol任何粒子的集合体所含有的粒子数目约为6.02×1023
1mol的物质所具有的质量。其数值与该粒子的相对分子质量或相对原子质量相等。
那么1mol物质的体积又是多少呢?
Solid
Liquid
Gas
思考与讨论
气体 0℃、101kPa时的体积/L 液体 20℃时的体积/cm3 固体 20℃时的体积/cm3
H2 22.4 H2O 18.0 Fe 7.12
O2 22.4 H2SO4 53.6 Al 10.0
在一定条件下,1mol不同物质的体积如下表所示,观察并分析表中的数据,你能得出哪些结论?
相同条件下,1 mol气体的体积相同
结论:
相同条件下,1 mol固体或液体的体积不同
0℃,101kPa时,
(标准状况)
1mol
任何气体
的体积都
约是22.4L
3、标准状况下,0.5NA个CO分子所占有的体积为_____ _L。
4、标准状况下,44.8 L H2和CH4的混合气体所含的分子数目为________。
5、标准状况下,16gO2的体积为 。
1、标况下0.5molHCl的体积为 ________ L
2、标况下33.6LH2的物质的量为________mol ,质量为 g
11.2
1.5
3
11.2
2NA
11.2L
气体 0℃、101kPa时的体积/L 液体 20℃时的体积/cm3 固体 20℃时的体积/cm3
H2 22.4 H2O 18.0 Fe 7.12
O2 22.4 H2SO4 53.6 Al 10.0
相同条件下,1 mol气体的体积相同
结论:
相同条件下,1 mol固体或液体的体积不同
1mol不同物质的体积如下表所示
Solid
Liquid
Gas
固体和液体粒子之间的距离非常小
气体粒子之间的距离非常大
粒子数目
粒子间距
粒子大小
物质的体积影响因素
}
固体、液体体积
决定
}
决定
气体体积
受温度和压强影响
对于粒子数相同的气体来说,如果温度和压强相同,则微粒间的平均距离基本相同,体积也就相同。
物质的量相同,N=n×NA ,
0℃,101kPa时,
(标准状况)
1mol
任何气体
的体积都
约是22.4L
同温同压下
相同数目
任何气体
体积相同
条件
标准
对象
数值
注意、标况下,H2O、醇、CCl4、SO3、苯、HF等
不是气体。
同温同压下,气体体积与物质的量(分子数)成正比
气体摩尔体积
1.概念:单位物质的量的气体所占的体积。
L/mol 或(L mol-1)
m3/mol或(m3 mol-1)
2.符号:Vm
1mol气体 0℃、101kPa时的体积/L
H2 22.4
O2 22.4
可以是单一气体,也可以是混合气体
5.影响因素:温度、压强
标准状况
标准状况下,气体摩尔体积约为22.4L/mol
4.计算公式:
3.单位:
1、CO2 的摩尔体积是22.4L/mol。( )
2、25℃,101 kPa下,11.2LH2中质子的数目为1NA。( )
3、23g Na与水反应,生成11.2L的H2。( )
4、标准状况下,1molO2和N2混合气体的体积约为22.4L。( )
5、标准状况下,1.12 L H2和O2的混合气体含有的原子数为0.1NA 。( )
6、在标准状况下,1molH2O的体积约是22.4L。 ( )
7、1molCl2的体积约是22.4L。 ( )
8、常温常压下,44.8L的NH3质量为34g。( )
9、标况下,33.6L的O2与CO2的混合气体中,含有氧原子数为3NA。( )
×
√
×
√
√
×
×
×
√
1、标况下,3.36L的H2其质量为 g
2、标况下,44.8LN2中含有氮原子数是 。
3、标况下,16gO2的体积是 。
4、标况下,5.6L的CH4中含有质子数为 。
5、判断正误:
①44 g二氧化碳的体积约是22.4 L 。( )
②标况下,1 mol H2O的体积是22.4 L。( )
③常温常压下,14 g氮气所含的氮原子数为NA。( )
④25℃、101 kPa时,22.4L的HCl有36.5g。( )
⑤22.4 L(标准状况)氮气中含有7NA个中子。( )
⑥标准状况下,11.2 L甲烷和C2H4混合气体中含氢原子数目为2NA。( )
0.2
4NA
11.2
2.5NA
×
×
√
×
×
√
溶液的质量
×100%
溶质的质量
=
溶质质量+溶剂质量
×100%
溶质的质量
溶液浓度的表示方法:
60%
质量分数 =
1mol
2mol
1mol
1mol
1mol
某工厂生产“84”消毒液,要求该消毒液中含有NaClO 745g,需要取NaOH溶液的量
为 。
Cl2 + 2NaOH = NaCl + NaClO + H2O
2mol/L
60%
物质的量浓度
3. 单位:
mol / L 或 mol·L-1
=
1. 定义: 单位体积溶液里含有溶质B 的物质的量,称为B的物质的量浓度。
即1L溶液中所含溶质B的物质的量。
2. 符号:
CB
物质的量浓度(mol/L)=
溶液的体积(L)
溶质的物质的量(mol)
4. 公式:
(3)标况下,33.6L HCl 溶于水配成 0.5L 盐酸, 其物质的量浓度
为 。从中取出100mL溶液,取出的溶液中HCl的浓度为 。
(4) 500mL 2mol/L的硫酸溶液, H+的浓度为 ,含硫酸的物质的量为 mol 。
(2)将71g Na2SO4固体溶于水配成1L溶液,其物质的量浓度为 ,其中Na+的物质的量浓度为 ,SO42-的物质的量浓度为__ _ 。
(1)制 500 mL 0.1 mol/L 的NaOH 溶液所需NaOH的质量是 。
2g
0.5mol/L
1mol/L
0.5mol/L
3mol/L
3mol/L
4mol/L
1
1、500mL 0.1mol/L的AlCl3溶液中c(Cl—)= ,从中取出100mL溶液,取出的溶液中AlCl3的物质的量浓度为 、AlCl3的物质的量为 。
2、制 100 mL 1.00 mol/L 的NaCl 溶液所需NaCl的质量是 。
3、将53.0gNa2CO3 溶解在水中,配成500mL溶液,该Na2CO3 溶液物质的量浓度为 。其中c(Na+)= 。
4、判断正误:
①1 L 1 mol·L 1 NaCl溶液含有28NA个电子。( )
②将40g NaOH溶于2L水中配成溶液,其物质的量浓度为0.5mol/L。( )
③将22.4L的NH3溶于水配制成1L的溶液,所得溶液中溶质的物质的量浓度为1mol/L。( )
④2mol/L的BaCl2溶液中Cl— 的物质的量为4mol。( )
0.3mol/L
0.1mol/L
0.01mol
5.85g
1mol/L
2mol/L
×
×
×
×
配制100 mL 1.00 mol·L-1 氯化钠溶液
量筒
烧杯
1、构造: 带有磨口玻璃塞;细长颈、梨形、平底玻璃瓶。
颈部标有刻度线,瓶上标有容积、温度 。
2、常见规格:50mL、100mL、250mL、500mL、1000mL。选择容量瓶的原则为“大而近”,例如:配制体积为480mL的溶液,应选用规格为 。
3、使用前要检漏
4、不能用容量瓶溶解或稀释溶液
5、不能用作反应容器,或长时间存放溶液
6、不能加热
500mL容量瓶
容量瓶
影响精度
配制100 mL 1.00 mol·L-1 氯化钠溶液
计算
仪器:
称量:NaCl g
m(NaCl)=5.85g
托盘天平
药匙
5.9
仪器:
玻璃棒
烧杯
注意:玻璃棒搅拌;要冷却至室温
仪器:
100mL容量瓶
注意:玻璃棒引流
称量
溶解
转移
配制100 mL 1.00 mol·L-1 氯化钠溶液
洗涤
1. 用蒸馏水洗涤玻璃棒和烧杯内壁2~3次
2. 将洗涤液都注入容量瓶中
3. 轻轻摇动容量瓶使溶液混合均匀
1. 将蒸馏水注入容量瓶至液面离刻度线1~2cm
2. 改用胶头滴管滴加蒸馏水至凹液面与刻
度线相切
1. 塞好瓶塞,反复上下颠倒,摇匀
定容
摇匀
用 1.00 mol·L-1 氯化钠溶液
配制100mL 0.5mol·L-1 氯化钠溶液
思考与交流
家里只有一瓶蔗糖水,但是小明偏要喝两瓶,于是妈妈把蔗糖水稀释成两瓶,请问,小明吃到的糖有没有变多?
稀释前后, 溶质的量(质量或物质的量)保持不变 。
对于所有的溶液稀释都有:m(溶液稀释前) = m(溶液稀释后)
n(溶液稀释前) = n(溶液稀释后)
m(浓)ω(浓)=m(稀)ω(稀) 或m1ω1=m2ω2
c(浓)V(浓)=c(稀)V(稀) 或c1V1=c2V2
1、配制250mL 1.0mol/L H2SO4溶液,需要18mol/L H2SO4溶液的体积是多少?
2、0.1 L 1.00 mol·L-1的NaCl溶液, 需要溶液稀释至500 mL,稀释后溶液的浓度为 。
3、用98%的浓硫酸(密度为1.84g/cm3)配制100mL1mol/L的稀硫酸,需要取浓硫酸的体积为 。
P44 P48
13.9mL
0.2mol/L
5.4L
用 1.00 mol·L-1 氯化钠溶液配制100mL 0.5mol·L-1 氯化钠溶液
计算
量取
稀释
移液
洗涤
定容
摇匀
装瓶
可能引起误差的一些操作 c的影响
托盘 天平 天平的砝码沾有其他物质或已生锈
用滤纸称NaOH固体
物质、砝码位置放反(使用了游码)
量筒 用量筒量取液体时,俯视读数
用量筒量取液体时,仰视读数
容量瓶未干燥
转移液体时有少量洒落
未洗涤烧杯和玻璃棒
溶液未冷却至室温就注入容量瓶中
定容时水加多后用滴管吸出
定容时俯视刻度线
定容时仰视刻度线
误差分析
偏高
偏低
偏低
偏高
不影响
偏低
偏低
偏低
偏高
偏低
偏高
偏低
液面与刻度线相切
P46
第三节 物质的量
看不见的世界也精彩
2H2 + O2 2H2O
点燃
微观意义
2个H2分子 与1个O2分子反应, 生成2个H2O分子
宏观意义
(质量)
4gH2 与32gO2反应, 生成36gH2O
约1.204×1024个H2分子与6.02×1023个O2分子反应,生成1.204×1024个H2O分子
n
物质的量(n):表示含有一定数目粒子的集合体。单位:mol
1 mol任何粒子的粒子数约为6.02×1023
2mol
1mol
2mol
一滴水中约含有1.67×1021个水分子,让10亿人数,每人每分钟数100个,要数3万年
例:1、0.5 mol CO2中含 个二氧化碳分子。含有氧原子的物质的量为 。
2、 2 mol CO2中含 个二氧化碳分子。含有氧原子的数目为 。
3、 3.01×1023个N2分子的物质的量为 。
4、1.806×1023个CH3COOH分子中含有氢原子的物质的量 。
0.5NA
1NA
2NA
4NA
0.5NA
1.2NA
一、物质的量
①定义:
表示含有一定数目粒子的集合体的基本物理量。
②符号:
n
③单位:
摩尔,简称摩(mol)
注意:物质的量只适用微观粒子,如分子、原子、离子、原子团、电子、质子、中子等及这些粒子的特定组合。不能表示宏观的物质,如不能说1mol米、不能说1mol的氧、不能说1mol的铁元素。
二. 阿伏加德罗常数
①定义:
②符号:
③单位:
1 mol任何粒子的粒子数,数值 :约为6.02×1023
NA
mol-1
物质的量、阿伏伽德罗常数、微粒数三者之间的换算
微粒数= 物质的量×(6.02×1023)
NA
n
N
=
×
例:1 mol 碳原子约含_____个碳原子。
2 mol 碳原子约含_____个碳原子。
NA
N
n =
1NA
2NA
1 、0.5 mol H2含有氢分子数 个
2、 1 mol OH—含有电子数 个
3 、 1 mol 硫酸分子含有氧原子数 个,氢原子的物质的量为 。
4、 1. 204 1024 个水分子中氢原子物质的量为 ,
含质子数为 个
3.01 10 23
10NA
2.408 1024
4mol
5、2mol CO2中含有的原子数为 。
6、3.01×1023 NH3中含有的电子数为 。
20NA
6NA
【随堂练习】
5NA
2mol
1.2 mol (NH4)2SO4中含NH4+的数目为_______,含硫酸根离子的数目为 。
2、0.5molNH4+中含有原子数 ________个,含质子的物质的量为 ________,电子数________ 个。
3 、2molOH- 中含 ________mol原子, ________个质子,含电子的物质的量为________ 。
4、1.204×1023个NH3 中氢原子的物质的量________,质子数 ________,电子数________。
4NA
2NA
2.5NA
5.5NA
5NA
4NA
18NA
20NA
0.6NA
6NA
6NA
2H2 + O2 2H2O
点燃
微观意义
宏观意义
(质量)
4gH2 与32gO2反应, 生成36gH2O
约1.204×1024个H2分子与6.02×1023个O2分子反应,生成1.204×1024个H2O分子
n
1 mol任何粒子的粒子数约为6.02×1023
2mol
1mol
2mol
1 mol物质的质量(g),其数值与相对原子质量或相对分子质量相等
1、9.8gH2SO4的物质的量是
2、22gCO2的物质的量是
3、4molH2的质量是
4、NH3的摩尔质量是
5、0.1molOH—的质量是
0.1mol
0.5mol
8g
17g/mol
1.7g
练一练
三、摩尔质量
①定义:
②符号:
④单位:
1mol的物质所具有的质量。其数值与该粒子的相对分子质量或相对原子质量相等。
M
g/mol(或g·mol-1)
如:M(H) = 1g/mol M(O2) = 32g/mol
M(CO2) = ________ M(NaCl) = _________
③表达式:
m
—
M
n =
44g/mol
58.5g/mol
1、 90g H2O的物质的量为 ,含有氢原子个数为 。
2、0.5 mol Cu的质量是 。
3、H2SO4的摩尔质量为 ,4.9gH2SO4中氧原子数为 。
4、10.6 g Na2CO3的物质的量是______,氧原子的物质的量是_______ 。
5、3.01×1023个水分子的物质的量为_______,质量为_______。
6、 1.204×1023个NH3 的质量为______g,其中氢原子的物质的量为 。
7、3g He含有的中子数为 。
5mol
10NA
32g
98g/mol
0.2NA
0.1mol
0.3mol
0.5mol
9g
3.4
0.6mol
1.5NA
物质的量
概念:表示含有一定数目粒子的集合体,通常用字母“n”表示。
单位:摩尔,简称:摩,符号:mol
物质的量
阿伏加德罗常数
概念:1mol任何粒子的粒子数,符号NA。通常用6.02×1023 mol-1表示。
重要公式
摩尔质量
概念:单位物质的量的物质所具有的质量,通常用字母“M”表示。
单位:g/mol
1mol的物质所具有的质量。其数值与该粒子的相对分子质量或相对原子质量相等。
1mol任何粒子的集合体所含有的粒子数目约为6.02×1023
1mol的物质所具有的质量。其数值与该粒子的相对分子质量或相对原子质量相等。
那么1mol物质的体积又是多少呢?
Solid
Liquid
Gas
思考与讨论
气体 0℃、101kPa时的体积/L 液体 20℃时的体积/cm3 固体 20℃时的体积/cm3
H2 22.4 H2O 18.0 Fe 7.12
O2 22.4 H2SO4 53.6 Al 10.0
在一定条件下,1mol不同物质的体积如下表所示,观察并分析表中的数据,你能得出哪些结论?
相同条件下,1 mol气体的体积相同
结论:
相同条件下,1 mol固体或液体的体积不同
0℃,101kPa时,
(标准状况)
1mol
任何气体
的体积都
约是22.4L
3、标准状况下,0.5NA个CO分子所占有的体积为_____ _L。
4、标准状况下,44.8 L H2和CH4的混合气体所含的分子数目为________。
5、标准状况下,16gO2的体积为 。
1、标况下0.5molHCl的体积为 ________ L
2、标况下33.6LH2的物质的量为________mol ,质量为 g
11.2
1.5
3
11.2
2NA
11.2L
气体 0℃、101kPa时的体积/L 液体 20℃时的体积/cm3 固体 20℃时的体积/cm3
H2 22.4 H2O 18.0 Fe 7.12
O2 22.4 H2SO4 53.6 Al 10.0
相同条件下,1 mol气体的体积相同
结论:
相同条件下,1 mol固体或液体的体积不同
1mol不同物质的体积如下表所示
Solid
Liquid
Gas
固体和液体粒子之间的距离非常小
气体粒子之间的距离非常大
粒子数目
粒子间距
粒子大小
物质的体积影响因素
}
固体、液体体积
决定
}
决定
气体体积
受温度和压强影响
对于粒子数相同的气体来说,如果温度和压强相同,则微粒间的平均距离基本相同,体积也就相同。
物质的量相同,N=n×NA ,
0℃,101kPa时,
(标准状况)
1mol
任何气体
的体积都
约是22.4L
同温同压下
相同数目
任何气体
体积相同
条件
标准
对象
数值
注意、标况下,H2O、醇、CCl4、SO3、苯、HF等
不是气体。
同温同压下,气体体积与物质的量(分子数)成正比
气体摩尔体积
1.概念:单位物质的量的气体所占的体积。
L/mol 或(L mol-1)
m3/mol或(m3 mol-1)
2.符号:Vm
1mol气体 0℃、101kPa时的体积/L
H2 22.4
O2 22.4
可以是单一气体,也可以是混合气体
5.影响因素:温度、压强
标准状况
标准状况下,气体摩尔体积约为22.4L/mol
4.计算公式:
3.单位:
1、CO2 的摩尔体积是22.4L/mol。( )
2、25℃,101 kPa下,11.2LH2中质子的数目为1NA。( )
3、23g Na与水反应,生成11.2L的H2。( )
4、标准状况下,1molO2和N2混合气体的体积约为22.4L。( )
5、标准状况下,1.12 L H2和O2的混合气体含有的原子数为0.1NA 。( )
6、在标准状况下,1molH2O的体积约是22.4L。 ( )
7、1molCl2的体积约是22.4L。 ( )
8、常温常压下,44.8L的NH3质量为34g。( )
9、标况下,33.6L的O2与CO2的混合气体中,含有氧原子数为3NA。( )
×
√
×
√
√
×
×
×
√
1、标况下,3.36L的H2其质量为 g
2、标况下,44.8LN2中含有氮原子数是 。
3、标况下,16gO2的体积是 。
4、标况下,5.6L的CH4中含有质子数为 。
5、判断正误:
①44 g二氧化碳的体积约是22.4 L 。( )
②标况下,1 mol H2O的体积是22.4 L。( )
③常温常压下,14 g氮气所含的氮原子数为NA。( )
④25℃、101 kPa时,22.4L的HCl有36.5g。( )
⑤22.4 L(标准状况)氮气中含有7NA个中子。( )
⑥标准状况下,11.2 L甲烷和C2H4混合气体中含氢原子数目为2NA。( )
0.2
4NA
11.2
2.5NA
×
×
√
×
×
√
溶液的质量
×100%
溶质的质量
=
溶质质量+溶剂质量
×100%
溶质的质量
溶液浓度的表示方法:
60%
质量分数 =
1mol
2mol
1mol
1mol
1mol
某工厂生产“84”消毒液,要求该消毒液中含有NaClO 745g,需要取NaOH溶液的量
为 。
Cl2 + 2NaOH = NaCl + NaClO + H2O
2mol/L
60%
物质的量浓度
3. 单位:
mol / L 或 mol·L-1
=
1. 定义: 单位体积溶液里含有溶质B 的物质的量,称为B的物质的量浓度。
即1L溶液中所含溶质B的物质的量。
2. 符号:
CB
物质的量浓度(mol/L)=
溶液的体积(L)
溶质的物质的量(mol)
4. 公式:
(3)标况下,33.6L HCl 溶于水配成 0.5L 盐酸, 其物质的量浓度
为 。从中取出100mL溶液,取出的溶液中HCl的浓度为 。
(4) 500mL 2mol/L的硫酸溶液, H+的浓度为 ,含硫酸的物质的量为 mol 。
(2)将71g Na2SO4固体溶于水配成1L溶液,其物质的量浓度为 ,其中Na+的物质的量浓度为 ,SO42-的物质的量浓度为__ _ 。
(1)制 500 mL 0.1 mol/L 的NaOH 溶液所需NaOH的质量是 。
2g
0.5mol/L
1mol/L
0.5mol/L
3mol/L
3mol/L
4mol/L
1
1、500mL 0.1mol/L的AlCl3溶液中c(Cl—)= ,从中取出100mL溶液,取出的溶液中AlCl3的物质的量浓度为 、AlCl3的物质的量为 。
2、制 100 mL 1.00 mol/L 的NaCl 溶液所需NaCl的质量是 。
3、将53.0gNa2CO3 溶解在水中,配成500mL溶液,该Na2CO3 溶液物质的量浓度为 。其中c(Na+)= 。
4、判断正误:
①1 L 1 mol·L 1 NaCl溶液含有28NA个电子。( )
②将40g NaOH溶于2L水中配成溶液,其物质的量浓度为0.5mol/L。( )
③将22.4L的NH3溶于水配制成1L的溶液,所得溶液中溶质的物质的量浓度为1mol/L。( )
④2mol/L的BaCl2溶液中Cl— 的物质的量为4mol。( )
0.3mol/L
0.1mol/L
0.01mol
5.85g
1mol/L
2mol/L
×
×
×
×
配制100 mL 1.00 mol·L-1 氯化钠溶液
量筒
烧杯
1、构造: 带有磨口玻璃塞;细长颈、梨形、平底玻璃瓶。
颈部标有刻度线,瓶上标有容积、温度 。
2、常见规格:50mL、100mL、250mL、500mL、1000mL。选择容量瓶的原则为“大而近”,例如:配制体积为480mL的溶液,应选用规格为 。
3、使用前要检漏
4、不能用容量瓶溶解或稀释溶液
5、不能用作反应容器,或长时间存放溶液
6、不能加热
500mL容量瓶
容量瓶
影响精度
配制100 mL 1.00 mol·L-1 氯化钠溶液
计算
仪器:
称量:NaCl g
m(NaCl)=5.85g
托盘天平
药匙
5.9
仪器:
玻璃棒
烧杯
注意:玻璃棒搅拌;要冷却至室温
仪器:
100mL容量瓶
注意:玻璃棒引流
称量
溶解
转移
配制100 mL 1.00 mol·L-1 氯化钠溶液
洗涤
1. 用蒸馏水洗涤玻璃棒和烧杯内壁2~3次
2. 将洗涤液都注入容量瓶中
3. 轻轻摇动容量瓶使溶液混合均匀
1. 将蒸馏水注入容量瓶至液面离刻度线1~2cm
2. 改用胶头滴管滴加蒸馏水至凹液面与刻
度线相切
1. 塞好瓶塞,反复上下颠倒,摇匀
定容
摇匀
用 1.00 mol·L-1 氯化钠溶液
配制100mL 0.5mol·L-1 氯化钠溶液
思考与交流
家里只有一瓶蔗糖水,但是小明偏要喝两瓶,于是妈妈把蔗糖水稀释成两瓶,请问,小明吃到的糖有没有变多?
稀释前后, 溶质的量(质量或物质的量)保持不变 。
对于所有的溶液稀释都有:m(溶液稀释前) = m(溶液稀释后)
n(溶液稀释前) = n(溶液稀释后)
m(浓)ω(浓)=m(稀)ω(稀) 或m1ω1=m2ω2
c(浓)V(浓)=c(稀)V(稀) 或c1V1=c2V2
1、配制250mL 1.0mol/L H2SO4溶液,需要18mol/L H2SO4溶液的体积是多少?
2、0.1 L 1.00 mol·L-1的NaCl溶液, 需要溶液稀释至500 mL,稀释后溶液的浓度为 。
3、用98%的浓硫酸(密度为1.84g/cm3)配制100mL1mol/L的稀硫酸,需要取浓硫酸的体积为 。
P44 P48
13.9mL
0.2mol/L
5.4L
用 1.00 mol·L-1 氯化钠溶液配制100mL 0.5mol·L-1 氯化钠溶液
计算
量取
稀释
移液
洗涤
定容
摇匀
装瓶
可能引起误差的一些操作 c的影响
托盘 天平 天平的砝码沾有其他物质或已生锈
用滤纸称NaOH固体
物质、砝码位置放反(使用了游码)
量筒 用量筒量取液体时,俯视读数
用量筒量取液体时,仰视读数
容量瓶未干燥
转移液体时有少量洒落
未洗涤烧杯和玻璃棒
溶液未冷却至室温就注入容量瓶中
定容时水加多后用滴管吸出
定容时俯视刻度线
定容时仰视刻度线
误差分析
偏高
偏低
偏低
偏高
不影响
偏低
偏低
偏低
偏高
偏低
偏高
偏低
液面与刻度线相切
P46
