安徽省合肥市西递中学2024~2025学年九年级下学期化学开学考试模拟试卷(含答案)
文档属性
| 名称 | 安徽省合肥市西递中学2024~2025学年九年级下学期化学开学考试模拟试卷(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 819.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-21 15:21:35 | ||
图片预览


文档简介
2024~2025学年下学期九年级化学开学考模拟试题
附相对原子质量:H-1;C-12;N-14;O-16;Mg-24;Cl-35.5。
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1.下列过程中主要发生化学变化的是( )
A.自制汽水 B.洗涤剂洗碗
C.探究铁生锈的条件 D.自制白糖晶体
2.生活离不开化学,下列生活实例涉及的化学知识正确的是( )
选项 生活实例 化学知识
A 洗洁精清洗餐具 洗洁精与油污形成溶液
B 燃气灶上方安装燃气报警器 天然气密度比空气小
C 自动感温喷淋头喷水灭火 降低可燃物的着火点
D 喝雪碧会打嗝 温度升高,气体溶解度增大
A.A B.B C.C D.D
3.2024年中国环境日的主题为“全面推进美丽中国建设”。下列做法错误的是( )
A.分类回收处理生活垃圾 B.随意丢弃废旧电池
C.生活污水处理达标后再排放 D.喷灌、滴灌农作物
4.2024年3月20日,鹊桥二号中继星成功发射,其中用的伞状天线是用镀金钼丝编织而成。如图是钼元素在元素周期表的相关信息。下列说法不正确的是( )
A.钼元素属于非金属元素 B.钼元素的相对原子质量为95.96
C.金属钼具有良好的延展性 D.钼原子核外有42个电子
5.正确的操作是实验成功的前提,下列有关试管的操作正确的是( )
A.滴加液体 B.塞橡胶塞 C.加热液体 D.添加固体药品
6.青蒿琥酯()是我国研发的治疗疟疾的药物。青蒿琥酯的说法正确的是( )
A.青蒿琥酯分子是由碳元素、氢元素组成的
B.青蒿琥酯由19个碳原子、28个氢原子和8个氧原子构成
C.青蒿琥酯中氢、氧原子个数比为2:7
D.青蒿琥酯中氢元素质量分数约为7.3%
7.“科学思维”是化学学科的核心素养之一。下列解释中正确的是
A.热水能使压瘪的乒乓球复原是因为气体分子体积变大
B.氢气在氯气中燃烧生成氯化氢,说明分子是化学变化中的最小粒子
C.单质中只含有一种元素,所以只含有一种元素的物质一定是单质
D.金刚石的硬度大而石墨质软,是因为它们的碳原子排列方式不同
8.我国科研人员实现了用高效催化剂将甲烷与氧气在常温下制甲酸,下图为该反应的微观示意图。下列有关说法正确的是( )
A.反应过程中共有两种氧化物 B.高效催化剂的作用是增加生成物质量
C.参加反应的甲和乙的分子个数比为2:3 D.反应前后元素的化合价都未改变
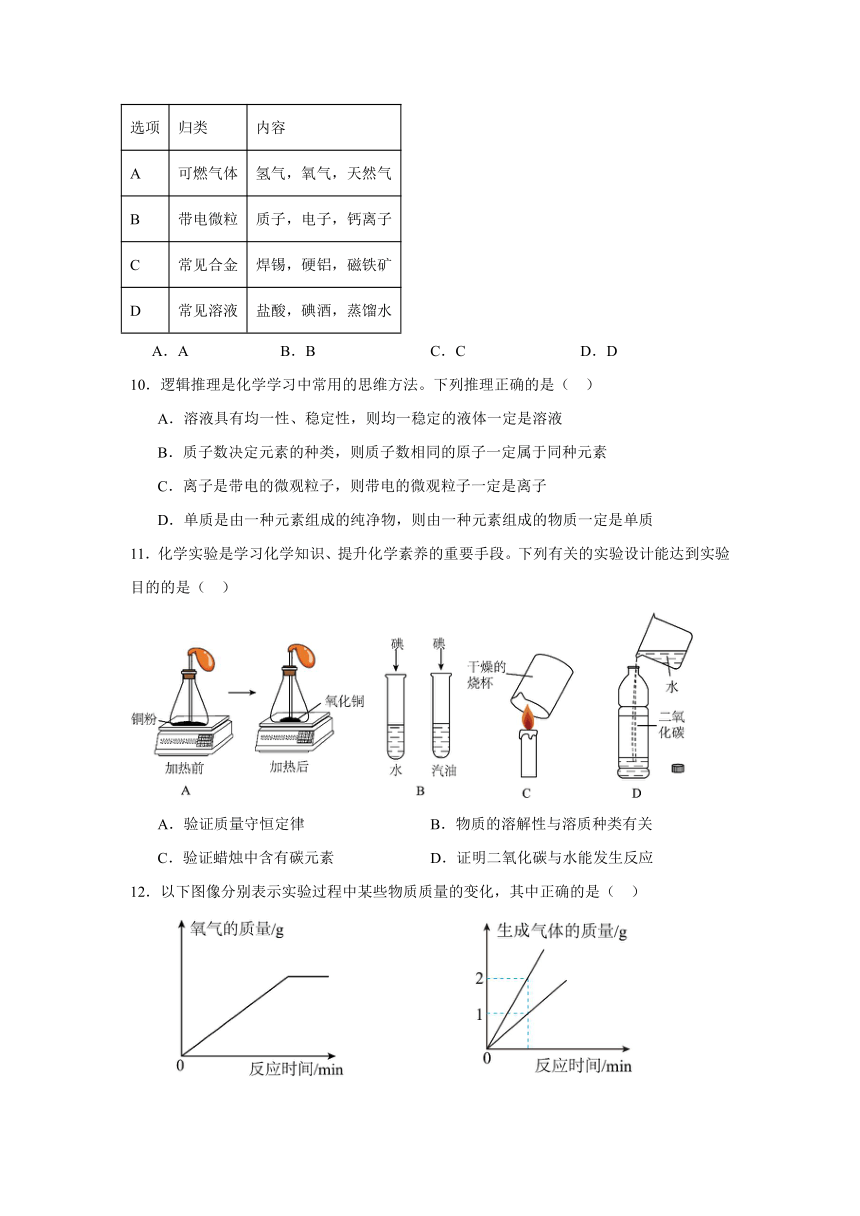
9.下列归类正确的是( )
选项 归类 内容
A 可燃气体 氢气,氧气,天然气
B 带电微粒 质子,电子,钙离子
C 常见合金 焊锡,硬铝,磁铁矿
D 常见溶液 盐酸,碘酒,蒸馏水
A.A B.B C.C D.D
10.逻辑推理是化学学习中常用的思维方法。下列推理正确的是( )
A.溶液具有均一性、稳定性,则均一稳定的液体一定是溶液
B.质子数决定元素的种类,则质子数相同的原子一定属于同种元素
C.离子是带电的微观粒子,则带电的微观粒子一定是离子
D.单质是由一种元素组成的纯净物,则由一种元素组成的物质一定是单质
11.化学实验是学习化学知识、提升化学素养的重要手段。下列有关的实验设计能达到实验目的的是( )
A.验证质量守恒定律 B.物质的溶解性与溶质种类有关
C.验证蜡烛中含有碳元素 D.证明二氧化碳与水能发生反应
12.以下图像分别表示实验过程中某些物质质量的变化,其中正确的是( )
A.加热一定质量的高锰酸钾固体 B.电解水生成两种气体
C.木炭在盛有氧气的密闭容器内燃烧 D.一定质量的铜丝在空气中加热
二、本大题包括5小题,共28分
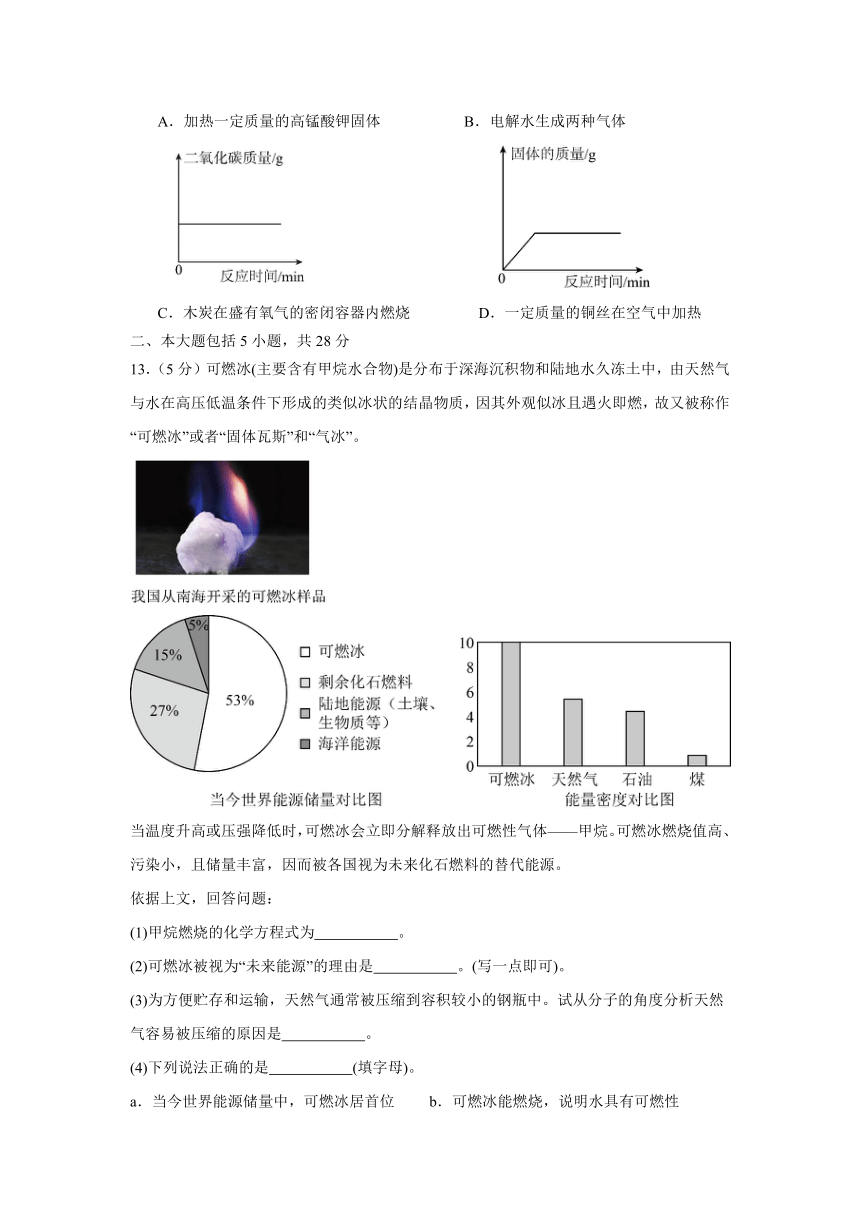
13.(5分)可燃冰(主要含有甲烷水合物)是分布于深海沉积物和陆地水久冻土中,由天然气与水在高压低温条件下形成的类似冰状的结晶物质,因其外观似冰且遇火即燃,故又被称作“可燃冰”或者“固体瓦斯”和“气冰”。
当温度升高或压强降低时,可燃冰会立即分解释放出可燃性气体——甲烷。可燃冰燃烧值高、污染小,且储量丰富,因而被各国视为未来化石燃料的替代能源。
依据上文,回答问题:
(1)甲烷燃烧的化学方程式为 。
(2)可燃冰被视为“未来能源”的理由是 。(写一点即可)。
(3)为方便贮存和运输,天然气通常被压缩到容积较小的钢瓶中。试从分子的角度分析天然气容易被压缩的原因是 。
(4)下列说法正确的是 (填字母)。
a.当今世界能源储量中,可燃冰居首位 b.可燃冰能燃烧,说明水具有可燃性
c.可燃冰的能量密度约为煤的十倍 d.可燃冰燃烧污染大
14.(6分)根据如图所示实验装置回答问题:
(1)仪器①的名称是 。
(2)实验室用高锰酸钾制取氧气的化学方程式 ,若实验开始前就把发生装置与D连接,则收集到的气体不纯,原因是 。
(3)实验室制取二氧化碳的发生装置由B改进为C的优点是 ,若用B和E组装一套气密性良好的装置来测定生成二氧化碳的体积,反应结束后,发现量筒内收集到的水的体积总是比理论值小,原因是 。
15.(6分)工业上以粗煤为原料生产甲醇(CH3OH),实验室模拟工业生产甲醇的操作流程如图所示:
(1)步骤②操作A中玻璃棒的作用是 。
(2)步骤③发生的反应为化合反应,其化学方程式是 。
(3)步骤④中发生反应的化学方程式是X+H2O=H2SO4,则X的化学式是 。
(4)甲醇和乙醇同属于醇类物质,由乙醇推测甲醇的一点化学性质 。
(5)除得到产品甲醇和硫酸外,工业上该生产流程的意义还有 。
16.(6+3分)化学兴趣小组对铁制品生锈展开了项目式探究。
【任务一】探究铁生锈的条件
实验1:
(1)小组同学设计如上图的实验1进行实验,一段时间后,当观察到只有 (填字母序号)试管中的铁钉出现了明显生锈现象,可以得出铁生锈的条件是 ;铁锈的化学式 。
【任务二】探究铁生锈速率的影响因素
【查阅资料】炭粉可加快铁的生锈,炭粉不与食盐和醋酸反应
实验2:
小组同学设计如上图的实验2进行分组实验,利用氧气传感器监测该过程中氧气浓度的变化判断铁生锈的情况。实验记录如下表:
序号 其他试剂 初始时氧气浓度/% 时氧气浓度/%
水/ 食盐质量/ 醋酸/滴
① 0 0 0 20.8 20.8
② 1.0 0 0 20.8 15.2
③ 1.0 0 5 20.8 12.7
④ 1.0 1.0 0 20.8 8.0
(2)①中时氧气浓度没有变化的原因是 。
(3)对比②④可以得出的结论是 。
(4)小组同学猜想铁生锈的快慢还可能与氧气的浓度有关,为判断该猜想是否正确,请设计实验进行验证。简述实验步骤,现象和结论。 。
【任务三】探究铁生锈能量的变化
小组同学设计如下图的实验3在室温下进行实验,利用温度传感器监测该过程中温度的变化。检查气密性后,将铁粉,炭粉和食盐加入集气瓶中,时刻加入水。
【若正确回答下列问题加3分,总分不超过40分】
(5)时刻曲线变化的原因是 。
【拓展交流】(6)根据铁生锈的原理分析,铁粉在生活中的相关用途有 (任写一点)
17.(5分)工业上用电解氯化镁的方法生产镁,反应的化学方程式为MgCl2Mg+ Cl2↑。现欲电解1000kg含杂质5%的氯化镁(杂质不参加反应),理论上能生产多少kg金属镁?
答案
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1 2 3 4 5 6 7 8 9 10
A B B A B D D C B B
11 12
A A
二、本大题包括5小题,共28分
13.(5分)(2) CH4+2O2CO2+2H2O;(2)可燃冰燃烧值高、污染小,且储量丰富;
(3)分子之间有间隔,受压时分子之间的间隔变小;(4)ac。
14.(6分)(1)长颈漏斗;
(2) 2KMnO4K2MnO4+MnO2+O2↑;一开始就收集会导致收集到的气体中含有空气;
(3)可以控制反应的发生和停止;二氧化碳能溶于水且与水发生反应。
15.(6分)(1)引流;(2)CO+2H2CH3OH;(3)SO3;(4)可燃性;
(5)防止二氧化硫污染环境等。
16.(6分)(1)A;氧气和水共同作用;Fe2O3;(2)铁粉未与水接触,没有生锈,氧气浓度不变;
(3)食盐能加快铁的生锈;
(4)将大小相同的2根洁净的铁钉分别放入大小相同的试管中,再加入适量且等量的水,最后充入浓度不同的氧气,一段时间后,观察到氧气浓度较高的试管中铁钉生锈更严重。由此可得出氧气浓度越高,铁生锈越快;
(5)集气瓶中温度升高,是因为时刻加入水后,铁与氧气和水同时接触发生铁的生锈,且铁生锈是放热反应;集气瓶中温度下降并慢慢恢复至室温,是因为时刻后铁生锈接近停止,产生的热量小于体系散失的热量(合理即可);
(6)干燥剂(或除氧剂、暖宝宝、发热贴)(合理即可)。
17.(5分)解:设理论上能生产金属镁的质量为x。
答:理论上能产生240kg金属镁。
附相对原子质量:H-1;C-12;N-14;O-16;Mg-24;Cl-35.5。
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1.下列过程中主要发生化学变化的是( )
A.自制汽水 B.洗涤剂洗碗
C.探究铁生锈的条件 D.自制白糖晶体
2.生活离不开化学,下列生活实例涉及的化学知识正确的是( )
选项 生活实例 化学知识
A 洗洁精清洗餐具 洗洁精与油污形成溶液
B 燃气灶上方安装燃气报警器 天然气密度比空气小
C 自动感温喷淋头喷水灭火 降低可燃物的着火点
D 喝雪碧会打嗝 温度升高,气体溶解度增大
A.A B.B C.C D.D
3.2024年中国环境日的主题为“全面推进美丽中国建设”。下列做法错误的是( )
A.分类回收处理生活垃圾 B.随意丢弃废旧电池
C.生活污水处理达标后再排放 D.喷灌、滴灌农作物
4.2024年3月20日,鹊桥二号中继星成功发射,其中用的伞状天线是用镀金钼丝编织而成。如图是钼元素在元素周期表的相关信息。下列说法不正确的是( )
A.钼元素属于非金属元素 B.钼元素的相对原子质量为95.96
C.金属钼具有良好的延展性 D.钼原子核外有42个电子
5.正确的操作是实验成功的前提,下列有关试管的操作正确的是( )
A.滴加液体 B.塞橡胶塞 C.加热液体 D.添加固体药品
6.青蒿琥酯()是我国研发的治疗疟疾的药物。青蒿琥酯的说法正确的是( )
A.青蒿琥酯分子是由碳元素、氢元素组成的
B.青蒿琥酯由19个碳原子、28个氢原子和8个氧原子构成
C.青蒿琥酯中氢、氧原子个数比为2:7
D.青蒿琥酯中氢元素质量分数约为7.3%
7.“科学思维”是化学学科的核心素养之一。下列解释中正确的是
A.热水能使压瘪的乒乓球复原是因为气体分子体积变大
B.氢气在氯气中燃烧生成氯化氢,说明分子是化学变化中的最小粒子
C.单质中只含有一种元素,所以只含有一种元素的物质一定是单质
D.金刚石的硬度大而石墨质软,是因为它们的碳原子排列方式不同
8.我国科研人员实现了用高效催化剂将甲烷与氧气在常温下制甲酸,下图为该反应的微观示意图。下列有关说法正确的是( )
A.反应过程中共有两种氧化物 B.高效催化剂的作用是增加生成物质量
C.参加反应的甲和乙的分子个数比为2:3 D.反应前后元素的化合价都未改变
9.下列归类正确的是( )
选项 归类 内容
A 可燃气体 氢气,氧气,天然气
B 带电微粒 质子,电子,钙离子
C 常见合金 焊锡,硬铝,磁铁矿
D 常见溶液 盐酸,碘酒,蒸馏水
A.A B.B C.C D.D
10.逻辑推理是化学学习中常用的思维方法。下列推理正确的是( )
A.溶液具有均一性、稳定性,则均一稳定的液体一定是溶液
B.质子数决定元素的种类,则质子数相同的原子一定属于同种元素
C.离子是带电的微观粒子,则带电的微观粒子一定是离子
D.单质是由一种元素组成的纯净物,则由一种元素组成的物质一定是单质
11.化学实验是学习化学知识、提升化学素养的重要手段。下列有关的实验设计能达到实验目的的是( )
A.验证质量守恒定律 B.物质的溶解性与溶质种类有关
C.验证蜡烛中含有碳元素 D.证明二氧化碳与水能发生反应
12.以下图像分别表示实验过程中某些物质质量的变化,其中正确的是( )
A.加热一定质量的高锰酸钾固体 B.电解水生成两种气体
C.木炭在盛有氧气的密闭容器内燃烧 D.一定质量的铜丝在空气中加热
二、本大题包括5小题,共28分
13.(5分)可燃冰(主要含有甲烷水合物)是分布于深海沉积物和陆地水久冻土中,由天然气与水在高压低温条件下形成的类似冰状的结晶物质,因其外观似冰且遇火即燃,故又被称作“可燃冰”或者“固体瓦斯”和“气冰”。
当温度升高或压强降低时,可燃冰会立即分解释放出可燃性气体——甲烷。可燃冰燃烧值高、污染小,且储量丰富,因而被各国视为未来化石燃料的替代能源。
依据上文,回答问题:
(1)甲烷燃烧的化学方程式为 。
(2)可燃冰被视为“未来能源”的理由是 。(写一点即可)。
(3)为方便贮存和运输,天然气通常被压缩到容积较小的钢瓶中。试从分子的角度分析天然气容易被压缩的原因是 。
(4)下列说法正确的是 (填字母)。
a.当今世界能源储量中,可燃冰居首位 b.可燃冰能燃烧,说明水具有可燃性
c.可燃冰的能量密度约为煤的十倍 d.可燃冰燃烧污染大
14.(6分)根据如图所示实验装置回答问题:
(1)仪器①的名称是 。
(2)实验室用高锰酸钾制取氧气的化学方程式 ,若实验开始前就把发生装置与D连接,则收集到的气体不纯,原因是 。
(3)实验室制取二氧化碳的发生装置由B改进为C的优点是 ,若用B和E组装一套气密性良好的装置来测定生成二氧化碳的体积,反应结束后,发现量筒内收集到的水的体积总是比理论值小,原因是 。
15.(6分)工业上以粗煤为原料生产甲醇(CH3OH),实验室模拟工业生产甲醇的操作流程如图所示:
(1)步骤②操作A中玻璃棒的作用是 。
(2)步骤③发生的反应为化合反应,其化学方程式是 。
(3)步骤④中发生反应的化学方程式是X+H2O=H2SO4,则X的化学式是 。
(4)甲醇和乙醇同属于醇类物质,由乙醇推测甲醇的一点化学性质 。
(5)除得到产品甲醇和硫酸外,工业上该生产流程的意义还有 。
16.(6+3分)化学兴趣小组对铁制品生锈展开了项目式探究。
【任务一】探究铁生锈的条件
实验1:
(1)小组同学设计如上图的实验1进行实验,一段时间后,当观察到只有 (填字母序号)试管中的铁钉出现了明显生锈现象,可以得出铁生锈的条件是 ;铁锈的化学式 。
【任务二】探究铁生锈速率的影响因素
【查阅资料】炭粉可加快铁的生锈,炭粉不与食盐和醋酸反应
实验2:
小组同学设计如上图的实验2进行分组实验,利用氧气传感器监测该过程中氧气浓度的变化判断铁生锈的情况。实验记录如下表:
序号 其他试剂 初始时氧气浓度/% 时氧气浓度/%
水/ 食盐质量/ 醋酸/滴
① 0 0 0 20.8 20.8
② 1.0 0 0 20.8 15.2
③ 1.0 0 5 20.8 12.7
④ 1.0 1.0 0 20.8 8.0
(2)①中时氧气浓度没有变化的原因是 。
(3)对比②④可以得出的结论是 。
(4)小组同学猜想铁生锈的快慢还可能与氧气的浓度有关,为判断该猜想是否正确,请设计实验进行验证。简述实验步骤,现象和结论。 。
【任务三】探究铁生锈能量的变化
小组同学设计如下图的实验3在室温下进行实验,利用温度传感器监测该过程中温度的变化。检查气密性后,将铁粉,炭粉和食盐加入集气瓶中,时刻加入水。
【若正确回答下列问题加3分,总分不超过40分】
(5)时刻曲线变化的原因是 。
【拓展交流】(6)根据铁生锈的原理分析,铁粉在生活中的相关用途有 (任写一点)
17.(5分)工业上用电解氯化镁的方法生产镁,反应的化学方程式为MgCl2Mg+ Cl2↑。现欲电解1000kg含杂质5%的氯化镁(杂质不参加反应),理论上能生产多少kg金属镁?
答案
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1 2 3 4 5 6 7 8 9 10
A B B A B D D C B B
11 12
A A
二、本大题包括5小题,共28分
13.(5分)(2) CH4+2O2CO2+2H2O;(2)可燃冰燃烧值高、污染小,且储量丰富;
(3)分子之间有间隔,受压时分子之间的间隔变小;(4)ac。
14.(6分)(1)长颈漏斗;
(2) 2KMnO4K2MnO4+MnO2+O2↑;一开始就收集会导致收集到的气体中含有空气;
(3)可以控制反应的发生和停止;二氧化碳能溶于水且与水发生反应。
15.(6分)(1)引流;(2)CO+2H2CH3OH;(3)SO3;(4)可燃性;
(5)防止二氧化硫污染环境等。
16.(6分)(1)A;氧气和水共同作用;Fe2O3;(2)铁粉未与水接触,没有生锈,氧气浓度不变;
(3)食盐能加快铁的生锈;
(4)将大小相同的2根洁净的铁钉分别放入大小相同的试管中,再加入适量且等量的水,最后充入浓度不同的氧气,一段时间后,观察到氧气浓度较高的试管中铁钉生锈更严重。由此可得出氧气浓度越高,铁生锈越快;
(5)集气瓶中温度升高,是因为时刻加入水后,铁与氧气和水同时接触发生铁的生锈,且铁生锈是放热反应;集气瓶中温度下降并慢慢恢复至室温,是因为时刻后铁生锈接近停止,产生的热量小于体系散失的热量(合理即可);
(6)干燥剂(或除氧剂、暖宝宝、发热贴)(合理即可)。
17.(5分)解:设理论上能生产金属镁的质量为x。
答:理论上能产生240kg金属镁。
同课章节目录
