安徽省合肥市瑶海区众望初级中学2024~2025学年九年级下学期2月份月考化学试卷(含答案)
文档属性
| 名称 | 安徽省合肥市瑶海区众望初级中学2024~2025学年九年级下学期2月份月考化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 490.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-21 15:20:42 | ||
图片预览


文档简介
2024~2025学年度下学期九年级化学2月份月考试题
附相对原子质量:H-1;C-12;N-14;O-16;S-32;Fe-56;Cu-64。
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1、实验室几种仪器和物品在聊天,你认为叙述中涉及化学变化的是( )
A.酒精灯:酒精挥发了 B.细口瓶:我的标签被腐蚀了
C.集气瓶:我的底儿破裂了 D.陶土网:别小看我,我有隔热作用
2、下列有关化学与生活的说法中正确的是( )
A.室内起火时立即打开所有门窗会加大火势 B.在煤炉边放一盆水,可以防止煤烟中毒
C.用水灭火的原理是降低了可燃物的着火点 D.生活中可以用过滤的方法降低水的硬度
3、我国“十四五”规划和2035年远景目标纲要中第十一篇为“推动绿色发展,促进人与自然和谐共生”。下列有利于实现该目标的是( )
A.提倡私家车出行,节约时间成本 B.积极植树造林,扩大植被面积
C.使用一次性木筷,减少细菌感染 D.秸秆就地焚烧,增强土壤肥力
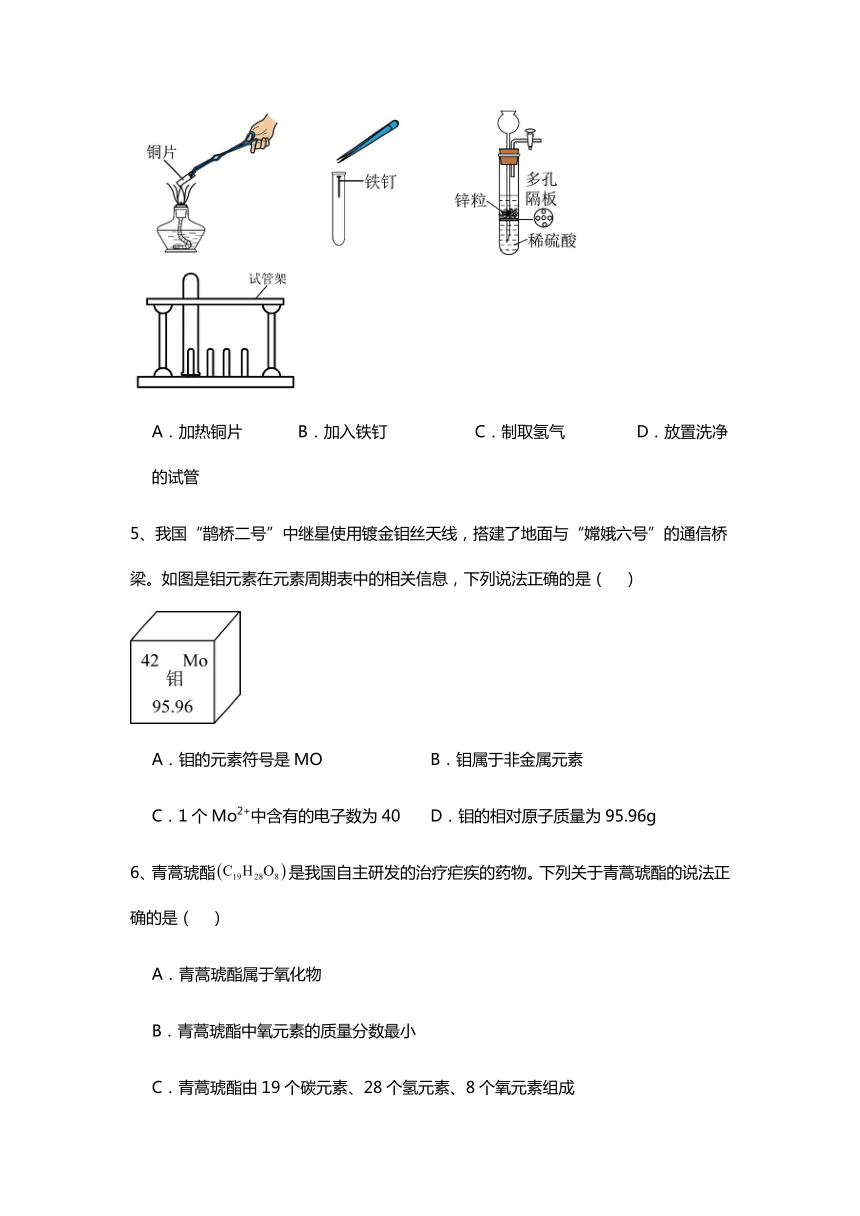
4、在“金属的化学性质及应用”实验中,下列装置或操作错误的是( )
A.加热铜片 B.加入铁钉 C.制取氢气 D.放置洗净的试管
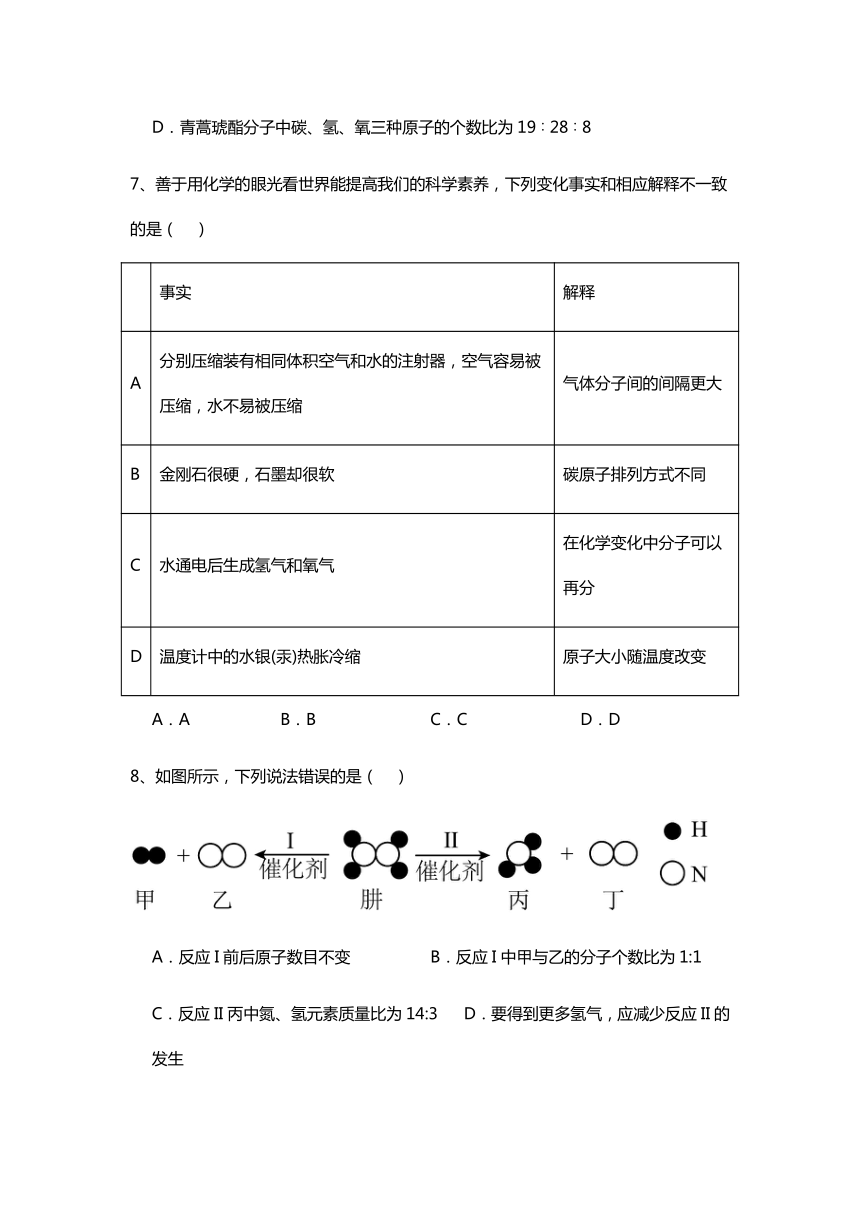
5、我国“鹊桥二号”中继星使用镀金钼丝天线,搭建了地面与“嫦娥六号”的通信桥梁。如图是钼元素在元素周期表中的相关信息,下列说法正确的是( )
A.钼的元素符号是MO B.钼属于非金属元素
C.1个Mo2+中含有的电子数为40 D.钼的相对原子质量为95.96g
6、青蒿琥酯是我国自主研发的治疗疟疾的药物。下列关于青蒿琥酯的说法正确的是( )
A.青蒿琥酯属于氧化物
B.青蒿琥酯中氧元素的质量分数最小
C.青蒿琥酯由19个碳元素、28个氢元素、8个氧元素组成
D.青蒿琥酯分子中碳、氢、氧三种原子的个数比为19∶28∶8
7、善于用化学的眼光看世界能提高我们的科学素养,下列变化事实和相应解释不一致的是( )
事实 解释
A 分别压缩装有相同体积空气和水的注射器,空气容易被压缩,水不易被压缩 气体分子间的间隔更大
B 金刚石很硬,石墨却很软 碳原子排列方式不同
C 水通电后生成氢气和氧气 在化学变化中分子可以再分
D 温度计中的水银(汞)热胀冷缩 原子大小随温度改变
A.A B.B C.C D.D
8、如图所示,下列说法错误的是( )
A.反应I前后原子数目不变 B.反应I中甲与乙的分子个数比为1:1
C.反应II丙中氮、氢元素质量比为14:3 D.要得到更多氢气,应减少反应II的发生
9、西汉青铜雁鱼灯工作原理如图所示。灯罩为两片弧形板,可转动开合调整挡风和光照,燃油(含碳元素)燃烧产生的炭黑等烟气可通过雁脖子进入腹部导入水中。下列说法错误的是( )
A.青铜是一种金属材料
B.烟气是燃油完全燃烧的产物
C.水既能降低灯体的温度,也能吸收部分烟气
D.关闭灯罩,灯火熄灭是因为空气的进入量减少,不足以支持燃烧
10、运用推理、归纳、类比、对比的方法得出下列结论,其中合理的是( )
A.铝表面的氧化铝薄膜能起到保护作用,则铁表面的铁锈也能起到保护作用
B.活泼金属能和稀盐酸反应放出气体,则能和稀盐酸反应放出气体的一定是活泼金属
C.合金中一定含有金属元素,氧化镁中含有金属元素,则氧化镁是一种合金
D.化学反应伴随着能量变化,则钢铁生锈过程一定伴随能量变化
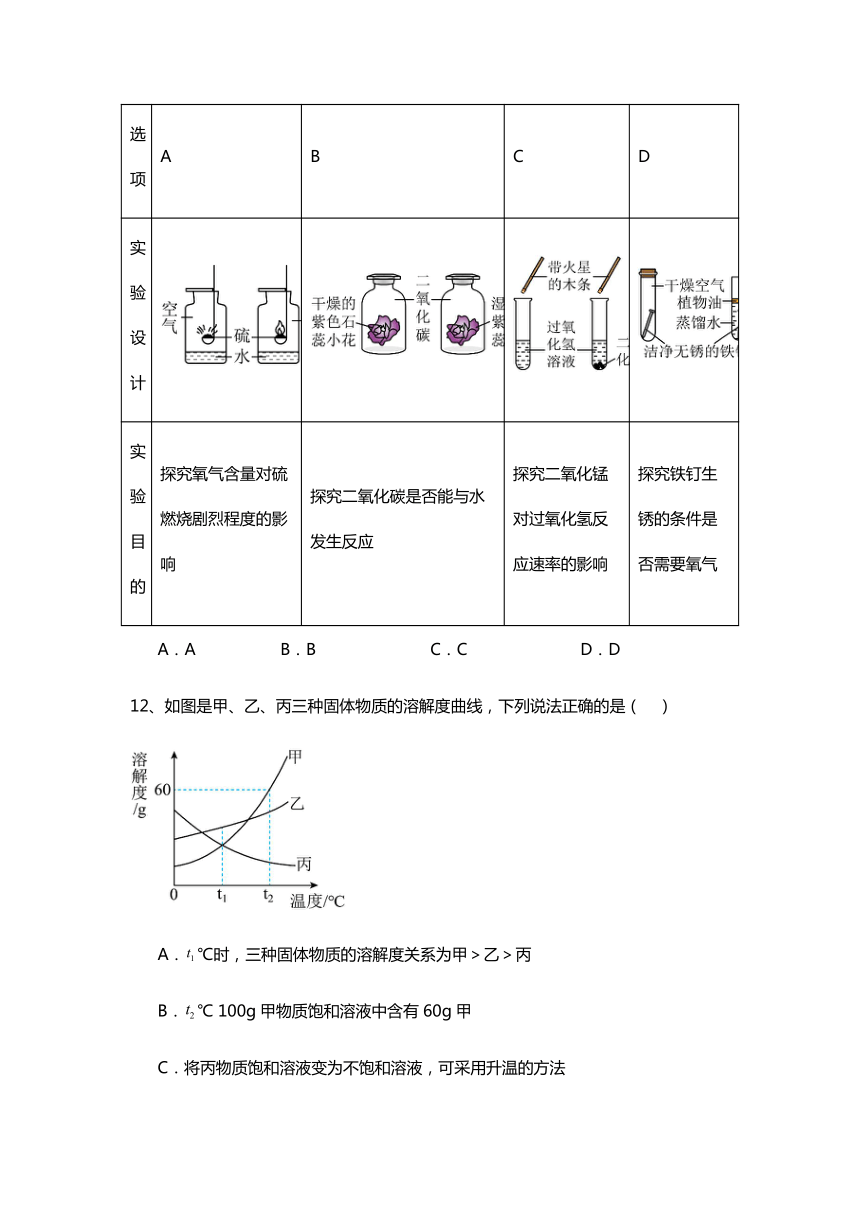
11、控制变量是科学实验的重要方法,下列实验设计不能达到目的的是( )
选项 A B C D
实验设计
实验目的 探究氧气含量对硫燃烧剧烈程度的影响 探究二氧化碳是否能与水发生反应 探究二氧化锰对过氧化氢反应速率的影响 探究铁钉生锈的条件是否需要氧气
A.A B.B C.C D.D
12、如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是( )
A.℃时,三种固体物质的溶解度关系为甲>乙>丙
B.℃ 100g甲物质饱和溶液中含有60g甲
C.将丙物质饱和溶液变为不饱和溶液,可采用升温的方法
D.℃时,分别用100g水配制甲、乙的饱和溶液,再降温到℃,析出无水晶体的质量:甲>乙
二、本大题包括5小题,共28分
13、(5分)某校化学兴趣小组同学了解当地生活用水并进行自制简易净水器的实践活动。
【任务一】了解生活饮用水标准
新版《生活饮用水卫生标准》中规定水质必须在感官性指标、化学指标、病理学指标等方面均达标方可成为生活饮用水。
(1)其中规定了镉、铅、汞的限量,这里的镉、铅、汞指的是 (选填“分子”“原子”或“元素”)。
【任务二】检测净化水的硬度
同学们查阅相关资料,了解到国家有关水的硬度的标准为:
类别 极软水 软水 中硬水 硬水 高硬水
以CaCO3浓度计(mg/L) 0~75 75~150 150~300 300~450 450~700
(2)某同学在家中取少量净水器净化后的水,用便携式水硬度检测仪测得该水的硬度为78.2mg/L,说明该水属于 。
【任务三】制作简易净水器
同学们向自来水中加入明矾[KAl(SO4)2 12H2O],静置一段时间后,再将处理后的水倒入净水装置中(如图),最终得到无色澄清透明的水。
(3)该设计图中①②处放置的材料较合理的是______(填字母)。
A.①处放细沙,②处放活性炭
B.①处放活性炭,②处放细沙
(4)通过该简易净水器净化后的水的硬度 (选填“会”或“不会”)改变。
(5)为使该简易净水器的净水效果更好,你的建议是 (写一条)。
14、(6分)请结合如图回答问题:
(1)仪器X的名称为 。
(2)实验室用A装置制取氧气的化学方程式为 。
(3)若要收集一瓶氧气进行铁丝燃烧实验,则应选择的最佳收集装置是 (填字母序号)。
(4)B和C装置都可以用于实验室制取二氧化碳,与B装置相比,C装置的优点是 。若用装置D排空气法收集二氧化碳,气体应从 (填“a”或“b”)管口通入。
15、(6分)下图为实验室模拟工业上利用煤炭生产甲醇()的操作流程:
(1)步骤①:煤属于 (填“可再生”或“不可再生”)能源;步骤①中的操作原理与 (填一种实验操作名称)的原理相同。
(2)步骤②:为使精炼煤和水蒸气充分接触,可采取的方法是 (写出一种即可)。
(3)步骤③:该反应的化学方程式为 。
(4)步骤④:基本反应类型为 。
16、(6+3分)兴趣小组对“影响金属锌与稀硫酸反应速率的因素”进行了如下实验探究。
【进行实验】
室温下,选用20mL不同溶质质量分数的硫酸(4%和8%)分别与0.5g颗粒状和粉末状的金属锌进行实验(固定夹持仪器略去)。
(1)金属锌与稀硫酸反应的化学方程式为 。
(2)老师提醒,开始实验时注射器中的稀硫酸应快速推入锥形瓶中,你认为原因是 。
(3)实验小组进行实验后,获得的相关实验数据如下表所示:
实验编号 硫酸溶质质量分数(均取20mL) 金属锌形态(均取0.5g) 氢气体积(mL) (均收集前20S的气体)
a 4% 粉状 85.7
b 4% 颗粒 53.0
c 8% 粉状 162.2
d 8% 颗粒 84.3
①比较不同溶质质量分数的硫酸对反应速率的影响,可选择的实验编号是 ,由此可得到的结论是 。
②从以上数据中,实验小组还打算研究的问题是 。
【拓展延伸】
【若正确回答下列问题加3分,总分不超过40分】
(4)你认为影响金属锌与稀硫酸反应速率的因素还有 ,请设计实验方案验证你的猜想 。
17、(5分)为测定某含铁的混合物样品(杂质不溶于水,也不与其它反应)中铁的含量进行了如下实验:
(1)滤液中含有的溶质为 (填化学式)。
(2)请计算出含铁的混合物样品中铁的质量?
答案
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1 2 3 4 5 6 7 8 9 10
B A B B C D D B B D
11 12
D D
二、本大题包括5小题,共28分
13、(5分)(1)元素;(2)软水;(3)A;(4)不会;
(5)增加过滤层(或使用高效过滤材料、定期更换过滤材料如活性炭、蓬松棉等)。
14、(6分).(1)酒精灯;(2) 2KMnO4K2MnO4+MnO2+O2↑;(3) F;
(4)可以控制反应的发生与停止;a。
15、(6分)(1)不可再生;过滤;(2)将煤粉碎(合理即可);(3);(4)化合反应。
16、(6+3分)(1);
(2)由于锌和稀硫酸反应生成硫酸锌和氢气,生成了气体,装置内压强增大,缓慢推入,会导致硫酸无法全部推入;
(3) ac或bd;当其他条件相同时,溶质质量分数越大,反应速率越大;金属锌的形态对反应速率的影响;
(4)温度;取两份颗粒大小相同质量相同的金属锌于两试管中(其中一试管在50℃的水浴中,另一试管在常温下),分别加入等体积的溶质质量分数相同的硫酸,观察反应的剧烈程度,发现温度越高,金属锌与硫酸反应越剧烈,反应速率越大。
17、(5分)(1) FeSO4;
(2)解:设该含铁混合物样品中铁的质量为x。
x=2.8g
答:该含铁混合物样品中铁的质量为2.8g。
附相对原子质量:H-1;C-12;N-14;O-16;S-32;Fe-56;Cu-64。
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1、实验室几种仪器和物品在聊天,你认为叙述中涉及化学变化的是( )
A.酒精灯:酒精挥发了 B.细口瓶:我的标签被腐蚀了
C.集气瓶:我的底儿破裂了 D.陶土网:别小看我,我有隔热作用
2、下列有关化学与生活的说法中正确的是( )
A.室内起火时立即打开所有门窗会加大火势 B.在煤炉边放一盆水,可以防止煤烟中毒
C.用水灭火的原理是降低了可燃物的着火点 D.生活中可以用过滤的方法降低水的硬度
3、我国“十四五”规划和2035年远景目标纲要中第十一篇为“推动绿色发展,促进人与自然和谐共生”。下列有利于实现该目标的是( )
A.提倡私家车出行,节约时间成本 B.积极植树造林,扩大植被面积
C.使用一次性木筷,减少细菌感染 D.秸秆就地焚烧,增强土壤肥力
4、在“金属的化学性质及应用”实验中,下列装置或操作错误的是( )
A.加热铜片 B.加入铁钉 C.制取氢气 D.放置洗净的试管
5、我国“鹊桥二号”中继星使用镀金钼丝天线,搭建了地面与“嫦娥六号”的通信桥梁。如图是钼元素在元素周期表中的相关信息,下列说法正确的是( )
A.钼的元素符号是MO B.钼属于非金属元素
C.1个Mo2+中含有的电子数为40 D.钼的相对原子质量为95.96g
6、青蒿琥酯是我国自主研发的治疗疟疾的药物。下列关于青蒿琥酯的说法正确的是( )
A.青蒿琥酯属于氧化物
B.青蒿琥酯中氧元素的质量分数最小
C.青蒿琥酯由19个碳元素、28个氢元素、8个氧元素组成
D.青蒿琥酯分子中碳、氢、氧三种原子的个数比为19∶28∶8
7、善于用化学的眼光看世界能提高我们的科学素养,下列变化事实和相应解释不一致的是( )
事实 解释
A 分别压缩装有相同体积空气和水的注射器,空气容易被压缩,水不易被压缩 气体分子间的间隔更大
B 金刚石很硬,石墨却很软 碳原子排列方式不同
C 水通电后生成氢气和氧气 在化学变化中分子可以再分
D 温度计中的水银(汞)热胀冷缩 原子大小随温度改变
A.A B.B C.C D.D
8、如图所示,下列说法错误的是( )
A.反应I前后原子数目不变 B.反应I中甲与乙的分子个数比为1:1
C.反应II丙中氮、氢元素质量比为14:3 D.要得到更多氢气,应减少反应II的发生
9、西汉青铜雁鱼灯工作原理如图所示。灯罩为两片弧形板,可转动开合调整挡风和光照,燃油(含碳元素)燃烧产生的炭黑等烟气可通过雁脖子进入腹部导入水中。下列说法错误的是( )
A.青铜是一种金属材料
B.烟气是燃油完全燃烧的产物
C.水既能降低灯体的温度,也能吸收部分烟气
D.关闭灯罩,灯火熄灭是因为空气的进入量减少,不足以支持燃烧
10、运用推理、归纳、类比、对比的方法得出下列结论,其中合理的是( )
A.铝表面的氧化铝薄膜能起到保护作用,则铁表面的铁锈也能起到保护作用
B.活泼金属能和稀盐酸反应放出气体,则能和稀盐酸反应放出气体的一定是活泼金属
C.合金中一定含有金属元素,氧化镁中含有金属元素,则氧化镁是一种合金
D.化学反应伴随着能量变化,则钢铁生锈过程一定伴随能量变化
11、控制变量是科学实验的重要方法,下列实验设计不能达到目的的是( )
选项 A B C D
实验设计
实验目的 探究氧气含量对硫燃烧剧烈程度的影响 探究二氧化碳是否能与水发生反应 探究二氧化锰对过氧化氢反应速率的影响 探究铁钉生锈的条件是否需要氧气
A.A B.B C.C D.D
12、如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是( )
A.℃时,三种固体物质的溶解度关系为甲>乙>丙
B.℃ 100g甲物质饱和溶液中含有60g甲
C.将丙物质饱和溶液变为不饱和溶液,可采用升温的方法
D.℃时,分别用100g水配制甲、乙的饱和溶液,再降温到℃,析出无水晶体的质量:甲>乙
二、本大题包括5小题,共28分
13、(5分)某校化学兴趣小组同学了解当地生活用水并进行自制简易净水器的实践活动。
【任务一】了解生活饮用水标准
新版《生活饮用水卫生标准》中规定水质必须在感官性指标、化学指标、病理学指标等方面均达标方可成为生活饮用水。
(1)其中规定了镉、铅、汞的限量,这里的镉、铅、汞指的是 (选填“分子”“原子”或“元素”)。
【任务二】检测净化水的硬度
同学们查阅相关资料,了解到国家有关水的硬度的标准为:
类别 极软水 软水 中硬水 硬水 高硬水
以CaCO3浓度计(mg/L) 0~75 75~150 150~300 300~450 450~700
(2)某同学在家中取少量净水器净化后的水,用便携式水硬度检测仪测得该水的硬度为78.2mg/L,说明该水属于 。
【任务三】制作简易净水器
同学们向自来水中加入明矾[KAl(SO4)2 12H2O],静置一段时间后,再将处理后的水倒入净水装置中(如图),最终得到无色澄清透明的水。
(3)该设计图中①②处放置的材料较合理的是______(填字母)。
A.①处放细沙,②处放活性炭
B.①处放活性炭,②处放细沙
(4)通过该简易净水器净化后的水的硬度 (选填“会”或“不会”)改变。
(5)为使该简易净水器的净水效果更好,你的建议是 (写一条)。
14、(6分)请结合如图回答问题:
(1)仪器X的名称为 。
(2)实验室用A装置制取氧气的化学方程式为 。
(3)若要收集一瓶氧气进行铁丝燃烧实验,则应选择的最佳收集装置是 (填字母序号)。
(4)B和C装置都可以用于实验室制取二氧化碳,与B装置相比,C装置的优点是 。若用装置D排空气法收集二氧化碳,气体应从 (填“a”或“b”)管口通入。
15、(6分)下图为实验室模拟工业上利用煤炭生产甲醇()的操作流程:
(1)步骤①:煤属于 (填“可再生”或“不可再生”)能源;步骤①中的操作原理与 (填一种实验操作名称)的原理相同。
(2)步骤②:为使精炼煤和水蒸气充分接触,可采取的方法是 (写出一种即可)。
(3)步骤③:该反应的化学方程式为 。
(4)步骤④:基本反应类型为 。
16、(6+3分)兴趣小组对“影响金属锌与稀硫酸反应速率的因素”进行了如下实验探究。
【进行实验】
室温下,选用20mL不同溶质质量分数的硫酸(4%和8%)分别与0.5g颗粒状和粉末状的金属锌进行实验(固定夹持仪器略去)。
(1)金属锌与稀硫酸反应的化学方程式为 。
(2)老师提醒,开始实验时注射器中的稀硫酸应快速推入锥形瓶中,你认为原因是 。
(3)实验小组进行实验后,获得的相关实验数据如下表所示:
实验编号 硫酸溶质质量分数(均取20mL) 金属锌形态(均取0.5g) 氢气体积(mL) (均收集前20S的气体)
a 4% 粉状 85.7
b 4% 颗粒 53.0
c 8% 粉状 162.2
d 8% 颗粒 84.3
①比较不同溶质质量分数的硫酸对反应速率的影响,可选择的实验编号是 ,由此可得到的结论是 。
②从以上数据中,实验小组还打算研究的问题是 。
【拓展延伸】
【若正确回答下列问题加3分,总分不超过40分】
(4)你认为影响金属锌与稀硫酸反应速率的因素还有 ,请设计实验方案验证你的猜想 。
17、(5分)为测定某含铁的混合物样品(杂质不溶于水,也不与其它反应)中铁的含量进行了如下实验:
(1)滤液中含有的溶质为 (填化学式)。
(2)请计算出含铁的混合物样品中铁的质量?
答案
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1 2 3 4 5 6 7 8 9 10
B A B B C D D B B D
11 12
D D
二、本大题包括5小题,共28分
13、(5分)(1)元素;(2)软水;(3)A;(4)不会;
(5)增加过滤层(或使用高效过滤材料、定期更换过滤材料如活性炭、蓬松棉等)。
14、(6分).(1)酒精灯;(2) 2KMnO4K2MnO4+MnO2+O2↑;(3) F;
(4)可以控制反应的发生与停止;a。
15、(6分)(1)不可再生;过滤;(2)将煤粉碎(合理即可);(3);(4)化合反应。
16、(6+3分)(1);
(2)由于锌和稀硫酸反应生成硫酸锌和氢气,生成了气体,装置内压强增大,缓慢推入,会导致硫酸无法全部推入;
(3) ac或bd;当其他条件相同时,溶质质量分数越大,反应速率越大;金属锌的形态对反应速率的影响;
(4)温度;取两份颗粒大小相同质量相同的金属锌于两试管中(其中一试管在50℃的水浴中,另一试管在常温下),分别加入等体积的溶质质量分数相同的硫酸,观察反应的剧烈程度,发现温度越高,金属锌与硫酸反应越剧烈,反应速率越大。
17、(5分)(1) FeSO4;
(2)解:设该含铁混合物样品中铁的质量为x。
x=2.8g
答:该含铁混合物样品中铁的质量为2.8g。
同课章节目录
