破难点2 滴定计算 热重分析计算 课件 (共37张PPT) 2025届高考化学二轮复习
文档属性
| 名称 | 破难点2 滴定计算 热重分析计算 课件 (共37张PPT) 2025届高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-22 16:08:57 | ||
图片预览










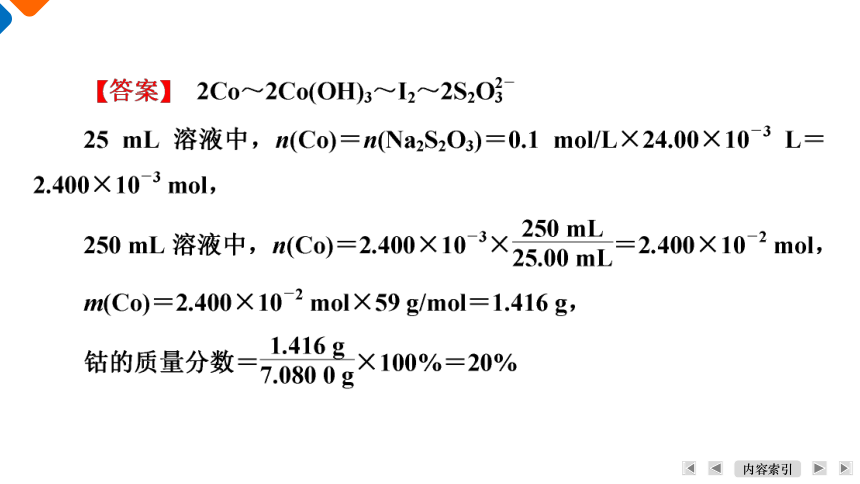
文档简介
(共37张PPT)
主题2
无机物转化与应用
破难点2 滴定计算 热重分析计算
内容索引
检测反馈
难点精讲
名卷优选
名 卷 优 选
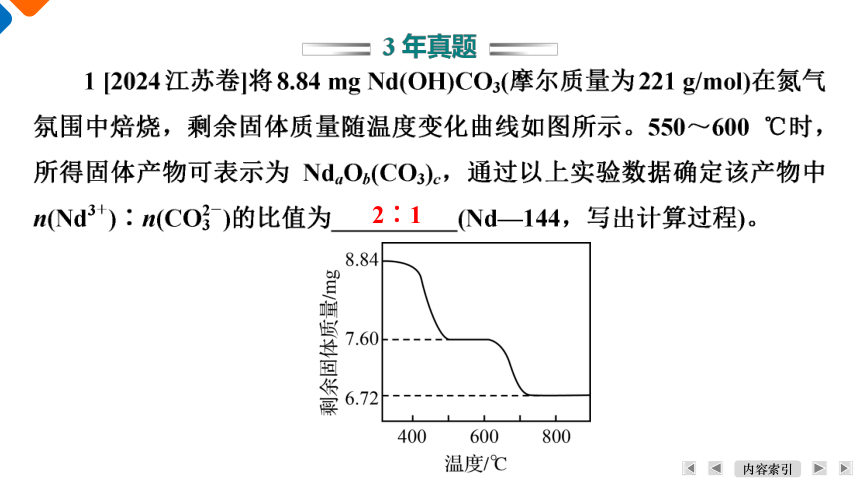
2∶1
2 [2022江苏卷]硫铁化合物(FeS、FeS2等)应用广泛。FeS2、FeS在空气中易被氧化,将FeS2在空气中氧化,测得氧化过程中剩余固体的质量与起始FeS2的质量的比值随温度变化的曲线如图所示。800 ℃时,FeS2氧化成含有两种元素的固体产物为____________(填化学式,写出计算过程)。
Fe2O3
3 [2020江苏卷]二氯异氰尿酸钠(C3N3O3Cl2Na)是常用的杀菌消毒剂。二氯异氰尿酸钠优质品要求有效氯大于60%。通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。实验检测原理如下:
准确称取1.120 0 g样品,用容量瓶配成250.0 mL溶液;取25.00 mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5 min;用0.100 0 mol/L Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液20.00 mL。通过计算判断该样品是否为优质品。
1 [2024连云港期末]测定制得的[Co(NH3)6]Cl3样品中Co含量。准确称取7.080 0 g样品于烧杯中,加入足量NaOH溶液充分反应,微沸加热至无NH3放出。冷却至室温后,加入过量的KI固体和盐酸,充分摇荡。将所得溶液定容至250 mL,然后取出25.00 mL溶液放入锥形瓶中,滴加少量淀粉溶液,用0.1 mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为24.00 mL。计算样品中钴元素的质量分数:__________ (Co—59,写出计算过程)。
20%
2 [2024南通如皋适应性考试一]为测定草酸钴样品的纯度,进行如下实验:
(1) 取草酸钴样品3.000 g,加入100.00 mL 0.100 0 mol/L酸性KMnO4溶液,加热充分反应至不再有CO2气体产生(该条件下Co2+不被氧化,杂质不参与反应)。
(2) 将溶液冷却,加水稀释定容至250 mL。
(3) 取25.00 mL溶液,用0.100 0 mol/L FeSO4溶液滴定过量的KMnO4,恰好完全反应时消耗18.00 mL FeSO4溶液。计算样品中CoC2O4·2H2O的质量分数:___________(Co—59,写出计算过程)。
97.60%
【答案】 25.00 mL溶液中,n(FeSO4)=0.100 0 mol/L×18.00×10-3 L=1.8×10-3 mol,
依据得失电子守恒:n(KMnO4)×5=n(FeSO4)×1,
250 mL溶液中,剩余的n(KMnO4)=3.6×10-3 mol,
则与CoC2O4反应的KMnO4的物质的量:
0.1 L×0.1 mol/L-0.003 6 mol=0.006 4 mol,
依据得失电子守恒:n(KMnO4)×5=n(CoC2O4)×2
n(CoC2O4)=0.016 mol,
3 [2025南通如东期初]MnCO3在空气流中热解得到不同价态锰的氧化物,其固体残留率随温度的变化如图所示。
770 ℃时,剩余固体中n(Mn)∶n(O)为__________(Mn—55,写出计算过程)。
3∶4
4 [2025苏州调研]LiCoO2电极。从废锂电池正极材料LiCoO2回收Li、Co等金属路线如下:
(1) 写出“溶解”步骤发生反应的离子方程式:_________________ ___________________________________________。
(2) Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知290 ℃以上,Co(OH)2已完全脱水,在350~400 ℃范围内,剩余固体成分为______________________(Co—59,写出计算过程)。
Co2O3和Co3O4
【答案】 假设Co(OH)2的物质的量为1 mol,即质量为93 g,
在350~400 ℃时,固体残留率在89.25%~86.38%之间,
难 点 精 讲
难点1 实验测定方法——滴定法
1 分类。定量实验中的滴定方法包括:酸碱中和滴定、沉淀滴定、氧化还原滴定、配位滴定等,主要是根据滴定过程中标准溶液的消耗量来计算待测溶液的浓度。
(1) 连续滴定法:第一步滴定反应生成的产物,还可以继续参加第二步的滴定。根据第二步滴定的消耗量,可计算出第一步滴定的反应物的量。
(2) 返滴定法:第一步用的滴定剂是过量的,第二步再用另一物质返滴定过量的物质。用第一步加入的量减去第二步中过量的量,即可得出第一步所求物质的物质的量。
2 指示剂的选择和终点现象
定量实验方法 举例 指示剂的选择 终点现象
酸碱中 和滴定 盐酸标准溶液滴定NaOH溶液 酚酞 试液 当滴入最后半滴标准液,溶液由红色变为无色,且半分钟内不变色
甲基橙 溶液 当滴入最后半滴标准液,溶液由黄色变为橙色,且半分钟内不变色
定量实验方法 举例 指示剂的选择 终点现象
氧化还 原滴定 KMnO4标准溶液滴定草酸溶液 KMnO4 溶液 当滴入最后半滴标准液,溶液由无色变为浅红色,且半分钟内不变色
Na2S2O3标准溶液滴定I2溶液 淀粉 溶液 当滴入最后半滴标准液,溶液蓝色褪去,且半分钟内不变色
氧化还 原滴定 用标准碘溶液滴定溶有SO2的水溶液,以测定水中SO2的含量 淀粉 溶液 当滴入最后半滴标准液,溶液由无色变为蓝色,且半分钟内不变色
定量实验方法 举例 指示剂的选择 终点现象
氧化还 原滴定 用标准KI溶液滴定含有Fe3+的溶液 KSCN 溶液 当滴入最后半滴标准KI溶液,溶液的红色褪去,且半分钟内不变色
沉淀 滴定 AgNO3标准溶液滴定NaCl溶液 — —
配位 滴定 EDTA标准溶液滴定含Zn2+的溶液 — —
难点2 热重分析
热重分析是利用某些物质(通常是结晶水合物)受热分解后残留固体的质量变化,通过分析计算,从而确定分解反应产物的一类题型,这类题通常提供热重曲线,曲线的横坐标为温度,纵坐标为质量变化或固体残留率。解题时,可以从质量变化或质量变化率入手,找出质量关系,通过列式计算确定产物成分。
一般认为加热结晶水合盐反应可分三步进行:
第一步,脱去部分水;
第二步,生成碱式盐或含水盐;
第三步,生成金属氧化物。
如果热重实验的气氛为空气,则加热过程中可能被氧化,反应将变得更复杂一些。基于这些,中学化学热重曲线试题可分为两类:第一类,试样发生分解反应,以脱水、分解等方式失重,气氛物质不参加反应;第二类,试样发生氧化还原反应,以氧化还原等方式失重,气氛物质可参加反应,如被氧气氧化等。
解析热重曲线试题的关键:应以1 mol物质为研究对象,抓住失重时减少的质量,结合摩尔质量,即可快速求得结果。
具体步骤:
(1) 设晶体为1 mol。
(2) 失重一般是先失水,再失非金属氧化物。
检 测 反 馈
2
4
1
3
1 [2024苏州期末]制备的TiO2产品中TiO2的纯度测定。
准确称取0.200 0 g样品,加入适量浓硫酸,加热至样品完全溶解,冷却后用水稀释,冷却至室温后再加入铝片将TiO2+还原为Ti3+,用0.100 0 mol/L NH4Fe(SO4)2溶液滴定至终点,平行滴定3次,平均消耗NH4Fe(SO4)2溶液18.00 mL。计算样品中TiO2的纯度:___________ (Ti—48,已知:Ti3+可将Fe3+还原为Fe2+。写出计算过程)。
72.00%
2
4
1
3
2 [2023连云港调研]五氧化二钒(V2O5)是广泛用于冶金、化工等行业的催化剂。NH4VO3在空气中灼烧得V2O5。称取0.80 g灼烧后的产物,加入稀硫酸溶解后,向其中加入0.200 0 mol/L H2C2O4溶液25 mL,再用0.100 0 mol/L KMnO4溶液滴定过量的H2C2O4溶液至终点,消耗KMnO4溶液的体积为4.00 mL,则产物中V2O5的质量分数为__________ (V—51,写出计算过程)。
91%
2
4
1
3
2
4
3
1
3 [2024南京、盐城一模]将一定质量的CuC2O4置于Ar气中热解,测得剩余固体的质量与原始固体的质量的比值随温度变化的曲线如图所示。350~400 ℃下剩余固体的化学式为________(写出推断过程)。
Cu
2
4
3
1
【答案】 热重曲线计算推导核心:减重全程金属原子的物质的量不变。由图可推知,350~400 ℃下,剩余固体的摩尔质量=152 g/mol× 42.11%=64 g/mol,为金属铜,化学式为Cu
2
4
3
1
2
4
3
1
谢谢观看
Thank you for watching
主题2
无机物转化与应用
破难点2 滴定计算 热重分析计算
内容索引
检测反馈
难点精讲
名卷优选
名 卷 优 选
2∶1
2 [2022江苏卷]硫铁化合物(FeS、FeS2等)应用广泛。FeS2、FeS在空气中易被氧化,将FeS2在空气中氧化,测得氧化过程中剩余固体的质量与起始FeS2的质量的比值随温度变化的曲线如图所示。800 ℃时,FeS2氧化成含有两种元素的固体产物为____________(填化学式,写出计算过程)。
Fe2O3
3 [2020江苏卷]二氯异氰尿酸钠(C3N3O3Cl2Na)是常用的杀菌消毒剂。二氯异氰尿酸钠优质品要求有效氯大于60%。通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。实验检测原理如下:
准确称取1.120 0 g样品,用容量瓶配成250.0 mL溶液;取25.00 mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5 min;用0.100 0 mol/L Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液20.00 mL。通过计算判断该样品是否为优质品。
1 [2024连云港期末]测定制得的[Co(NH3)6]Cl3样品中Co含量。准确称取7.080 0 g样品于烧杯中,加入足量NaOH溶液充分反应,微沸加热至无NH3放出。冷却至室温后,加入过量的KI固体和盐酸,充分摇荡。将所得溶液定容至250 mL,然后取出25.00 mL溶液放入锥形瓶中,滴加少量淀粉溶液,用0.1 mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为24.00 mL。计算样品中钴元素的质量分数:__________ (Co—59,写出计算过程)。
20%
2 [2024南通如皋适应性考试一]为测定草酸钴样品的纯度,进行如下实验:
(1) 取草酸钴样品3.000 g,加入100.00 mL 0.100 0 mol/L酸性KMnO4溶液,加热充分反应至不再有CO2气体产生(该条件下Co2+不被氧化,杂质不参与反应)。
(2) 将溶液冷却,加水稀释定容至250 mL。
(3) 取25.00 mL溶液,用0.100 0 mol/L FeSO4溶液滴定过量的KMnO4,恰好完全反应时消耗18.00 mL FeSO4溶液。计算样品中CoC2O4·2H2O的质量分数:___________(Co—59,写出计算过程)。
97.60%
【答案】 25.00 mL溶液中,n(FeSO4)=0.100 0 mol/L×18.00×10-3 L=1.8×10-3 mol,
依据得失电子守恒:n(KMnO4)×5=n(FeSO4)×1,
250 mL溶液中,剩余的n(KMnO4)=3.6×10-3 mol,
则与CoC2O4反应的KMnO4的物质的量:
0.1 L×0.1 mol/L-0.003 6 mol=0.006 4 mol,
依据得失电子守恒:n(KMnO4)×5=n(CoC2O4)×2
n(CoC2O4)=0.016 mol,
3 [2025南通如东期初]MnCO3在空气流中热解得到不同价态锰的氧化物,其固体残留率随温度的变化如图所示。
770 ℃时,剩余固体中n(Mn)∶n(O)为__________(Mn—55,写出计算过程)。
3∶4
4 [2025苏州调研]LiCoO2电极。从废锂电池正极材料LiCoO2回收Li、Co等金属路线如下:
(1) 写出“溶解”步骤发生反应的离子方程式:_________________ ___________________________________________。
(2) Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知290 ℃以上,Co(OH)2已完全脱水,在350~400 ℃范围内,剩余固体成分为______________________(Co—59,写出计算过程)。
Co2O3和Co3O4
【答案】 假设Co(OH)2的物质的量为1 mol,即质量为93 g,
在350~400 ℃时,固体残留率在89.25%~86.38%之间,
难 点 精 讲
难点1 实验测定方法——滴定法
1 分类。定量实验中的滴定方法包括:酸碱中和滴定、沉淀滴定、氧化还原滴定、配位滴定等,主要是根据滴定过程中标准溶液的消耗量来计算待测溶液的浓度。
(1) 连续滴定法:第一步滴定反应生成的产物,还可以继续参加第二步的滴定。根据第二步滴定的消耗量,可计算出第一步滴定的反应物的量。
(2) 返滴定法:第一步用的滴定剂是过量的,第二步再用另一物质返滴定过量的物质。用第一步加入的量减去第二步中过量的量,即可得出第一步所求物质的物质的量。
2 指示剂的选择和终点现象
定量实验方法 举例 指示剂的选择 终点现象
酸碱中 和滴定 盐酸标准溶液滴定NaOH溶液 酚酞 试液 当滴入最后半滴标准液,溶液由红色变为无色,且半分钟内不变色
甲基橙 溶液 当滴入最后半滴标准液,溶液由黄色变为橙色,且半分钟内不变色
定量实验方法 举例 指示剂的选择 终点现象
氧化还 原滴定 KMnO4标准溶液滴定草酸溶液 KMnO4 溶液 当滴入最后半滴标准液,溶液由无色变为浅红色,且半分钟内不变色
Na2S2O3标准溶液滴定I2溶液 淀粉 溶液 当滴入最后半滴标准液,溶液蓝色褪去,且半分钟内不变色
氧化还 原滴定 用标准碘溶液滴定溶有SO2的水溶液,以测定水中SO2的含量 淀粉 溶液 当滴入最后半滴标准液,溶液由无色变为蓝色,且半分钟内不变色
定量实验方法 举例 指示剂的选择 终点现象
氧化还 原滴定 用标准KI溶液滴定含有Fe3+的溶液 KSCN 溶液 当滴入最后半滴标准KI溶液,溶液的红色褪去,且半分钟内不变色
沉淀 滴定 AgNO3标准溶液滴定NaCl溶液 — —
配位 滴定 EDTA标准溶液滴定含Zn2+的溶液 — —
难点2 热重分析
热重分析是利用某些物质(通常是结晶水合物)受热分解后残留固体的质量变化,通过分析计算,从而确定分解反应产物的一类题型,这类题通常提供热重曲线,曲线的横坐标为温度,纵坐标为质量变化或固体残留率。解题时,可以从质量变化或质量变化率入手,找出质量关系,通过列式计算确定产物成分。
一般认为加热结晶水合盐反应可分三步进行:
第一步,脱去部分水;
第二步,生成碱式盐或含水盐;
第三步,生成金属氧化物。
如果热重实验的气氛为空气,则加热过程中可能被氧化,反应将变得更复杂一些。基于这些,中学化学热重曲线试题可分为两类:第一类,试样发生分解反应,以脱水、分解等方式失重,气氛物质不参加反应;第二类,试样发生氧化还原反应,以氧化还原等方式失重,气氛物质可参加反应,如被氧气氧化等。
解析热重曲线试题的关键:应以1 mol物质为研究对象,抓住失重时减少的质量,结合摩尔质量,即可快速求得结果。
具体步骤:
(1) 设晶体为1 mol。
(2) 失重一般是先失水,再失非金属氧化物。
检 测 反 馈
2
4
1
3
1 [2024苏州期末]制备的TiO2产品中TiO2的纯度测定。
准确称取0.200 0 g样品,加入适量浓硫酸,加热至样品完全溶解,冷却后用水稀释,冷却至室温后再加入铝片将TiO2+还原为Ti3+,用0.100 0 mol/L NH4Fe(SO4)2溶液滴定至终点,平行滴定3次,平均消耗NH4Fe(SO4)2溶液18.00 mL。计算样品中TiO2的纯度:___________ (Ti—48,已知:Ti3+可将Fe3+还原为Fe2+。写出计算过程)。
72.00%
2
4
1
3
2 [2023连云港调研]五氧化二钒(V2O5)是广泛用于冶金、化工等行业的催化剂。NH4VO3在空气中灼烧得V2O5。称取0.80 g灼烧后的产物,加入稀硫酸溶解后,向其中加入0.200 0 mol/L H2C2O4溶液25 mL,再用0.100 0 mol/L KMnO4溶液滴定过量的H2C2O4溶液至终点,消耗KMnO4溶液的体积为4.00 mL,则产物中V2O5的质量分数为__________ (V—51,写出计算过程)。
91%
2
4
1
3
2
4
3
1
3 [2024南京、盐城一模]将一定质量的CuC2O4置于Ar气中热解,测得剩余固体的质量与原始固体的质量的比值随温度变化的曲线如图所示。350~400 ℃下剩余固体的化学式为________(写出推断过程)。
Cu
2
4
3
1
【答案】 热重曲线计算推导核心:减重全程金属原子的物质的量不变。由图可推知,350~400 ℃下,剩余固体的摩尔质量=152 g/mol× 42.11%=64 g/mol,为金属铜,化学式为Cu
2
4
3
1
2
4
3
1
谢谢观看
Thank you for watching
同课章节目录
