微主题1 物质的结构、性质 元素周期律 课件 (共93张PPT) 2025届高考化学二轮复习
文档属性
| 名称 | 微主题1 物质的结构、性质 元素周期律 课件 (共93张PPT) 2025届高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-22 16:34:03 | ||
图片预览










文档简介
(共93张PPT)
主题1
物质的结构与性质
微主题1 物质的结构、性质 元素
周期律
内容索引
核心串讲
体系建构
名卷优选
基础回归
检测反馈
基 础 回 归
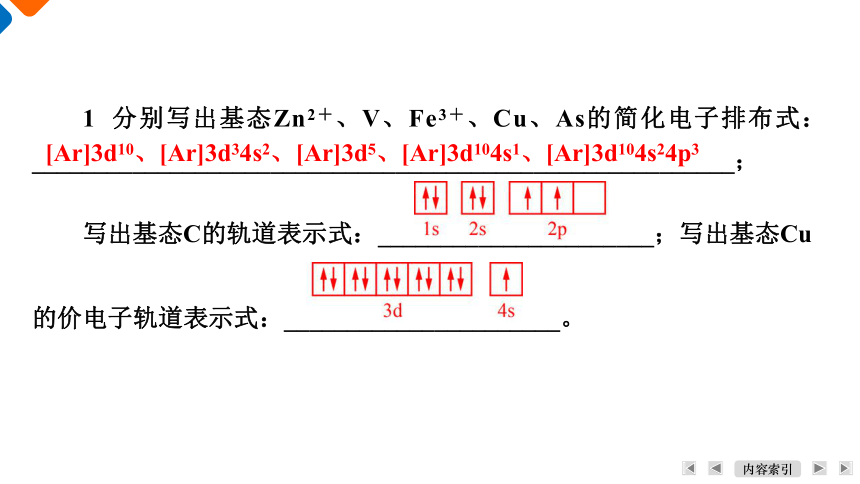
1 分别写出基态Zn2+、V、Fe3+、Cu、As的简化电子排布式:________________________________________________________;
写出基态C的轨道表示式:______________________;写出基态Cu
的价电子轨道表示式:______________________。
[Ar]3d10、[Ar]3d34s2、[Ar]3d5、[Ar]3d104s1、[Ar]3d104s24p3
2 某晶胞如图所示。
写出该物质的化学式:_____________。Y原子的配位数为______。
XY或YX
6
3 比较下列物质的熔、沸点。
(1) CCl4______CH4。
(2) H2O______H2S。
(3) NaCl______MgCl2。
>
>
<
>
【解析】 (1)(2)(4)中的物质为分子晶体。(1) CCl4的相对分子质量大,范德华力强,熔、沸点高。(2) 水形成分子间氢键,熔、沸点高。(3) NaCl、MgCl2为离子晶体,镁离子半径小,所带电荷多,晶格能大,熔、沸点高。(4) 前者可形成分子间氢键,后者形成分子内氢键,故后者熔、沸点低。
4 根据电负性判断ICl水解产物:______________。
【解析】 电负性Cl>I,ICl中Cl带负电性,I带正电性;水中氢原子带正电性,氧带负电性,故相异电荷吸引结合得到HCl和HIO。
HIO、HCl
5 SO2与SO3中硫原子杂化方式分别为___________;微粒空间结构分别为____________________;键角大小为_____________。
【解析】 SO2与SO3均为sp2杂化,SO2中硫原子有一个孤电子对,SO3中硫原子电子全部参与成键,孤电子对斥力大于成键电子对,故SO3键角大于SO2。
sp2、sp2
V形、平面三角形
SO3>SO2
体 系 建 构
名 卷 优 选
考向1 原子结构与元素性质 元素周期律
1 (1) [2022江苏卷改编]基态锗原子(32Ge)的价电子排布式为__________。
(2) [2021江苏第二次适应性考试]基态Mn2+的电子排布式为_______________________________。
4s24p2
1s22s22p63s23p63d5或[Ar]3d5
2 (1) [2023江苏卷改编]C、Si、Ge位于元素周期表中ⅣA族。原子半径大小顺序为____________;第一电离能大小顺序为_____________。
(2) [2023江苏卷]电负性大小:χ(F) ______χ(O)。
(3) [2020江苏卷]C、N、O元素的第一电离能大小顺序为________。
CC>Si>Ge
>
N>O>C
3 [2021江苏卷]前4周期主族元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,Y的周期序数与族序数相等,基态时Z原子3p原子轨道上有5个电子,W与Z处于同一主族。下列说法正确的是( )
A. 原子半径:r(X)B. X的第一电离能比同周期相邻元素的大
C. Y的最高价氧化物对应的水化物的酸性比Z的强
D. Z的简单气态氢化物的热稳定性比W的弱
B
【解析】 由题意知X、Y、Z、W分别为N、Al、Cl、Br。同一周期主族元素原子半径依次减小,铝原子半径大于氯,A错误;氮元素原子最外层p轨道为半满的稳定结构,第一电离能大于同周期相邻元素,B正确;非金属性AlHBr,D错误。
考向2 分子结构与性质
4 (1) [2024江苏卷改编]石墨转化为金刚石,碳原子轨道的杂化类型变化为____________________。
由sp2转变为sp3
sp3、sp3
sp3、sp2
7
5 (1) [2024江苏卷改编]丁烷催化裂化为乙烷和乙烯,丁烷断裂________(填“σ键”或“π键”)。
σ键
1
16
【解析】 (3) 氨气分子中氮原子与3个氢原子形成3个σ键,与锌离子形成配位键,也是σ键,故1 mol [Zn(NH3)4]Cl2中含有σ键的物质的量为(3+1)×4 mol=16 mol。
<
<
V形
平面三角形
不能
易溶于水
乙醇分子间存在
氢键
【解析】 H4V4O12具有八元环结构,根据价态规律可以得出八元环应由4个V和4个O构成; 化合物中V为+5价,形成5个共用电子对,每个V在环上与O形成2个共用电子对,还与另外两个氧分别形成双键和单键。
8 [2023江苏卷]已知H4V4O12具有八元环结构,其结构式可表示为
___________________________。
或
考向3 晶体结构与性质
9 判断下列说法是否正确,并说明原因。
(1) [2023江苏卷]碳单质、晶体硅、SiC均为共价晶体。
_____________________________________________________________________________________。
(2) [2022江苏卷]ⅣA族元素单质的晶体类型相同。
________________________________________________________________________________。
错误,碳单质有多种同素异形体,金刚石为共价晶体,C60为分子晶体,石墨为混合型晶体
错误,ⅣA族元素中碳有多种单质,有分子晶体、共价晶体等,锡、铅单质为金属晶体
(3) [2023江苏卷]H2O分子之间形成氢键,得出H2O(g)的热稳定性比H2S(g)的高。
________________________________________________________________________________________________。
错误,H2O分子之间形成氢键主要影响其熔、沸点等物理性质,热稳定性是化学性质,与非金属性有关
10 (1) [2024江苏卷]铁酸铋晶胞如图所示(图中有4个Fe原子位于晶胞体对角线上,O原子未画出),其中原子数目比N(Fe)∶N(Bi)=_________。
(2) [2021江苏卷]AgI晶胞(如图)中含有______个I-。
2∶1
4
4
【答案】
考向4 化学用语
12 [2024江苏卷]反应PbS+4H2O2===PbSO4+4H2O可用于壁画修复。下列说法正确的是( )
C
考向5 物质结构与性质综合
CN—NHD和DCOO-
(1) 电负性不同的元素形成共用电子对,电负性强的元素带________ (填“负电荷”和“正电荷”)。
(2) Fe、O、H电负性大小关系为____________。
负电荷
O>H>Fe
在催化剂表面吸附在O2-和Fe2+上的氢原子分别带有_____________ _______ (填“负电荷”和“正电荷”)。
(3) Fe2+上的氢原子用“H*”表示,则生成水和甲酸根的化学式分别为______________________。
正电荷、负
电荷
HH*O、HCOO-
15 [2021江苏卷]利用铜—铈氧化物(xCuO·yCeO2,Ce是活泼金属)催化氧化可除去H2中少量CO,催化氧化过程中Cu、Ce的化合价均发生变化,可能机理如图1所示。将n(CO)∶n(O2)∶n(H2)∶n(N2)=1∶1∶ 49∶49的混合气体以一定流速通过装有xCuO·yCeO2催化剂的反应器,CO的转化率随温度变化的曲线如图2所示。
图1
图2
【解析】 共价化合物中元素形成极性键(共用电子对)的数目是该元素化合价的数值。基态Ce原子核外电子排布式为[Xe]4f15d16s2,价电子全部与氧原子形成4个共用电子对,表现为+4价。步骤(ⅰ)中失去1个氧原子,铜和铈均减少1个共用电子对,化合价均降低1,故铜的化合价由+2变为+1,铈的化合价由+4变为+3。
(1) 基态Ce原子核外电子排布式为[Xe]4f15d16s2,图2所示机理的步骤(ⅰ)中,元素Cu、Ce化合价发生的变化为_______________________ _____________________。
(2) 当催化氧化温度超过150 ℃时,催化剂的催化活性下降,其可能原因是______________________________________________________。
铜由+2价变为+1价,
铈由+4价变为+3价
高温下,Cu(Ⅱ)或Cu(Ⅰ)被H2(或CO)还原为Cu
考向1 原子结构与元素性质 元素周期律
1 书写基态粒子的电子排布式(价电子排布式)。电离能、电负性大小比较。
(1) [2024南京调研]基态Mn2+的价电子排布式为__________。
(2) [2024扬州期末]基态Ga的电子排布式为___________________。
(3) [2023南通通州月考]比较B、C、Al的第一电离能:__________。
3d5
[Ar]3d104s24p1
C>B>Al
(4) [2022常州前黄中学、溧阳中学联考]A、B、C、D为短周期的四种元素,原子序数依次增大。A、B、D三种元素分别位于不同短周期的不同主族。C、D对应的简单离子核外电子排布相同,A、B、C、D元素可形成一种新型漂白剂,结构如下:
四种元素电负性大小顺序为__________________(用元素符号由大到小排列)。
O>H>B>Mg
(5) [2024南京调研改编]硼碳氮(BCN)材料可用作耐磨涂层。成分中三种元素原子半径大小顺序为______________;三种元素最高价氧化物的水化物的酸性由强到弱的顺序为____________________________ (用分子式表示)。
B>C>N
HNO3>H2CO3>H3BO3
【解析】 (1) 第四周期过渡元素的价电子指3d和4s轨道上的电子,主族元素的价电子指最外层电子。(3) 同周期主族元素从左到右第一电离能有增大趋势,ⅡA族的第一电离能大于ⅢA族的,碳为ⅣA族,电离能无特殊性,同族元素,上一周期的第一电离能大于下一周期,则I1(C)>I1(B)>I1(Al)。(4) A、B、D三种元素分别位于不同短周期的不同主族,则A为氢,B位于第二周期,D位于第三周期,结合新型漂白剂的结构分析,D形成+2价阳离子,说明D为镁元素,B形成四个共价键,且所形成的阴离子带两个负电荷,则B为硼元素,C形成两个共价键,则C为氧元素。非金属元素的电负性大于金属元素的电负性,同周期主族元素越靠右电负性越大,氢的电负性在O和B之间,电负性的顺序为O>H>B>Mg。(5) 非金属性N>C>B,故酸性HNO3>H2CO3>H3BO3。
考向2 分子结构与性质
2 关于共价键类型和数目判断,分子空间结构判断,分子性质对溶解性、熔沸点影响的考查。
(1) [2024苏北八市三模]1 mol SiO2晶体中含有Si—O σ键的数目为______mol。
4
16∶1
sp3、sp2
1
正四面体形
四面体形
可能
(9) [2023连云港期中]H2S分子和H2O分子中的键角更大的是
_________。
(10) [2024南京调研]室温下,在水中A的溶解度比B的______(填“大”“小”或“无差别”)。
H2O
大
NH3分子间可形成氢键
_______________________________________________。
或
考向3 晶体结构与性质
3 关于晶胞中原子数目、配位数及位置判断。
(1) [2024南京调研]一种成分的晶胞结构如图所示,每个O2-周围紧邻的Cu2+的个数为______。
(2) [2024苏锡常镇二模]净化时生成的CaF2沉淀晶胞结构如图所示。在CaF2晶胞中F-周围距离最近的Ca2+形成的空隙结构为___________。
4
正四面体
(3) [2024苏北八市三模]充电时,Li+脱嵌形成Li1-xFePO4(00.25
(4) [2024南京二模]β-FeSO4的晶胞沿c轴(c轴垂直于a、b轴)方向投影的平面图如图所示,其中硫原子的杂化方式为_______;已知该晶胞中S原子的数目为4,试预测Fe2+是否占据该晶胞的所有顶点、面心和体心,并说明理由:_______________________________________________
____________________________________________________________________________。
sp3
考向4 化学用语
4 [2024苏州期初]反应CaSO4+2NH3+CO2+H2O===CaCO3+(NH4)2SO4可制备硫酸铵晶体。下列说法正确的是( )
A
考向5 物质结构与性质综合
5 [2024苏州期末]压强0.7 MPa、温度370
℃下,化合物WS2催化反应H2S+CH3OH===
H2O+CH3SH可用于制备甲硫醇。下列说法正
确的是( )
B
6 (1) [2024南通一模]α-FeOOH在环境保护等领域有广泛应用。
①α-FeOOH的结构中,每个Fe(Ⅲ)与羟基氧和非羟基氧构成了FeO3(OH)3八面体,相同环境的氧原子之间构成正三角形。请补充完整该八面体的结构。
【答案】 或
②α-FeOOH可用于脱除烟气中的H2S。脱硫、再生过程中可能的物种变化如图甲所示。生成的S8(结构如图乙所示)覆盖在α-FeOOH的表面。
甲 乙
工业可使用四氯乙烯(C2Cl4)溶解S8并实现与α-FeOOH分离。四氯乙烯能溶解S8的原因是_____________________________________________ ________。部分环状分子(如苯)中由于存在大π键,增强了分子的稳定性。S8分子中不能形成大π键的原因是______________________________ _________________________。
四氯乙烯与S8都是非极性分子,符合“相似相溶”
规则
S8中S原子采取sp3杂化,无剩
余的p轨道用于形成π键
(2) [2024苏北七市二模]在“Cu0/Cu+双位点”催化作用下,CH3OH与水反应的反应路径如图所示,画出图中方框内中间体的结构:
__________。
核 心 串 讲
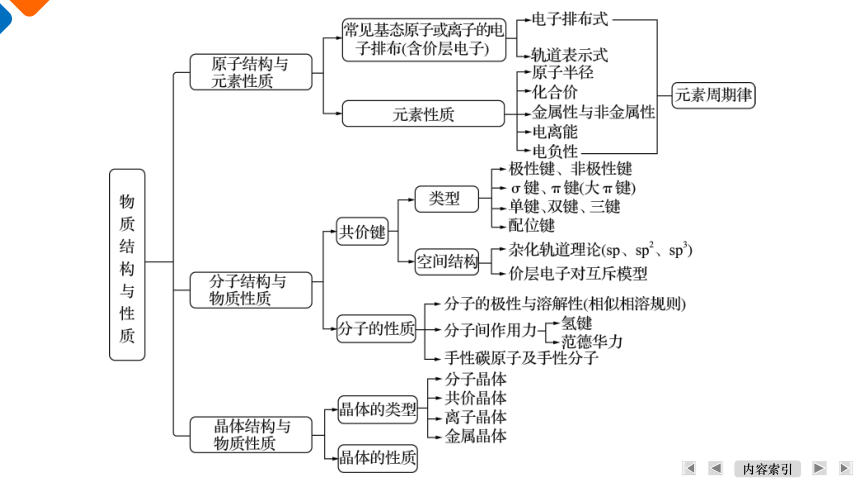
核心1 物质的结构、性质 元素周期律
1 几种基态原子或离子常见的表示方法
表示方法 举例
电子排布式 Co2+:__________________________________
Ge:________________________________________
S2-:_____________________________
Cu:__________________________________
价电子排布式 Fe:_______________
Ge:_______________
1s22s22p63s23p63d7或[Ar]3d7
1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2
1s22s22p63s23p6或[Ne]3s23p6
1s22s22p63s23p63d104s1或[Ar]3d104s1
3d64s2
4s24p2
表示方法 举例
电子排布图 (或轨道表示式)
O:______________________________
价电子排布图
Fe:_____________________________
特别提醒 ①基态原子核外电子运动状态数与核外电子数相等;基态原子核外电子空间运动状态即占据的轨道数。
②能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量_______。如24Cr的基态原子的电子排布式为_______________________,而不是1s22s22p63s23p63d44s2。
③金属原子失去电子时先失去最外层电子,如Fe2+为1s22s22p63s23p63d6 (失去4s轨道2个电子)。)
较低
1s22s22p63s23p63d54s1
同周期元素从左到右,第一电离能总体呈______趋势,但_______、_______两族反常,高于相邻主族元素;如第三周期Si、P、S元素第一电离能大小为__________。
2 元素周期律
(1) 第一电离能
1~36号元素的第一电离能
增大
ⅡA
ⅤA
P>S>Si
(2) 电负性(苏教版教材)
主族元素的电负性
两种元素形成共价键时,电负性强的带负电荷,显负价;电负性弱的带正电荷,显正价;反之亦成立。如电负性:Cl>N>H,NH3中氮为________价,NCl3中氮为________价。
-3
+3
核心2 分子空间结构与性质
1 杂化与分子结构判断
(1) 根据中心原子价层电子对数(杂化轨道数目)判断
对于ABm型分子(A是中心原子,B是配位原子),分子的价电子对数可以通过下式确定:
其中,中心原子的价电子数等于中心原子的最外层电子数,配位原子中卤素原子、氢原子提供1个价电子,氧原子和硫原子按不提供价电子计算。
价层电子对数 2 3 4
杂化类型 sp sp2 sp3
(2) 根据分子空间结构判断
空间结构 直线形 平面三角形 四面体形
杂化类型 ________ __________ __________
sp
sp2
sp3
2 价层电子对互斥模型判断分子或离子的空间结构
价层电 子对数 电子对的 排列方式 VSEPR 模型 分子类型 ABm 分子或离子
的空间结构
2 ______ AB2 __________
3 __________ AB3 ___________
AB2 ____
4 __________ AB4 __________
AB3 ________
AB2 ____
直线形
直线形
平面三角形
平面三角形
V形
正四面体形
正四面体形
三角锥形
V形
3 键角大小的判断方法
(2) 结构相似,中心原子不同时,看中心原子的电负性:中心原子的电负性越大,成键电子对越靠近中心原子,成键电子对排斥力________,键角________。如键角:NH3______PH3______AsH3;H2O______H2S______H2Se。
越大
越小
>
>
<
越大
越大
>
>
>
>
(3) 中心原子及孤电子对数相同,配位原子不同且结构相似——看配位原子的电负性:配位原子电负性越大,成键电子对越偏离中心原子,成键电子对排斥力________,键角________。如键角:NF3______NCl3 ______NBr3;NF3______NH3;OF2______H2O。
越小
越小
<
<
<
<
4★ 氢键 氢键对物质物理性质的影响
(1) 氢键形成及表示方法
氢键是除范德华力之外的另一种分子间作用力,它是由已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间形成的作用力。
X—H…Y—
(X、Y为N、O、F,“—”表示共价键,“…”表示形成的氢键)
(2) 氢键对物质物理性质的影响
图示氢键 对物质性质的影响 举例
HF分子间的氢键 以分子间氢键缔合 而成的二聚体结构 分子间氢 键使物质 沸点较高 沸点:NH3______PH3、
C2H5OH______CH3OCH3
分子内氢 键使物质 沸点较低 沸点:
CH3COOH______HNO3
>
>
>
图示氢键 对物质性质的影响 举例
形成分子内氢键 使物质易 溶于水 NH3、C2H5OH、H2O2、CH3COOH等易溶于水
解释一些 特殊现象 水结冰后,体积膨胀并漂浮在水面上
(水分子间形成氢键,体积变大,密度变小)。
水蒸气形成(H2O)n, 相对分子质量偏大
5 极性分子与非极性分子
(1) H2O2结构中氧原子为sp3杂化,形成如图所示结构。H2O2为__________(填“极性分子”或“非极性分子”,下同)。
极性分子
(2) O3结构类似SO2,中心氧原子为sp2杂化,与另外2个氧原子形成V形结构分子,为____________。
(3) 白磷(P4)为正四面体结构,为______________。
(4) 甲烷为正四面体结构,为____________;CH3Cl为四面体(不是正四面体)结构,为__________。
极性分子
非极性分子
非极性分子
极性分子
核心3 晶体类型和性质
1 常见典型晶体的晶胞结构图及其主要性质
化学式 晶胞 晶体类型 微粒间作用力 熔、沸点 配位数
CO2 _________ ____________ ____________ 较低 ________
H2O (冰) _________ ____________ ____________ 较低 —
分子晶体
分子间作用
力(范德华力)
12
分子晶体
范德华力和氢键
化学式 晶胞 晶体类型 微粒间作用力 熔、沸点 配位数
NaCl __________ __________ 较高 ______
CsCl __________ __________ 较高 ______
离子晶体
离子键
6
离子晶体
共价键
8
化学式 晶胞 晶体类型 微粒间作用力 熔、沸点 配位数
C(金 刚石) __________ __________ 很高 —
SiO2 __________ __________ 高 —
共价晶体
共价键
共价晶体
共价键
2 晶胞中微粒数目的计算方法——均摊法
石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)被三个六边形共有,每个六边形占______个碳原子。
2
3 分子晶体熔、沸点的比较
(1) 组成和结构相似的分子晶体,分子间作用力越大,物质的熔、沸点越高。具有分子间氢键的分子晶体,熔、沸点反常地高。如H2O、H2S、H2Se、H2Te熔、沸点高低顺序为___________________________;C2H5OH、CH3OCH3熔、沸点高低顺序为________________________;烃、卤代烃、醇、醛、羧酸等有机物一般随着分子里碳原子数增加,熔、沸点________。
(2) 组成和结构不相似的物质(相对分子质量相近),分子极性________,其熔、沸点就________。如熔、沸点:CO______N2。
H2O>H2Te>H2Se>H2S
C2H5OH>CH3OCH3
增大
越大
越高
>
(3) 同分异构体:链烃及其衍生物的同分异构体随着支链________,熔、沸点________。如CH3(CH2)3 CH3(正戊烷)______CH3CH2CH(CH3)2 (异戊烷)______(CH3)4C(新戊烷)。
增多
降低
>
>
检 测 反 馈
2
4
1
3
1 [2024苏州期初]N、P、As位于元素周期表中ⅤA族。下列说法正确的是( )
A. 半径大小:r(N)>r(P)>r(As)
B. 电离能大小:I1(N)C. 沸点大小:NH3D. 酸性强弱:HNO3>H3PO4>H3AsO4
5
D
2
4
1
3
【解析】 原子半径r(N)<r(P)<r(As),A错误;N、P、As的电子层数逐渐增多,失去电子的能力增强,则I1(N)>I1(P)>I1(As),B错误;NH3分子间有氢键,所以NH3的沸点比PH3、AsH3的高,C错误;非金属性N>P>As,则最高价氧化物对应的水化物的酸性HNO3>H3PO4>H3AsO4,D正确。
5
2
4
1
3
2 X、Y、Z、M、N均为短周期主族元素,原子序数依次增大。X是宇宙中含量最高的元素,YX3分子呈三角锥形,Z的价电子排布式为nsnnpn+2,五种元素中M的电负性最小,N的最高价含氧酸的酸性最强。下列说法正确的是( )
5
C
2
4
1
3
5
2
4
3
1
3 [2025泰州中学调研]下列说法正确的是( )
A. 如图所示是Cu2S晶胞中S2-位置,则1个晶胞中含有8个Cu+
B. 基态Cu+转化为基态Cu原子,得到的电子填充在3d轨道上
C. H2S和SO2的中心S原子都采取sp3杂化
D. SO2的键角比SO3的键角大
5
A
2
4
3
1
5
2
4
3
1
4 [2024盐城、南京期末]利用铜—铈氧化物(xCuO·yCeO2,Ce是活泼金属)催化氧化除去H2中少量CO,总反应为2CO(g)+O2(g)===2CO2(g) ΔH,反应机理如图所示。下列说法正确的是( )
5
D
2
4
3
1
5
2
3
1
5
4
范德华力和氢键(或分子间作用力)
2
3
1
【答案】 或
5
4
2
3
1
(2) [2024苏州期初]V2O5作催化剂,NH3将NO还原为N2的一种反应历程如图所示。V2O5与H2O形成能提供质子的酸性位,NH3以“氢键”形式吸附在酸性位上生成“中间体X”,NO与X反应生成不稳定的“过渡态”物质,随后分解生成N2和H2O。“中间体X”的结构式可表示为
______________。
5
4
2
3
1
5
4
谢谢观看
Thank you for watching
主题1
物质的结构与性质
微主题1 物质的结构、性质 元素
周期律
内容索引
核心串讲
体系建构
名卷优选
基础回归
检测反馈
基 础 回 归
1 分别写出基态Zn2+、V、Fe3+、Cu、As的简化电子排布式:________________________________________________________;
写出基态C的轨道表示式:______________________;写出基态Cu
的价电子轨道表示式:______________________。
[Ar]3d10、[Ar]3d34s2、[Ar]3d5、[Ar]3d104s1、[Ar]3d104s24p3
2 某晶胞如图所示。
写出该物质的化学式:_____________。Y原子的配位数为______。
XY或YX
6
3 比较下列物质的熔、沸点。
(1) CCl4______CH4。
(2) H2O______H2S。
(3) NaCl______MgCl2。
>
>
<
>
【解析】 (1)(2)(4)中的物质为分子晶体。(1) CCl4的相对分子质量大,范德华力强,熔、沸点高。(2) 水形成分子间氢键,熔、沸点高。(3) NaCl、MgCl2为离子晶体,镁离子半径小,所带电荷多,晶格能大,熔、沸点高。(4) 前者可形成分子间氢键,后者形成分子内氢键,故后者熔、沸点低。
4 根据电负性判断ICl水解产物:______________。
【解析】 电负性Cl>I,ICl中Cl带负电性,I带正电性;水中氢原子带正电性,氧带负电性,故相异电荷吸引结合得到HCl和HIO。
HIO、HCl
5 SO2与SO3中硫原子杂化方式分别为___________;微粒空间结构分别为____________________;键角大小为_____________。
【解析】 SO2与SO3均为sp2杂化,SO2中硫原子有一个孤电子对,SO3中硫原子电子全部参与成键,孤电子对斥力大于成键电子对,故SO3键角大于SO2。
sp2、sp2
V形、平面三角形
SO3>SO2
体 系 建 构
名 卷 优 选
考向1 原子结构与元素性质 元素周期律
1 (1) [2022江苏卷改编]基态锗原子(32Ge)的价电子排布式为__________。
(2) [2021江苏第二次适应性考试]基态Mn2+的电子排布式为_______________________________。
4s24p2
1s22s22p63s23p63d5或[Ar]3d5
2 (1) [2023江苏卷改编]C、Si、Ge位于元素周期表中ⅣA族。原子半径大小顺序为____________;第一电离能大小顺序为_____________。
(2) [2023江苏卷]电负性大小:χ(F) ______χ(O)。
(3) [2020江苏卷]C、N、O元素的第一电离能大小顺序为________。
C
>
N>O>C
3 [2021江苏卷]前4周期主族元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,Y的周期序数与族序数相等,基态时Z原子3p原子轨道上有5个电子,W与Z处于同一主族。下列说法正确的是( )
A. 原子半径:r(X)
C. Y的最高价氧化物对应的水化物的酸性比Z的强
D. Z的简单气态氢化物的热稳定性比W的弱
B
【解析】 由题意知X、Y、Z、W分别为N、Al、Cl、Br。同一周期主族元素原子半径依次减小,铝原子半径大于氯,A错误;氮元素原子最外层p轨道为半满的稳定结构,第一电离能大于同周期相邻元素,B正确;非金属性Al
考向2 分子结构与性质
4 (1) [2024江苏卷改编]石墨转化为金刚石,碳原子轨道的杂化类型变化为____________________。
由sp2转变为sp3
sp3、sp3
sp3、sp2
7
5 (1) [2024江苏卷改编]丁烷催化裂化为乙烷和乙烯,丁烷断裂________(填“σ键”或“π键”)。
σ键
1
16
【解析】 (3) 氨气分子中氮原子与3个氢原子形成3个σ键,与锌离子形成配位键,也是σ键,故1 mol [Zn(NH3)4]Cl2中含有σ键的物质的量为(3+1)×4 mol=16 mol。
<
<
V形
平面三角形
不能
易溶于水
乙醇分子间存在
氢键
【解析】 H4V4O12具有八元环结构,根据价态规律可以得出八元环应由4个V和4个O构成; 化合物中V为+5价,形成5个共用电子对,每个V在环上与O形成2个共用电子对,还与另外两个氧分别形成双键和单键。
8 [2023江苏卷]已知H4V4O12具有八元环结构,其结构式可表示为
___________________________。
或
考向3 晶体结构与性质
9 判断下列说法是否正确,并说明原因。
(1) [2023江苏卷]碳单质、晶体硅、SiC均为共价晶体。
_____________________________________________________________________________________。
(2) [2022江苏卷]ⅣA族元素单质的晶体类型相同。
________________________________________________________________________________。
错误,碳单质有多种同素异形体,金刚石为共价晶体,C60为分子晶体,石墨为混合型晶体
错误,ⅣA族元素中碳有多种单质,有分子晶体、共价晶体等,锡、铅单质为金属晶体
(3) [2023江苏卷]H2O分子之间形成氢键,得出H2O(g)的热稳定性比H2S(g)的高。
________________________________________________________________________________________________。
错误,H2O分子之间形成氢键主要影响其熔、沸点等物理性质,热稳定性是化学性质,与非金属性有关
10 (1) [2024江苏卷]铁酸铋晶胞如图所示(图中有4个Fe原子位于晶胞体对角线上,O原子未画出),其中原子数目比N(Fe)∶N(Bi)=_________。
(2) [2021江苏卷]AgI晶胞(如图)中含有______个I-。
2∶1
4
4
【答案】
考向4 化学用语
12 [2024江苏卷]反应PbS+4H2O2===PbSO4+4H2O可用于壁画修复。下列说法正确的是( )
C
考向5 物质结构与性质综合
CN—NHD和DCOO-
(1) 电负性不同的元素形成共用电子对,电负性强的元素带________ (填“负电荷”和“正电荷”)。
(2) Fe、O、H电负性大小关系为____________。
负电荷
O>H>Fe
在催化剂表面吸附在O2-和Fe2+上的氢原子分别带有_____________ _______ (填“负电荷”和“正电荷”)。
(3) Fe2+上的氢原子用“H*”表示,则生成水和甲酸根的化学式分别为______________________。
正电荷、负
电荷
HH*O、HCOO-
15 [2021江苏卷]利用铜—铈氧化物(xCuO·yCeO2,Ce是活泼金属)催化氧化可除去H2中少量CO,催化氧化过程中Cu、Ce的化合价均发生变化,可能机理如图1所示。将n(CO)∶n(O2)∶n(H2)∶n(N2)=1∶1∶ 49∶49的混合气体以一定流速通过装有xCuO·yCeO2催化剂的反应器,CO的转化率随温度变化的曲线如图2所示。
图1
图2
【解析】 共价化合物中元素形成极性键(共用电子对)的数目是该元素化合价的数值。基态Ce原子核外电子排布式为[Xe]4f15d16s2,价电子全部与氧原子形成4个共用电子对,表现为+4价。步骤(ⅰ)中失去1个氧原子,铜和铈均减少1个共用电子对,化合价均降低1,故铜的化合价由+2变为+1,铈的化合价由+4变为+3。
(1) 基态Ce原子核外电子排布式为[Xe]4f15d16s2,图2所示机理的步骤(ⅰ)中,元素Cu、Ce化合价发生的变化为_______________________ _____________________。
(2) 当催化氧化温度超过150 ℃时,催化剂的催化活性下降,其可能原因是______________________________________________________。
铜由+2价变为+1价,
铈由+4价变为+3价
高温下,Cu(Ⅱ)或Cu(Ⅰ)被H2(或CO)还原为Cu
考向1 原子结构与元素性质 元素周期律
1 书写基态粒子的电子排布式(价电子排布式)。电离能、电负性大小比较。
(1) [2024南京调研]基态Mn2+的价电子排布式为__________。
(2) [2024扬州期末]基态Ga的电子排布式为___________________。
(3) [2023南通通州月考]比较B、C、Al的第一电离能:__________。
3d5
[Ar]3d104s24p1
C>B>Al
(4) [2022常州前黄中学、溧阳中学联考]A、B、C、D为短周期的四种元素,原子序数依次增大。A、B、D三种元素分别位于不同短周期的不同主族。C、D对应的简单离子核外电子排布相同,A、B、C、D元素可形成一种新型漂白剂,结构如下:
四种元素电负性大小顺序为__________________(用元素符号由大到小排列)。
O>H>B>Mg
(5) [2024南京调研改编]硼碳氮(BCN)材料可用作耐磨涂层。成分中三种元素原子半径大小顺序为______________;三种元素最高价氧化物的水化物的酸性由强到弱的顺序为____________________________ (用分子式表示)。
B>C>N
HNO3>H2CO3>H3BO3
【解析】 (1) 第四周期过渡元素的价电子指3d和4s轨道上的电子,主族元素的价电子指最外层电子。(3) 同周期主族元素从左到右第一电离能有增大趋势,ⅡA族的第一电离能大于ⅢA族的,碳为ⅣA族,电离能无特殊性,同族元素,上一周期的第一电离能大于下一周期,则I1(C)>I1(B)>I1(Al)。(4) A、B、D三种元素分别位于不同短周期的不同主族,则A为氢,B位于第二周期,D位于第三周期,结合新型漂白剂的结构分析,D形成+2价阳离子,说明D为镁元素,B形成四个共价键,且所形成的阴离子带两个负电荷,则B为硼元素,C形成两个共价键,则C为氧元素。非金属元素的电负性大于金属元素的电负性,同周期主族元素越靠右电负性越大,氢的电负性在O和B之间,电负性的顺序为O>H>B>Mg。(5) 非金属性N>C>B,故酸性HNO3>H2CO3>H3BO3。
考向2 分子结构与性质
2 关于共价键类型和数目判断,分子空间结构判断,分子性质对溶解性、熔沸点影响的考查。
(1) [2024苏北八市三模]1 mol SiO2晶体中含有Si—O σ键的数目为______mol。
4
16∶1
sp3、sp2
1
正四面体形
四面体形
可能
(9) [2023连云港期中]H2S分子和H2O分子中的键角更大的是
_________。
(10) [2024南京调研]室温下,在水中A的溶解度比B的______(填“大”“小”或“无差别”)。
H2O
大
NH3分子间可形成氢键
_______________________________________________。
或
考向3 晶体结构与性质
3 关于晶胞中原子数目、配位数及位置判断。
(1) [2024南京调研]一种成分的晶胞结构如图所示,每个O2-周围紧邻的Cu2+的个数为______。
(2) [2024苏锡常镇二模]净化时生成的CaF2沉淀晶胞结构如图所示。在CaF2晶胞中F-周围距离最近的Ca2+形成的空隙结构为___________。
4
正四面体
(3) [2024苏北八市三模]充电时,Li+脱嵌形成Li1-xFePO4(0
(4) [2024南京二模]β-FeSO4的晶胞沿c轴(c轴垂直于a、b轴)方向投影的平面图如图所示,其中硫原子的杂化方式为_______;已知该晶胞中S原子的数目为4,试预测Fe2+是否占据该晶胞的所有顶点、面心和体心,并说明理由:_______________________________________________
____________________________________________________________________________。
sp3
考向4 化学用语
4 [2024苏州期初]反应CaSO4+2NH3+CO2+H2O===CaCO3+(NH4)2SO4可制备硫酸铵晶体。下列说法正确的是( )
A
考向5 物质结构与性质综合
5 [2024苏州期末]压强0.7 MPa、温度370
℃下,化合物WS2催化反应H2S+CH3OH===
H2O+CH3SH可用于制备甲硫醇。下列说法正
确的是( )
B
6 (1) [2024南通一模]α-FeOOH在环境保护等领域有广泛应用。
①α-FeOOH的结构中,每个Fe(Ⅲ)与羟基氧和非羟基氧构成了FeO3(OH)3八面体,相同环境的氧原子之间构成正三角形。请补充完整该八面体的结构。
【答案】 或
②α-FeOOH可用于脱除烟气中的H2S。脱硫、再生过程中可能的物种变化如图甲所示。生成的S8(结构如图乙所示)覆盖在α-FeOOH的表面。
甲 乙
工业可使用四氯乙烯(C2Cl4)溶解S8并实现与α-FeOOH分离。四氯乙烯能溶解S8的原因是_____________________________________________ ________。部分环状分子(如苯)中由于存在大π键,增强了分子的稳定性。S8分子中不能形成大π键的原因是______________________________ _________________________。
四氯乙烯与S8都是非极性分子,符合“相似相溶”
规则
S8中S原子采取sp3杂化,无剩
余的p轨道用于形成π键
(2) [2024苏北七市二模]在“Cu0/Cu+双位点”催化作用下,CH3OH与水反应的反应路径如图所示,画出图中方框内中间体的结构:
__________。
核 心 串 讲
核心1 物质的结构、性质 元素周期律
1 几种基态原子或离子常见的表示方法
表示方法 举例
电子排布式 Co2+:__________________________________
Ge:________________________________________
S2-:_____________________________
Cu:__________________________________
价电子排布式 Fe:_______________
Ge:_______________
1s22s22p63s23p63d7或[Ar]3d7
1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2
1s22s22p63s23p6或[Ne]3s23p6
1s22s22p63s23p63d104s1或[Ar]3d104s1
3d64s2
4s24p2
表示方法 举例
电子排布图 (或轨道表示式)
O:______________________________
价电子排布图
Fe:_____________________________
特别提醒 ①基态原子核外电子运动状态数与核外电子数相等;基态原子核外电子空间运动状态即占据的轨道数。
②能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量_______。如24Cr的基态原子的电子排布式为_______________________,而不是1s22s22p63s23p63d44s2。
③金属原子失去电子时先失去最外层电子,如Fe2+为1s22s22p63s23p63d6 (失去4s轨道2个电子)。)
较低
1s22s22p63s23p63d54s1
同周期元素从左到右,第一电离能总体呈______趋势,但_______、_______两族反常,高于相邻主族元素;如第三周期Si、P、S元素第一电离能大小为__________。
2 元素周期律
(1) 第一电离能
1~36号元素的第一电离能
增大
ⅡA
ⅤA
P>S>Si
(2) 电负性(苏教版教材)
主族元素的电负性
两种元素形成共价键时,电负性强的带负电荷,显负价;电负性弱的带正电荷,显正价;反之亦成立。如电负性:Cl>N>H,NH3中氮为________价,NCl3中氮为________价。
-3
+3
核心2 分子空间结构与性质
1 杂化与分子结构判断
(1) 根据中心原子价层电子对数(杂化轨道数目)判断
对于ABm型分子(A是中心原子,B是配位原子),分子的价电子对数可以通过下式确定:
其中,中心原子的价电子数等于中心原子的最外层电子数,配位原子中卤素原子、氢原子提供1个价电子,氧原子和硫原子按不提供价电子计算。
价层电子对数 2 3 4
杂化类型 sp sp2 sp3
(2) 根据分子空间结构判断
空间结构 直线形 平面三角形 四面体形
杂化类型 ________ __________ __________
sp
sp2
sp3
2 价层电子对互斥模型判断分子或离子的空间结构
价层电 子对数 电子对的 排列方式 VSEPR 模型 分子类型 ABm 分子或离子
的空间结构
2 ______ AB2 __________
3 __________ AB3 ___________
AB2 ____
4 __________ AB4 __________
AB3 ________
AB2 ____
直线形
直线形
平面三角形
平面三角形
V形
正四面体形
正四面体形
三角锥形
V形
3 键角大小的判断方法
(2) 结构相似,中心原子不同时,看中心原子的电负性:中心原子的电负性越大,成键电子对越靠近中心原子,成键电子对排斥力________,键角________。如键角:NH3______PH3______AsH3;H2O______H2S______H2Se。
越大
越小
>
>
<
越大
越大
>
>
>
>
(3) 中心原子及孤电子对数相同,配位原子不同且结构相似——看配位原子的电负性:配位原子电负性越大,成键电子对越偏离中心原子,成键电子对排斥力________,键角________。如键角:NF3______NCl3 ______NBr3;NF3______NH3;OF2______H2O。
越小
越小
<
<
<
<
4★ 氢键 氢键对物质物理性质的影响
(1) 氢键形成及表示方法
氢键是除范德华力之外的另一种分子间作用力,它是由已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间形成的作用力。
X—H…Y—
(X、Y为N、O、F,“—”表示共价键,“…”表示形成的氢键)
(2) 氢键对物质物理性质的影响
图示氢键 对物质性质的影响 举例
HF分子间的氢键 以分子间氢键缔合 而成的二聚体结构 分子间氢 键使物质 沸点较高 沸点:NH3______PH3、
C2H5OH______CH3OCH3
分子内氢 键使物质 沸点较低 沸点:
CH3COOH______HNO3
>
>
>
图示氢键 对物质性质的影响 举例
形成分子内氢键 使物质易 溶于水 NH3、C2H5OH、H2O2、CH3COOH等易溶于水
解释一些 特殊现象 水结冰后,体积膨胀并漂浮在水面上
(水分子间形成氢键,体积变大,密度变小)。
水蒸气形成(H2O)n, 相对分子质量偏大
5 极性分子与非极性分子
(1) H2O2结构中氧原子为sp3杂化,形成如图所示结构。H2O2为__________(填“极性分子”或“非极性分子”,下同)。
极性分子
(2) O3结构类似SO2,中心氧原子为sp2杂化,与另外2个氧原子形成V形结构分子,为____________。
(3) 白磷(P4)为正四面体结构,为______________。
(4) 甲烷为正四面体结构,为____________;CH3Cl为四面体(不是正四面体)结构,为__________。
极性分子
非极性分子
非极性分子
极性分子
核心3 晶体类型和性质
1 常见典型晶体的晶胞结构图及其主要性质
化学式 晶胞 晶体类型 微粒间作用力 熔、沸点 配位数
CO2 _________ ____________ ____________ 较低 ________
H2O (冰) _________ ____________ ____________ 较低 —
分子晶体
分子间作用
力(范德华力)
12
分子晶体
范德华力和氢键
化学式 晶胞 晶体类型 微粒间作用力 熔、沸点 配位数
NaCl __________ __________ 较高 ______
CsCl __________ __________ 较高 ______
离子晶体
离子键
6
离子晶体
共价键
8
化学式 晶胞 晶体类型 微粒间作用力 熔、沸点 配位数
C(金 刚石) __________ __________ 很高 —
SiO2 __________ __________ 高 —
共价晶体
共价键
共价晶体
共价键
2 晶胞中微粒数目的计算方法——均摊法
石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)被三个六边形共有,每个六边形占______个碳原子。
2
3 分子晶体熔、沸点的比较
(1) 组成和结构相似的分子晶体,分子间作用力越大,物质的熔、沸点越高。具有分子间氢键的分子晶体,熔、沸点反常地高。如H2O、H2S、H2Se、H2Te熔、沸点高低顺序为___________________________;C2H5OH、CH3OCH3熔、沸点高低顺序为________________________;烃、卤代烃、醇、醛、羧酸等有机物一般随着分子里碳原子数增加,熔、沸点________。
(2) 组成和结构不相似的物质(相对分子质量相近),分子极性________,其熔、沸点就________。如熔、沸点:CO______N2。
H2O>H2Te>H2Se>H2S
C2H5OH>CH3OCH3
增大
越大
越高
>
(3) 同分异构体:链烃及其衍生物的同分异构体随着支链________,熔、沸点________。如CH3(CH2)3 CH3(正戊烷)______CH3CH2CH(CH3)2 (异戊烷)______(CH3)4C(新戊烷)。
增多
降低
>
>
检 测 反 馈
2
4
1
3
1 [2024苏州期初]N、P、As位于元素周期表中ⅤA族。下列说法正确的是( )
A. 半径大小:r(N)>r(P)>r(As)
B. 电离能大小:I1(N)
5
D
2
4
1
3
【解析】 原子半径r(N)<r(P)<r(As),A错误;N、P、As的电子层数逐渐增多,失去电子的能力增强,则I1(N)>I1(P)>I1(As),B错误;NH3分子间有氢键,所以NH3的沸点比PH3、AsH3的高,C错误;非金属性N>P>As,则最高价氧化物对应的水化物的酸性HNO3>H3PO4>H3AsO4,D正确。
5
2
4
1
3
2 X、Y、Z、M、N均为短周期主族元素,原子序数依次增大。X是宇宙中含量最高的元素,YX3分子呈三角锥形,Z的价电子排布式为nsnnpn+2,五种元素中M的电负性最小,N的最高价含氧酸的酸性最强。下列说法正确的是( )
5
C
2
4
1
3
5
2
4
3
1
3 [2025泰州中学调研]下列说法正确的是( )
A. 如图所示是Cu2S晶胞中S2-位置,则1个晶胞中含有8个Cu+
B. 基态Cu+转化为基态Cu原子,得到的电子填充在3d轨道上
C. H2S和SO2的中心S原子都采取sp3杂化
D. SO2的键角比SO3的键角大
5
A
2
4
3
1
5
2
4
3
1
4 [2024盐城、南京期末]利用铜—铈氧化物(xCuO·yCeO2,Ce是活泼金属)催化氧化除去H2中少量CO,总反应为2CO(g)+O2(g)===2CO2(g) ΔH,反应机理如图所示。下列说法正确的是( )
5
D
2
4
3
1
5
2
3
1
5
4
范德华力和氢键(或分子间作用力)
2
3
1
【答案】 或
5
4
2
3
1
(2) [2024苏州期初]V2O5作催化剂,NH3将NO还原为N2的一种反应历程如图所示。V2O5与H2O形成能提供质子的酸性位,NH3以“氢键”形式吸附在酸性位上生成“中间体X”,NO与X反应生成不稳定的“过渡态”物质,随后分解生成N2和H2O。“中间体X”的结构式可表示为
______________。
5
4
2
3
1
5
4
谢谢观看
Thank you for watching
同课章节目录
