第二单元 物质结构研究的范式与方法 课件(66张) 2025年高中化学 选择性必修2 (苏教版2019)
文档属性
| 名称 | 第二单元 物质结构研究的范式与方法 课件(66张) 2025年高中化学 选择性必修2 (苏教版2019) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-23 10:00:44 | ||
图片预览











文档简介
(共66张PPT)
第二单元
物质结构研究的范式与方法
课
程 标
准 1.认识物质的空间结构可以借助某些实验手段来测定,通过这些
手段所获得的信息为建立物质结构模型或相关理论解释提供支
撑。
2.知道原子光谱、红外光谱、晶体X射线衍射等是测定物质结构
的基本方法和实验手段
目 录
1、基础知识·准落实
2、教学效果·勤检测
3、学科素养·稳提升
基础知识·准落实
1
梳理归纳 高效学习
分点突破(一) 物质结构研究的范式
1. 归纳范式
(1)过程为“从 到 ”。根据事实进行概括归
纳,抽象出 ,上升为 。
个别
一般
共同点
本质规律
(2)实例
个别性质 一般规律
通过甲烷(CH4)、乙烷
(C2H6)、丙烷(C3H8)、丁烷
(C4H10)等的分子式 归纳出饱和链状烷烃的通式为
通过比较1~20号元素的原子核外
电子排布来认识前20号元素对应
原子结构的不同 归纳出元素的原子核外电子排布
规律,并从结构上解释了同族元
素性质相似的原因
C n H2 n+2
个别性质 一般规律
通过研究含有双键和三键不饱和
烃的加成反应和氧化反应,发现
不饱和键具有不稳定的性质 根据结构与性质的关系归纳得出
这类有机物的通性:易发生
反应和 反应
2. 演绎范式
(1)过程通常为“从 到 ”。是从某个一般结论
出发,向从属于这一结论的 进行推理的过程。
加
成
氧化
一般
个别
多个要素
(2)实例
一般规律 个别性质
门捷列夫建立了元
素周期表 人们发现了“类铝”(镓),“类硼”
(钪),“类硅”(锗)
根据钠原子最外电
子层上1个电子极易
失去表现出强还原
性的特点 推出同族半径更大的钾、铷、铯元素具有更强
的还原性
一般规律 个别性质
水是极性较强的分
子,水分子之间存
在较强的氢键,水
分子既可为生成氢
键提供H,又有孤
电子对接受H CH3CH2OH、CH3COOH等能为生成氢键提供和
接受H的溶质分子,极性与水相似,均可通过氢
键和水结合,在水中溶解度较大;碳氢化合物
极性较小,也难以和水形成氢键,在水中溶解
度很小。这就是著名的“相似相溶规则”
3. 归纳与演绎的关系
(1)从科学研究的途径来看,一般为先归纳、后演绎。“实验—
假说—理论—新实验”的过程,本质上就是从个别到一般,
再到个别的过程。
(2)归纳需要演绎作指导,以解决归纳研究的目的性、方向性
和结果的正确性问题;而演绎需要归纳提供前提。在演绎
的指导下归纳,在归纳的基础上演绎,两者互相联系、互
为前提。
1. 根据CO2、SO2、SO3与碱、水均反应的性质,得出酸性氧化物的通
性,然后预测酸性氧化物SiO2也能与上述两种物质反应,以下说法
错误的是( )
A. 酸性氧化物通性的得出运用的是归纳范式
B. SiO2能与碱、水两种物质反应
C. 预测酸性氧化物SiO2的性质运用的是演绎范式
D. 运用演绎范式预测得出的结论不一定完全正确
解析: SiO2不溶于水,与水不反应,B项错误。
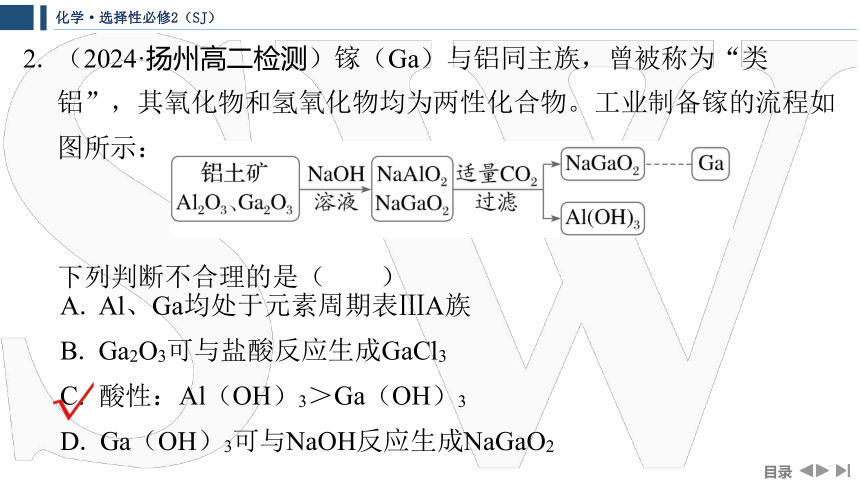
2. (2024·扬州高二检测)镓(Ga)与铝同主族,曾被称为“类
铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如
图所示:
下列判断不合理的是( )
A. Al、Ga均处于元素周期表ⅢA族
B. Ga2O3可与盐酸反应生成GaCl3
C. 酸性:Al(OH)3>Ga(OH)3
D. Ga(OH)3可与NaOH反应生成NaGaO2
解析: Al与Ga同族,均处于元素周期表ⅢA族,A正确;Ga2O3
与Al2O3性质具有相似性,可与盐酸反应生成GaCl3,B正确;化学
反应遵循较强酸制较弱酸的原理,在NaGaO2和NaAlO2的混合溶液
里通入二氧化碳,只有Al(OH)3沉淀,而没有Ga(OH)3沉淀,
可能的原因是镓酸酸性强于碳酸,酸性:Al(OH)3<Ga(OH)
3,C错误;Ga(OH)3与Al(OH)3的性质相似,都是两性氢氧化
物,可与NaOH反应生成NaGaO2,D正确。
3. 利用归纳范式得通式。
(1)如图为一种无限长单链状结构的多硼酸根离子,其化学式
为 (用 n 表示)。
[BO2
(2)分析下表中各项的排布规律,按此规律排布第26项应
为 。
1 2 3 4 5
C2H4 C2H6 C2H6O C2H4O2 C3H6
6 7 8 9 10
C3H8 C3H8O C3H6O2 C4H8 C4H10
解析:由表中信息可知,循环顺序为C n H2 n 、C n H2 n+
2、C n H2 n+2O、C n H2 n O2,26=4×6+2,则第24项为
C7H14O2,第25项为C8H16,第26项为C8H18。
C8H18
分点突破(二) 物质结构研究的方法
1. 科学假设和论证
(1)研究问题的步骤
(2)建立理论
理论是建立在大量的 基础之上并为实验所
的解释。
观察
证实
(3)修正理论
当反常现象大量出现,而原有理论又不能很好地作出解释
时,就需对原有理论加以修改,甚至需要提出新的理论。
(4)科学假设与论证
假设是人们关于某一事物或现象的一种理性推测,假设需要
实验进行验证,经实验证明正确的假设还需通过建立理论来
将这些知识组织起来,使之成为知识体系。
2. 实验方法
化学是一门以实验为基础的学科,人们往往需要借助实验观测的事
实对假设的正确与否进行检验。
3. 模型方法
(1)含义
科学家需要运用一定的 对实验结果
进行处理。模型既可以是对原型的
,也可以是结合某种理论形态下建立的 。
逻辑推理与模型思维
简化和纯化、抽象和近
似
思维模型
(2)分类
分类 实物模型 微观结构模型
含义 可观察到
的物体的
宏观模型 物质的微观层次结构,难以直接观察到,需要通
过思维加工使 的微观世界以
的形式展现出来
实例 如汽车模
型、飞机
模型和建
筑模型等 如原子结构模型、离子键模型、共价键模型和氢
键模型,有机化合物的分子结构模型等
抽象
可视化
(3)意义
①对沟通科学现象与其本质的认识过程,起到重要的桥梁
作用。
②利用模型深刻地认识物质的微观结构特点,揭示结构与性
质的关系,是模型研究的重要功能。
阴极射线的发现、α粒子散射实验、氢原子光谱的发现和研究,对
揭示原子内部结构的奥秘具有极为重要的作用。道尔顿、汤姆生、卢
瑟福、玻尔等人提出的原子结构模型对人类探索物质结构作出了巨大
贡献。
【交流讨论】
1. 人们借助实验观测的事实对假设的正确与否进行检验时用到了哪些
仪器和手段?
提示:显微红外光谱仪、电子显微镜、原子吸收分光光度计、X射
线衍射仪等。
2. 根据以下信息,思考以下模型是哪类模型?
提示:黄鹤楼模型为实物模型,青蒿素分子模型为微观结构模型。
3. 如何认识模型方法?
提示:模型既可以是对原型的简化和纯化、抽象和近似,也可以是
结合某种理论形态下建立的思维模型。模型研究对科学家探索物质
的微观结构具有非常重要的意义。
1. (2024·扬州高二检测)在探索微观世界的过程中,科学家们常通
过提出假说来把握物质的结构及特点,不断拓展认识的新领域。关
于假说,有如下表述,其中正确的是( )
A. 假说是对现实中已知事物或现象的一种简化处理
B. 假说是根据已知的科学事实和原理对未知领域的事物或现象的本
质提出的一种推测
C. 假说是对一个问题的所有幻想和假定
D. 假说最终都可以变成科学理论
解析: 假说是科学家以事物或现象和科学理论为依据,对未知
领域的事物或现象提出的一种推测。A、C、D错误,B正确。
2. (2024·徐州高二检测)化学中的模型有助于我们形成化学学科的
思想和方法,其中,实物模型是依靠物质的基本形态所做的模仿。
下列属于实物模型的是( )
A 卢瑟福原子结构模型
B CH4分子的结构模型
C 氧化汞受热分解示意图
D 接触法制硫酸示意图
解析: 原子结构模型属于微观结构模型;分子结构模型属于微
观结构模型;从微观分析化学变化,属于微观结构模型;接触法制
硫酸示意图是依靠实际物质所做,属于实物模型。
题后点拨
物质结构研究的方法
(1)借助科学仪器等物质手段。
(2)借助化学研究的方法:科学假设和论证、实验方法、模型方
法等。
教学效果·勤检测
2
强化技能 查缺补漏
1. 下列有关物质结构研究的范式说法正确的是( )
A. 由乙烯的性质推断丙烯的性质是归纳范式
B. 归纳范式和演绎范式是相辅相成的
C. 假说都是不科学的
D. 归纳的结果一定是正确的,不需要验证
解析: A. 由乙烯的性质推断丙烯的性质是从个别到个别,不是
归纳范式,错误;C. 假说具有一般性,可能是科学的,错误;D.
归纳的结果不一定是正确的,需要验证。
2. 原子结构模型经历了五个主要阶段:1803年实心球模型 1904
年“葡萄干面包”模型 1911年原子核式结构模型 1913年
轨道模型 20世纪初量子力学的原子结构模型。对轨道模型贡
献最大的科学家是( )
A. 汤姆生 B. 玻尔
C. 卢瑟福 D. 道尔顿
解析: 引入量子论观点,提出电子在一定轨道上运动的原子结
构模型。
3. 1909年,新西兰出生的物理学家——卢瑟福把一束变速运动的α粒
子(质量数为4的带2个正电荷的质子粒)射向一片极薄的金箔,他
惊奇地发现,过去一直认为原子是“实心球”,而由这种“实心
球”紧密排列而成的金箔,竟让大多数α粒子畅通无阻地通过,就
像金箔不在那儿似的,但也有极少量的α粒子发生偏转或被笔直地
弹回。
(1)根据以上实验现象能得出关于金箔中金原子结构的一些结
论,试写出其中的三点:
①原子中存在 ,且只占原子体积的很小一部分。
原子核
②金原子核带 电荷,且电荷数远大于α粒子的电荷数,两
者产生静电 作用。
③金原子的质量远 (填“大于”“小于”或“等
于”)α粒子的质量。
正
排斥
大于
解析: 大多数α粒子畅通无阻地通过极薄的金箔,证明原子不是实心的球体,内部有“广阔”的空间。有极少数α粒子被笔直地弹回,证明了原子核的存在,但占原子极小的体积,同时证明金原子核的质量远大于α粒子的质量,还能证明金原子核所带电荷种类与α粒子相同,否则两者就会相互吸引;又能证明金原子核所带电荷数远大于α粒子,否则偏转的就不会是α粒子,而是金原子核。
(2)这是利用了物质结构研究的什么方法? 。
解析:此方法是实验法。
实验法
学科素养·稳提升
3
内化知识 知能升华
题组一 物质结构研究的范式
1. 下列关于归纳范式的说法不正确的是( )
A. 归纳范式的过程为“从个别到一般”
B. 由相似相溶规则可推知乙醇易溶于水运用的是归纳法
C. 由甲烷、乙烷、丙烷等的性质可归纳出烷烃的性质
D. 归纳范式,就是根据事实进行概括归纳,抽象出共同点
解析:由相似相溶规则可推知乙醇易溶于水运用的是演绎范式。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
2. 下列物质研究的范式不属于演绎范式的是( )
A. 由乙烯、丙烯均能与Br2、HCl、H2发生加成反应得出烯烃能发生
加成反应
B. 在元素理论的指导下,人们于1875年发现了“类铝”(镓)
C. 利用酸的通性推知乙酸可与NaHCO3溶液发生反应
D. 利用元素周期律可推断出还原性:K>Na
解析: 由乙烯、丙烯均能与Br2、HCl、H2发生加成反应得出烯
烃能发生加成反应,运用的是归纳范式。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
3. (2024·宿迁高二检测)演绎范式是物质结构研究的常用范式,其
过程通常为“从一般到个别”。下列属于演绎范式的应用且结论正
确的是( )
A. 由元素周期律推测酸性强弱:HClO4>HBrO4
B. 由勒夏特列原理预测:其他条件不变,增大 c (O2),2SO2(g)
+O2(g) 2SO3(g)平衡体系中SO3的体积分数一定增大
C. 由第三周期元素性质的递变规律获得周期表中同周期元素性质的
变化规律
D. 由金属单质与盐溶液的置换反应获得金属活动性顺序
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析: 由元素周期律推测酸性强弱:HClO4>HBrO4,过程是
“从一般到个别”,属于演绎范式的应用,且结论正确,A项符合
题意;由勒夏特列原理预测化学平衡移动方向属于演绎范式的应
用,但是其他条件不变,增大体系中 c (O2),2SO2(g)+O2
(g) 2SO3(g)平衡体系中SO3的体积分数不一定增大,当投料
比 <2时,增大 c (O2),平衡时SO3的体积分数反而减
小,B项不符合题意;由第三周期元素性质的递变规律获得周期表
中同周期元素性质的变化规律,过程是“从个别到一般”,不属于
演绎范式的应用,C项不符合题意;由金属单质与盐溶液的置换反应获得金属活动性顺序,过程也是“从个别到一般”,不属于演绎范式的应用,D项不符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
4. (2024·连云港高二检测)嫦娥五号携带月壤样本成功返回地球,
月壤中含有Ti、3He、活性化合物等多种物质。下列相关说法正确
的是( )
A. 稀土元素单质均为不活泼的金属,主要用于电子、激光、军工等
行业和领域
B. 月壤中的某活性化合物有催化性能,推测此活性化合物可能含有
过渡元素
C. 嫦娥五号采用的纳米陶瓷铝合金是一种合金材料
D. 已知 He H He H+18.4MeV,该反应属于非氧化还原
反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析: 稀土元素为ⅢB族元素,其单质均为活泼金属,A错误;
某些过渡元素的单质或氧化物(如铁、钒的单质和氧化物)可作催
化剂,该活性化合物具有催化性能,因此推测该化合物中可能含有
过渡元素,B正确;纳米陶瓷铝合金是一种复合材料,C错误;该
反应不属于化学反应,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
题组二 物质结构研究的方法
5. 某同学想利用所学的知识去探究SO2的性质,设计了如下研究程
序,合理的是( )
A. 观察(得出SO2的物理性质)→分类(预测SO2的化学性质)→实
验(观察实验现象、验证预测)→比较并得出结论,对于异常现
象再预测,再实验,再验证
B. 分类(预测SO2的化学性质)→观察(得出SO2的物理性质)→实
验→比较并得出结论
C. 观察(得出SO2的物理性质)→实验→分类(预测SO2的化学性
质)→比较并得出结论
D. 实验→分类(预测SO2的化学性质)→观察(得出SO2的物理性
质)→比较并得出结论
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析: 探究SO2的性质时其基本程序是先从色、态方面观察二
氧化硫的外观,得出SO2的物理性质,然后根据二氧化硫可能具有
的性质,预测SO2的化学性质,再做实验验证预测,观察实验并记
录现象,分析实验现象并用已知化学知识解释现象,最后得出结
论,所以A项合理。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
6. (2024·苏州高二检测)“假说”在化学科学的研究和发展中起不
可替代的作用,但必须以已有的科学事实和理论为依据,更要用系
统的科学观察和实验来验证。下列“假说”在化学科学发展过程中
曾经起到一定的作用,从目前的化学理论看,仍然正确的是( )
A. 阿伦尼乌斯提出的假说:电解质在溶液中会自发离解成带电的粒子
B. 道尔顿提出的假说:元素的原子以其原子质量为特征,原子不可再分
C. 盖·吕萨克提出的假说:同温同压下,相同体积的不同气体含有相同数目的原子
D. 贝采里乌斯提出的假说:不同原子显不同电性,因而产生吸引力,由此形成化合物
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析: 阿伦尼乌斯提出的“电解质在溶液中会自发离解成带电
的粒子”与电解质的电离是相同的,即该理论科学,A正确;因质
子数决定元素的种类,则每一元素的原子以质子数为特征,则道尔
顿提出的“以其原子质量为其特征”不科学,B错误;在同温同压
下,相同体积的不同气体含有相同数目的分子,相同的分子数不一
定具有相同的原子数,则盖·吕萨克提出的理论不科学,C错误;因
原子不带电,带相反电荷的离子可构成化合物,则贝采里乌斯提出
的理论不科学,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
7. (2024·扬州高二检测)关于物质结构研究的范式与方法的说法错
误的是( )
A. 由ⅠA族和ⅦA族各元素性质总结同主族元素性质的递变规律是归
纳范式的运用
B. 依据核外电子排布规律书写某元素的原子结构示意图是演绎范式
的运用
C. 乙炔为直线形分子,其球棍模型为
D. 假说是根据已知的科学事实和原理对未知领域的事物或现象的本
质提出的一种推测
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析: 由ⅠA族和ⅦA族各元素性质总结同主族元素性质的递变
规律,是由个别到一般的过程,是归纳范式的运用,A正确;依据
核外电子排布规律书写某元素的原子结构示意图,是由一般到个别
的过程,是演绎范式的运用,B正确;乙炔为直线形分子,其球棍
模型为 ,其空间填充模型为 ,C错误;在探索微观
世界的过程中,科学家们常通过提出假说来把握物质的结构及特
点,不断拓展认识新领域,假说是根据已知的科学事实和原理对未
知领域的事物或现象的本质提出的一种推测,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
8. 化学实验模型有助于我们形成化学学科的思想和方法,其中属于微
观结构模型的是( )
解析: 难以直接观察到原型的模型为微观结构模型。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
9. (2024·镇江高二检测)类推的思维方式在化学学习与研究中经常
采用,但类推出的结论是否正确最终要经过实验的验证。以下类推
的结论正确的是( )
A. 由“Cl2+H2O HCl+HClO”可推出“F2+H2O HF+HFO”也
能发生
B. HCl的水溶液显强酸性,推出HF的水溶液也显强酸性
C. 由“2Fe+3Cl2 2FeCl3”可推出“2Fe+3I2 2FeI3”也能发生
D. Na、K在周期表中属于同一主族,化学性质相似,Na常温下与水
剧烈反应,故K常温下也能与水剧烈反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析: 氟单质具有强氧化性,和水反应生成氧气:2F2+2H2O
4HF+O2,A错误;HF为弱酸,不是强酸,B错误;铁与碘生
成碘化亚铁:Fe+I2 FeI2,C错误;同一主族元素从上到下,元
素的金属性逐渐增强,Na、K在周期表中属于同一主族元素,化学
性质相似,且钾的金属性强于钠,Na常温下与水剧烈反应,故K常
温下也能与水剧烈反应,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
10. (2024·盐城高二检测)认识和掌握物质结构研究的范式与方法,
具有极为重要的意义。下列说法正确的是( )
A. 由元素周期表发现新的元素属于归纳范式
B. 通过甲烷(CH4)、乙烷(C2H6)、丙烷(C3H8)、丁烷
(C4H10)的分子式,总结出饱和链状烷烃的通式为C n H2 n+2,属
于演绎范式
C. 实验方法只能通过化学实验才能实现
D. 归纳范式和演绎范式两者相互联系、互为前提
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析: 由元素周期表提供了元素之间联系的一般理论,发现
新元素是个别,属于一般到个别过程,故发现新的元素属于演绎
范式,A错误;通过甲烷(CH4)、乙烷(C2H6)、丙烷
(C3H8)、丁烷(C4H10)的分子式,总结出饱和链状烷烃的通式
为C n H2 n+2,属于归纳范式,B错误;实验方法多种多样,可以是
调查归纳,也可以是实践,也可以通过化学实验验证,C错误;
归纳范式和演绎范式作为一对普遍适用的逻辑方法,在化学研究
中得到了广泛应用,两者不是孤立使用的,在实际研究中常常融
合在一起,相互联系、互为前提,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
11. 下列说法不正确的是( )
A. 假说经过反复验证和修正,才发展成为科学的理论
B. 化学模型在研究物质的结构和性质变化时有很重要的作用
C. 模型有实物模型,也有微观结构模型
D. 探究物质性质的基本程序是做实验并观察实验现象→分析、解
释,得出结论
解析: 探究物质性质的基本程序是观察物质的外部特征→预
测物质的性质→实验和观察→解释和结论,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
12. 下列说法不正确的是( )
A. 利用归纳范式可以获得物质的通性
B. 假说一旦上升为理论,就无须进行修正
C. 模型抽取了物质原型的关键要素,是对原型的简化
D. 利用乙烯、乙炔的球棍模型可以认识其结构特点及结构与性质之
间的关系
解析: 当反常现象大量出现,原有理论不能很好地进行解释
时,就需要对原有理论加以修改,甚至提出新的理论。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
13. (2024·盐城高二检测)前四周期主族元素的单质及其化合物在生
产、生活中应用广泛。部分元素在周期表中位置如图。
下列关于K、S、Cl、Br这四种元素说法错误的是( )
A. 非金属性最强的是Br
B. 原子半径最大的是K
C. 核外电子数最少的是S
D. 简单氢化物最稳定的是HCl
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析: K、S、Cl、Br中非金属性最强的是Cl,A项错误;K、
S、Cl、Br中原子半径最大的是K,B项正确;K、S、Cl、Br的核
外电子数依次为19、16、17、35,即核外电子数最少的是S,C项
正确;简单氢化物最稳定的是HCl,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
14.19世纪中叶,门捷列夫总结出如下表所示的元素化学性质的变化
情况。请回答下列问题:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(1)门捷列夫的突出贡献是 。(填字母,下同)
A. 提出了原子学说
B. 提出了分子学说
C. 发现元素周期律
D. 发现能量守恒定律
C
解析:门捷列夫的贡献是发现了元素周期律,并根据
元素周期律制得第一张元素周期表。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(2)关于该表下列说法正确的是 。
A. 事物的性质总是在不断地发生变化
B. 根据归纳法可以推断元素周期表中最右上角的氦元素是非金属性
最强的元素
C. 由ⅡA族元素的金属性演绎ⅢA族元素也全具有金属性
D. 物质发生量变到一定程度必然引起质变
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:A项,同主族元素的性质既有相似性,又有递变性,同周期元素的性质是递变的,错误;B项,非金属性最强的元素是氟,错误;C项,ⅢA族元素不全是金属元素,错误;D项,随着原子序数的递增,同周期元素由金属元素变化到非金属元素,同主族元素由非金属元素过渡到金属元素(ⅡA和ⅦA族除外),即由量变引起质变,正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(3)按照表中元素的位置,认真观察从ⅢA族的硼到ⅦA族的砹
连接的一条折线,我们能从分界线附近找到 。
A. 耐高温材料
B. 新型农药材料
C. 半导体材料
D. 新型催化剂材料
C
解析:因为分界线是金属和非金属元素的分界线,所以能找到半导体材料。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
感谢欣赏
THE END
第二单元
物质结构研究的范式与方法
课
程 标
准 1.认识物质的空间结构可以借助某些实验手段来测定,通过这些
手段所获得的信息为建立物质结构模型或相关理论解释提供支
撑。
2.知道原子光谱、红外光谱、晶体X射线衍射等是测定物质结构
的基本方法和实验手段
目 录
1、基础知识·准落实
2、教学效果·勤检测
3、学科素养·稳提升
基础知识·准落实
1
梳理归纳 高效学习
分点突破(一) 物质结构研究的范式
1. 归纳范式
(1)过程为“从 到 ”。根据事实进行概括归
纳,抽象出 ,上升为 。
个别
一般
共同点
本质规律
(2)实例
个别性质 一般规律
通过甲烷(CH4)、乙烷
(C2H6)、丙烷(C3H8)、丁烷
(C4H10)等的分子式 归纳出饱和链状烷烃的通式为
通过比较1~20号元素的原子核外
电子排布来认识前20号元素对应
原子结构的不同 归纳出元素的原子核外电子排布
规律,并从结构上解释了同族元
素性质相似的原因
C n H2 n+2
个别性质 一般规律
通过研究含有双键和三键不饱和
烃的加成反应和氧化反应,发现
不饱和键具有不稳定的性质 根据结构与性质的关系归纳得出
这类有机物的通性:易发生
反应和 反应
2. 演绎范式
(1)过程通常为“从 到 ”。是从某个一般结论
出发,向从属于这一结论的 进行推理的过程。
加
成
氧化
一般
个别
多个要素
(2)实例
一般规律 个别性质
门捷列夫建立了元
素周期表 人们发现了“类铝”(镓),“类硼”
(钪),“类硅”(锗)
根据钠原子最外电
子层上1个电子极易
失去表现出强还原
性的特点 推出同族半径更大的钾、铷、铯元素具有更强
的还原性
一般规律 个别性质
水是极性较强的分
子,水分子之间存
在较强的氢键,水
分子既可为生成氢
键提供H,又有孤
电子对接受H CH3CH2OH、CH3COOH等能为生成氢键提供和
接受H的溶质分子,极性与水相似,均可通过氢
键和水结合,在水中溶解度较大;碳氢化合物
极性较小,也难以和水形成氢键,在水中溶解
度很小。这就是著名的“相似相溶规则”
3. 归纳与演绎的关系
(1)从科学研究的途径来看,一般为先归纳、后演绎。“实验—
假说—理论—新实验”的过程,本质上就是从个别到一般,
再到个别的过程。
(2)归纳需要演绎作指导,以解决归纳研究的目的性、方向性
和结果的正确性问题;而演绎需要归纳提供前提。在演绎
的指导下归纳,在归纳的基础上演绎,两者互相联系、互
为前提。
1. 根据CO2、SO2、SO3与碱、水均反应的性质,得出酸性氧化物的通
性,然后预测酸性氧化物SiO2也能与上述两种物质反应,以下说法
错误的是( )
A. 酸性氧化物通性的得出运用的是归纳范式
B. SiO2能与碱、水两种物质反应
C. 预测酸性氧化物SiO2的性质运用的是演绎范式
D. 运用演绎范式预测得出的结论不一定完全正确
解析: SiO2不溶于水,与水不反应,B项错误。
2. (2024·扬州高二检测)镓(Ga)与铝同主族,曾被称为“类
铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如
图所示:
下列判断不合理的是( )
A. Al、Ga均处于元素周期表ⅢA族
B. Ga2O3可与盐酸反应生成GaCl3
C. 酸性:Al(OH)3>Ga(OH)3
D. Ga(OH)3可与NaOH反应生成NaGaO2
解析: Al与Ga同族,均处于元素周期表ⅢA族,A正确;Ga2O3
与Al2O3性质具有相似性,可与盐酸反应生成GaCl3,B正确;化学
反应遵循较强酸制较弱酸的原理,在NaGaO2和NaAlO2的混合溶液
里通入二氧化碳,只有Al(OH)3沉淀,而没有Ga(OH)3沉淀,
可能的原因是镓酸酸性强于碳酸,酸性:Al(OH)3<Ga(OH)
3,C错误;Ga(OH)3与Al(OH)3的性质相似,都是两性氢氧化
物,可与NaOH反应生成NaGaO2,D正确。
3. 利用归纳范式得通式。
(1)如图为一种无限长单链状结构的多硼酸根离子,其化学式
为 (用 n 表示)。
[BO2
(2)分析下表中各项的排布规律,按此规律排布第26项应
为 。
1 2 3 4 5
C2H4 C2H6 C2H6O C2H4O2 C3H6
6 7 8 9 10
C3H8 C3H8O C3H6O2 C4H8 C4H10
解析:由表中信息可知,循环顺序为C n H2 n 、C n H2 n+
2、C n H2 n+2O、C n H2 n O2,26=4×6+2,则第24项为
C7H14O2,第25项为C8H16,第26项为C8H18。
C8H18
分点突破(二) 物质结构研究的方法
1. 科学假设和论证
(1)研究问题的步骤
(2)建立理论
理论是建立在大量的 基础之上并为实验所
的解释。
观察
证实
(3)修正理论
当反常现象大量出现,而原有理论又不能很好地作出解释
时,就需对原有理论加以修改,甚至需要提出新的理论。
(4)科学假设与论证
假设是人们关于某一事物或现象的一种理性推测,假设需要
实验进行验证,经实验证明正确的假设还需通过建立理论来
将这些知识组织起来,使之成为知识体系。
2. 实验方法
化学是一门以实验为基础的学科,人们往往需要借助实验观测的事
实对假设的正确与否进行检验。
3. 模型方法
(1)含义
科学家需要运用一定的 对实验结果
进行处理。模型既可以是对原型的
,也可以是结合某种理论形态下建立的 。
逻辑推理与模型思维
简化和纯化、抽象和近
似
思维模型
(2)分类
分类 实物模型 微观结构模型
含义 可观察到
的物体的
宏观模型 物质的微观层次结构,难以直接观察到,需要通
过思维加工使 的微观世界以
的形式展现出来
实例 如汽车模
型、飞机
模型和建
筑模型等 如原子结构模型、离子键模型、共价键模型和氢
键模型,有机化合物的分子结构模型等
抽象
可视化
(3)意义
①对沟通科学现象与其本质的认识过程,起到重要的桥梁
作用。
②利用模型深刻地认识物质的微观结构特点,揭示结构与性
质的关系,是模型研究的重要功能。
阴极射线的发现、α粒子散射实验、氢原子光谱的发现和研究,对
揭示原子内部结构的奥秘具有极为重要的作用。道尔顿、汤姆生、卢
瑟福、玻尔等人提出的原子结构模型对人类探索物质结构作出了巨大
贡献。
【交流讨论】
1. 人们借助实验观测的事实对假设的正确与否进行检验时用到了哪些
仪器和手段?
提示:显微红外光谱仪、电子显微镜、原子吸收分光光度计、X射
线衍射仪等。
2. 根据以下信息,思考以下模型是哪类模型?
提示:黄鹤楼模型为实物模型,青蒿素分子模型为微观结构模型。
3. 如何认识模型方法?
提示:模型既可以是对原型的简化和纯化、抽象和近似,也可以是
结合某种理论形态下建立的思维模型。模型研究对科学家探索物质
的微观结构具有非常重要的意义。
1. (2024·扬州高二检测)在探索微观世界的过程中,科学家们常通
过提出假说来把握物质的结构及特点,不断拓展认识的新领域。关
于假说,有如下表述,其中正确的是( )
A. 假说是对现实中已知事物或现象的一种简化处理
B. 假说是根据已知的科学事实和原理对未知领域的事物或现象的本
质提出的一种推测
C. 假说是对一个问题的所有幻想和假定
D. 假说最终都可以变成科学理论
解析: 假说是科学家以事物或现象和科学理论为依据,对未知
领域的事物或现象提出的一种推测。A、C、D错误,B正确。
2. (2024·徐州高二检测)化学中的模型有助于我们形成化学学科的
思想和方法,其中,实物模型是依靠物质的基本形态所做的模仿。
下列属于实物模型的是( )
A 卢瑟福原子结构模型
B CH4分子的结构模型
C 氧化汞受热分解示意图
D 接触法制硫酸示意图
解析: 原子结构模型属于微观结构模型;分子结构模型属于微
观结构模型;从微观分析化学变化,属于微观结构模型;接触法制
硫酸示意图是依靠实际物质所做,属于实物模型。
题后点拨
物质结构研究的方法
(1)借助科学仪器等物质手段。
(2)借助化学研究的方法:科学假设和论证、实验方法、模型方
法等。
教学效果·勤检测
2
强化技能 查缺补漏
1. 下列有关物质结构研究的范式说法正确的是( )
A. 由乙烯的性质推断丙烯的性质是归纳范式
B. 归纳范式和演绎范式是相辅相成的
C. 假说都是不科学的
D. 归纳的结果一定是正确的,不需要验证
解析: A. 由乙烯的性质推断丙烯的性质是从个别到个别,不是
归纳范式,错误;C. 假说具有一般性,可能是科学的,错误;D.
归纳的结果不一定是正确的,需要验证。
2. 原子结构模型经历了五个主要阶段:1803年实心球模型 1904
年“葡萄干面包”模型 1911年原子核式结构模型 1913年
轨道模型 20世纪初量子力学的原子结构模型。对轨道模型贡
献最大的科学家是( )
A. 汤姆生 B. 玻尔
C. 卢瑟福 D. 道尔顿
解析: 引入量子论观点,提出电子在一定轨道上运动的原子结
构模型。
3. 1909年,新西兰出生的物理学家——卢瑟福把一束变速运动的α粒
子(质量数为4的带2个正电荷的质子粒)射向一片极薄的金箔,他
惊奇地发现,过去一直认为原子是“实心球”,而由这种“实心
球”紧密排列而成的金箔,竟让大多数α粒子畅通无阻地通过,就
像金箔不在那儿似的,但也有极少量的α粒子发生偏转或被笔直地
弹回。
(1)根据以上实验现象能得出关于金箔中金原子结构的一些结
论,试写出其中的三点:
①原子中存在 ,且只占原子体积的很小一部分。
原子核
②金原子核带 电荷,且电荷数远大于α粒子的电荷数,两
者产生静电 作用。
③金原子的质量远 (填“大于”“小于”或“等
于”)α粒子的质量。
正
排斥
大于
解析: 大多数α粒子畅通无阻地通过极薄的金箔,证明原子不是实心的球体,内部有“广阔”的空间。有极少数α粒子被笔直地弹回,证明了原子核的存在,但占原子极小的体积,同时证明金原子核的质量远大于α粒子的质量,还能证明金原子核所带电荷种类与α粒子相同,否则两者就会相互吸引;又能证明金原子核所带电荷数远大于α粒子,否则偏转的就不会是α粒子,而是金原子核。
(2)这是利用了物质结构研究的什么方法? 。
解析:此方法是实验法。
实验法
学科素养·稳提升
3
内化知识 知能升华
题组一 物质结构研究的范式
1. 下列关于归纳范式的说法不正确的是( )
A. 归纳范式的过程为“从个别到一般”
B. 由相似相溶规则可推知乙醇易溶于水运用的是归纳法
C. 由甲烷、乙烷、丙烷等的性质可归纳出烷烃的性质
D. 归纳范式,就是根据事实进行概括归纳,抽象出共同点
解析:由相似相溶规则可推知乙醇易溶于水运用的是演绎范式。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
2. 下列物质研究的范式不属于演绎范式的是( )
A. 由乙烯、丙烯均能与Br2、HCl、H2发生加成反应得出烯烃能发生
加成反应
B. 在元素理论的指导下,人们于1875年发现了“类铝”(镓)
C. 利用酸的通性推知乙酸可与NaHCO3溶液发生反应
D. 利用元素周期律可推断出还原性:K>Na
解析: 由乙烯、丙烯均能与Br2、HCl、H2发生加成反应得出烯
烃能发生加成反应,运用的是归纳范式。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
3. (2024·宿迁高二检测)演绎范式是物质结构研究的常用范式,其
过程通常为“从一般到个别”。下列属于演绎范式的应用且结论正
确的是( )
A. 由元素周期律推测酸性强弱:HClO4>HBrO4
B. 由勒夏特列原理预测:其他条件不变,增大 c (O2),2SO2(g)
+O2(g) 2SO3(g)平衡体系中SO3的体积分数一定增大
C. 由第三周期元素性质的递变规律获得周期表中同周期元素性质的
变化规律
D. 由金属单质与盐溶液的置换反应获得金属活动性顺序
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析: 由元素周期律推测酸性强弱:HClO4>HBrO4,过程是
“从一般到个别”,属于演绎范式的应用,且结论正确,A项符合
题意;由勒夏特列原理预测化学平衡移动方向属于演绎范式的应
用,但是其他条件不变,增大体系中 c (O2),2SO2(g)+O2
(g) 2SO3(g)平衡体系中SO3的体积分数不一定增大,当投料
比 <2时,增大 c (O2),平衡时SO3的体积分数反而减
小,B项不符合题意;由第三周期元素性质的递变规律获得周期表
中同周期元素性质的变化规律,过程是“从个别到一般”,不属于
演绎范式的应用,C项不符合题意;由金属单质与盐溶液的置换反应获得金属活动性顺序,过程也是“从个别到一般”,不属于演绎范式的应用,D项不符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
4. (2024·连云港高二检测)嫦娥五号携带月壤样本成功返回地球,
月壤中含有Ti、3He、活性化合物等多种物质。下列相关说法正确
的是( )
A. 稀土元素单质均为不活泼的金属,主要用于电子、激光、军工等
行业和领域
B. 月壤中的某活性化合物有催化性能,推测此活性化合物可能含有
过渡元素
C. 嫦娥五号采用的纳米陶瓷铝合金是一种合金材料
D. 已知 He H He H+18.4MeV,该反应属于非氧化还原
反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析: 稀土元素为ⅢB族元素,其单质均为活泼金属,A错误;
某些过渡元素的单质或氧化物(如铁、钒的单质和氧化物)可作催
化剂,该活性化合物具有催化性能,因此推测该化合物中可能含有
过渡元素,B正确;纳米陶瓷铝合金是一种复合材料,C错误;该
反应不属于化学反应,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
题组二 物质结构研究的方法
5. 某同学想利用所学的知识去探究SO2的性质,设计了如下研究程
序,合理的是( )
A. 观察(得出SO2的物理性质)→分类(预测SO2的化学性质)→实
验(观察实验现象、验证预测)→比较并得出结论,对于异常现
象再预测,再实验,再验证
B. 分类(预测SO2的化学性质)→观察(得出SO2的物理性质)→实
验→比较并得出结论
C. 观察(得出SO2的物理性质)→实验→分类(预测SO2的化学性
质)→比较并得出结论
D. 实验→分类(预测SO2的化学性质)→观察(得出SO2的物理性
质)→比较并得出结论
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析: 探究SO2的性质时其基本程序是先从色、态方面观察二
氧化硫的外观,得出SO2的物理性质,然后根据二氧化硫可能具有
的性质,预测SO2的化学性质,再做实验验证预测,观察实验并记
录现象,分析实验现象并用已知化学知识解释现象,最后得出结
论,所以A项合理。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
6. (2024·苏州高二检测)“假说”在化学科学的研究和发展中起不
可替代的作用,但必须以已有的科学事实和理论为依据,更要用系
统的科学观察和实验来验证。下列“假说”在化学科学发展过程中
曾经起到一定的作用,从目前的化学理论看,仍然正确的是( )
A. 阿伦尼乌斯提出的假说:电解质在溶液中会自发离解成带电的粒子
B. 道尔顿提出的假说:元素的原子以其原子质量为特征,原子不可再分
C. 盖·吕萨克提出的假说:同温同压下,相同体积的不同气体含有相同数目的原子
D. 贝采里乌斯提出的假说:不同原子显不同电性,因而产生吸引力,由此形成化合物
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析: 阿伦尼乌斯提出的“电解质在溶液中会自发离解成带电
的粒子”与电解质的电离是相同的,即该理论科学,A正确;因质
子数决定元素的种类,则每一元素的原子以质子数为特征,则道尔
顿提出的“以其原子质量为其特征”不科学,B错误;在同温同压
下,相同体积的不同气体含有相同数目的分子,相同的分子数不一
定具有相同的原子数,则盖·吕萨克提出的理论不科学,C错误;因
原子不带电,带相反电荷的离子可构成化合物,则贝采里乌斯提出
的理论不科学,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
7. (2024·扬州高二检测)关于物质结构研究的范式与方法的说法错
误的是( )
A. 由ⅠA族和ⅦA族各元素性质总结同主族元素性质的递变规律是归
纳范式的运用
B. 依据核外电子排布规律书写某元素的原子结构示意图是演绎范式
的运用
C. 乙炔为直线形分子,其球棍模型为
D. 假说是根据已知的科学事实和原理对未知领域的事物或现象的本
质提出的一种推测
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析: 由ⅠA族和ⅦA族各元素性质总结同主族元素性质的递变
规律,是由个别到一般的过程,是归纳范式的运用,A正确;依据
核外电子排布规律书写某元素的原子结构示意图,是由一般到个别
的过程,是演绎范式的运用,B正确;乙炔为直线形分子,其球棍
模型为 ,其空间填充模型为 ,C错误;在探索微观
世界的过程中,科学家们常通过提出假说来把握物质的结构及特
点,不断拓展认识新领域,假说是根据已知的科学事实和原理对未
知领域的事物或现象的本质提出的一种推测,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
8. 化学实验模型有助于我们形成化学学科的思想和方法,其中属于微
观结构模型的是( )
解析: 难以直接观察到原型的模型为微观结构模型。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
9. (2024·镇江高二检测)类推的思维方式在化学学习与研究中经常
采用,但类推出的结论是否正确最终要经过实验的验证。以下类推
的结论正确的是( )
A. 由“Cl2+H2O HCl+HClO”可推出“F2+H2O HF+HFO”也
能发生
B. HCl的水溶液显强酸性,推出HF的水溶液也显强酸性
C. 由“2Fe+3Cl2 2FeCl3”可推出“2Fe+3I2 2FeI3”也能发生
D. Na、K在周期表中属于同一主族,化学性质相似,Na常温下与水
剧烈反应,故K常温下也能与水剧烈反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析: 氟单质具有强氧化性,和水反应生成氧气:2F2+2H2O
4HF+O2,A错误;HF为弱酸,不是强酸,B错误;铁与碘生
成碘化亚铁:Fe+I2 FeI2,C错误;同一主族元素从上到下,元
素的金属性逐渐增强,Na、K在周期表中属于同一主族元素,化学
性质相似,且钾的金属性强于钠,Na常温下与水剧烈反应,故K常
温下也能与水剧烈反应,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
10. (2024·盐城高二检测)认识和掌握物质结构研究的范式与方法,
具有极为重要的意义。下列说法正确的是( )
A. 由元素周期表发现新的元素属于归纳范式
B. 通过甲烷(CH4)、乙烷(C2H6)、丙烷(C3H8)、丁烷
(C4H10)的分子式,总结出饱和链状烷烃的通式为C n H2 n+2,属
于演绎范式
C. 实验方法只能通过化学实验才能实现
D. 归纳范式和演绎范式两者相互联系、互为前提
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析: 由元素周期表提供了元素之间联系的一般理论,发现
新元素是个别,属于一般到个别过程,故发现新的元素属于演绎
范式,A错误;通过甲烷(CH4)、乙烷(C2H6)、丙烷
(C3H8)、丁烷(C4H10)的分子式,总结出饱和链状烷烃的通式
为C n H2 n+2,属于归纳范式,B错误;实验方法多种多样,可以是
调查归纳,也可以是实践,也可以通过化学实验验证,C错误;
归纳范式和演绎范式作为一对普遍适用的逻辑方法,在化学研究
中得到了广泛应用,两者不是孤立使用的,在实际研究中常常融
合在一起,相互联系、互为前提,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
11. 下列说法不正确的是( )
A. 假说经过反复验证和修正,才发展成为科学的理论
B. 化学模型在研究物质的结构和性质变化时有很重要的作用
C. 模型有实物模型,也有微观结构模型
D. 探究物质性质的基本程序是做实验并观察实验现象→分析、解
释,得出结论
解析: 探究物质性质的基本程序是观察物质的外部特征→预
测物质的性质→实验和观察→解释和结论,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
12. 下列说法不正确的是( )
A. 利用归纳范式可以获得物质的通性
B. 假说一旦上升为理论,就无须进行修正
C. 模型抽取了物质原型的关键要素,是对原型的简化
D. 利用乙烯、乙炔的球棍模型可以认识其结构特点及结构与性质之
间的关系
解析: 当反常现象大量出现,原有理论不能很好地进行解释
时,就需要对原有理论加以修改,甚至提出新的理论。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
13. (2024·盐城高二检测)前四周期主族元素的单质及其化合物在生
产、生活中应用广泛。部分元素在周期表中位置如图。
下列关于K、S、Cl、Br这四种元素说法错误的是( )
A. 非金属性最强的是Br
B. 原子半径最大的是K
C. 核外电子数最少的是S
D. 简单氢化物最稳定的是HCl
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析: K、S、Cl、Br中非金属性最强的是Cl,A项错误;K、
S、Cl、Br中原子半径最大的是K,B项正确;K、S、Cl、Br的核
外电子数依次为19、16、17、35,即核外电子数最少的是S,C项
正确;简单氢化物最稳定的是HCl,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
14.19世纪中叶,门捷列夫总结出如下表所示的元素化学性质的变化
情况。请回答下列问题:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(1)门捷列夫的突出贡献是 。(填字母,下同)
A. 提出了原子学说
B. 提出了分子学说
C. 发现元素周期律
D. 发现能量守恒定律
C
解析:门捷列夫的贡献是发现了元素周期律,并根据
元素周期律制得第一张元素周期表。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(2)关于该表下列说法正确的是 。
A. 事物的性质总是在不断地发生变化
B. 根据归纳法可以推断元素周期表中最右上角的氦元素是非金属性
最强的元素
C. 由ⅡA族元素的金属性演绎ⅢA族元素也全具有金属性
D. 物质发生量变到一定程度必然引起质变
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:A项,同主族元素的性质既有相似性,又有递变性,同周期元素的性质是递变的,错误;B项,非金属性最强的元素是氟,错误;C项,ⅢA族元素不全是金属元素,错误;D项,随着原子序数的递增,同周期元素由金属元素变化到非金属元素,同主族元素由非金属元素过渡到金属元素(ⅡA和ⅦA族除外),即由量变引起质变,正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(3)按照表中元素的位置,认真观察从ⅢA族的硼到ⅦA族的砹
连接的一条折线,我们能从分界线附近找到 。
A. 耐高温材料
B. 新型农药材料
C. 半导体材料
D. 新型催化剂材料
C
解析:因为分界线是金属和非金属元素的分界线,所以能找到半导体材料。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
感谢欣赏
THE END
