第二章 分子结构与性质--2024-2025学年高中化学人教版选择性必修二单元测试(含答案)
文档属性
| 名称 | 第二章 分子结构与性质--2024-2025学年高中化学人教版选择性必修二单元测试(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-25 09:18:54 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
第二章 分子结构与性质--2024-2025学年高中化学人教版选择性必修二单元测试
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H∶1 C∶12 N∶14 O∶16 Na∶23 S∶32
一、单选题(每题3分,共42分)
1.下列反应产物不能用反应物中键的极性解释的是( )
A.
B.
C.
D.
2.物质的结构决定其性质。下列实例与解释相符的是( )
选项 实例 解释
A 酸性: 的相对分子质量大,酸性强
B 分子的极性: 键的极性小于键的极性
C 热稳定性: 分子间存在氢键,分子间不存在氢键
D 比易液化 分子间能形成氢键
A.A B.B C.C D.D
3.下列事实可用氢键解释的是( )
A.氯气易液化 B.极易溶于水
C.比稳定 D.比酸性弱
4.下列事实不能用氢键解释的是( )
A.密度: B.沸点:
C.稳定性: D.溶解性(水中):
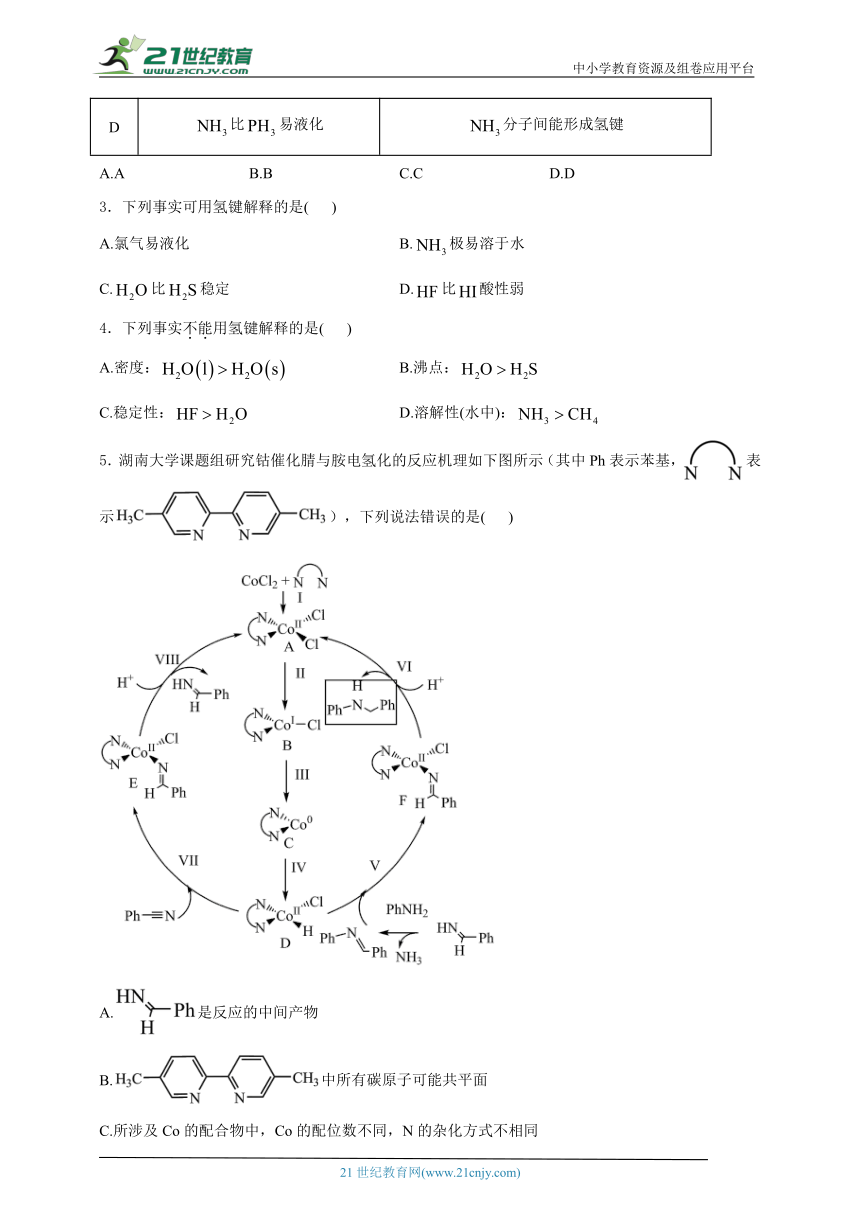
5.湖南大学课题组研究钴催化腈与胺电氢化的反应机理如下图所示(其中Ph表示苯基,表示),下列说法错误的是( )
A.是反应的中间产物
B.中所有碳原子可能共平面
C.所涉及Co的配合物中,Co的配位数不同,N的杂化方式不相同
D.该反应的总方程式为
6.工业上从硒化亚铜中提取Se的反应之一为。下列与该反应有关的化学用语表述正确的是( )
A.的电子式为
B.的空间结构是三角锥形
C.键角:
D.基态Se原子核外电子有34种空间运动状态
7.下列各组物质中,都是由极性键构成的极性分子的是( )
A.和 B.(g)和HCl
C.和 D.和
8.水的状态除了气、液和固态外还有玻璃态。玻璃态水是由液态水急速冷却到160飞时形成的粥状透明液体,它无固定形状,不存在晶体结构且密度与普通液态水的密度相同。下列有关玻璃态水的叙述中,正确的是( )
A.玻璃态水中也存在范德华力与氢键
B.玻璃态水的熔点是0℃
C.玻璃态水中不存在氢键
D.玻璃态水是分子晶体,晶胞与冰相似
9.下列说法中不正确的是( )
A.双键、三键都含有π键
B.成键原子间原子轨道重叠得越多,共价键越牢固
C.因每个原子未成对电子数是一定的,故与之成键的原子个数也一定
D.所有原子轨道在空间都有自己的方向性
10.已知晶体很可能具有比金刚石更大的硬度,且原子间均以单键结合。下列关于晶体的说法中,正确的是( )。
A.晶体是分子晶体
B.晶体中键的键长比金刚石中键的键长要长
C.晶体中键的键长比金刚石中键的键长要短
D.晶体中微粒间通过离子键结合
11.下列分子中,存在π键的是( )。
A. B. C. D.HCl
12.下列叙述中,正确的是( )。
A.是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B.是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C.是极性分子,分子中O原子不处在2个H原子所连线段的中点
D.是非极性分子,分子中C原子不处在2个O原子所连线段的中点
13.工业上制备保险粉的反应为。下列有关说法正确的是( )
A.的结构示意图为
B.的电子式为
C.HCOONa中含有键和键的数目之比为3:1
D.基态原子的外围电子的轨道表达式为
14.已知:
下列说法正确的是( )
A.
B.
C.升温时,丙烷与氯自由基反应速率加快,与溴自由基反应速率减慢
D.HCl与HBr的键能差可以表示为
二、解答题(共4题,58分)
15.与光气反应可用于制取四氯化钛。中σ键和π键的数目比为__________,其空间构型为__________。
16.硫的化合物丰富多样、应用广泛,请回答以下问题:
(1)单质硫即存在多样的同素异形体。
Ⅰ.一种硫单质的存在形式是无限长的链状结构,硫原子之间以单键相连。若仅考虑其中的3个硫原子,则它们所形成的空间构型为:________(选填“V形”或“直线形”);
Ⅱ.硫单质最稳定的存在形式是环状结构分子。将3.24g硫溶于40g苯中,所得溶液的沸点升高了0.83K。已知:①对于稀溶液沸点升高的数值,可通过沸点升高公式求得。式中为稀溶液沸点升高常数,苯的沸点升高常数;②在沸点升高公式中,b为溶质的质量摩尔浓度,计算公式为:,单位为:;③苯中硫的存在形式即为最稳定的形式。
请通过以上信息,计算该形式下硫的分子式,并画出该分子的结构示意图________(参考数据);
(2)连硫酸是一类S原子直接相连成键的酸。通式为,对应的命名为连x硫酸。几种常见连硫酸可通过氧化低价硫化合物的方式制得,写出下列反应的化学方程式:
Ⅰ.用细粉状的氧化亚硫酸,可在溶液中生成连二硫酸,同时产生一种碱:________;
Ⅱ.与饱和冷溶液反应可得连三硫酸钠,同时产生一种硫酸盐:________;
(3)事实上,硫酸在稀溶液中第二步的解离其实是不完全的,且,则在pH=1的溶液中,________。
17.锰氧化物具有较大应用价值,回答下列问题:
(1)在元素周期表中位于第________周期________族;同周期中,基态原子未成对电子数比多的元素是________(填元素符号)。
(2)如某种氧化物的四方晶胞及其在xy平面的投影如图所示,该氧化物化学式为________。
当晶体有O原子脱出时,出现O空位,的化合价________(填“升高”“降低”或“不变”),O空位的产生使晶体具有半导体性质。下列氧化物晶体难以通过该方式获有半导体性质的是________(填标号)。
A. B. C. D.
(3)(见下图)是晶型转变的诱导剂。的空间构型为________;中咪唑环存在大键,则N原子采取的轨道杂化方式为________。
(4)可作转化为的催化剂(见下图)。的熔点远大于,除相对分子质量存在差异外,另一重要原因是_______。
18.钴及其化合物应用广泛。回答下列问题:
(1)Co元素在元素周期表中位于第_______周期第_______族,基态Co原子的价层电子排布式为________。
(2)可由5—氰基四唑(结构简式如图)和反应制备起爆药CP。
①5一氰基四唑分子中σ键与π键的数目之比为_____,C原子的杂化方式为__________。
②在配合物中,中心原子的配位数为_________,钴元素的化合价为_________,的空间构型为_________。
参考答案
1.答案:D
解析:反应物中有极性键的断裂,则可以用键的极性解释。
A(×)乙醛分子中的是极性共价键,在反应中断裂。
B(×)乙酰氯中的C-Cl是极性共价键,在反应中断裂。
C(×)乙醇中C-O是极性共价键,在反应中断裂。
D(√)丙烯中的是非极性共价键,双键中有一个σ键,较稳定,一个π键,不稳定,且中的H-H也是非极性键,反应与反应物中键的极性没有关系。
2.答案:D
解析:含有分子间氢键的氢化物沸点高,易液化,分子间存在氢键,分子间不存在氢键,所以氨气易液化,D正确;
答案选C。
3.答案:B
解析:A.氯气熔沸点低,易液化,与氢键无关,A不符合题意;
B.与能形成氢键,导致极易溶于水,B符合题意;
C.S非金属性(电负性)小于O,中H-O共价键的强度大于中的H-S强度,比稳定,与氢键无关,C不符合题意;
D.F非金属性(电负性)大于I,HF中H-F共价键的强度大于HI中的H-I强度,H-I比H-F键易断裂形成,酸性更强,与氢键无关,D不符合题意;
故答案选B。
4.答案:C
解析:A.水分子间存在氢键,氢键具有方向性,导致水结冰时存在较大空隙,密度比液态水小,A不符题意;
B.水分子间可形成氢键,硫化氢分子间不能形成氢键,所以沸点:,B不符题意;
C.原子半径:,键长:,键能:,所以稳定性:,与氢键无关,C符合题意;
D.氨分子与水分子间可形成氢键,增大溶解性;甲烷分子与水分子间不能形成氢键,所以溶解性(水中):,D不符题意;
答案选C。
5.答案:C
解析:A.在第Ⅷ步生成,又与反应生成和,是反应的中间产物,A项正确;B.中环上的碳原子和N原子采取杂化,上碳原子与环上碳原子直接相连,结合单键可以旋转,中所有碳原子可能共平面,B项正确;C.所涉及Co的配合物中,N的杂化方式都为杂化,C项错误;D.根据解题思路,总方程式为,D项正确;答案选C。
6.答案:A
解析:A.中O原子与2个H形成共用电子对,电子式为:,故A正确;
B.中心S原子价层电子对数为4,无孤电子对,空间构型为正四面体形,故B错误;
C.O原子半径小于S,中成键电子对之间的斥力较大,因此键角大于,故C错误;
D.基态Se原子核外电子排布为:,所以基态硒原子核外有18种不同空间运动状态的电子,D项错误;
故选:A。
7.答案:A
解析:A.中只存在P-Cl极性键、中只存在N-Cl极性键,二者中心原子价层电子对个数都是3+=4且含有1个孤电子对,二者都是三角锥形结构,正负电荷重心不重合,为极性分子,故A符合题意;
B.中只存在Be-Cl极性键,HCl中存在H-Cl极性键,中Be原子价层电子对个数=2+=2且不含孤电子对,为直线形分子,正负电荷重心重合,为非极性分子;HCl正负电荷重心不重合,为极性分子,故B不符合题意;
C.中N原子价层电子对个数=3+=4且含有1个孤电子对,为三角锥形结构,正负电荷重心不重合为极性分子,只存在N-H极性键;中B原子价层电子对个数=3+=3且不含孤电子对,为平面正三角形结构,正负电荷重心重合,为非极性分子,只存在B-H极性键,故C不符合题意;
D.中碳原子价层电子对个数=2+=2且不含孤电子对,为直线形分子,正负电荷重心重合,为非极性分子,只存在O=C极性键;中S原子价层电子对个数=2+=3且含有1个孤电子对,为V形结构,正负电荷重心不重合,为极性分子,只存在极性键,故D不符合题意。
答案选A。
8.答案:A
解析:水分子间存在范德华力和氢键,所以玻璃态水中也存在范德华力与氢键,A项正确,C项错误;玻璃态水无固定形状,不存在晶体结构,故玻璃态水不属于晶体,没有固定的熔点,B、D项错误。
9.答案:D
解析:双键、三键中都含有π键,A项正确;成键原子间原子轨道重叠越多,电子在两核间出现的机会越多,形成的共价键越牢固,B项正确;每个原子的未成对电子数是一定的,在形成共价键的过程中一个原子有几个未成对电子,通常就只能和几个自旋方向相反的电子形成共价键,故与之成键的原子个数也一定,C项正确;s轨道呈球形,没有方向性,D项错误。
10.答案:C
解析:晶体很可能具有比金刚石更大的硬度,且原子间均以单键结合,所以晶体为共价晶体,不存在离子键,A、D项错误;N原子半径比C原子半径小,C-N键的键长比C-C键的短,B项错误,C项正确。
11.答案:C
解析:分子中H原子之间以共价单键相结合,所以只含σ键,故A错误;分子中N原子与H原子之间以共价单键相结合,所以只含σ键,故B错误;的结构式为,其中含有共价三键,所以分子中含有σ键和π键,故C正确;HCl分子中Cl原子和H原子之间以共价单键相结合,所以只含σ键,故D错误。
12.答案:C
解析:A项,为三角锥形结构,4个原子不共面,错误;B项,为正四面体形结构,是非极性分子,C原子处在正四面体的中心,错误;C项,为角形结构,正确;D项,为直线形结构,C原子处于2个O原子所连线段的中点,错误。
13.答案:C
解析:的最外电子层上有8个,且的核电荷数为11,A错误;
NaOH为离子化合物,其电子式为,B错误;
HCOONa中含有的。键和键全部位于中,其结构式为,其中单键为键,双键中有1个σ键和1个π键,故HCOONa中含有键和键的数目之比为3:1,C正确;
基态S原子核外价电子数为6,电子先排3s能级的s轨道上,根据洪特规则,在3p能级的p轨道中排布的电子,要优先单独占据每一个轨道,即基态S原子核外价电子的轨道表达式,D错误。
14.答案:B
解析:A.Cl比Br活泼,且HCl比HBr稳定,能量越低物质越稳定,则,故A错误;
B.由盖斯定律可知,①-③=②-④,则,故B正确;
C.升高温度可加快反应速率,则升高温度,吸热反应、放热反应速率都增大,丙烷与溴自由基反应速率加快,故C错误;
D.③-①得4,,键能差为,故D错误;
故选B。
15.答案:3:1;平面三角形
解析:中C是中心原子,含有的价层电子对数目为3+=3,不含孤电子对,其空间构型为平面三角形;的结构式为:,1个分子中含有3个σ键和1个π键,σ键和π键数目比为3:1。
16.答案:(1)V形;由得:,而硫的质量摩尔浓度,所以,设一个分子中有n个硫原子,则,即分子式为,结构为
(2);
(3)10
解析:(1)Ⅰ.硫原子之间以单键相连,若仅考虑其中的3个硫原子,则S的价层电子对数为4,孤电子对数为2,它们所形成的空间构型为V形;
Ⅱ.由得:,而硫的质量摩尔浓度,所以,设一个分子中有n个硫原子,则,即分子式为,结构为;
(2)Ⅰ.用细粉状的氧化亚硫酸,可在溶液中生成连二硫酸,同时产生一种碱为,反应的化学方程式为:;
Ⅱ.与饱和冷溶液反应可得连三硫酸钠,同时产生一种硫酸盐为硫酸钠,反应的化学方程式为:;
(3)硫酸在稀溶液中第二步的解离其实是不完全的,且,在pH=1的溶液中,。
17.答案:(1)四;ⅦB;Cr
(2);降低;A
(3)正四面体形;
(4)FDCA形成的分子间氢键更多
解析:(1)Mn的原子序数为25,位于元素周期表第四周期ⅦB族;基态Mn的电子排布式为:,未成对电子数有5个,同周期中,基态原子未成对电子数比Mn多的元素是Cr,基态Cr的电子排布式为,有6个未成对电子。
(2)由均摊法得,晶胞中Mn的数目为,O的数目为,即该氧化物的化学式为;晶体有O原子脱出时,出现O空位,即x减小,的化合价为+2x,即Mn的化合价降低;CaO中Ca的化合价为+2价、中V的化合价为+5价、中Fe的化合价为+3、CuO中Cu的化合价为+2,其中CaO中Ca的化合价下降只能为0,其余可下降得到比0大的价态,说明CaO不能通过这种方式获得半导体性质。
(3)根据价电子对互斥理论可知,中孤电子对,价电子对数为4,则的空间构型为正四面体形。由题意可知,中咪唑环存在大π键,形成大π键的原子轨道是未杂化的轨道,垂直于杂化轨道,则N原子的杂化方式为。
(4)由HMF和FDCA的结构可知,HMF和FDCA均能形成分子间氢键,但FDCA形成的分子间氢键更多,使得FDCA的熔点远大于HMF。
18.答案:(1)四;Ⅷ;
(2)①2:1;、sp
②6:+3:正四面体
解析:
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
第二章 分子结构与性质--2024-2025学年高中化学人教版选择性必修二单元测试
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H∶1 C∶12 N∶14 O∶16 Na∶23 S∶32
一、单选题(每题3分,共42分)
1.下列反应产物不能用反应物中键的极性解释的是( )
A.
B.
C.
D.
2.物质的结构决定其性质。下列实例与解释相符的是( )
选项 实例 解释
A 酸性: 的相对分子质量大,酸性强
B 分子的极性: 键的极性小于键的极性
C 热稳定性: 分子间存在氢键,分子间不存在氢键
D 比易液化 分子间能形成氢键
A.A B.B C.C D.D
3.下列事实可用氢键解释的是( )
A.氯气易液化 B.极易溶于水
C.比稳定 D.比酸性弱
4.下列事实不能用氢键解释的是( )
A.密度: B.沸点:
C.稳定性: D.溶解性(水中):
5.湖南大学课题组研究钴催化腈与胺电氢化的反应机理如下图所示(其中Ph表示苯基,表示),下列说法错误的是( )
A.是反应的中间产物
B.中所有碳原子可能共平面
C.所涉及Co的配合物中,Co的配位数不同,N的杂化方式不相同
D.该反应的总方程式为
6.工业上从硒化亚铜中提取Se的反应之一为。下列与该反应有关的化学用语表述正确的是( )
A.的电子式为
B.的空间结构是三角锥形
C.键角:
D.基态Se原子核外电子有34种空间运动状态
7.下列各组物质中,都是由极性键构成的极性分子的是( )
A.和 B.(g)和HCl
C.和 D.和
8.水的状态除了气、液和固态外还有玻璃态。玻璃态水是由液态水急速冷却到160飞时形成的粥状透明液体,它无固定形状,不存在晶体结构且密度与普通液态水的密度相同。下列有关玻璃态水的叙述中,正确的是( )
A.玻璃态水中也存在范德华力与氢键
B.玻璃态水的熔点是0℃
C.玻璃态水中不存在氢键
D.玻璃态水是分子晶体,晶胞与冰相似
9.下列说法中不正确的是( )
A.双键、三键都含有π键
B.成键原子间原子轨道重叠得越多,共价键越牢固
C.因每个原子未成对电子数是一定的,故与之成键的原子个数也一定
D.所有原子轨道在空间都有自己的方向性
10.已知晶体很可能具有比金刚石更大的硬度,且原子间均以单键结合。下列关于晶体的说法中,正确的是( )。
A.晶体是分子晶体
B.晶体中键的键长比金刚石中键的键长要长
C.晶体中键的键长比金刚石中键的键长要短
D.晶体中微粒间通过离子键结合
11.下列分子中,存在π键的是( )。
A. B. C. D.HCl
12.下列叙述中,正确的是( )。
A.是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B.是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C.是极性分子,分子中O原子不处在2个H原子所连线段的中点
D.是非极性分子,分子中C原子不处在2个O原子所连线段的中点
13.工业上制备保险粉的反应为。下列有关说法正确的是( )
A.的结构示意图为
B.的电子式为
C.HCOONa中含有键和键的数目之比为3:1
D.基态原子的外围电子的轨道表达式为
14.已知:
下列说法正确的是( )
A.
B.
C.升温时,丙烷与氯自由基反应速率加快,与溴自由基反应速率减慢
D.HCl与HBr的键能差可以表示为
二、解答题(共4题,58分)
15.与光气反应可用于制取四氯化钛。中σ键和π键的数目比为__________,其空间构型为__________。
16.硫的化合物丰富多样、应用广泛,请回答以下问题:
(1)单质硫即存在多样的同素异形体。
Ⅰ.一种硫单质的存在形式是无限长的链状结构,硫原子之间以单键相连。若仅考虑其中的3个硫原子,则它们所形成的空间构型为:________(选填“V形”或“直线形”);
Ⅱ.硫单质最稳定的存在形式是环状结构分子。将3.24g硫溶于40g苯中,所得溶液的沸点升高了0.83K。已知:①对于稀溶液沸点升高的数值,可通过沸点升高公式求得。式中为稀溶液沸点升高常数,苯的沸点升高常数;②在沸点升高公式中,b为溶质的质量摩尔浓度,计算公式为:,单位为:;③苯中硫的存在形式即为最稳定的形式。
请通过以上信息,计算该形式下硫的分子式,并画出该分子的结构示意图________(参考数据);
(2)连硫酸是一类S原子直接相连成键的酸。通式为,对应的命名为连x硫酸。几种常见连硫酸可通过氧化低价硫化合物的方式制得,写出下列反应的化学方程式:
Ⅰ.用细粉状的氧化亚硫酸,可在溶液中生成连二硫酸,同时产生一种碱:________;
Ⅱ.与饱和冷溶液反应可得连三硫酸钠,同时产生一种硫酸盐:________;
(3)事实上,硫酸在稀溶液中第二步的解离其实是不完全的,且,则在pH=1的溶液中,________。
17.锰氧化物具有较大应用价值,回答下列问题:
(1)在元素周期表中位于第________周期________族;同周期中,基态原子未成对电子数比多的元素是________(填元素符号)。
(2)如某种氧化物的四方晶胞及其在xy平面的投影如图所示,该氧化物化学式为________。
当晶体有O原子脱出时,出现O空位,的化合价________(填“升高”“降低”或“不变”),O空位的产生使晶体具有半导体性质。下列氧化物晶体难以通过该方式获有半导体性质的是________(填标号)。
A. B. C. D.
(3)(见下图)是晶型转变的诱导剂。的空间构型为________;中咪唑环存在大键,则N原子采取的轨道杂化方式为________。
(4)可作转化为的催化剂(见下图)。的熔点远大于,除相对分子质量存在差异外,另一重要原因是_______。
18.钴及其化合物应用广泛。回答下列问题:
(1)Co元素在元素周期表中位于第_______周期第_______族,基态Co原子的价层电子排布式为________。
(2)可由5—氰基四唑(结构简式如图)和反应制备起爆药CP。
①5一氰基四唑分子中σ键与π键的数目之比为_____,C原子的杂化方式为__________。
②在配合物中,中心原子的配位数为_________,钴元素的化合价为_________,的空间构型为_________。
参考答案
1.答案:D
解析:反应物中有极性键的断裂,则可以用键的极性解释。
A(×)乙醛分子中的是极性共价键,在反应中断裂。
B(×)乙酰氯中的C-Cl是极性共价键,在反应中断裂。
C(×)乙醇中C-O是极性共价键,在反应中断裂。
D(√)丙烯中的是非极性共价键,双键中有一个σ键,较稳定,一个π键,不稳定,且中的H-H也是非极性键,反应与反应物中键的极性没有关系。
2.答案:D
解析:含有分子间氢键的氢化物沸点高,易液化,分子间存在氢键,分子间不存在氢键,所以氨气易液化,D正确;
答案选C。
3.答案:B
解析:A.氯气熔沸点低,易液化,与氢键无关,A不符合题意;
B.与能形成氢键,导致极易溶于水,B符合题意;
C.S非金属性(电负性)小于O,中H-O共价键的强度大于中的H-S强度,比稳定,与氢键无关,C不符合题意;
D.F非金属性(电负性)大于I,HF中H-F共价键的强度大于HI中的H-I强度,H-I比H-F键易断裂形成,酸性更强,与氢键无关,D不符合题意;
故答案选B。
4.答案:C
解析:A.水分子间存在氢键,氢键具有方向性,导致水结冰时存在较大空隙,密度比液态水小,A不符题意;
B.水分子间可形成氢键,硫化氢分子间不能形成氢键,所以沸点:,B不符题意;
C.原子半径:,键长:,键能:,所以稳定性:,与氢键无关,C符合题意;
D.氨分子与水分子间可形成氢键,增大溶解性;甲烷分子与水分子间不能形成氢键,所以溶解性(水中):,D不符题意;
答案选C。
5.答案:C
解析:A.在第Ⅷ步生成,又与反应生成和,是反应的中间产物,A项正确;B.中环上的碳原子和N原子采取杂化,上碳原子与环上碳原子直接相连,结合单键可以旋转,中所有碳原子可能共平面,B项正确;C.所涉及Co的配合物中,N的杂化方式都为杂化,C项错误;D.根据解题思路,总方程式为,D项正确;答案选C。
6.答案:A
解析:A.中O原子与2个H形成共用电子对,电子式为:,故A正确;
B.中心S原子价层电子对数为4,无孤电子对,空间构型为正四面体形,故B错误;
C.O原子半径小于S,中成键电子对之间的斥力较大,因此键角大于,故C错误;
D.基态Se原子核外电子排布为:,所以基态硒原子核外有18种不同空间运动状态的电子,D项错误;
故选:A。
7.答案:A
解析:A.中只存在P-Cl极性键、中只存在N-Cl极性键,二者中心原子价层电子对个数都是3+=4且含有1个孤电子对,二者都是三角锥形结构,正负电荷重心不重合,为极性分子,故A符合题意;
B.中只存在Be-Cl极性键,HCl中存在H-Cl极性键,中Be原子价层电子对个数=2+=2且不含孤电子对,为直线形分子,正负电荷重心重合,为非极性分子;HCl正负电荷重心不重合,为极性分子,故B不符合题意;
C.中N原子价层电子对个数=3+=4且含有1个孤电子对,为三角锥形结构,正负电荷重心不重合为极性分子,只存在N-H极性键;中B原子价层电子对个数=3+=3且不含孤电子对,为平面正三角形结构,正负电荷重心重合,为非极性分子,只存在B-H极性键,故C不符合题意;
D.中碳原子价层电子对个数=2+=2且不含孤电子对,为直线形分子,正负电荷重心重合,为非极性分子,只存在O=C极性键;中S原子价层电子对个数=2+=3且含有1个孤电子对,为V形结构,正负电荷重心不重合,为极性分子,只存在极性键,故D不符合题意。
答案选A。
8.答案:A
解析:水分子间存在范德华力和氢键,所以玻璃态水中也存在范德华力与氢键,A项正确,C项错误;玻璃态水无固定形状,不存在晶体结构,故玻璃态水不属于晶体,没有固定的熔点,B、D项错误。
9.答案:D
解析:双键、三键中都含有π键,A项正确;成键原子间原子轨道重叠越多,电子在两核间出现的机会越多,形成的共价键越牢固,B项正确;每个原子的未成对电子数是一定的,在形成共价键的过程中一个原子有几个未成对电子,通常就只能和几个自旋方向相反的电子形成共价键,故与之成键的原子个数也一定,C项正确;s轨道呈球形,没有方向性,D项错误。
10.答案:C
解析:晶体很可能具有比金刚石更大的硬度,且原子间均以单键结合,所以晶体为共价晶体,不存在离子键,A、D项错误;N原子半径比C原子半径小,C-N键的键长比C-C键的短,B项错误,C项正确。
11.答案:C
解析:分子中H原子之间以共价单键相结合,所以只含σ键,故A错误;分子中N原子与H原子之间以共价单键相结合,所以只含σ键,故B错误;的结构式为,其中含有共价三键,所以分子中含有σ键和π键,故C正确;HCl分子中Cl原子和H原子之间以共价单键相结合,所以只含σ键,故D错误。
12.答案:C
解析:A项,为三角锥形结构,4个原子不共面,错误;B项,为正四面体形结构,是非极性分子,C原子处在正四面体的中心,错误;C项,为角形结构,正确;D项,为直线形结构,C原子处于2个O原子所连线段的中点,错误。
13.答案:C
解析:的最外电子层上有8个,且的核电荷数为11,A错误;
NaOH为离子化合物,其电子式为,B错误;
HCOONa中含有的。键和键全部位于中,其结构式为,其中单键为键,双键中有1个σ键和1个π键,故HCOONa中含有键和键的数目之比为3:1,C正确;
基态S原子核外价电子数为6,电子先排3s能级的s轨道上,根据洪特规则,在3p能级的p轨道中排布的电子,要优先单独占据每一个轨道,即基态S原子核外价电子的轨道表达式,D错误。
14.答案:B
解析:A.Cl比Br活泼,且HCl比HBr稳定,能量越低物质越稳定,则,故A错误;
B.由盖斯定律可知,①-③=②-④,则,故B正确;
C.升高温度可加快反应速率,则升高温度,吸热反应、放热反应速率都增大,丙烷与溴自由基反应速率加快,故C错误;
D.③-①得4,,键能差为,故D错误;
故选B。
15.答案:3:1;平面三角形
解析:中C是中心原子,含有的价层电子对数目为3+=3,不含孤电子对,其空间构型为平面三角形;的结构式为:,1个分子中含有3个σ键和1个π键,σ键和π键数目比为3:1。
16.答案:(1)V形;由得:,而硫的质量摩尔浓度,所以,设一个分子中有n个硫原子,则,即分子式为,结构为
(2);
(3)10
解析:(1)Ⅰ.硫原子之间以单键相连,若仅考虑其中的3个硫原子,则S的价层电子对数为4,孤电子对数为2,它们所形成的空间构型为V形;
Ⅱ.由得:,而硫的质量摩尔浓度,所以,设一个分子中有n个硫原子,则,即分子式为,结构为;
(2)Ⅰ.用细粉状的氧化亚硫酸,可在溶液中生成连二硫酸,同时产生一种碱为,反应的化学方程式为:;
Ⅱ.与饱和冷溶液反应可得连三硫酸钠,同时产生一种硫酸盐为硫酸钠,反应的化学方程式为:;
(3)硫酸在稀溶液中第二步的解离其实是不完全的,且,在pH=1的溶液中,。
17.答案:(1)四;ⅦB;Cr
(2);降低;A
(3)正四面体形;
(4)FDCA形成的分子间氢键更多
解析:(1)Mn的原子序数为25,位于元素周期表第四周期ⅦB族;基态Mn的电子排布式为:,未成对电子数有5个,同周期中,基态原子未成对电子数比Mn多的元素是Cr,基态Cr的电子排布式为,有6个未成对电子。
(2)由均摊法得,晶胞中Mn的数目为,O的数目为,即该氧化物的化学式为;晶体有O原子脱出时,出现O空位,即x减小,的化合价为+2x,即Mn的化合价降低;CaO中Ca的化合价为+2价、中V的化合价为+5价、中Fe的化合价为+3、CuO中Cu的化合价为+2,其中CaO中Ca的化合价下降只能为0,其余可下降得到比0大的价态,说明CaO不能通过这种方式获得半导体性质。
(3)根据价电子对互斥理论可知,中孤电子对,价电子对数为4,则的空间构型为正四面体形。由题意可知,中咪唑环存在大π键,形成大π键的原子轨道是未杂化的轨道,垂直于杂化轨道,则N原子的杂化方式为。
(4)由HMF和FDCA的结构可知,HMF和FDCA均能形成分子间氢键,但FDCA形成的分子间氢键更多,使得FDCA的熔点远大于HMF。
18.答案:(1)四;Ⅷ;
(2)①2:1;、sp
②6:+3:正四面体
解析:
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
