第一章 原子结构与性质--2024-2025学年高中化学人教版选择性必修二单元测试(含答案)
文档属性
| 名称 | 第一章 原子结构与性质--2024-2025学年高中化学人教版选择性必修二单元测试(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-25 09:20:45 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
第一章 原子结构与性质--2024-2025学年高中化学人教版选择性必修二单元测试
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H∶1 C∶12 N∶14 O∶16 Na∶23 S∶32
一、单选题(每题3分,共42分)
1.已知W、X、Y、Z均为短周期元素,常温下它们的最高价氧化物对应的水化物溶液(浓度均为)和原子半径、原子序数的关系如图所示。下列说法中错误的是( )
A.氧化物的熔点:X>Y B.气态氢化物的热稳定性:Y>Z
C.简单离子半径:W>X D.第一电离能:W>Y
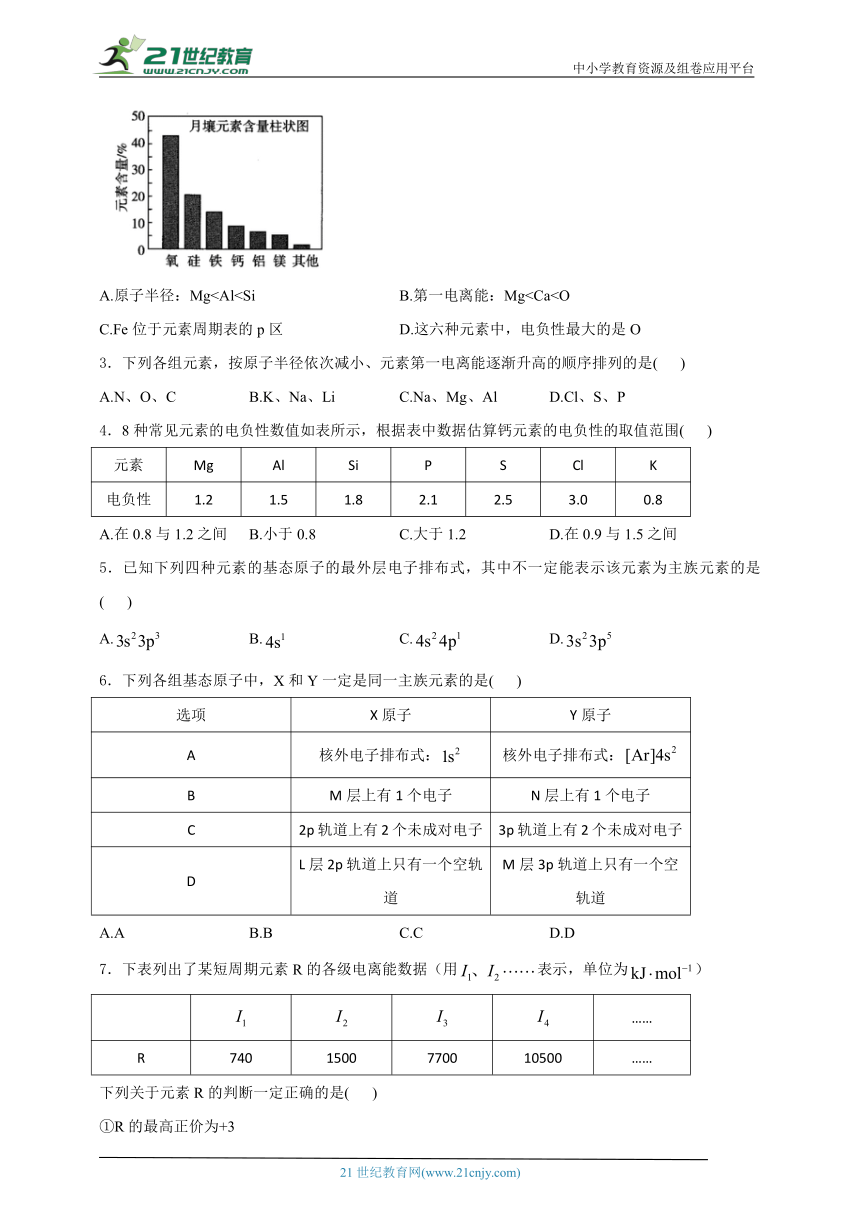
2.嫦娥5号月球探测器带回的月壤样品的元素解题思路结果如图,下列关于含量前六位元素的说法正确的是( )
A.原子半径:MgC.Fe位于元素周期表的p区 D.这六种元素中,电负性最大的是O
3.下列各组元素,按原子半径依次减小、元素第一电离能逐渐升高的顺序排列的是( )
A.N、O、C B.K、Na、Li C.Na、Mg、Al D.Cl、S、P
4.8种常见元素的电负性数值如表所示,根据表中数据估算钙元素的电负性的取值范围( )
元素 Mg Al Si P S Cl K
电负性 1.2 1.5 1.8 2.1 2.5 3.0 0.8
A.在0.8与1.2之间 B.小于0.8 C.大于1.2 D.在0.9与1.5之间
5.已知下列四种元素的基态原子的最外层电子排布式,其中不一定能表示该元素为主族元素的是( )
A. B. C. D.
6.下列各组基态原子中,X和Y一定是同一主族元素的是( )
选项 X原子 Y原子
A 核外电子排布式: 核外电子排布式:
B M层上有1个电子 N层上有1个电子
C 2p轨道上有2个未成对电子 3p轨道上有2个未成对电子
D L层2p轨道上只有一个空轨道 M层3p轨道上只有一个空轨道
A.A B.B C.C D.D
7.下表列出了某短周期元素R的各级电离能数据(用表示,单位为)
……
R 740 1500 7700 10500 ……
下列关于元素R的判断一定正确的是( )
①R的最高正价为+3
②R元素位于元素周期表中第ⅡA族
③R元素第一电离能大于同周期相邻元素
④R元素基态原子的电子排布式为
A.①② B.②③ C.③④ D.①④
8.下列关于电离能和电负性的说法不正确的是( )
A.同族元素在性质上的相似性,取决于原子价电子排布的相似性
B.通常元素的第一电离能越小,元素的金属性越强
C.根据主族元素逐级电离能的数值可以确定其最高化合价
D.在形成化合物时,元素电负性大的显正价,电负性小的显负价
9.下列各组元素中,彼此的化学性质一定相似的是( )
选项 (Ⅰ)基态原子结构信息 (Ⅱ)基态原子结构信息
A 最外层电子排布式: 最外层电子排布式:
B 核外有12个电子 K、L层电子数之和与M、N层电子数之和相等
C 2p能级上有1个未成对电子 核外电子共有17种运动状态
D L层上只有一个空轨道 M层上有3个p电子
A.A B.B C.C D.D
10.下列能正确表示原子的轨道表示式,且其能量处于最低状态的是( )
A. B.
C. D.
11.下列碳原子最外层的各能级中,轨道表示式书写正确的是( )
A. B.
C. D.
12.人们通常将在同一原子轨道上运动、自旋状态相反的2个电子,称为“电子对”,将在某一原子轨道上运动的单个电子,称为“未成对电子”。下列基态原子的电子排布式中,未成对电子数最多的是( )
A. B.
C. D.
13.下列有关基态微粒的电子排布式书写正确的是( )
A.Ti: B.
C. D.
14.俗称雄黄,下列有关叙述错误的是( )
A.基态As原子核外有8种不同能量的电子
B.基态As原子核外有18种空间运动状态的电子
C.基态As原子核外有33种运动状态不同的电子
D.基态S原子核外有10种空间运动状态的电子
二、解答题(共4题,58分)
15.A、B、C、D、E、F、G是元素周期表前四周期中常见的七种元素,其原子序数依次增大,其相关信息如下表:
元素 相关信息
A A的基态原子核外3个能级上有电子,且每个能级上的电子数相等
B B原子基态时s电子与p电子数目相同
C C在组成化合物时没有正价
D 常温常压下,D单质是淡黄色固体,常在火山口附近沉积
E E和D同周期,E的电负性大于D
F F原子基态时未成对电子数是同周期中最多的
G G的一种核素的质量数为63,中子数为34
(1)的立体构型为____________,其中A的杂化轨道类型是___________;
(2)与互为等电子体,则的电子式可表示为___________,中含有共用电子对的数目为___________;
(3)是一种常用的溶剂,的分子中存在___________个π键。表中C、D、E三种元素分别与氢形成的共价键中,键长最大的是___________(用具体元素符号组成的化学键表示)。
(4)下列有关的说法正确的是___________。
A.分子中所有原子都满足8电子稳定结构
B.每个分子中σ键和π键数目之比为2:3
C.它是由极性键和非极性键构成的分子
D.分子的空间构型为直线形
(5)工业上常通过在空气中煅烧G的低价含硫矿获得G单质,请写出该反应的方程式____________________;若往含有的溶液中加过量氢氧化钠溶液,可生成溶液,具有的化学键类型有__________。
A.离子键 B.极性共价键 C.非极性共价键 D配位键
16.门捷列夫最早预言了具有半导体特性类硅元素锗,工业上用精硫锗矿(主要成分为)制取高纯度锗,其工艺流程如图所示:
已知:①硅和锗是同主族相邻元素,结构和性质类似;②在的盐酸中溶解度最小。
(1)基态锗原子的价电子排布式为__________,晶体锗的晶体类型是__________。
(2),使精硫锗矿在氛围中升华的原因:__________。
(3)还原时发生反应:,比较键角:__________(填“>”“<”或“=”),其原因是(从杂化和价层电子对互斥角度解释)______________。
(4)酸浸时温度不能过高的原因:_____________________。
(5)氯化除生成外,反应还生成一种V形分子,写出相应的化学方程式:_____________________。
(6)水解得到,该步骤高纯水不能过量,原因是_____________________。
(7)与碱反应可生成锗酸盐,其中是一种难溶电解质,一定温度下,在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是________(填序号)。
A.n点与p点对应的相等
B.q点无沉淀生成
C.通过蒸发可以使溶液由q点变到p点
D.加入可以使溶液由n点变到m点
17.由汞()、锗()、锑()形成一种新物质M为潜在的拓扑绝缘体材料。M晶体可视为晶体(立方晶胞如图a所示)中部分原子被和取代后形成(晶胞如图c所示),M的摩尔质量为。
请回答:
(1)已知汞的价层电子排布式为,它位于周期表的___________区,M晶胞中与距离最近的共有___________个。
(2)下列说法正确的是___________。
A.1个晶胞中含有4个原子
B.晶胞中原子的杂化方式为杂化
C.M的化学式为
D.M晶体的密度为:
(3)①锗晶体类型为___________,与C同族,但不能像C原子那样原子之间可以形成双键或叁键,从原子结构角度解释原因___________。
②图b不是晶胞单元的理由是___________。
18.一种锌浸出渣主要成分有等物质,从该浸出渣获得金属镓、金属锗、金属铟的流程如下:
已知:
①为一种有效的金属萃取剂,不溶于水。用(以表示)萃取酸浸液中的铟:。
②与硫酸反应生成,已知的。
③Ga与Al的性质相似,但高纯度的镓难溶于酸或碱。
请回答下列问题:
(1)金属铟为49号元素,基态铟原子简化的核外电子排布式为________。
(2)为了提高“酸浸”的反应速率,“酸浸”前对锌浸出渣的处理方式为________。“酸浸”时与硫酸反应的离子方程式为________。
(3)加入盐酸作反萃取剂,其原理是________。
(4)与过量氢氧化钠反应的化学方程式为________;“电解”所用装置如下图所示,阴极的电极反应为________。
(5)为测定的纯度,称取样品,在加热条件下溶解,用将其还原为,用标准溶液滴定,消耗标准溶液的平均体积为,需选用的指示剂为_______,样品纯度为_________%。(实验条件下,未被氧化)[已知:(未配平);]。
参考答案
1.答案:B
解析:Na的氧化物为离子晶体,S的氧化物为分子晶体,离子晶体的熔点更高,A正确;元素的非金属性越强,气态氢化物的稳定性越强,非金属性:,则气态氢化物的稳定性:,B错误;的电子层结构相同,核电荷数小的半径大,则简单离子半径:,C正确;N的第一电离能大于O,O的第一电离能大于S,则第一电离能:N>S,D正确。
2.答案:D
解析:A(×)同周期元素,根据二看核:核小径大,可知原子半径。
B(×)根据同周期:随原子序数的递增,元素的第一电离能呈增大趋势可知,;根据同主族:从上到下,元素的第…电离能依次减小可知,。则第一电离能。
C(×)铁元素的原子序数为26,其基态原子的价电子排布式为,电子最后填入的能级是d能级,则Fe位于元素周期表的d区。
D(√)根据元素在元素周期表中的位置进行判断:越靠近F的电负性越大可知,电负性最大的是O。
3.答案:B
解析:A(×)N、O、C位于同一周期,根据二看核:核小径大,比较原子半径,原子半径C>N>O。同周期,第电离能按依次增大,则第一电离能CB(1)K、Na、Li位于同一主族,根据一看层:般情况下层多径大,比较原子半径,则原子半径K>Na>Li。同主族:从上到下,第一电离能依次减小,则第一电离能KC(×)Na、Mg、Al位于同一周期,根据二看核:核小径大,比较原子半径,原子半径Na>Mg>Al。同周期,第一电离能按依次增大,则第一电离能NaD(×)Cl、S、P位于同一周期,根据二看核:核小径大,比较原子半径,原子半径P>S>Cl。同周期,第一电离能按依次增大,则第一电离能S4.答案:A
解析:A(√)元素的电负性越小,元素原子越易失去电子,元素的金属性越强;元素的电负性越大,元素原子越难失电子,元素的非金属性越强,金属性越弱。依据金属活动性顺序表,钙的金属活动性比钾的弱,则钙的电负性大于钾;钙的金属活动性比镁的强,则钙的电负性小于镁,所以钙的电负性介于钾和镁之间,即在0.8与1.2之间。
5.答案:B
解析:
选项 解题思路 结论
A →内层排满电子→第3周期第ⅤA族 不符合题意
B 内层的3d能级若有电子→副族或第Ⅷ族元素内层的3能级若没有电子→主族元素(K) 符合题意
C →内层排满电子→第4周期第ⅢA族 不符合题意
D →内层排满电子→第3周期第ⅦA族 不符合题意
6.答案:D
解析:A(×)核外电子排布式为1s2的元素是He,核外电子排布式为的元素是Ca,前者属于0族,后者属于ⅡA族,A不符合题意。
B(×)M层上有1个电子,该元素为Na,N层上有一个电子,该元素可能是K,也可能是Cr、Cu,B不符合题意。
C(×)2p轨道上有2个未成对电子,该元素可能是C,也可能是O,3p轨道上有2个未成对电子,该元素可能是Si,也可能是S,它们可能属于同一主族,也可能不属于同一主族,C不符合题意。
D(√)L层2p轨道上只有一个空轨道,该元素为C,M层3p轨道上只有一个空轨道,该元素为Si,它们属于同一主族,D符合题意。
7.答案:B
解析:根据逐级电离能数据判断元素化合价:,说明该原子易失去2个电子,最高正价为+2,该元素处于第ⅡA族,该元素原子存在第五电离能,说明其核外电子数目大于4,又R为短周期元素,则R为Mg。
①(×)②(√)由上述解题思路知,Mg的最高正价为+2,处于第ⅠA族。
③(√)根据周期,第电离能存在两特例:第ⅡA族>第ⅢA族,第ⅤA族>第ⅥA族。故Mg的第一电离能大于其同周期相邻元素。
④(×)R为Mg,其基态原子的核外电子排布式为。
8.答案:D
解析:A(√)同主族元素原子的最外层电子数相同,由结构决定性质可知,原子价电子排布的相似性决定同族元素在性质上的相似性。
B(√)元素的第一电离能是指气态原子失去1个电子所需要的最低能量,则第一电离能越小,表示气态时该原子越易失去电子,元素的金属性越强。
C(√)对于同一元素来说,失去该元素原子同一电子层上的电子需要的能量相近;失去不同电子层上的电子需要的能量相差较大,故根据逐级电离能的数值可确定元素原子核外电子的分层排布情况,主族元素的最高化合价等于其最外层电子数。
D(×)利用电负性判断元素化合价:在形成化合物时,元素电负性大的显负价,电负性小的显正价。
9.答案:B
解析:A(×)最外层电子排布式为的元素是He,是稀有气体元素,化学性质稳定;最外层电子排布式为的元素为Be,是金属元素,两者化学性质不相似,不符合题意。
B(√)基态原子核外有12个电子的元素为Mg;K、L层排满时共有10个电子,故M层有8个电子,N层有2个电子,该元素为Ca。Mg和Ca是同一主族元素,故性质一定相似,符合题意。
C(×)2p轨道上有1个未成对电子,核外电子排布可能为或,对应元素为B或F;核外电子有17种运动状态的元素为Cl。F和Cl为同一主族元素,性质相似,但B与Cl位于不同主族,性质不相似,不符合题意。
D(×)L层上只有一个空轨道,对应元素为C,M层上有3个p电子,对应元素为P,两者位于不同主族,性质不相似,不符合题意。
10.答案:D
解析:A(×)2s能级的能量比2p的低,电子优先占据能量最低的轨道,题给轨道表示式处于能量较高的激发态,不符合能量最低原理。
B(×)2p能级的3个轨道能量相同,电子总是先单独分占一个轨道且自旋平行,题给轨道表示式书写错误,符合陷阱3违反洪特规则,正确的轨道表示式为。
C(×)2s能级的能量比2p的低,电子排满2s能级后,再排2p能级,题给轨道表示式不符合能量最低原理,表示B原子的激发态。
D(√)能级能量由低到高的顺序为1s、2s、2p;每个轨道最多只能容纳2个电子,且自旋方向相反,能级相同的轨道中电子将尽可能地分占不同的原子轨道,且自旋方向相同,能量最低,题给轨道表示式符合能量最低原理。
11.答案:C
解析:
题给信息 陷阱 原因解题思路 正确书写
A 陷阱1违反能量最低原理陷阱3违反洪特规则 2s能级轨道未填满,就直接填2p能级轨道,违反能量最低原理;2p能级中的三个轨道是简并的,电子优先单独分占一个轨道且自旋平行,违反洪特规则
B 陷阱3违反洪特规则 2p能级中的三个轨道是简并的,电子优先单独分占一个轨道且自旋平行,违反洪特规则
C
D 陷阱1违反能量最低原理 2s能级轨道未填满,就直接填2p能级轨道,违反能量最低原理
12.答案:C
解析:A(×)s能级最多排2个电子,p能级最多排6个电子,选项所给电子排布式无未成对电子,不符合题意。
B(×)3d能级有5个原子轨道,排了5个电子,5个电子分占5个不同的轨道,且自旋平行,故有5个未成对电子,不符合题意。
C(√)3d能级有5个原子轨道,选项所给电子排布式3d轨道上的5个电子分占5个不同的轨道,4s只有1个原子轨道,则3d有5个未成对电子,4s有1个未成对电子,共6个未成对电子,符合题意。
D(×)题给电子排布式中有1个未成对电子,不符合题意。
13.答案:A
解析:
Sepl填入顺序:按照构造原理写出电子填入能级的顺序 Step2根据各能级所能容纳的电子数填充电子 Step3书写顺序:按电子层顺序书写(同一电子层的放一块,且电子层低的能级写在左边) Step4检查是否符合洪特规则特例
Ti的原子序数为22 1s2s2p3s3p4s3d4p.....
Ni的原子序数为28 1s2s2p3s3p4s3d4p......
Cu的原子序数为29 1s2s2p3s3p4s3d4p...... 符合,调整3d和4s能级上的电子,为
Br的原子序数为35 1s2s2p3s3p4s3d4p5s4d5p......
A(√)第3周期稀有气体元素Ar的原子序数为18,则Ti的简化电子排布式为。
B(×)先失去最外层电子,则的简化电子排布式为。
C(×)基态Cu原子的电子排布式为,轨道全充满,4s轨道半充满,符合能量最低原理,选项所给Cu的电子排布式不符合洪特规则特例。
D(×)原子得到1个电子变为,得到的1个电子填在基态Br原子电子排布式的最外层能级上,为,则的简化电子排布式为。
14.答案:D
解析:
Sepl填入顺序:按照构造原理写出电子填入能级的顺序 Step2根据各能级所能容纳的电子数填充电子 Step3书写顺序:按电子层顺序书写(同一电子层的放一块,且电子层低的能级写在左边)
As的原子序数为33 1s2s2p3s3p4s3d4p......
S的原子序数为16 1s2s2p3s3p4s3d4p......
A(√)As原子的核外电子分布于8个不同的能级,故有8种不同能量的电子。
B(√)由As的核外电子排布式知,As原子的电子占据的原子轨道数为18,根据等式1空间运动状态数=电子占据的原子轨道数可知,As原子核外电子的空间运动状态数为18。
C(√)As原子核外电子数为33,根据等式2电子运动状态数=原子核外电子数目可知,电子运动状态数为33。
D(×)由S的核外电子排布式知,S原子的电子占据的原子轨道数为9,根据等式1空间运动状态数=电子占据的原子轨道数可知,S原子核外电子的空间运动状态数为9。
15.答案:((1)平面三角形;
(2);3
(3)2;H-S
(4)CD
(5);ABD
解析:A、B、C、D、E、F、G是元素周期表前四周期中常见的七种元素,其原子序数依次增大,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等则其原子核外电子排布式为,故A为C;B原子基态时s电子与p电子数目相同,则其原子核外电子排布式为,则B为O;C在组成化合物时没有正价,则C为F;常温常压下,D单质是淡黄色固体,常在火山口附近沉积,则D为S;E和D同周期,E的电负性大于D,则E为Cl;F原子基态时未成对电子数是同周期中最多的,则其外围电子排布式为,故F为Cr;G的一种核素的质量数为63,中子数为34,其质子数是63-34=29,则G为Cu。
(1)中C形成3个σ键,孤电子对数为:,价层电子对数为3+0=3,C为杂化,为平面三角形;
(2)和互为等电子体,其电子式为:,和互为等电子体,因此1mol中共用电子对数为3;
(3)和互为等电子体,因此中有2个π键,F、S、Cl的非金属性F>Cl>S,因此键能H-F>H-Cl>H-S,键长H-F(4)中:H没有达到8电子稳定结构,A错误;每个分子中σ键和π键数目之比为3:2,B错误;C与C形成非极性键,C与H形成极性键,C正确;C为sp杂化,分子呈现直线型,D正确;
(5)Cu的低价硫化物在空气中煅烧生成Cu和:,存在离子因此有离子键,铜离子和氢氧根离子之间形成配位键,氢氧根离子内部存在极性共价键。
16.答案:(1);共价晶体
(2)避免被氧化,得到较为纯净的
(3)>;和分子中心原子都是杂化,但中心原子N上有1个孤电子对,而中心原子S上有2个孤电子对,孤电子对越多,对成键电子对排斥越大,键角越小,故分子键角相对较小
(4)浓硝酸受热易挥发、易分解
(5)
(6)高纯水过量会使得到的盐酸浓度小于,增大的溶解量,最终使锗产率降低
(7)AB
解析:(1)Ge是第四周期第ⅣA族元素,所以基态锗原子的价电子排布式为。由于硅和锗的结构和性质相似,所以晶体锗也属于共价晶体。
(2)中S显-2价,高温下易被空气中氧化,所以使用作为保护气进行升华。
(3)由于分子中的N原子和分子中的S原子都采用杂化,而中心原子N上只有1个孤电子对,中心原子S上有2个孤电子对,而斥力:孤电子对一孤电子对>孤电子对-成键电子对>成键电子对一成键电子对,所以键角:。
(4)温度过高会促进浓硝酸挥发和分解,降低利用率。
(5)由题意可知与反应除生成外还生成一种V形分子,再由元素守恒可知是,所以发生的反应为。
(6)由题意可知在的盐酸中溶解度最小,所以若水解过程中高纯水过量会使生成的盐酸浓度变小,从而增大的溶解量,使得产率降低。
(7)n点和p点在曲线上,均是该温度下的饱和溶液,则相同,A正确;q点,是的不饱和溶液而没有沉淀生成,B正确;蒸发结晶使得和均增大,C错误;加入可使浓度增大,同时的浓度会降低,n点无法变到m点,D错误。
17.答案:(1)ds;4
(2)BC
(3)共价晶体;Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键;不符合晶胞是晶体的最小重复单元,不具有“无隙并置”的特点
解析:(1)Hg的价层电子排布式为,则Hg为第六周期第ⅡB族元素,位于元素周期表的ds区;由晶胞结构可知,M晶胞中位于体心的锗原子与4个距离最近的锑原子构成四面体形结构。
(2)A.由晶胞结构可知,晶胞中位于顶点、面心和体内的锗原子个数为8×+6×+4=8,故A错误;B.每个锗原子与其周围的4个锗原子形成4个单键,故锗原子采用杂化,故B正确;C.由Sb原子均位于晶胞内,因此1个晶胞中含有Sb原子数为8,Ge原子位于晶胞顶点、面心、体心,因此1个晶胞中含有Ge原子数为1+8×+4×=4;Hg原子位于棱边、面心,因此1个晶胞中含有Hg原子数为6×+4×=4,则该晶胞中粒子个数比Hg:Ge:Sb=4:4:8=1:1:2,最简式为,故C正确;D.由晶胞结构可知,晶胞中位于顶点、面上和体心的锗原子个数为8×+4×+1=4,位于面心和棱上的汞原子个数为6×+4×=4,位于体内的锑原子个数为8,则M的最简式为,设晶体的密度为,由晶胞的质量公式可得:,解得d=,故D错误;故选BC。
(3)①根据晶胞的结构可知,和同族的金刚石晶型一样,面心立方基础上在(,,)等几个位置各补上一个原子,每个配位数4,为共价晶体;虽然Ge与C是同族元素,C原子之间可以形成双键、叁键,但考虑Ge的原子半径大,难以通过“肩并肩”方式形成π键,所以Ge原子之间难以形成双键或叁键,故原因为:Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键;②对比图b和图c可得M晶体的晶胞中上下两个单元内的原子位置不完全相同,不符合晶胞是晶体的最小重复单元,不具有“无隙并置”的特点。
18.答案:(1)
(2)粉碎;
(3)增大溶液中浓度,使的平衡逆向移动,从萃取剂中脱出,同时回收萃取剂
(4)或;
(5)淀粉溶液;
解析:(1)金属鋼为49号元素。在元素周期表中的位置为第五周期第ⅢA族。基态铟原子简化的核外电子排布式为。
(2)增大固液接触面积可以加快反应速率,故为了提高“酸浸”的反应速率。“酸浸”前对锌浸出渣的处理方式为粉碎。根据信息可知,与碳酸反应生成和硫酸锌,为弱电解质,离子方程式为。
(3)根据平衡移动原理可知,加入盐酸.增大溶液中浓度,使的平衡逆向移动,从萃取剂中脱出,同时可以回收萃取剂,
(4)根据信息可知,Ga与Al的性质相似,则与过量氢氧化钠反应的化学方程式为或;根据图示。阴极得到电子发生还原反应生成Ga单质。电极反应为。
(5)由已知反应知若过量可产生。所以选择淀粉作为指示剂。由得失电子守恒得关系式为,得,最终计算纯度为。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
第一章 原子结构与性质--2024-2025学年高中化学人教版选择性必修二单元测试
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H∶1 C∶12 N∶14 O∶16 Na∶23 S∶32
一、单选题(每题3分,共42分)
1.已知W、X、Y、Z均为短周期元素,常温下它们的最高价氧化物对应的水化物溶液(浓度均为)和原子半径、原子序数的关系如图所示。下列说法中错误的是( )
A.氧化物的熔点:X>Y B.气态氢化物的热稳定性:Y>Z
C.简单离子半径:W>X D.第一电离能:W>Y
2.嫦娥5号月球探测器带回的月壤样品的元素解题思路结果如图,下列关于含量前六位元素的说法正确的是( )
A.原子半径:Mg
3.下列各组元素,按原子半径依次减小、元素第一电离能逐渐升高的顺序排列的是( )
A.N、O、C B.K、Na、Li C.Na、Mg、Al D.Cl、S、P
4.8种常见元素的电负性数值如表所示,根据表中数据估算钙元素的电负性的取值范围( )
元素 Mg Al Si P S Cl K
电负性 1.2 1.5 1.8 2.1 2.5 3.0 0.8
A.在0.8与1.2之间 B.小于0.8 C.大于1.2 D.在0.9与1.5之间
5.已知下列四种元素的基态原子的最外层电子排布式,其中不一定能表示该元素为主族元素的是( )
A. B. C. D.
6.下列各组基态原子中,X和Y一定是同一主族元素的是( )
选项 X原子 Y原子
A 核外电子排布式: 核外电子排布式:
B M层上有1个电子 N层上有1个电子
C 2p轨道上有2个未成对电子 3p轨道上有2个未成对电子
D L层2p轨道上只有一个空轨道 M层3p轨道上只有一个空轨道
A.A B.B C.C D.D
7.下表列出了某短周期元素R的各级电离能数据(用表示,单位为)
……
R 740 1500 7700 10500 ……
下列关于元素R的判断一定正确的是( )
①R的最高正价为+3
②R元素位于元素周期表中第ⅡA族
③R元素第一电离能大于同周期相邻元素
④R元素基态原子的电子排布式为
A.①② B.②③ C.③④ D.①④
8.下列关于电离能和电负性的说法不正确的是( )
A.同族元素在性质上的相似性,取决于原子价电子排布的相似性
B.通常元素的第一电离能越小,元素的金属性越强
C.根据主族元素逐级电离能的数值可以确定其最高化合价
D.在形成化合物时,元素电负性大的显正价,电负性小的显负价
9.下列各组元素中,彼此的化学性质一定相似的是( )
选项 (Ⅰ)基态原子结构信息 (Ⅱ)基态原子结构信息
A 最外层电子排布式: 最外层电子排布式:
B 核外有12个电子 K、L层电子数之和与M、N层电子数之和相等
C 2p能级上有1个未成对电子 核外电子共有17种运动状态
D L层上只有一个空轨道 M层上有3个p电子
A.A B.B C.C D.D
10.下列能正确表示原子的轨道表示式,且其能量处于最低状态的是( )
A. B.
C. D.
11.下列碳原子最外层的各能级中,轨道表示式书写正确的是( )
A. B.
C. D.
12.人们通常将在同一原子轨道上运动、自旋状态相反的2个电子,称为“电子对”,将在某一原子轨道上运动的单个电子,称为“未成对电子”。下列基态原子的电子排布式中,未成对电子数最多的是( )
A. B.
C. D.
13.下列有关基态微粒的电子排布式书写正确的是( )
A.Ti: B.
C. D.
14.俗称雄黄,下列有关叙述错误的是( )
A.基态As原子核外有8种不同能量的电子
B.基态As原子核外有18种空间运动状态的电子
C.基态As原子核外有33种运动状态不同的电子
D.基态S原子核外有10种空间运动状态的电子
二、解答题(共4题,58分)
15.A、B、C、D、E、F、G是元素周期表前四周期中常见的七种元素,其原子序数依次增大,其相关信息如下表:
元素 相关信息
A A的基态原子核外3个能级上有电子,且每个能级上的电子数相等
B B原子基态时s电子与p电子数目相同
C C在组成化合物时没有正价
D 常温常压下,D单质是淡黄色固体,常在火山口附近沉积
E E和D同周期,E的电负性大于D
F F原子基态时未成对电子数是同周期中最多的
G G的一种核素的质量数为63,中子数为34
(1)的立体构型为____________,其中A的杂化轨道类型是___________;
(2)与互为等电子体,则的电子式可表示为___________,中含有共用电子对的数目为___________;
(3)是一种常用的溶剂,的分子中存在___________个π键。表中C、D、E三种元素分别与氢形成的共价键中,键长最大的是___________(用具体元素符号组成的化学键表示)。
(4)下列有关的说法正确的是___________。
A.分子中所有原子都满足8电子稳定结构
B.每个分子中σ键和π键数目之比为2:3
C.它是由极性键和非极性键构成的分子
D.分子的空间构型为直线形
(5)工业上常通过在空气中煅烧G的低价含硫矿获得G单质,请写出该反应的方程式____________________;若往含有的溶液中加过量氢氧化钠溶液,可生成溶液,具有的化学键类型有__________。
A.离子键 B.极性共价键 C.非极性共价键 D配位键
16.门捷列夫最早预言了具有半导体特性类硅元素锗,工业上用精硫锗矿(主要成分为)制取高纯度锗,其工艺流程如图所示:
已知:①硅和锗是同主族相邻元素,结构和性质类似;②在的盐酸中溶解度最小。
(1)基态锗原子的价电子排布式为__________,晶体锗的晶体类型是__________。
(2),使精硫锗矿在氛围中升华的原因:__________。
(3)还原时发生反应:,比较键角:__________(填“>”“<”或“=”),其原因是(从杂化和价层电子对互斥角度解释)______________。
(4)酸浸时温度不能过高的原因:_____________________。
(5)氯化除生成外,反应还生成一种V形分子,写出相应的化学方程式:_____________________。
(6)水解得到,该步骤高纯水不能过量,原因是_____________________。
(7)与碱反应可生成锗酸盐,其中是一种难溶电解质,一定温度下,在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是________(填序号)。
A.n点与p点对应的相等
B.q点无沉淀生成
C.通过蒸发可以使溶液由q点变到p点
D.加入可以使溶液由n点变到m点
17.由汞()、锗()、锑()形成一种新物质M为潜在的拓扑绝缘体材料。M晶体可视为晶体(立方晶胞如图a所示)中部分原子被和取代后形成(晶胞如图c所示),M的摩尔质量为。
请回答:
(1)已知汞的价层电子排布式为,它位于周期表的___________区,M晶胞中与距离最近的共有___________个。
(2)下列说法正确的是___________。
A.1个晶胞中含有4个原子
B.晶胞中原子的杂化方式为杂化
C.M的化学式为
D.M晶体的密度为:
(3)①锗晶体类型为___________,与C同族,但不能像C原子那样原子之间可以形成双键或叁键,从原子结构角度解释原因___________。
②图b不是晶胞单元的理由是___________。
18.一种锌浸出渣主要成分有等物质,从该浸出渣获得金属镓、金属锗、金属铟的流程如下:
已知:
①为一种有效的金属萃取剂,不溶于水。用(以表示)萃取酸浸液中的铟:。
②与硫酸反应生成,已知的。
③Ga与Al的性质相似,但高纯度的镓难溶于酸或碱。
请回答下列问题:
(1)金属铟为49号元素,基态铟原子简化的核外电子排布式为________。
(2)为了提高“酸浸”的反应速率,“酸浸”前对锌浸出渣的处理方式为________。“酸浸”时与硫酸反应的离子方程式为________。
(3)加入盐酸作反萃取剂,其原理是________。
(4)与过量氢氧化钠反应的化学方程式为________;“电解”所用装置如下图所示,阴极的电极反应为________。
(5)为测定的纯度,称取样品,在加热条件下溶解,用将其还原为,用标准溶液滴定,消耗标准溶液的平均体积为,需选用的指示剂为_______,样品纯度为_________%。(实验条件下,未被氧化)[已知:(未配平);]。
参考答案
1.答案:B
解析:Na的氧化物为离子晶体,S的氧化物为分子晶体,离子晶体的熔点更高,A正确;元素的非金属性越强,气态氢化物的稳定性越强,非金属性:,则气态氢化物的稳定性:,B错误;的电子层结构相同,核电荷数小的半径大,则简单离子半径:,C正确;N的第一电离能大于O,O的第一电离能大于S,则第一电离能:N>S,D正确。
2.答案:D
解析:A(×)同周期元素,根据二看核:核小径大,可知原子半径。
B(×)根据同周期:随原子序数的递增,元素的第一电离能呈增大趋势可知,;根据同主族:从上到下,元素的第…电离能依次减小可知,。则第一电离能。
C(×)铁元素的原子序数为26,其基态原子的价电子排布式为,电子最后填入的能级是d能级,则Fe位于元素周期表的d区。
D(√)根据元素在元素周期表中的位置进行判断:越靠近F的电负性越大可知,电负性最大的是O。
3.答案:B
解析:A(×)N、O、C位于同一周期,根据二看核:核小径大,比较原子半径,原子半径C>N>O。同周期,第电离能按依次增大,则第一电离能C
解析:A(√)元素的电负性越小,元素原子越易失去电子,元素的金属性越强;元素的电负性越大,元素原子越难失电子,元素的非金属性越强,金属性越弱。依据金属活动性顺序表,钙的金属活动性比钾的弱,则钙的电负性大于钾;钙的金属活动性比镁的强,则钙的电负性小于镁,所以钙的电负性介于钾和镁之间,即在0.8与1.2之间。
5.答案:B
解析:
选项 解题思路 结论
A →内层排满电子→第3周期第ⅤA族 不符合题意
B 内层的3d能级若有电子→副族或第Ⅷ族元素内层的3能级若没有电子→主族元素(K) 符合题意
C →内层排满电子→第4周期第ⅢA族 不符合题意
D →内层排满电子→第3周期第ⅦA族 不符合题意
6.答案:D
解析:A(×)核外电子排布式为1s2的元素是He,核外电子排布式为的元素是Ca,前者属于0族,后者属于ⅡA族,A不符合题意。
B(×)M层上有1个电子,该元素为Na,N层上有一个电子,该元素可能是K,也可能是Cr、Cu,B不符合题意。
C(×)2p轨道上有2个未成对电子,该元素可能是C,也可能是O,3p轨道上有2个未成对电子,该元素可能是Si,也可能是S,它们可能属于同一主族,也可能不属于同一主族,C不符合题意。
D(√)L层2p轨道上只有一个空轨道,该元素为C,M层3p轨道上只有一个空轨道,该元素为Si,它们属于同一主族,D符合题意。
7.答案:B
解析:根据逐级电离能数据判断元素化合价:,说明该原子易失去2个电子,最高正价为+2,该元素处于第ⅡA族,该元素原子存在第五电离能,说明其核外电子数目大于4,又R为短周期元素,则R为Mg。
①(×)②(√)由上述解题思路知,Mg的最高正价为+2,处于第ⅠA族。
③(√)根据周期,第电离能存在两特例:第ⅡA族>第ⅢA族,第ⅤA族>第ⅥA族。故Mg的第一电离能大于其同周期相邻元素。
④(×)R为Mg,其基态原子的核外电子排布式为。
8.答案:D
解析:A(√)同主族元素原子的最外层电子数相同,由结构决定性质可知,原子价电子排布的相似性决定同族元素在性质上的相似性。
B(√)元素的第一电离能是指气态原子失去1个电子所需要的最低能量,则第一电离能越小,表示气态时该原子越易失去电子,元素的金属性越强。
C(√)对于同一元素来说,失去该元素原子同一电子层上的电子需要的能量相近;失去不同电子层上的电子需要的能量相差较大,故根据逐级电离能的数值可确定元素原子核外电子的分层排布情况,主族元素的最高化合价等于其最外层电子数。
D(×)利用电负性判断元素化合价:在形成化合物时,元素电负性大的显负价,电负性小的显正价。
9.答案:B
解析:A(×)最外层电子排布式为的元素是He,是稀有气体元素,化学性质稳定;最外层电子排布式为的元素为Be,是金属元素,两者化学性质不相似,不符合题意。
B(√)基态原子核外有12个电子的元素为Mg;K、L层排满时共有10个电子,故M层有8个电子,N层有2个电子,该元素为Ca。Mg和Ca是同一主族元素,故性质一定相似,符合题意。
C(×)2p轨道上有1个未成对电子,核外电子排布可能为或,对应元素为B或F;核外电子有17种运动状态的元素为Cl。F和Cl为同一主族元素,性质相似,但B与Cl位于不同主族,性质不相似,不符合题意。
D(×)L层上只有一个空轨道,对应元素为C,M层上有3个p电子,对应元素为P,两者位于不同主族,性质不相似,不符合题意。
10.答案:D
解析:A(×)2s能级的能量比2p的低,电子优先占据能量最低的轨道,题给轨道表示式处于能量较高的激发态,不符合能量最低原理。
B(×)2p能级的3个轨道能量相同,电子总是先单独分占一个轨道且自旋平行,题给轨道表示式书写错误,符合陷阱3违反洪特规则,正确的轨道表示式为。
C(×)2s能级的能量比2p的低,电子排满2s能级后,再排2p能级,题给轨道表示式不符合能量最低原理,表示B原子的激发态。
D(√)能级能量由低到高的顺序为1s、2s、2p;每个轨道最多只能容纳2个电子,且自旋方向相反,能级相同的轨道中电子将尽可能地分占不同的原子轨道,且自旋方向相同,能量最低,题给轨道表示式符合能量最低原理。
11.答案:C
解析:
题给信息 陷阱 原因解题思路 正确书写
A 陷阱1违反能量最低原理陷阱3违反洪特规则 2s能级轨道未填满,就直接填2p能级轨道,违反能量最低原理;2p能级中的三个轨道是简并的,电子优先单独分占一个轨道且自旋平行,违反洪特规则
B 陷阱3违反洪特规则 2p能级中的三个轨道是简并的,电子优先单独分占一个轨道且自旋平行,违反洪特规则
C
D 陷阱1违反能量最低原理 2s能级轨道未填满,就直接填2p能级轨道,违反能量最低原理
12.答案:C
解析:A(×)s能级最多排2个电子,p能级最多排6个电子,选项所给电子排布式无未成对电子,不符合题意。
B(×)3d能级有5个原子轨道,排了5个电子,5个电子分占5个不同的轨道,且自旋平行,故有5个未成对电子,不符合题意。
C(√)3d能级有5个原子轨道,选项所给电子排布式3d轨道上的5个电子分占5个不同的轨道,4s只有1个原子轨道,则3d有5个未成对电子,4s有1个未成对电子,共6个未成对电子,符合题意。
D(×)题给电子排布式中有1个未成对电子,不符合题意。
13.答案:A
解析:
Sepl填入顺序:按照构造原理写出电子填入能级的顺序 Step2根据各能级所能容纳的电子数填充电子 Step3书写顺序:按电子层顺序书写(同一电子层的放一块,且电子层低的能级写在左边) Step4检查是否符合洪特规则特例
Ti的原子序数为22 1s2s2p3s3p4s3d4p.....
Ni的原子序数为28 1s2s2p3s3p4s3d4p......
Cu的原子序数为29 1s2s2p3s3p4s3d4p...... 符合,调整3d和4s能级上的电子,为
Br的原子序数为35 1s2s2p3s3p4s3d4p5s4d5p......
A(√)第3周期稀有气体元素Ar的原子序数为18,则Ti的简化电子排布式为。
B(×)先失去最外层电子,则的简化电子排布式为。
C(×)基态Cu原子的电子排布式为,轨道全充满,4s轨道半充满,符合能量最低原理,选项所给Cu的电子排布式不符合洪特规则特例。
D(×)原子得到1个电子变为,得到的1个电子填在基态Br原子电子排布式的最外层能级上,为,则的简化电子排布式为。
14.答案:D
解析:
Sepl填入顺序:按照构造原理写出电子填入能级的顺序 Step2根据各能级所能容纳的电子数填充电子 Step3书写顺序:按电子层顺序书写(同一电子层的放一块,且电子层低的能级写在左边)
As的原子序数为33 1s2s2p3s3p4s3d4p......
S的原子序数为16 1s2s2p3s3p4s3d4p......
A(√)As原子的核外电子分布于8个不同的能级,故有8种不同能量的电子。
B(√)由As的核外电子排布式知,As原子的电子占据的原子轨道数为18,根据等式1空间运动状态数=电子占据的原子轨道数可知,As原子核外电子的空间运动状态数为18。
C(√)As原子核外电子数为33,根据等式2电子运动状态数=原子核外电子数目可知,电子运动状态数为33。
D(×)由S的核外电子排布式知,S原子的电子占据的原子轨道数为9,根据等式1空间运动状态数=电子占据的原子轨道数可知,S原子核外电子的空间运动状态数为9。
15.答案:((1)平面三角形;
(2);3
(3)2;H-S
(4)CD
(5);ABD
解析:A、B、C、D、E、F、G是元素周期表前四周期中常见的七种元素,其原子序数依次增大,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等则其原子核外电子排布式为,故A为C;B原子基态时s电子与p电子数目相同,则其原子核外电子排布式为,则B为O;C在组成化合物时没有正价,则C为F;常温常压下,D单质是淡黄色固体,常在火山口附近沉积,则D为S;E和D同周期,E的电负性大于D,则E为Cl;F原子基态时未成对电子数是同周期中最多的,则其外围电子排布式为,故F为Cr;G的一种核素的质量数为63,中子数为34,其质子数是63-34=29,则G为Cu。
(1)中C形成3个σ键,孤电子对数为:,价层电子对数为3+0=3,C为杂化,为平面三角形;
(2)和互为等电子体,其电子式为:,和互为等电子体,因此1mol中共用电子对数为3;
(3)和互为等电子体,因此中有2个π键,F、S、Cl的非金属性F>Cl>S,因此键能H-F>H-Cl>H-S,键长H-F
(5)Cu的低价硫化物在空气中煅烧生成Cu和:,存在离子因此有离子键,铜离子和氢氧根离子之间形成配位键,氢氧根离子内部存在极性共价键。
16.答案:(1);共价晶体
(2)避免被氧化,得到较为纯净的
(3)>;和分子中心原子都是杂化,但中心原子N上有1个孤电子对,而中心原子S上有2个孤电子对,孤电子对越多,对成键电子对排斥越大,键角越小,故分子键角相对较小
(4)浓硝酸受热易挥发、易分解
(5)
(6)高纯水过量会使得到的盐酸浓度小于,增大的溶解量,最终使锗产率降低
(7)AB
解析:(1)Ge是第四周期第ⅣA族元素,所以基态锗原子的价电子排布式为。由于硅和锗的结构和性质相似,所以晶体锗也属于共价晶体。
(2)中S显-2价,高温下易被空气中氧化,所以使用作为保护气进行升华。
(3)由于分子中的N原子和分子中的S原子都采用杂化,而中心原子N上只有1个孤电子对,中心原子S上有2个孤电子对,而斥力:孤电子对一孤电子对>孤电子对-成键电子对>成键电子对一成键电子对,所以键角:。
(4)温度过高会促进浓硝酸挥发和分解,降低利用率。
(5)由题意可知与反应除生成外还生成一种V形分子,再由元素守恒可知是,所以发生的反应为。
(6)由题意可知在的盐酸中溶解度最小,所以若水解过程中高纯水过量会使生成的盐酸浓度变小,从而增大的溶解量,使得产率降低。
(7)n点和p点在曲线上,均是该温度下的饱和溶液,则相同,A正确;q点,是的不饱和溶液而没有沉淀生成,B正确;蒸发结晶使得和均增大,C错误;加入可使浓度增大,同时的浓度会降低,n点无法变到m点,D错误。
17.答案:(1)ds;4
(2)BC
(3)共价晶体;Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键;不符合晶胞是晶体的最小重复单元,不具有“无隙并置”的特点
解析:(1)Hg的价层电子排布式为,则Hg为第六周期第ⅡB族元素,位于元素周期表的ds区;由晶胞结构可知,M晶胞中位于体心的锗原子与4个距离最近的锑原子构成四面体形结构。
(2)A.由晶胞结构可知,晶胞中位于顶点、面心和体内的锗原子个数为8×+6×+4=8,故A错误;B.每个锗原子与其周围的4个锗原子形成4个单键,故锗原子采用杂化,故B正确;C.由Sb原子均位于晶胞内,因此1个晶胞中含有Sb原子数为8,Ge原子位于晶胞顶点、面心、体心,因此1个晶胞中含有Ge原子数为1+8×+4×=4;Hg原子位于棱边、面心,因此1个晶胞中含有Hg原子数为6×+4×=4,则该晶胞中粒子个数比Hg:Ge:Sb=4:4:8=1:1:2,最简式为,故C正确;D.由晶胞结构可知,晶胞中位于顶点、面上和体心的锗原子个数为8×+4×+1=4,位于面心和棱上的汞原子个数为6×+4×=4,位于体内的锑原子个数为8,则M的最简式为,设晶体的密度为,由晶胞的质量公式可得:,解得d=,故D错误;故选BC。
(3)①根据晶胞的结构可知,和同族的金刚石晶型一样,面心立方基础上在(,,)等几个位置各补上一个原子,每个配位数4,为共价晶体;虽然Ge与C是同族元素,C原子之间可以形成双键、叁键,但考虑Ge的原子半径大,难以通过“肩并肩”方式形成π键,所以Ge原子之间难以形成双键或叁键,故原因为:Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键;②对比图b和图c可得M晶体的晶胞中上下两个单元内的原子位置不完全相同,不符合晶胞是晶体的最小重复单元,不具有“无隙并置”的特点。
18.答案:(1)
(2)粉碎;
(3)增大溶液中浓度,使的平衡逆向移动,从萃取剂中脱出,同时回收萃取剂
(4)或;
(5)淀粉溶液;
解析:(1)金属鋼为49号元素。在元素周期表中的位置为第五周期第ⅢA族。基态铟原子简化的核外电子排布式为。
(2)增大固液接触面积可以加快反应速率,故为了提高“酸浸”的反应速率。“酸浸”前对锌浸出渣的处理方式为粉碎。根据信息可知,与碳酸反应生成和硫酸锌,为弱电解质,离子方程式为。
(3)根据平衡移动原理可知,加入盐酸.增大溶液中浓度,使的平衡逆向移动,从萃取剂中脱出,同时可以回收萃取剂,
(4)根据信息可知,Ga与Al的性质相似,则与过量氢氧化钠反应的化学方程式为或;根据图示。阴极得到电子发生还原反应生成Ga单质。电极反应为。
(5)由已知反应知若过量可产生。所以选择淀粉作为指示剂。由得失电子守恒得关系式为,得,最终计算纯度为。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
