3.2分子晶体与共价晶体--2024-2025学年高中化学人教版选择性必修二课时作业
文档属性
| 名称 | 3.2分子晶体与共价晶体--2024-2025学年高中化学人教版选择性必修二课时作业 |  | |
| 格式 | doc | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-25 09:23:10 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
分子晶体与共价晶体--2024-2025学年高中化学人教版选择性必修二课时作业
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H∶1 C∶12 N∶14 O∶16 Na∶23 S∶32
一、单选题(每题3分,共42分)
1.下列推论正确的( )
A.的沸点高于,可推测的沸点高于
B.为正四面体结构,可推测出也为正四面体结构
C.晶体是分子晶体,可推测晶体也是分子晶体,
D.是碳链为直线型的非极性分子,可推测也是碳链为直线型的非极性分子
2.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,11.2L己烷中所含分子数目为0.5
B.1L0.1乙酸溶液中含H+的数目为0.1
C.常温常压下,16g甲烷中含有的质子数目为10
D.在含2molSi-O键的晶体中,氧原子的数目为2
3.由单质形成晶体一定不存在的微粒是( )
A.原子 B.分子 C.阴离子 D.阳离子
4.设是阿伏加德罗常数的值,下列说法正确的是( )
A.由和组成的混合气体中所含中子数为15
B.石英晶体中含有的键的数目是0.2
C.时,的溶液中含有数为0.1
D.电解精炼铜时,若阳极质量减少,则电路中转移的电子数目为2
5.下列晶体中由原子直接构成的是( )
A.金刚石 B.足球烯 C.金属钾 D.白磷
6.已知R、W、X、Y、Z均为短周期主族元素,其中R元素所在的周期数是其族序数的一半,且R对应的两种常见氧化物均为酸性氧化物;W元素与Z元素在同一主族;X是短周期主族元素中原子半径最大的;Y元素原子最外层电子数为m,次外层电子数为n;Z元素原子L层电子数为m+n,M层电子数为m-n。下列叙述正确的是( )
A.R、X、Y对应的简单离子半径:YB.W和Z的最高价氧化物的晶体类型相同
C.与的VSEPR模型相同,空间结构不同
D.Y的简单氢化物的熔、沸点比R的简单氢化物的熔、沸点低
7.氮化碳是新发现的高硬度材料,其部分结构如下图所示。下列有关其说法正确的是( )
A.氮化碳中C原子和N原子的最外层都满足8电子稳定结构
B.氮化碳中碳显-4价,氮显+3价
C.氮化碳的硬度比金刚石略小
D.该晶体与金刚石相似,都是原子间以非极性键结合形成的空间网状结构
8.2024年5月,我国首辆火星车“祝融号”成功着陆。“祝融号”火星车的车身选用高强韧性的新型铝基碳化硅复合材料。碳化硅(SiC)属于( )
A.共价晶体 B.分子晶体 C.离子晶体 D.金属晶体
9.类比推理是化学中常用的思维方法。下列说法正确的是( )
A.干冰晶体是分子密堆积,则冰晶体也是分子密堆积
B.氧化铝是两性氧化物,则氧化铍也是两性氧化物
C.氯水具有较强的漂白性,则碘水也具有较强的漂白性
D.元素、位于同一主族,则元素、也位于同一主族
10.物质结构决定物质性质,下列性质差异正确且与结构因素对应的是( )
物质性质 结构因素
A. 酸性: 分子极性
B. 沸点: 氢键的键能
C. 水中溶解度: > 分子极性
D. 熔点:金刚石>晶体硅 原子半径
A.A B.B C.C D.D
11.下列叙述中正确的是( )
A.分子晶体中一定存在共价键 B.离子晶体中一定含金属元素
C.共价晶体中一定不存在分子 D.晶体中有阳离子必定含有阴离子
12.利用可实现人工合成金刚石。下列关于该反应的说法错误的是( )
A.C(金刚石)属于共价晶体
B.该反应利用了的强还原性
C.晶体硅和金刚石中的、C的杂化方式都是
D.晶体中每个周围与它最接近且距离相等的有12个
13.下列各组物质各自形成的晶体,均属于分子晶体的化合物是( )
A.、、 B.,、
C.、、 D.,、
14.下列说法错误的是( )
A.共价晶体中只存在非极性共价键
B.分子晶体的状态变化,需克服分子间作用力而不破坏共价键
C.金属晶体通常具有导电、导热和良好的延展性
D.离子晶体在熔化状态下能导电
二、解答题(共4题,58分)
15.GaN是制造微电子器件,光电子器件的新型半导体材料。综合利用炼锌矿渣{主要含铁酸镓[]、铁酸锌(),还含少量Fe及一些难溶于酸的物质}获得金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如图。
已知:①在酸性条件下不稳定,易转化为。
②常温下,“浸出液”中的金属离子对应的氢氧化物的溶度积常数如下表,离子浓度小于时可视为沉淀完全。
氢氧化物
③,。
回答下列问题:
(1)为提高浸出率,可采取的措施为___________(填标号)。
a.将矿渣粉碎 b.降低温度
c.把稀硫酸换成浓硫酸 d.延长浸出时间
(2)已知纤锌矿结构的GaN晶胞结构与金刚石结构类似,则该种GaN晶体的类型为___________,基态Ga原子价层电子的轨道表示式为___________。
(3)与稀硫酸反应的化学方程式为___________。
(4)“调pH”时需调节溶液pH的最小值为___________。
(5)检验“滤液1”中是否含有的试剂为___________(填名称)。
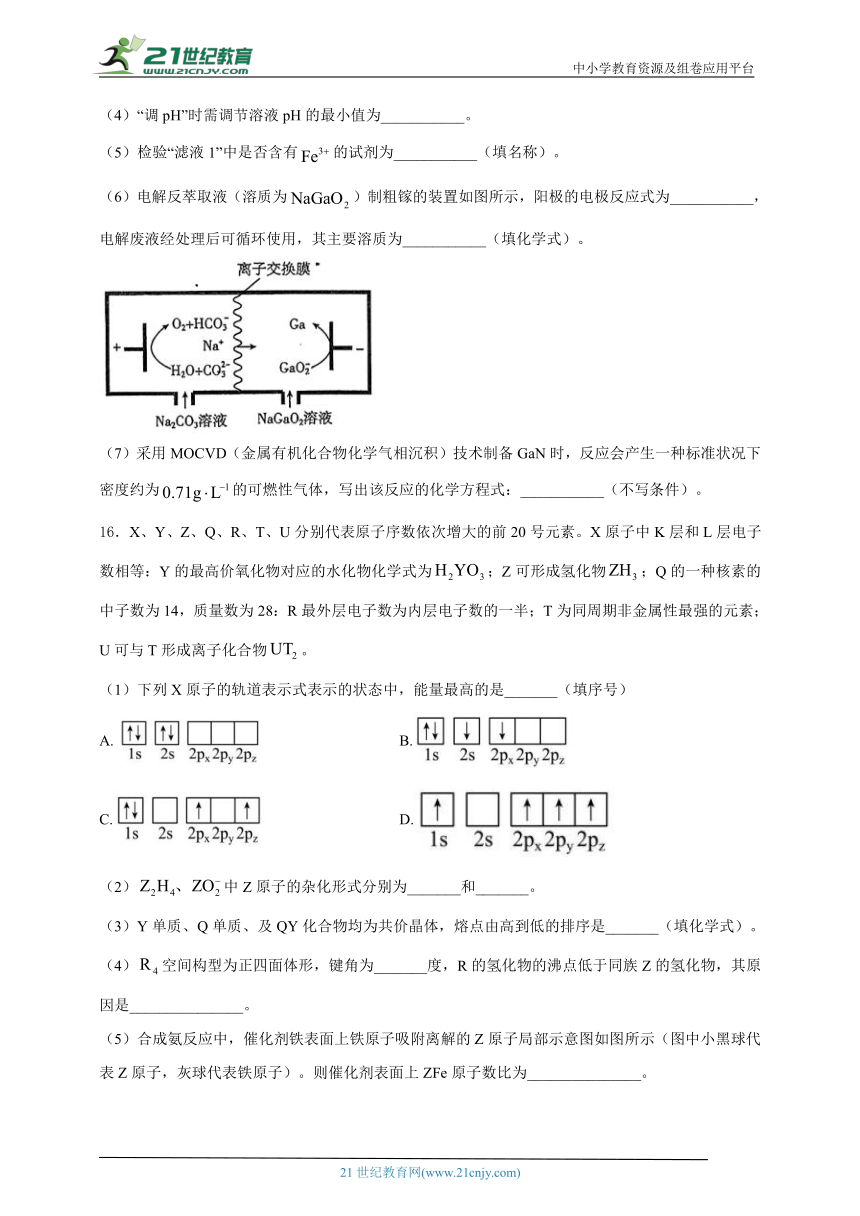
(6)电解反萃取液(溶质为)制粗镓的装置如图所示,阳极的电极反应式为___________,电解废液经处理后可循环使用,其主要溶质为___________(填化学式)。
(7)采用MOCVD(金属有机化合物化学气相沉积)技术制备GaN时,反应会产生一种标准状况下密度约为的可燃性气体,写出该反应的化学方程式:___________(不写条件)。
16.X、Y、Z、Q、R、T、U分别代表原子序数依次增大的前20号元素。X原子中K层和L层电子数相等:Y的最高价氧化物对应的水化物化学式为;Z可形成氢化物;Q的一种核素的中子数为14,质量数为28:R最外层电子数为内层电子数的一半;T为同周期非金属性最强的元素;U可与T形成离子化合物。
(1)下列X原子的轨道表示式表示的状态中,能量最高的是_______(填序号)
A. B.
C. D.
(2)中Z原子的杂化形式分别为_______和_______。
(3)Y单质、Q单质、及QY化合物均为共价晶体,熔点由高到低的排序是_______(填化学式)。
(4)空间构型为正四面体形,键角为_______度,R的氢化物的沸点低于同族Z的氢化物,其原因是_______________。
(5)合成氨反应中,催化剂铁表面上铁原子吸附离解的Z原子局部示意图如图所示(图中小黑球代表Z原子,灰球代表铁原子)。则催化剂表面上ZFe原子数比为_______________。
17.如图是几种晶体的结构示意图,它们是NaCl、干冰、金刚石、石墨结构中的一部分。
(1)其中代表金刚石的是_________(填字母),金刚石属于_________晶体。
(2)其中代表石墨的是_________(填字母),其晶体中碳原子呈平面层状结构排列。
(3)其中代表NaCl的是_________(填字母),晶体中与之间通过_________结合。
(4)其中代表干冰的是_________(填字母),它属于_________晶体,分子间通过_________结合。
(5)A、B、C所代表物质的熔点由高到低的排列顺序为_________(填字母)。
18.有下列8种晶体,用序号回答下列问题:
①CO
②NaCl
③Na
④Si
⑤
⑥金刚石
⑦
⑧
(1)属于共价晶体的是_______含有共价键的离子晶体是_______。
(2)已知①的熔沸点比⑧高,原因是_______。
(3)①~⑤五种物质的熔点由高到低的顺序是_______。
参考答案
1.答案:B
解析:和都属于分子晶体相对分子质量越大陒、沸点越高、则的沸点高于和也属于分子晶体但分子间存在氢键,沸点高于,故A错误。
N、P是同主族元責,形成的离子和结构相似都是正四面体构型故B正确。
是分子晶体、而是原子晶体、故C错误。
中两个对称,是非极性分子,而是锯齿形结构,是极性分子,故D错误。
2.答案:C
解析:
3.答案:C
解析:单质晶体可能有:硅、金刚石——原子晶体,P、S、——分子晶体,Na、Mg——金属晶体,在这些晶体中,构成晶体的粒子分别是原子、分子、金属离子和自由电子。C中阴离子只有存在于离子晶体中,构成离子晶体的粒子是阴、阳离子,所以离子晶体不可能形成单质晶体,答案选C。
4.答案:A
解析:A.含有15个中子,含有15个中子,由和组成的混合气体中所含中子数为15,A正确;
B.中含键,则石英晶体即中含有的键的数目是0.4,B错误;
C.溶液体积未知,无法计算离子数目,C错误;
D.电解精炼铜时阳极除了铜失电子外,锌和铁也会失去电子,即阳极质量减少,电路中转移的电子数目不是2,D错误;
故选A。
5.答案:A
解析:
6.答案:C
解析:A.R、X、Y对应的简单离子分别为、、,离子半径为>>,A错误;
B.W和Z的最高价氧化物分别为、,其中晶体类型为分子晶体,晶体类型为共价晶体,晶体类型不相同,B错误;
C.与分别为,的VSEPR模型为平面三角形,空间结构为平面正三角形,的VSEPR模型为平面三角形,空间结构为形,故二者VSEPR模型相同,空间结构不同,C正确;
D.Y、R的简单氢化物分别为、,二者晶体类型都为分子晶体,分子间形成氢键,熔、沸点高于,D错误;
答案选C。
7.答案:A
解析:A.由图可知C与周围4个N形成单键,N与周围3个C形成单键,每个原子都满足8电子稳定结构,故A正确;
B.N的非金属性比C强,两者形成共价键时,N显负价,C显正价,故B错误;
C.N原子半径小于C,键长比金刚石中键短,键能更大,氮化碳的硬度大于金刚石,故C错误;
D.C和N形成极性键,故D错误;
故选:A。
8.答案:A
解析:SiC中的Si和C以共价键结合形成空间网状结构,和金刚石结构相似,SiC属于共价晶体,故选A。
9.答案:B
解析:A.冰晶体中水分子间存在氢键,不是分子密堆积,故A错误;
B.氧化铝是两性氧化物,氧化铍和氧化铝的组成相似,也是两性氧化物,故B正确;
C.氯水具有较强的漂白性,碘水不具有漂白性,故C错误;
D.元素Sr、Ba位于同一主族元素,但Ba和W不是同一主族,故D错误。
10.答案:D
解析:
11.答案:C
解析:A.稀有气体形成的分子晶体中不存在共价键,A错误;
B.氯化铵离子晶体中不含金属元素,B错误;
C.共价晶体靠共价键形成,共价晶体中一定不存在分子,C正确;
D.金属晶体中有阳离子,但是不含有阴离子,D错误;
故选C。
12.答案:D
解析:A,金刚石是由C原子通过共价键聚集而成的共价晶体,A正确;B.该反应中Na元素的化合物升高,作氧化剂,利用的强还原性将中的C还原为金刚石,B正确;C晶体硅中的原子、金刚石中的C原子均形成4个键,价层电子对数为4,为杂化,C正确;D.的晶胞结构如图所示,以体心为例,晶体中每个周围与它最接近且距离相等的有6个,D错误;综上所述答案为D。
13.答案:B
解析:不是化合物,A错误;、、均为化合物且都是分子晶体,B正确;是共价晶体,C错误;、是离子晶体,D错误。
14.答案:A
解析:
15.答案:(1)ad
(2)共价晶体;
(3)
(4)5.3
(5)硫氰化钾
(6);
(7)
解析:(1)为提高浸出率,可采取的措施有粉碎矿渣,延长浸出时间,故选ad;
(2)金刚石为共价晶体,GaN晶胞结构与金刚石结构类似,则该种GaN晶体的类型为共价晶体;Ga为31号元素,则基态Ga原子价层电子的轨道表示式为;
(3)根据化合物中各元素化合价代数和为0可知,铁元素的化合价为+3价,与稀硫酸反应生成硫酸锌、硫酸铁和水,反应的化学方程式为;
(4)调节pH,沉淀铁离子和,滤液1中含有锌离子,,,,pH=6-lg5=5.3,则“调”时需调节溶液的最小值为5.3;
(5)遇到硫氰根离子显红色,则检验“滤液1”中是否含有的试剂为硫氰化钾;
(6)由图可知,阳极水失去电子生成氧气同时生成碳酸氢根离子,则阳极的电极反应式为:;“电解”反萃取液(溶质为)制粗镓后的电解废液经处理后可循环使用,阴极上水电离出的氢离子得电子产生氢气,电解废液的主要溶质为;
(7)采用MOCVD(金属有机化合物化学气相沉积)技术制备GaN时,反应会产生一种标准状况下密度约为的可燃性气体,则,则为甲烷气体,故该反应的化学方程式:。
16.答案:(1)①D
(2)①
②
(3)C>SiC>Si
(4)①60
②中存在分子间氢键
(5)1:2
解析:
17.答案:(1)B;共价
(2)D
(3)A;离子键
(4)C;分子;分子间作用力
(5)B>A>C
解析:金刚石是共价晶体,碳原子间以共价键结合,B是金刚石的结构模型。石墨是层状结构,D是石墨的结构模型。氯化钠是和按个数比1:1堆积而成的离子晶体,A是氯化钠的结构模型。干冰晶体中,分子间依靠分子间作用力结合,C是干冰的结构模型。一般来说,晶体的熔点:共价晶体>离子晶体>分子晶体。
18.答案:(1)④⑥;⑦
(2)同为分子晶体,相对分子质量接近的物质,分子的极性越大,其熔沸点越高
(3)④>②>③>⑤>①
解析:
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
分子晶体与共价晶体--2024-2025学年高中化学人教版选择性必修二课时作业
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H∶1 C∶12 N∶14 O∶16 Na∶23 S∶32
一、单选题(每题3分,共42分)
1.下列推论正确的( )
A.的沸点高于,可推测的沸点高于
B.为正四面体结构,可推测出也为正四面体结构
C.晶体是分子晶体,可推测晶体也是分子晶体,
D.是碳链为直线型的非极性分子,可推测也是碳链为直线型的非极性分子
2.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,11.2L己烷中所含分子数目为0.5
B.1L0.1乙酸溶液中含H+的数目为0.1
C.常温常压下,16g甲烷中含有的质子数目为10
D.在含2molSi-O键的晶体中,氧原子的数目为2
3.由单质形成晶体一定不存在的微粒是( )
A.原子 B.分子 C.阴离子 D.阳离子
4.设是阿伏加德罗常数的值,下列说法正确的是( )
A.由和组成的混合气体中所含中子数为15
B.石英晶体中含有的键的数目是0.2
C.时,的溶液中含有数为0.1
D.电解精炼铜时,若阳极质量减少,则电路中转移的电子数目为2
5.下列晶体中由原子直接构成的是( )
A.金刚石 B.足球烯 C.金属钾 D.白磷
6.已知R、W、X、Y、Z均为短周期主族元素,其中R元素所在的周期数是其族序数的一半,且R对应的两种常见氧化物均为酸性氧化物;W元素与Z元素在同一主族;X是短周期主族元素中原子半径最大的;Y元素原子最外层电子数为m,次外层电子数为n;Z元素原子L层电子数为m+n,M层电子数为m-n。下列叙述正确的是( )
A.R、X、Y对应的简单离子半径:Y
C.与的VSEPR模型相同,空间结构不同
D.Y的简单氢化物的熔、沸点比R的简单氢化物的熔、沸点低
7.氮化碳是新发现的高硬度材料,其部分结构如下图所示。下列有关其说法正确的是( )
A.氮化碳中C原子和N原子的最外层都满足8电子稳定结构
B.氮化碳中碳显-4价,氮显+3价
C.氮化碳的硬度比金刚石略小
D.该晶体与金刚石相似,都是原子间以非极性键结合形成的空间网状结构
8.2024年5月,我国首辆火星车“祝融号”成功着陆。“祝融号”火星车的车身选用高强韧性的新型铝基碳化硅复合材料。碳化硅(SiC)属于( )
A.共价晶体 B.分子晶体 C.离子晶体 D.金属晶体
9.类比推理是化学中常用的思维方法。下列说法正确的是( )
A.干冰晶体是分子密堆积,则冰晶体也是分子密堆积
B.氧化铝是两性氧化物,则氧化铍也是两性氧化物
C.氯水具有较强的漂白性,则碘水也具有较强的漂白性
D.元素、位于同一主族,则元素、也位于同一主族
10.物质结构决定物质性质,下列性质差异正确且与结构因素对应的是( )
物质性质 结构因素
A. 酸性: 分子极性
B. 沸点: 氢键的键能
C. 水中溶解度: > 分子极性
D. 熔点:金刚石>晶体硅 原子半径
A.A B.B C.C D.D
11.下列叙述中正确的是( )
A.分子晶体中一定存在共价键 B.离子晶体中一定含金属元素
C.共价晶体中一定不存在分子 D.晶体中有阳离子必定含有阴离子
12.利用可实现人工合成金刚石。下列关于该反应的说法错误的是( )
A.C(金刚石)属于共价晶体
B.该反应利用了的强还原性
C.晶体硅和金刚石中的、C的杂化方式都是
D.晶体中每个周围与它最接近且距离相等的有12个
13.下列各组物质各自形成的晶体,均属于分子晶体的化合物是( )
A.、、 B.,、
C.、、 D.,、
14.下列说法错误的是( )
A.共价晶体中只存在非极性共价键
B.分子晶体的状态变化,需克服分子间作用力而不破坏共价键
C.金属晶体通常具有导电、导热和良好的延展性
D.离子晶体在熔化状态下能导电
二、解答题(共4题,58分)
15.GaN是制造微电子器件,光电子器件的新型半导体材料。综合利用炼锌矿渣{主要含铁酸镓[]、铁酸锌(),还含少量Fe及一些难溶于酸的物质}获得金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如图。
已知:①在酸性条件下不稳定,易转化为。
②常温下,“浸出液”中的金属离子对应的氢氧化物的溶度积常数如下表,离子浓度小于时可视为沉淀完全。
氢氧化物
③,。
回答下列问题:
(1)为提高浸出率,可采取的措施为___________(填标号)。
a.将矿渣粉碎 b.降低温度
c.把稀硫酸换成浓硫酸 d.延长浸出时间
(2)已知纤锌矿结构的GaN晶胞结构与金刚石结构类似,则该种GaN晶体的类型为___________,基态Ga原子价层电子的轨道表示式为___________。
(3)与稀硫酸反应的化学方程式为___________。
(4)“调pH”时需调节溶液pH的最小值为___________。
(5)检验“滤液1”中是否含有的试剂为___________(填名称)。
(6)电解反萃取液(溶质为)制粗镓的装置如图所示,阳极的电极反应式为___________,电解废液经处理后可循环使用,其主要溶质为___________(填化学式)。
(7)采用MOCVD(金属有机化合物化学气相沉积)技术制备GaN时,反应会产生一种标准状况下密度约为的可燃性气体,写出该反应的化学方程式:___________(不写条件)。
16.X、Y、Z、Q、R、T、U分别代表原子序数依次增大的前20号元素。X原子中K层和L层电子数相等:Y的最高价氧化物对应的水化物化学式为;Z可形成氢化物;Q的一种核素的中子数为14,质量数为28:R最外层电子数为内层电子数的一半;T为同周期非金属性最强的元素;U可与T形成离子化合物。
(1)下列X原子的轨道表示式表示的状态中,能量最高的是_______(填序号)
A. B.
C. D.
(2)中Z原子的杂化形式分别为_______和_______。
(3)Y单质、Q单质、及QY化合物均为共价晶体,熔点由高到低的排序是_______(填化学式)。
(4)空间构型为正四面体形,键角为_______度,R的氢化物的沸点低于同族Z的氢化物,其原因是_______________。
(5)合成氨反应中,催化剂铁表面上铁原子吸附离解的Z原子局部示意图如图所示(图中小黑球代表Z原子,灰球代表铁原子)。则催化剂表面上ZFe原子数比为_______________。
17.如图是几种晶体的结构示意图,它们是NaCl、干冰、金刚石、石墨结构中的一部分。
(1)其中代表金刚石的是_________(填字母),金刚石属于_________晶体。
(2)其中代表石墨的是_________(填字母),其晶体中碳原子呈平面层状结构排列。
(3)其中代表NaCl的是_________(填字母),晶体中与之间通过_________结合。
(4)其中代表干冰的是_________(填字母),它属于_________晶体,分子间通过_________结合。
(5)A、B、C所代表物质的熔点由高到低的排列顺序为_________(填字母)。
18.有下列8种晶体,用序号回答下列问题:
①CO
②NaCl
③Na
④Si
⑤
⑥金刚石
⑦
⑧
(1)属于共价晶体的是_______含有共价键的离子晶体是_______。
(2)已知①的熔沸点比⑧高,原因是_______。
(3)①~⑤五种物质的熔点由高到低的顺序是_______。
参考答案
1.答案:B
解析:和都属于分子晶体相对分子质量越大陒、沸点越高、则的沸点高于和也属于分子晶体但分子间存在氢键,沸点高于,故A错误。
N、P是同主族元責,形成的离子和结构相似都是正四面体构型故B正确。
是分子晶体、而是原子晶体、故C错误。
中两个对称,是非极性分子,而是锯齿形结构,是极性分子,故D错误。
2.答案:C
解析:
3.答案:C
解析:单质晶体可能有:硅、金刚石——原子晶体,P、S、——分子晶体,Na、Mg——金属晶体,在这些晶体中,构成晶体的粒子分别是原子、分子、金属离子和自由电子。C中阴离子只有存在于离子晶体中,构成离子晶体的粒子是阴、阳离子,所以离子晶体不可能形成单质晶体,答案选C。
4.答案:A
解析:A.含有15个中子,含有15个中子,由和组成的混合气体中所含中子数为15,A正确;
B.中含键,则石英晶体即中含有的键的数目是0.4,B错误;
C.溶液体积未知,无法计算离子数目,C错误;
D.电解精炼铜时阳极除了铜失电子外,锌和铁也会失去电子,即阳极质量减少,电路中转移的电子数目不是2,D错误;
故选A。
5.答案:A
解析:
6.答案:C
解析:A.R、X、Y对应的简单离子分别为、、,离子半径为>>,A错误;
B.W和Z的最高价氧化物分别为、,其中晶体类型为分子晶体,晶体类型为共价晶体,晶体类型不相同,B错误;
C.与分别为,的VSEPR模型为平面三角形,空间结构为平面正三角形,的VSEPR模型为平面三角形,空间结构为形,故二者VSEPR模型相同,空间结构不同,C正确;
D.Y、R的简单氢化物分别为、,二者晶体类型都为分子晶体,分子间形成氢键,熔、沸点高于,D错误;
答案选C。
7.答案:A
解析:A.由图可知C与周围4个N形成单键,N与周围3个C形成单键,每个原子都满足8电子稳定结构,故A正确;
B.N的非金属性比C强,两者形成共价键时,N显负价,C显正价,故B错误;
C.N原子半径小于C,键长比金刚石中键短,键能更大,氮化碳的硬度大于金刚石,故C错误;
D.C和N形成极性键,故D错误;
故选:A。
8.答案:A
解析:SiC中的Si和C以共价键结合形成空间网状结构,和金刚石结构相似,SiC属于共价晶体,故选A。
9.答案:B
解析:A.冰晶体中水分子间存在氢键,不是分子密堆积,故A错误;
B.氧化铝是两性氧化物,氧化铍和氧化铝的组成相似,也是两性氧化物,故B正确;
C.氯水具有较强的漂白性,碘水不具有漂白性,故C错误;
D.元素Sr、Ba位于同一主族元素,但Ba和W不是同一主族,故D错误。
10.答案:D
解析:
11.答案:C
解析:A.稀有气体形成的分子晶体中不存在共价键,A错误;
B.氯化铵离子晶体中不含金属元素,B错误;
C.共价晶体靠共价键形成,共价晶体中一定不存在分子,C正确;
D.金属晶体中有阳离子,但是不含有阴离子,D错误;
故选C。
12.答案:D
解析:A,金刚石是由C原子通过共价键聚集而成的共价晶体,A正确;B.该反应中Na元素的化合物升高,作氧化剂,利用的强还原性将中的C还原为金刚石,B正确;C晶体硅中的原子、金刚石中的C原子均形成4个键,价层电子对数为4,为杂化,C正确;D.的晶胞结构如图所示,以体心为例,晶体中每个周围与它最接近且距离相等的有6个,D错误;综上所述答案为D。
13.答案:B
解析:不是化合物,A错误;、、均为化合物且都是分子晶体,B正确;是共价晶体,C错误;、是离子晶体,D错误。
14.答案:A
解析:
15.答案:(1)ad
(2)共价晶体;
(3)
(4)5.3
(5)硫氰化钾
(6);
(7)
解析:(1)为提高浸出率,可采取的措施有粉碎矿渣,延长浸出时间,故选ad;
(2)金刚石为共价晶体,GaN晶胞结构与金刚石结构类似,则该种GaN晶体的类型为共价晶体;Ga为31号元素,则基态Ga原子价层电子的轨道表示式为;
(3)根据化合物中各元素化合价代数和为0可知,铁元素的化合价为+3价,与稀硫酸反应生成硫酸锌、硫酸铁和水,反应的化学方程式为;
(4)调节pH,沉淀铁离子和,滤液1中含有锌离子,,,,pH=6-lg5=5.3,则“调”时需调节溶液的最小值为5.3;
(5)遇到硫氰根离子显红色,则检验“滤液1”中是否含有的试剂为硫氰化钾;
(6)由图可知,阳极水失去电子生成氧气同时生成碳酸氢根离子,则阳极的电极反应式为:;“电解”反萃取液(溶质为)制粗镓后的电解废液经处理后可循环使用,阴极上水电离出的氢离子得电子产生氢气,电解废液的主要溶质为;
(7)采用MOCVD(金属有机化合物化学气相沉积)技术制备GaN时,反应会产生一种标准状况下密度约为的可燃性气体,则,则为甲烷气体,故该反应的化学方程式:。
16.答案:(1)①D
(2)①
②
(3)C>SiC>Si
(4)①60
②中存在分子间氢键
(5)1:2
解析:
17.答案:(1)B;共价
(2)D
(3)A;离子键
(4)C;分子;分子间作用力
(5)B>A>C
解析:金刚石是共价晶体,碳原子间以共价键结合,B是金刚石的结构模型。石墨是层状结构,D是石墨的结构模型。氯化钠是和按个数比1:1堆积而成的离子晶体,A是氯化钠的结构模型。干冰晶体中,分子间依靠分子间作用力结合,C是干冰的结构模型。一般来说,晶体的熔点:共价晶体>离子晶体>分子晶体。
18.答案:(1)④⑥;⑦
(2)同为分子晶体,相对分子质量接近的物质,分子的极性越大,其熔沸点越高
(3)④>②>③>⑤>①
解析:
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
