3.3金属晶体与离子晶体--2024-2025学年高中化学人教版选择性必修二课时作业(含答案)
文档属性
| 名称 | 3.3金属晶体与离子晶体--2024-2025学年高中化学人教版选择性必修二课时作业(含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-25 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
金属晶体与离子晶体--2024-2025学年高中化学人教版选择性必修二课时作业
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H∶1 C∶12 N∶14 O∶16 Na∶23 S∶32
一、单选题(每题3分,共42分)
1.氯化亚砜又称亚硫酰氯,常温下为黄色的液体,熔点,沸点,常用作有机合成工业中的氯化剂,遇水立即水解。下列说法不正确的是( )
A.与混合共热,可得无水
B.的空间结构为平面三角形
C.与足量溶液反应生成和
D.熔沸点比高
2.下列晶体性质的比较中,正确的是( )
A.熔点:金刚石>晶体硅>碳化硅 B.沸点:
C.硬度:白磷>冰>二氧化硅 D.熔点:
3.物质的结构决定其性质。下列实例与解释不相符的是( )
选项 实例 解释
A 用替代填充探空气球更安全 的电子构型稳定,不易得失电子
B 与形成配合物 中的B有空轨道接受中N的孤电子对
C 碱金属中的熔点最高 碱金属中的价电子数最少,金属键最强
D 不存在稳定的分子 N原子价层只有4个原子轨道,不能形成5个键
A.A B.B C.C D.D
4.下列各组物质熔化或升华时,所克服的粒子间作用属于同种类型的是( )。
A.和熔化 B.Mg和S熔化
C.氯化钠和蔗糖熔化 D.碘和干冰升华
5.氮化硼晶体有多种结构,六方相氮化硼结构与石墨相似,但不具有导电性,立方相氮化硼结构与金刚石相似。下列说法错误的是( )
A.六方相氮化硼层上键电子不能自由移动
B.六方相氮化硼熔点高于立方相氮化硼
C.立方相氮化硼中存在“N→B”的配位键
D.(六方相氮化硼)中含键
6.下列各组物质性质的比较,结论正确的是( )
A.物质的沸点: B.物质的硬度:金刚石<晶体硅
C.分子的还原性: D.分子的热稳定性:
7.科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为apm。阿伏加德罗常数的值为。下列说法错误的是
A.晶体最简化学式为
B.晶体中与最近且距离相等的有6个
C.晶胞中B和C原子构成的多面体有14个面
D.晶体的密度为
8.下列有关物质的晶体类型解题思路正确的是( )
A.均为离子晶体
B.常温下能导电的物质属于金属晶体
C.由单原子构成的物质一定是共价晶体
D.物质中存在共价键的晶体可能是离子晶体
9.下列物质的晶体一定属于离子晶体的是( )
A.在水中能电离出离子的物质 B.熔融状态下能导电的化合物
C.在水中能电离出的化合物 D.熔化时化学键无变化的化合物
10.下列物质按沸点由高到低排列的顺序是( )
①;②;③;④
A.②④①③ B.④②①③ C.④②③① D.②④③①
11.下列叙述错误的是( )
A.金属键无方向性和饱和性,原子配位数较高
B.晶体尽量采取紧密堆积方式,以使其变得比较稳定
C.因共价键有饱和性和方向性,所以原子晶体不遵循“紧密堆积”原理
D.金属铜和镁均以ABAB…方式堆积
12.下列离子晶体熔点排列顺序正确的是( )
A.NaClC.NaCl13.下列叙述正确的是( )
A.1个甘氨酸分子中存在9对共用电子对
B.和分子中所有原子的最外层都达到8电子稳定结构
C.和分子都是含极性键的极性分子
D.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅
14.下列叙述正确的是( )
A.任何晶体中,若含有阳离子,就一定含有阴离子
B.金属晶体的形成是因为晶体中存在金属阳离子间的相互作用
C.价电子数越多,金属元素的金属性越强
D.含有金属元素的离子不一定是阳离子
二、解答题(共4题,58分)
15.副族元素可以形成多种多样的化合物。回答下列问题:
(1)基态Zn原子能量最高的电子占据的能层是_______,铜转炉烟灰(主要成分为),加入氯化铵和氨水,生成,则浸取时反应的离子方程式为_______。
(2)已知的合成过程如下:HCl+
①+中存在配位键,接受孤电子对的离子或原子是_______。
②具有较低的熔点。从结构角度解释原因_______。
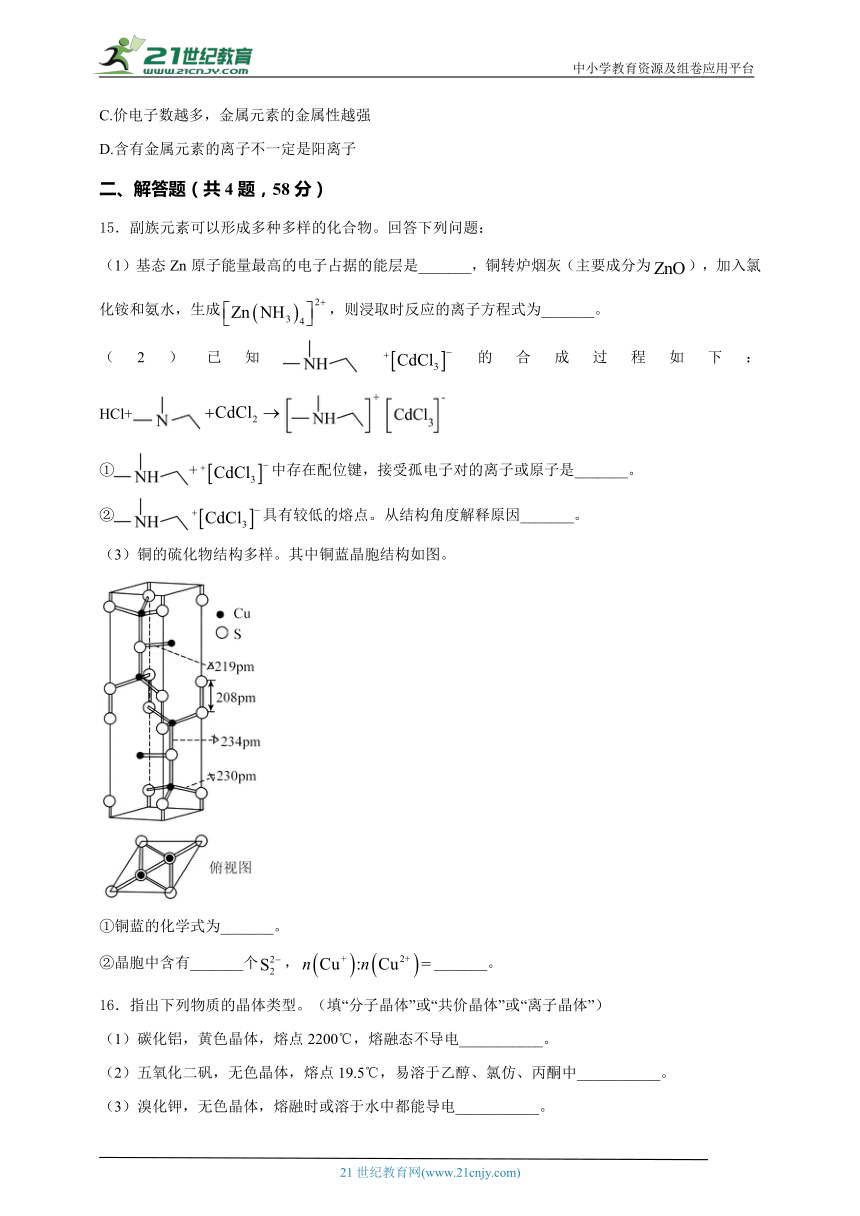
(3)铜的硫化物结构多样。其中铜蓝晶胞结构如图。
①铜蓝的化学式为_______。
②晶胞中含有_______个,_______。
16.指出下列物质的晶体类型。(填“分子晶体”或“共价晶体”或“离子晶体”)
(1)碳化铝,黄色晶体,熔点2200℃,熔融态不导电___________。
(2)五氧化二矾,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中___________。
(3)溴化钾,无色晶体,熔融时或溶于水中都能导电___________。
(4)氯化铁常温下为固体,熔点为282℃,沸点为315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断氧化铁晶体为___________。
17.Ⅰ.现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:3550 Li:181 HF:
硅晶体:1410 Na:98 :
硼晶体:2300 K:64 :
二氧化硅:1732 Rb:39 HI:
据此回答下列问题:
(1)由表格可知,A组物质熔点普遍偏高,A组属于__________晶体,硅晶体的熔点低于金刚石,是由于_____________________。
(2)C组中HF相对分子质量小于但熔点却高于,是由于_____________。
(3)D组晶体中、、、的熔点由高到低的顺序为______________。
Ⅱ.下图表示一些常见晶体的微观结构:
(4)其中代表的是__________(填字母);在干冰晶体中,每个分子周围紧邻的分子有__________个。
(5)晶体在的高压下和反应生成如上图1所示的晶胞结构,则该晶体的化学式为__________。
(6)的晶胞如上图2所示,密度为,相邻的两个的最近核间距为anm,则的摩尔质量为__________(列出代数式,设为阿伏加德罗常数的值)。
18.我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是_______(填标号,下同),用光谱仪可捕捉到发射光谱的是______________。
A. B.
C. D.
(2)中心原子为,中心原子为O,二者均为V形结构,但中存在大键()。中原子的轨道杂化方式为;键角_______键角(填“>”“<”或“=”)。
(3)镍能形成多种配合物,其中是无色挥发性液体,是红黄色单斜晶体。的熔点高于的原因是______________。
(4)水催化氧化是“分子人工光合作用”的关键步骤。水的晶体有普通冰和重冰等不同类型。普通冰的晶胞结构与水分子间的氢键如图甲、乙所示。晶胞参数,,;标注为1、2、3的氧原子在Z轴的分数坐标分别为:。晶胞中氢键的长度为_______(列出数学表达式,不必计算出结果)。
(5)是重要的稀土抛光材料,图甲为理想的的立方晶胞模型,但是几乎不存在完美的晶型,实际晶体中常存在缺陷(如图乙)。
已知:缺陷晶型中X处原子的分数坐标为(0,0,0),Y处原子的分数坐标为(),则氧空位处原子的分数坐标为_______,该缺陷晶型的化学式可表示为_______。设阿伏加德罗常数的值为,理想晶型的密度为,则原子与O原子的最近距离为_______(列出表达式)。
参考答案
1.答案:B
解析:A.加热生成氯化铝和水,氯化铝水溶液在加热时发生水解生成HCl和,而遇到水,水解生成HCl和,其中HCl抑制了氯化铝的水解,最后与混合共热,可得无水,A正确;
B.中心原子S的价层电子对数=,分子结构为三角锥形,B错误;
C.遇到水,水解生成HCl和,均与NaOH反应,生成物为和,C正确;
D.和均为分子晶体,范德华力越大,熔沸点越高,前者的相对分子质量大于后者,故熔沸点比高,D正确;
故答案选B。
2.答案:D
解析:由C—C、C—Si、Si—Si键的键能和键长可判断熔点;金刚石碳化硅晶体硅,A项错误;沸点:,B项错误;二氧化硅是共价晶体,硬度大,白磷和冰都是分子晶体,硬度小,C项错误;由、、的相对分子质量可判断熔点:,D项正确。
3.答案:C
解析:A.氢气具有可燃性,使用氢气填充气球存在一定的安全隐患,而相比之下,氦气是一种惰性气体,不易燃烧或爆炸,因此使用电子构型稳定,不易得失电子的氦气填充气球更加安全可靠,故A正确;
B.三氟化硼分子中硼原子具有空轨道,能与氨分子中具有孤对电子的氮原子形成配位键,所以三氟化硼能与氨分子形成配合物,故B正确;
C.碱金属元素的价电子数相等,都为1,锂离子的离子半径在碱金属中最小,形成的金属键最强,所以碱金属中锂的熔点最高,故C错误;
D.氮原子价层只有4个原子轨道,3个不成对电子,由共价键的饱和性可知,氮原子不能形成5个氮氟键,所以不存在稳定的五氟化氮分子,故D正确;
故选C。
4.答案:D
解析:熔化时破坏离子键,熔化时破坏共价键,A错误;Mg熔化时破坏金属键,S熔化时破坏分子间作用力,B错误;氯化钠熔化时破坏离子键,蔗糖熔化时破坏分子间作用力,C错误;碘和干冰都是分子晶体,升华时均破坏分子间作用力,D正确。
5.答案:D
解析:A.六方相氮化硼结构与石墨相似,有大键,但氮的电负性大吸引电子能力强,导致π电子不能自由移动,故A正确;
B.六方相氮化硼层间为分子间作用力,和石墨结构类似,为混合晶体,立方相氮化硼为空间网状结构,不存在分子,为共价晶体;类比石墨的熔点高于金刚石,所以六方相氮化硼熔点高于立方相氮化硼,故B正确;
C.B原子最外层有3个电子,存在空轨道,N原子最外层有5个电子,存在孤电子对,所以立方相氮化硼含配位键N→B,故C正确;
D.六方相氮化硼晶体中层内每个硼原子与相邻的3个氮原子构成平面三角形,每个共价键未被共有,所以1mol六方相氮化硼含3xmolB-N共价键,故D错误;
故选D。
6.答案:C
解析:
7.答案:B
解析:
8.答案:D
解析:是分子晶体,A错误;常温下石墨也能导电,但石墨是混合型晶体,B错误;稀有气体由单原子构成,是分子晶体,C错误;NaOH中含有H—O共价键,是离子晶体,D正确。
9.答案:B
解析:A.在水中能电离出离子的物质常见为电解质,可能是酸、碱、盐,如硫酸是分子晶体,但在水中能电离出氢离子和硫酸根离子,A项错误;
B.熔融状态下能导电的化合物一定是离子化合物,B项正确;
C.如硫酸是分子晶体,但在水中能电离出氢离子和硫酸根离子,C项错误;
D.熔化时化学键无变化的晶体可能是分子晶体,如冰融化变成液态水,D项错误;
故选B。
10.答案:A
解析:碳原子数相同时,支链越多,沸点越低,②和④中均含有5个C原子,但④中含支链,则沸点为②>④,①和③中均含有4个C原子,但③中含支链,则沸点为①>③,烷烃的相对分子质量越大,沸点越高,所以沸点由高到低的顺序为②④①③;故选A。
11.答案:D
解析:晶体一般尽量采取紧密堆积方式;金属键无饱和性和方向性;共价键有饱和性和方向性,所以原子晶体不遵循“紧密堆积”原理;Mg以…ABAB…方式堆积,但Cu以…ABCABC…方式堆积。
12.答案:A
解析:
13.答案:D
解析:A项,甘氨酸的结构简式为,其分子中含有10对共用电子对,A项错误;
B项,中P和Cl的最外层都达到8电子稳定结构,中B原子最外层为6个电子,B项错误;
C项,的分子构型为V型,正负电的中心不重合,是含极性键的极性分子,的分子构型为直线型,正负电中心重合,是含极性键的非极性分子,C项错误;
D项,金刚石、碳化硅、晶体硅都属于原子晶体,但原子半径,键长:,键能:,则熔点由高到低的顺序:金刚石>碳化硅>晶体硅,D项正确;
故答案选D。
14.答案:D
解析:金属晶体中存在阳离子,但没有阴离子,A错误;金属晶体的形成是因为晶体中存在金属阳离子与自由电子间的相互作用,B错误;价电子数多的金属原子的金属性不一定强,如Fe的价电子数比Na多,但Fe的金属性没有Na的强,C错误;含有金属元素的离子不一定是阳离子,如等,D正确。
15.答案:(1)N;
(2);该化合物是离子化合物,离子半径较大,离子键弱
(3)CuS;2;2:1
解析:(1)Zn是30号元素,基态Zn原子共4个电子层,能量最高的电子占据的能层是N层,铜转炉烟灰(主要成分为),加入氯化铵和氨水,生成,则浸取时和铵根离子、氨水反应生成和水,反应的离子方程式为。
(2)①中N、Cl-存在孤电子对,含有空轨道,接受孤电子对的离子或原子是;②是离子化合物,离子半径较大,离子键弱,所以具有较低的熔点。
(3)由晶胞可知与Cu形成3个键,个数为2个,为楞上2个S直接相连的部分,个数为,则S原子数为6个、由晶胞可知晶胞中Cu的总个数为6个;铜蓝的化学式为CuS。②晶胞中含有2个,晶胞中S的总价态为2×(-2)+2×(-2)=-8,由晶胞可知晶胞中Cu的总个数为6个,设的个数为x,的个数为y,则x+y=6,x+2y=+8,联立二式子解得x=2,y=1,2:1。
16.答案:(1)共价晶体
(2)分子晶体
(3)离子晶体
(4)分子晶体
解析:
17.答案:(1)共价;Si原子半径大于C原子半径,C—C键键长比Si—Si键键长小,故C—C键键能大
(2)HF分子间能形成氢键,其熔化时需要消耗的能量更多
(3)
(4)C;12
(5)
(6)
解析:
18.答案:(1)ACD
(2);>
(3)为离子晶体,而为分子晶体
(4)
(5)();;或
解析:(1)A中各轨道都处于全满状态比较稳定,较难失去电子,因此失去一个电子需要的能量最高;发射光谱是指电子从高能量轨道跃迁到低能量轨道时释放能量的现象,即原子从激发态到稳态过程发出电离辐射的过程,处于激发态的原子为CD,故答案为:A;CD;
(2)由中存在可以推断,其中Cl原子只能提供1对电子,有一个O原子提供1个电子,另一个O原子提供1对电子,这5个电子处于互相平行的轨道中形成大π键,Cl提供孤电子对与其中一个O形成配位键,Cl与另一个O形成的是普通的共价键(σ键,这个O只提供了一个电子参与形成大π键),Cl的价层电子对数3,则Cl原子的轨道杂化方式为;中心原子为O,其价层电子对数为2+=4,因此,的杂化方式为,根据价层电子对互斥理论可知,时,价电子对的几何构型为正四面体,时,价电子对的几何构型平面正三角形,杂化的键角一定大于的,因此,虽然和均为V形结构,但O-Cl-O键角大于Cl-O-Cl键角,
故答案为:;>;
(3)为离子晶体,熔化需要破坏离子键,离子键键能大,离子晶体熔沸点高;为分子晶体,熔化破坏分子间作用力,分子间作用力小,分子晶体熔沸点小,
故答案为:为离子晶体,而为分子晶体;
(4)氢键键长为通过氢键的两个氧原子的核间距,晶胞Z轴方向距离最近两个O原子的距离为氢键的长度(O-H…O的长度)为,
故答案为:;
(5)根据理想的的立方晶胞模型可知,O原子位于4个Ce原子组成的正四面体空隙中,的缺陷型晶型中,氧空位处的原子位于晶胞体对角线的处,所以其分数坐标是(,,)。该缺陷晶型中Ce原子个数为,O原子个数为7,故化学式是;每个晶胞中含有4个,设晶胞边长为apm,,晶胞边长pm,晶胞体对角线长为,再计算Ce原子核O原子的最近距离,其距离为晶胞体对角线长的,即或,
故答案为:(,,);;或。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
金属晶体与离子晶体--2024-2025学年高中化学人教版选择性必修二课时作业
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H∶1 C∶12 N∶14 O∶16 Na∶23 S∶32
一、单选题(每题3分,共42分)
1.氯化亚砜又称亚硫酰氯,常温下为黄色的液体,熔点,沸点,常用作有机合成工业中的氯化剂,遇水立即水解。下列说法不正确的是( )
A.与混合共热,可得无水
B.的空间结构为平面三角形
C.与足量溶液反应生成和
D.熔沸点比高
2.下列晶体性质的比较中,正确的是( )
A.熔点:金刚石>晶体硅>碳化硅 B.沸点:
C.硬度:白磷>冰>二氧化硅 D.熔点:
3.物质的结构决定其性质。下列实例与解释不相符的是( )
选项 实例 解释
A 用替代填充探空气球更安全 的电子构型稳定,不易得失电子
B 与形成配合物 中的B有空轨道接受中N的孤电子对
C 碱金属中的熔点最高 碱金属中的价电子数最少,金属键最强
D 不存在稳定的分子 N原子价层只有4个原子轨道,不能形成5个键
A.A B.B C.C D.D
4.下列各组物质熔化或升华时,所克服的粒子间作用属于同种类型的是( )。
A.和熔化 B.Mg和S熔化
C.氯化钠和蔗糖熔化 D.碘和干冰升华
5.氮化硼晶体有多种结构,六方相氮化硼结构与石墨相似,但不具有导电性,立方相氮化硼结构与金刚石相似。下列说法错误的是( )
A.六方相氮化硼层上键电子不能自由移动
B.六方相氮化硼熔点高于立方相氮化硼
C.立方相氮化硼中存在“N→B”的配位键
D.(六方相氮化硼)中含键
6.下列各组物质性质的比较,结论正确的是( )
A.物质的沸点: B.物质的硬度:金刚石<晶体硅
C.分子的还原性: D.分子的热稳定性:
7.科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为apm。阿伏加德罗常数的值为。下列说法错误的是
A.晶体最简化学式为
B.晶体中与最近且距离相等的有6个
C.晶胞中B和C原子构成的多面体有14个面
D.晶体的密度为
8.下列有关物质的晶体类型解题思路正确的是( )
A.均为离子晶体
B.常温下能导电的物质属于金属晶体
C.由单原子构成的物质一定是共价晶体
D.物质中存在共价键的晶体可能是离子晶体
9.下列物质的晶体一定属于离子晶体的是( )
A.在水中能电离出离子的物质 B.熔融状态下能导电的化合物
C.在水中能电离出的化合物 D.熔化时化学键无变化的化合物
10.下列物质按沸点由高到低排列的顺序是( )
①;②;③;④
A.②④①③ B.④②①③ C.④②③① D.②④③①
11.下列叙述错误的是( )
A.金属键无方向性和饱和性,原子配位数较高
B.晶体尽量采取紧密堆积方式,以使其变得比较稳定
C.因共价键有饱和性和方向性,所以原子晶体不遵循“紧密堆积”原理
D.金属铜和镁均以ABAB…方式堆积
12.下列离子晶体熔点排列顺序正确的是( )
A.NaCl
A.1个甘氨酸分子中存在9对共用电子对
B.和分子中所有原子的最外层都达到8电子稳定结构
C.和分子都是含极性键的极性分子
D.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅
14.下列叙述正确的是( )
A.任何晶体中,若含有阳离子,就一定含有阴离子
B.金属晶体的形成是因为晶体中存在金属阳离子间的相互作用
C.价电子数越多,金属元素的金属性越强
D.含有金属元素的离子不一定是阳离子
二、解答题(共4题,58分)
15.副族元素可以形成多种多样的化合物。回答下列问题:
(1)基态Zn原子能量最高的电子占据的能层是_______,铜转炉烟灰(主要成分为),加入氯化铵和氨水,生成,则浸取时反应的离子方程式为_______。
(2)已知的合成过程如下:HCl+
①+中存在配位键,接受孤电子对的离子或原子是_______。
②具有较低的熔点。从结构角度解释原因_______。
(3)铜的硫化物结构多样。其中铜蓝晶胞结构如图。
①铜蓝的化学式为_______。
②晶胞中含有_______个,_______。
16.指出下列物质的晶体类型。(填“分子晶体”或“共价晶体”或“离子晶体”)
(1)碳化铝,黄色晶体,熔点2200℃,熔融态不导电___________。
(2)五氧化二矾,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中___________。
(3)溴化钾,无色晶体,熔融时或溶于水中都能导电___________。
(4)氯化铁常温下为固体,熔点为282℃,沸点为315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断氧化铁晶体为___________。
17.Ⅰ.现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:3550 Li:181 HF:
硅晶体:1410 Na:98 :
硼晶体:2300 K:64 :
二氧化硅:1732 Rb:39 HI:
据此回答下列问题:
(1)由表格可知,A组物质熔点普遍偏高,A组属于__________晶体,硅晶体的熔点低于金刚石,是由于_____________________。
(2)C组中HF相对分子质量小于但熔点却高于,是由于_____________。
(3)D组晶体中、、、的熔点由高到低的顺序为______________。
Ⅱ.下图表示一些常见晶体的微观结构:
(4)其中代表的是__________(填字母);在干冰晶体中,每个分子周围紧邻的分子有__________个。
(5)晶体在的高压下和反应生成如上图1所示的晶胞结构,则该晶体的化学式为__________。
(6)的晶胞如上图2所示,密度为,相邻的两个的最近核间距为anm,则的摩尔质量为__________(列出代数式,设为阿伏加德罗常数的值)。
18.我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是_______(填标号,下同),用光谱仪可捕捉到发射光谱的是______________。
A. B.
C. D.
(2)中心原子为,中心原子为O,二者均为V形结构,但中存在大键()。中原子的轨道杂化方式为;键角_______键角(填“>”“<”或“=”)。
(3)镍能形成多种配合物,其中是无色挥发性液体,是红黄色单斜晶体。的熔点高于的原因是______________。
(4)水催化氧化是“分子人工光合作用”的关键步骤。水的晶体有普通冰和重冰等不同类型。普通冰的晶胞结构与水分子间的氢键如图甲、乙所示。晶胞参数,,;标注为1、2、3的氧原子在Z轴的分数坐标分别为:。晶胞中氢键的长度为_______(列出数学表达式,不必计算出结果)。
(5)是重要的稀土抛光材料,图甲为理想的的立方晶胞模型,但是几乎不存在完美的晶型,实际晶体中常存在缺陷(如图乙)。
已知:缺陷晶型中X处原子的分数坐标为(0,0,0),Y处原子的分数坐标为(),则氧空位处原子的分数坐标为_______,该缺陷晶型的化学式可表示为_______。设阿伏加德罗常数的值为,理想晶型的密度为,则原子与O原子的最近距离为_______(列出表达式)。
参考答案
1.答案:B
解析:A.加热生成氯化铝和水,氯化铝水溶液在加热时发生水解生成HCl和,而遇到水,水解生成HCl和,其中HCl抑制了氯化铝的水解,最后与混合共热,可得无水,A正确;
B.中心原子S的价层电子对数=,分子结构为三角锥形,B错误;
C.遇到水,水解生成HCl和,均与NaOH反应,生成物为和,C正确;
D.和均为分子晶体,范德华力越大,熔沸点越高,前者的相对分子质量大于后者,故熔沸点比高,D正确;
故答案选B。
2.答案:D
解析:由C—C、C—Si、Si—Si键的键能和键长可判断熔点;金刚石碳化硅晶体硅,A项错误;沸点:,B项错误;二氧化硅是共价晶体,硬度大,白磷和冰都是分子晶体,硬度小,C项错误;由、、的相对分子质量可判断熔点:,D项正确。
3.答案:C
解析:A.氢气具有可燃性,使用氢气填充气球存在一定的安全隐患,而相比之下,氦气是一种惰性气体,不易燃烧或爆炸,因此使用电子构型稳定,不易得失电子的氦气填充气球更加安全可靠,故A正确;
B.三氟化硼分子中硼原子具有空轨道,能与氨分子中具有孤对电子的氮原子形成配位键,所以三氟化硼能与氨分子形成配合物,故B正确;
C.碱金属元素的价电子数相等,都为1,锂离子的离子半径在碱金属中最小,形成的金属键最强,所以碱金属中锂的熔点最高,故C错误;
D.氮原子价层只有4个原子轨道,3个不成对电子,由共价键的饱和性可知,氮原子不能形成5个氮氟键,所以不存在稳定的五氟化氮分子,故D正确;
故选C。
4.答案:D
解析:熔化时破坏离子键,熔化时破坏共价键,A错误;Mg熔化时破坏金属键,S熔化时破坏分子间作用力,B错误;氯化钠熔化时破坏离子键,蔗糖熔化时破坏分子间作用力,C错误;碘和干冰都是分子晶体,升华时均破坏分子间作用力,D正确。
5.答案:D
解析:A.六方相氮化硼结构与石墨相似,有大键,但氮的电负性大吸引电子能力强,导致π电子不能自由移动,故A正确;
B.六方相氮化硼层间为分子间作用力,和石墨结构类似,为混合晶体,立方相氮化硼为空间网状结构,不存在分子,为共价晶体;类比石墨的熔点高于金刚石,所以六方相氮化硼熔点高于立方相氮化硼,故B正确;
C.B原子最外层有3个电子,存在空轨道,N原子最外层有5个电子,存在孤电子对,所以立方相氮化硼含配位键N→B,故C正确;
D.六方相氮化硼晶体中层内每个硼原子与相邻的3个氮原子构成平面三角形,每个共价键未被共有,所以1mol六方相氮化硼含3xmolB-N共价键,故D错误;
故选D。
6.答案:C
解析:
7.答案:B
解析:
8.答案:D
解析:是分子晶体,A错误;常温下石墨也能导电,但石墨是混合型晶体,B错误;稀有气体由单原子构成,是分子晶体,C错误;NaOH中含有H—O共价键,是离子晶体,D正确。
9.答案:B
解析:A.在水中能电离出离子的物质常见为电解质,可能是酸、碱、盐,如硫酸是分子晶体,但在水中能电离出氢离子和硫酸根离子,A项错误;
B.熔融状态下能导电的化合物一定是离子化合物,B项正确;
C.如硫酸是分子晶体,但在水中能电离出氢离子和硫酸根离子,C项错误;
D.熔化时化学键无变化的晶体可能是分子晶体,如冰融化变成液态水,D项错误;
故选B。
10.答案:A
解析:碳原子数相同时,支链越多,沸点越低,②和④中均含有5个C原子,但④中含支链,则沸点为②>④,①和③中均含有4个C原子,但③中含支链,则沸点为①>③,烷烃的相对分子质量越大,沸点越高,所以沸点由高到低的顺序为②④①③;故选A。
11.答案:D
解析:晶体一般尽量采取紧密堆积方式;金属键无饱和性和方向性;共价键有饱和性和方向性,所以原子晶体不遵循“紧密堆积”原理;Mg以…ABAB…方式堆积,但Cu以…ABCABC…方式堆积。
12.答案:A
解析:
13.答案:D
解析:A项,甘氨酸的结构简式为,其分子中含有10对共用电子对,A项错误;
B项,中P和Cl的最外层都达到8电子稳定结构,中B原子最外层为6个电子,B项错误;
C项,的分子构型为V型,正负电的中心不重合,是含极性键的极性分子,的分子构型为直线型,正负电中心重合,是含极性键的非极性分子,C项错误;
D项,金刚石、碳化硅、晶体硅都属于原子晶体,但原子半径,键长:,键能:,则熔点由高到低的顺序:金刚石>碳化硅>晶体硅,D项正确;
故答案选D。
14.答案:D
解析:金属晶体中存在阳离子,但没有阴离子,A错误;金属晶体的形成是因为晶体中存在金属阳离子与自由电子间的相互作用,B错误;价电子数多的金属原子的金属性不一定强,如Fe的价电子数比Na多,但Fe的金属性没有Na的强,C错误;含有金属元素的离子不一定是阳离子,如等,D正确。
15.答案:(1)N;
(2);该化合物是离子化合物,离子半径较大,离子键弱
(3)CuS;2;2:1
解析:(1)Zn是30号元素,基态Zn原子共4个电子层,能量最高的电子占据的能层是N层,铜转炉烟灰(主要成分为),加入氯化铵和氨水,生成,则浸取时和铵根离子、氨水反应生成和水,反应的离子方程式为。
(2)①中N、Cl-存在孤电子对,含有空轨道,接受孤电子对的离子或原子是;②是离子化合物,离子半径较大,离子键弱,所以具有较低的熔点。
(3)由晶胞可知与Cu形成3个键,个数为2个,为楞上2个S直接相连的部分,个数为,则S原子数为6个、由晶胞可知晶胞中Cu的总个数为6个;铜蓝的化学式为CuS。②晶胞中含有2个,晶胞中S的总价态为2×(-2)+2×(-2)=-8,由晶胞可知晶胞中Cu的总个数为6个,设的个数为x,的个数为y,则x+y=6,x+2y=+8,联立二式子解得x=2,y=1,2:1。
16.答案:(1)共价晶体
(2)分子晶体
(3)离子晶体
(4)分子晶体
解析:
17.答案:(1)共价;Si原子半径大于C原子半径,C—C键键长比Si—Si键键长小,故C—C键键能大
(2)HF分子间能形成氢键,其熔化时需要消耗的能量更多
(3)
(4)C;12
(5)
(6)
解析:
18.答案:(1)ACD
(2);>
(3)为离子晶体,而为分子晶体
(4)
(5)();;或
解析:(1)A中各轨道都处于全满状态比较稳定,较难失去电子,因此失去一个电子需要的能量最高;发射光谱是指电子从高能量轨道跃迁到低能量轨道时释放能量的现象,即原子从激发态到稳态过程发出电离辐射的过程,处于激发态的原子为CD,故答案为:A;CD;
(2)由中存在可以推断,其中Cl原子只能提供1对电子,有一个O原子提供1个电子,另一个O原子提供1对电子,这5个电子处于互相平行的轨道中形成大π键,Cl提供孤电子对与其中一个O形成配位键,Cl与另一个O形成的是普通的共价键(σ键,这个O只提供了一个电子参与形成大π键),Cl的价层电子对数3,则Cl原子的轨道杂化方式为;中心原子为O,其价层电子对数为2+=4,因此,的杂化方式为,根据价层电子对互斥理论可知,时,价电子对的几何构型为正四面体,时,价电子对的几何构型平面正三角形,杂化的键角一定大于的,因此,虽然和均为V形结构,但O-Cl-O键角大于Cl-O-Cl键角,
故答案为:;>;
(3)为离子晶体,熔化需要破坏离子键,离子键键能大,离子晶体熔沸点高;为分子晶体,熔化破坏分子间作用力,分子间作用力小,分子晶体熔沸点小,
故答案为:为离子晶体,而为分子晶体;
(4)氢键键长为通过氢键的两个氧原子的核间距,晶胞Z轴方向距离最近两个O原子的距离为氢键的长度(O-H…O的长度)为,
故答案为:;
(5)根据理想的的立方晶胞模型可知,O原子位于4个Ce原子组成的正四面体空隙中,的缺陷型晶型中,氧空位处的原子位于晶胞体对角线的处,所以其分数坐标是(,,)。该缺陷晶型中Ce原子个数为,O原子个数为7,故化学式是;每个晶胞中含有4个,设晶胞边长为apm,,晶胞边长pm,晶胞体对角线长为,再计算Ce原子核O原子的最近距离,其距离为晶胞体对角线长的,即或,
故答案为:(,,);;或。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
