3.1物质的聚集状态与晶体的常识--2024-2025学年高中化学人教版选择性必修二课时作业(含答案)
文档属性
| 名称 | 3.1物质的聚集状态与晶体的常识--2024-2025学年高中化学人教版选择性必修二课时作业(含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-25 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
物质的聚集状态与晶体的常识--2024-2025学年高中化学人教版选择性必修二课时作业
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H∶1 C∶12 N∶14 O∶16 Na∶23 S∶32
一、单选题(每题3分,共42分)
1.铁镁合金是目前储氢密度较高的材料之一,其晶胞结构如图所示,晶胞参数为a。下列说法正确的是( )
A.合金储氢的过程是物理变化
B.铁镁合金中存在金属键和离子键
C.晶体中Fe的配位数为4
D.晶胞中Fe与Mg的最短距离为
2.某离子型铁的氧化物立方晶胞如图所示(由X、Y组成),该离子型铁的氧化物晶体的晶胞参数为anm。设阿伏加德罗常数的值为,下列说法错误的是( )
A.基态Fe原子价层电子排布式为
B.该晶体中
C.该晶胞中有处于体心
D.该晶体的密度为
3.化学与人类生产、生活密切相关,下列说法中错误的是( )
A.歼-20上采用的氮化镓涂层,属于新型金属材料
B.液晶既有液体的流动性,又有类似晶体的各向异性
C.氯化钠不能使蛋白质变性,可用作食品防腐剂
D.碳酸氢铵、碳酸氢钠可用于制作面包等食品的膨松剂
4.具有双钙钠矿型氧化物通过掺杂改性可用作固体电解质材料,其晶体的一种完整结构单元如图所示,但真实的晶体中存在的O空位缺陷,下列说法错误的是( )
A.Ni原子与Mn原子的配位数相等
B.不考虑晶体缺陷,该晶体的化学式为
C.O空位的形成有利于的传导
D.考虑晶体缺陷,该晶体的+3价与+4价La原子个数比为4:1
5.过渡金属氮化物具有优良的性能,是当前材料科学研究的热点之一。Fe和N组成的一种立方晶胞如图所示,Fe原子和N原子都是紧密接触的刚性小球,Fe原子半径为,N原子半径为。下列说法正确的是( )
A.的核外电子填充了12个原子轨道
B.的空间构型为三角锥形
C.N原子位于Fe原子形成的六面体空隙中
D.该晶体的空间利用率为
6.Ce的某种氧化物具有良好的储氧放氧能力,可作为氧载体参与有机物氧化反应,其中Ce为面心立方堆积,O填充在Ce立方晶格所有的正四面体空隙中(如下图,未标注全部的O),下列说法错误的是( )
A.该氧化物化学式为
B.O原子周围等距且最近O原子个数为6
C.若反应后,晶胞中O脱离形成一个O的空位,则该物质中与的个数比为1:3
D.若顶点位置原子位于体心时,则面心原子位于棱心
7.某镁镍合金储氢后所得晶体的立方晶胞如图甲(为便于观察,省略了2个图乙的结构),晶胞边长为apm。下列说法正确的是( )
A.晶体的化学式为
B.晶胞中与1个Mg配位的Ni有6个
C.晶胞中2个Ni之间的最近距离为
D.镁镍合金中通过离子键结合
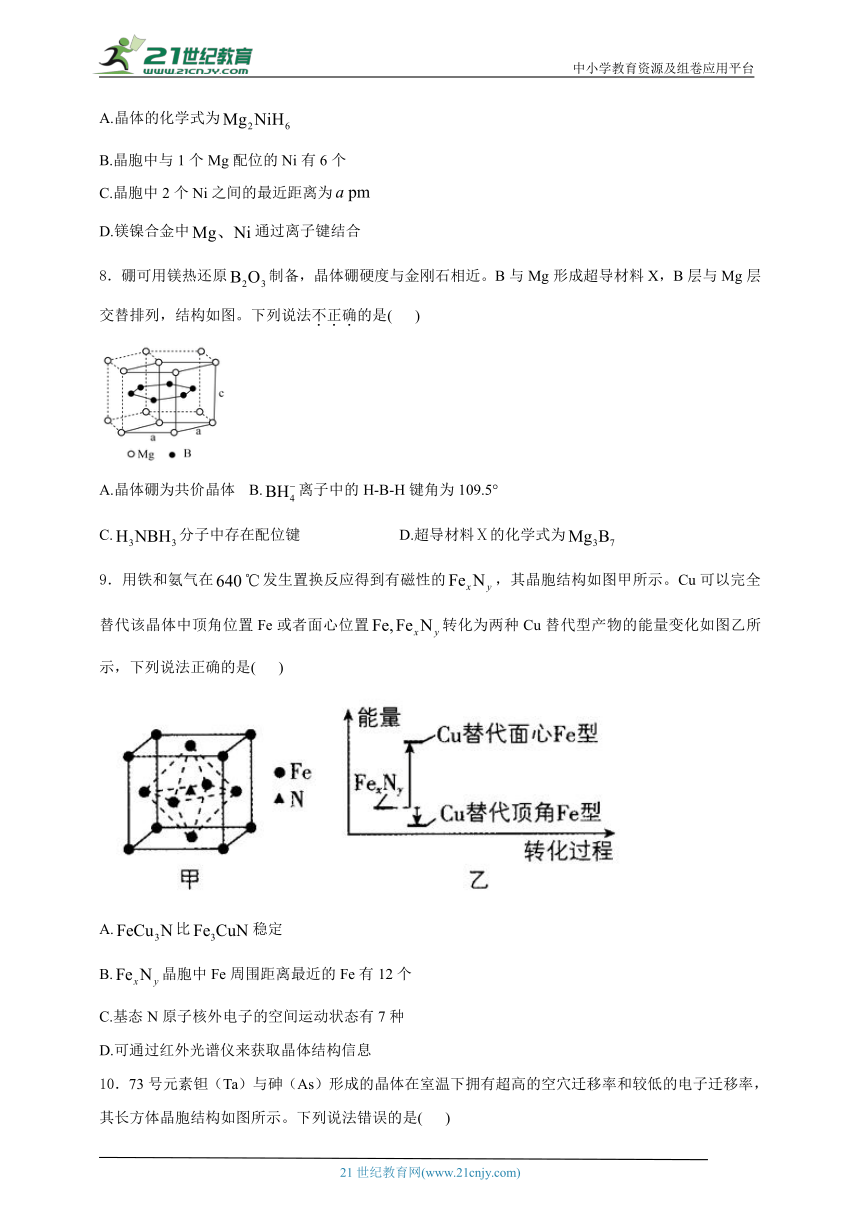
8.硼可用镁热还原制备,晶体硼硬度与金刚石相近。B与Mg形成超导材料X,B层与Mg层交替排列,结构如图。下列说法不正确的是( )
A.晶体硼为共价晶体 B.离子中的H-B-H键角为109.5°
C.分子中存在配位键 D.超导材料Ⅹ的化学式为
9.用铁和氨气在发生置换反应得到有磁性的,其晶胞结构如图甲所示。Cu可以完全替代该晶体中顶角位置Fe或者面心位置转化为两种Cu替代型产物的能量变化如图乙所示,下列说法正确的是( )
A.比稳定
B.晶胞中Fe周围距离最近的Fe有12个
C.基态N原子核外电子的空间运动状态有7种
D.可通过红外光谱仪来获取晶体结构信息
10.73号元素钽(Ta)与砷(As)形成的晶体在室温下拥有超高的空穴迁移率和较低的电子迁移率,其长方体晶胞结构如图所示。下列说法错误的是( )
A.基态As原子核外N层有4种空间运动状态不同的电子
B.该晶胞中As的配位数为4
C.该晶体的化学式为TaAs
D.TaAs的晶体密度
11.NiO与NaCl晶胞结构相似。在一定温度下,NiO晶体可以自发地分散并形成“单分子层”(如图所示),可以认为作密置单层排列,填充其中。设为阿伏加德罗常数的值,半径为。下列说法错误的是( )
A.Ni位于元素周期表第四周期第Ⅷ族
B.NiO晶体中、的配位数均为6
C.该“单分子层”面积密度为
D.NiO晶胞中与最近的有8个
12.LiZnAs晶体中的部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体。LiZnAs晶体的立方晶胞结构如图所示,a点原子分数坐标为,晶胞密度为。下列说法错误的是( )
A.b点原子分数坐标为
B.晶体中每个Zn周围距离最近的As原子共有4个
C.As原子与As原子之间的最短距离为
D.若Li的半径为rcm。则晶胞中Li的空间利用率为
13.砷化镉晶胞结构如图,图1中“①”和“②”位是“真空”,晶胞参数为apm,建立如图2,①号位的坐标为(,,)。已知:砷化镉的摩尔质量为,为阿伏加德罗常数的值,下列说法错误的是( )
A.砷化镉中与原子个数比为3∶2
B.两个原子间最短距离为0.5apm
C.③号位原子坐标参数为(,1,)
D.该晶胞的密度为
14.某镁铁合金是目前储氢密度最高的材料之一,其晶体的立方晶胞如图所示,晶胞边长为a pm。Mg原子占据Fe原子形成的所有四面体空隙。储氢后,分子占据Fe原子形成的八面体空隙,化学式为。下列说法正确的是( )
A.氢气储满后晶体的化学式为
B.该镁铁合金中Mg、Fe通过离子键结合
C.氢气储满后,分子和分子之间的最近距离为
D.该镁铁合金中,与1个Mg配位的Fe和与1个Fe配位的Mg均有4个
二、解答题(共4题,58分)
15.锡(Sn)是“五金”之一,粗锡电解精炼后的锡阳极泥中金属元素二次回收利用的部分工艺流程如图:
已知:①锡阳极泥中主要成分的质量分数如表所示:
成分 SnO Cu Sb
质量分数 44.81% 12.38% 8.13%
②常温下,锑(Sb)不溶于浓盐酸
③浸出液中主要存在的阳离子有和
(1)锡有多种同素异形体,其中灰锡的晶体结构与金刚石类似,灰锡属于__________晶体。
(2)锡阳极泥在“浸出”前,进行球磨、 分有利于__________________。
(3)“浸出”工序中,吹入适量空气的目的是__________________。
(4)“沉锡”时需在强酸性环境中进行,最适宜加入的试剂M为_________(填序号)。
A. B. C.
(5)“沉铜”工序中,加入海绵锑粉的作用是_________。
(6)“沉锑”工序中,生成的离子方程式为_______________________。
(7)回收得到的和可合成纳米锑掺杂二氧化锡(ATO)。二氧化锡的晶胞如图所示,其中位于晶胞体心的原子是_________(填元素符号);位于晶胞顶角的原子的配位数是______________。
16.钒是重要的战略资源,以硫酸工业产生的废钒催化剂为原料(含、、、以及少量的等),综合回收利用钒、硅、钾实现变废为宝、保护环境的目的,回收工艺流程如下:
已知:钒的氧化物在酸性条件下以、存在,增大时可转化为沉淀。
(1)“水浸”前,通常需要将催化剂粉碎,其目的是_________。
(2)“滤渣2”转化为的化学方程式是_________。
(3)“还原酸浸”时:
①硫酸的用量会影响钒的浸出率,需保持在1.2以下的原因是_________。
②过程中除了有被还原成,还涉及的反应离子方程式为_________。
③若以磷酸为介质处理废催化剂,可以提高钒的浸出率。一种钒磷配合物的结构如图所示,形成配位键时V提供_________(选填“孤对电子”或“空轨道”)。
(4)“萃取”时选择有机萃取剂,原理是:(有机层)(有机层),“反萃取”应选择在_________环境中进行(选填“酸性”、“中性”或“碱性”)。
(5)加氨水生成沉淀,若经焙烧得到产品,则消耗空气中_________。
(6)近年来,研究人员发现含钒的锑化物在超导方面表现出潜在的应用前景。某含钒的锑化物晶胞如图1所示,晶体中包含由V和组成的二维平面如图2。
该含钒的锑化物化学式为_________,钒原子周围紧邻的锑原子数为_________。
17.铅渣由多种氧化物及它们相互结合而形成的化合物、固溶体、共晶混合物所组成。对铅渣进行综合利用,回收其中的有价金属(Cu、Fe、Pb、Zn、Sb)的部分工艺流程如下:
已知:①常温下,,,。
②金属离子浓度等于时,可认为其恰好完全沉淀。
(1)Pb位于第六周期,与碳元素同主族,其价层电子排布式为____________。
(2)“还原焙烧”时,发生反应的化学方程式为____________。
(3)挥发烟尘中的主要氧化物为。
①区分挥发烟尘中的氧化物是晶体还是非晶体的最可靠的科学方法为____________。
②“转化”过程中,发生反应的化学方程式为____________。
(4)"氧化酸浸"过程中,若将物质的量为2 mol的合金(其中Cu与Sb物质的量之比为a:b)氧化,至少需要的物质的量为________mol(用含a、b的式子表示)。
(5)“过滤洗涤”过程中,加入酒石酸(表示为)发生如下配位反应:
①上述两个配合物中,提供空轨道的元素为____________(填元素符号)。
②“过滤洗涤”时,用酒石酸稀溶液洗涤滤渣而不用水。用酒石酸稀溶液洗涤可减少金属离子的损失原因为___________。
(6)“沉锑”过程中,锑恰好完全沉淀时,溶液中___________。
(7)一种铅卤基钙钛矿的晶胞结构如图所示,其中八面体体心为Pb,顶点为Br,晶体中各八面体顶点相连。
①该晶体的化学式为___________。
②若该晶体的晶胞以Cs为顶点,则Br在晶胞中的位置为___________。
18.钴属于稀缺金属。利用“微波辅助低共熔溶剂”浸取某废旧锂离子电池中钴酸锂粗品制备产品,实现资源的循环利用。主要工艺流程如下:
已知:①氯化胆碱是一种铵盐;
②在溶液中常以(蓝色)和(粉红色)形式存在;
③时,。
回答下列问题:
(1)中Li的化合价为___________。
(2)如图甲为“微波共熔”中氯化胆碱-草酸和粗品以不同的液固比在下微波处理10 min后锂和钴的浸取率图,则最佳液固比为________。
(3)“水浸”过程中溶液由蓝色变为粉红色,该变化的离子方程式为___________。
(4)时,“沉钴”反应完成后,溶液,此时_________。
(5)“滤饼2”在高温烧结前需要洗涤、干燥,检验“滤饼2”是否洗涤干净的操作及现象是__________。
(6)“高温烧结”中需要通入空气,其作用是__________。
(7)锂离子电池正极材料在多次充放电后由于可循环锂的损失,结构发生改变生成,导致电化学性能下降。
①晶体(常式尖晶石型)的晶胞示意图如图乙所示,则顶点上的离子为_______(用离子符号表示)。
②使用LiOH和30%溶液可以实现的修复,则修复过程中的化学反应方程式为_____________________。
参考答案
1.答案:D
解析:合金储氢的过程中形成了金属氢化物,为化学变化,A项错误;铁镁合金中存在金属键,不存在离子键,B项错误;以题给晶胞图中上方面心处Fe为研究对象,与其最近且距离相等的Mg有8个(上下两个晶胞各4个),故Fe的配位数为8,C项错误;晶胞中Fe与Mg的最短距离为晶胞体对角线长度的,即,D项正确。
2.答案:B
解析:Fe为26号元素,基态原子价层电子排布式为,A项正确;晶胞中共有,该晶体中,B项错误;将XY组装起来可知有处于体心,C项正确;晶体中:32,该晶体的密度为,D项正确
3.答案:A
解析:氮化镓属于化合物,属于新型非金属材料,A错误;液晶具有流动性、各向异性,B正确;氯化钠属于轻金属盐,能使蛋白质发生盐析,但不能使蛋白质变性,常见的食物防腐可通过盐渍实现,C正确;碳酸氢钠、碳酸氢铵受热均可以产生气体,可用作食品膨松剂,D正确。
4.答案:B
解析:该晶胞结构中,Ni原子与Mn原子均位于晶胞的顶点,周围最近且等距的O原子均为12个,则Ni原子与Mn原子的配位数均为12,A正确;根据均推法可得,该晶胞中含Ni原子的个数为,原子的个数为,La原子的个数为1,0原子的个数为,则该晶体的化学式为,B错误;O空位的形成有利于的传导,使该材料可用作固体电解质材料,C正确;根据题意及B项解题思路可知,真实的晶体中存在的0空位缺陷,当考虑晶体缺陷时,晶体的化学式转化为,根据化合物中各元素化合价代数和为0可得,La元素的平均化合价为+3.2,可用十字交叉法求解,即+3价La与+4价La的个数比为4:1,D正确。
5.答案:D
解析:基态的电子排布式为[Ar],其中、能级的所有轨道均有电子,每个s能级有1个原子轨道,每个p能级有3个原子轨道,d能级有5个原子轨道,因此电子共占据14个原子轨道,A错误;的中心原子N的成键电子对数为3,孤电子对数为,空间构型为平面三角形,B错误;晶胞中的N原子的上、下、前、后、左、右均存在最近且等距的Fe原子,因此N原子位于6个Fe原子构成的正八面体空隙中,C错误;该晶胞中,Fe位于棱心,N位于顶点,根据均推法,每个晶胞有个Fe原子和个N原子,因此晶胞中被占据的体积为,晶胞的一条棱长为N原子半径的2倍与Fe原子半径的2倍之和,则晶胞的总体积为,空间利用率为,D正确。
6.答案:C
解析:Ce为面心立方堆积,则晶胞中原子数与正四面体空隙数之比为1:2,若O原子填充在Ce立方晶格所有的正四面体空陌中,所得晶胞中Ce与O原子个数比为1:2,该Ce的氧化物的化学式为,A正确;将该立方体均分为8个小立方体,O原子位于每个小立方体的体心,O原子为简单立方堆积,则O原子周围等距且最近的O原子有6个,B正确;用均推法计算可知晶胞中Ce原子有个,O原子有8个,失去一个氧原子后晶体化学式为,为保证晶体呈电中性,有2个Ce原子的化合价从+4价降低至+3价,该物质中与的个数比为,C错误;顶点原子与面心原子的距离为晶胞面对角线长的一半,结合题图可知,若顶点位置原子位于体心时,则面心原子位于棱心,D正确。
7.答案:A
解析:由题图可知位于晶胞的顶点(8个)和面心(6个),所以平均每个晶胞含有个,而Mg位于晶胞的内部,有8个,所以该晶体的化学式为,A正确;由题图可知,Mg周围距离最近且相等的Ni有4个,则晶胞中与1个Mg配位的Ni有4个,B错误;晶胞中最近的2个Ni之间的距离为面对角线长度的一半,即为,C错误;镁镍合金中Mg、Ni通过金属键结合,D错误。
8.答案:D
解析:A.晶体硼硬度与金刚石相近,金刚石是共价晶体,所以晶体硼也属于共价晶体,A正确;
B.离子中中心原子B的价层电子对数为4,采取杂化,所以H-B-H键角为,B正确;
C.在中B原子为杂化,其中,1个B原子与3个H原子形成3个共价键,N提供孤电子对,B提供空轨道形成1个配位键,C正确;
D.观察图甲,由均摊法,晶胞中所含B原子个数为6,Mg原子个数为=3,则硼化镁的化学式为,D错误;
故选D。
9.答案:B
解析:结合图甲和题干内容可知,Cu替代面心Fe型产物为,替代顶角Fe型产物为,由图乙可知,能量高于,故比稳定,A错误;晶胞中Fe位于顶角和面心,Fe周围距离最近的Fe有12个,B正确;基态N原子核外电子排布式为,电子所占轨道数等于其空间运动状态种类数,故核外电子的空间运动状态有5种,C错误;可获取晶体结构信息的是X射线衍射仪,D错误。
10.答案:B
解析:基态As原子的价电子排布式为,空间运动状态数等于原子轨道数,N层电子共4种空间运动状态,A正确;该晶胞中As的配位数为6,B错误;根据均摊法,一个晶胞中有个Ta原子,有个As原子,该晶体的化学式为TaAs,C正确;m(晶胞)=,,则,D正确。
11.答案:D
解析:Ni是28号元素,基态原子核外电子排布式为,可知其位于第四周期第Ⅷ族,故A正确;NaCl晶体中离子的配位数均为6,与NaCl晶胞结构相似,则NiO晶体中的配位数均为6,故B正确;平面NiO基本结构单元为,每个结构单元含1个“NiO”,每个结构单元质量为,的半径为,则结构单元的面积为,则该“单分子层”面积密度为,故C正确;NiO与NaCl晶胞结构相似:,NiO晶胞中最近的有12个,故D错误。
12.答案:C
解析:b点原子分数坐标为,A正确;由图可知,晶体中每个周围距离最近的As原子共有4个,B正确,1个晶胞中有4个原子与原子之间的最短距离为晶胞面对角线长度的一半,设晶胞参数为,则,晶胞面对角线长度,则As原子与As原子之间的最短距离,C错误;1个的体积为,1个晶胞中有4个个的体积之和为,晶胞体积为,则晶胞中的空间利用率,D正确。
13.答案:D
解析:A.由晶胞结构可知,晶胞中位于体内的镉原子个数为6,位于顶点和面心的砷原子的个数为8×+6×=4,则镉与砷原子个数比为3:2,故A正确;
B.由晶胞结构可知,两个镉原子间最短距离为边长的,则最短距离为apm×=0.5apm,故B正确;
C.由位于体对角线处①号位的坐标为(,,)可知,晶胞的边长为1,则位于右侧面的面心上的③号位原子坐标参数为(,1,),故C正确;
D.由晶胞结构可知,晶胞中位于体内的镉原子个数为6,位于顶点和面心的砷原子的个数为8×+6×=4,设晶体的密度为dg/cm3,由晶胞的质量公式可得:=(10—10a)3d,解得d=,故D错误;故选D。
14.答案:A
解析:每个晶胞中含有4个Fe和8个Mg。晶胞中Fe原子形成的八面体空隙在晶胞的棱心和体心上,所以晶胞中Fe原子形成的八面体空隙的数目为,即每个晶胞中含有4个分子,故氢气储满后晶体的化学式为,A正确;
该镁铁合金中的元素均为金属元素,所以该镁铁合金中Mg、Fe通过金属键结合,B错误;
氢气储满后,分子和分子之间的最近距离为面对角线(pm)的二分之一,即pm,C错误;
该镁铁合金中,与1个Mg配位的Fe有4个,与1个Fe配位的Mg有8个,D错误。
15.答案:(1)共价
(2)增大接触面积,加快反应速率,提高浸出率
(3)氧化和SnO
(4)B
(5)将还原为,并减少沉淀剂的用量
(6)
(7)Sn;6
解析:(1)灰锡的晶体结构与金刚石类似,则灰锡属于共价晶体。
(7)该晶胞中白球位于上下底面和晶胞内,个数为,黑球位于顶点和体心,个数为,所以晶胞中位于体心的原子是Sn;以体心的Sn原子为解题思路对象,Sn原子的配位数为6。
16.答案:(1)增大催化剂与水的接触面积,提高反应速率与浸出率
(2)或
(3)水解程度增加或生成,影响钒的浸出率;,,,,;空轨道
(4)酸性
(5)0.5
(6);6
解析:(1)“水浸”前,通常需要将催化剂粉碎,其目的是增大催化剂与水的接触面积,提高反应速率与浸出率;
(2)“滤渣2”主要成分是,转化为的化学方程式是:或;
(3)①“还原酸浸”时,硫酸的用量会影响钒的浸出率,pH超过1.2时,成水解程度增加或生成,水解产物会进入滤渣中影响钒的浸出率;
②过程中除了有,被还原成成,还涉及的反应离子方程式为,,,,
③由图2可知,和V形成配位键的P、O、Cl均含有孤电子对,故V提供的是空轨道;
(4)“萃取”时选择有机萃取剂,原理是:(有机层)(有机层),“反萃取”应让平衡逆向移动,使进入水层,故选择在酸性环境中进行;
(5)沉淀经焙烧得到的方程式为:,若经焙烧得到1mol产品,则消耗空气中的物质的量为:mol=0.5mol;
(6)由该化合物的晶胞可知,Cs位于顶点,含有个,Sb位于棱上和晶胞内个,V位于面上和晶胞内,含有 个,所以锑化物M的化学式;晶胞中有4个面的面心由钒原子占据,这些钒原子填充在锑原子构成的八面体空隙中,周围紧邻的锑原子数为6;
17.答案:(1)
(2)(或)
(3)①X射线衍射法
②
(4)
(5)①Cu、Sh
②酒石酸与发生配位反应,形成配合物降低金属离子浓度,且溶液呈酸性,减小因水解生成难溶的氢氧化物造成的损失
(6)
(7)①
②面心
解析:(1)Pb是第六周期第ⅣA族元素,主族元素的价层电子即最外层电子,则其价层电子排布式为。
(2)可视为,还原焙烧时FeO被还原为不发生反应或与CaO反应生成,因为褐煤过量,所以氧化产物为CO,化学方程式为或。
(3)①可用X射线衍射法区分晶体和非晶体。
②该步骤中转化为,该反应的化学方程式为。
(4)Cu和Sb分别被在酸性条件下氧化的离子方程式为和。设合金中Cu和Sb的物质的量分别为和,则有,,由此得,,根据反应的离子方程式可知至少需要的物质的量为。
(5)①金属离子与酸根离子形成配合物时,金属离子提供空轨道。
②酒石酸可与形成配离子,使金属离子浓度降低,因此更有利于将沉淀中吸附的金属离子溶出,同时酒石酸稀溶液呈酸性,在一定程度上可以避免水解生成难溶的氢氧化物造成的损失。
(6)由已知信息②可知,当恰好完全沉淀时,,则,此时。
(7)①晶体中各八面体以顶点相连,则八面体顶点的Br位于题图所示晶胞的棱心,共有12个Br原子位于晶胞的12条棱的棱心,Pb位于晶胞的8个顶点,因此1个晶胞中有1个Cs原子、个Pb原子和个Br原子,该晶体的化学式为。
②若晶胞以Cs为顶点,则根据晶胞结构示意图将原晶胞中各原子平移后,Br原子位于晶胞6个面的面心。
18.答案:(1)+1
(2)60
(3)
(4)
(5)取最后一次洗涤液加入氯化钙(或氯化钡)溶液,无白色沉淀产生,则已洗净
(6)利用空气中的氧气将+2价Co氧化为+3价
(7)①
②
解析:(1)中Co为+3价,O为-2价,Li为+1价。
(2)图中信息显示当液固比为时钴的浸取率最高,锂的浸取率随液固比的增大变化不大,因此最佳液固比为。
(3)结合(3)的题干信息和已知信息②,可知“水浸”过程中存在转化为的过程,离子方程式为。
(4)时,已知,即溶液中,则此时溶液中氢氧根离子浓度为,。
(5)检验“滤饼2”是否洗涤干净只需要检验最后一次洗涤液中是否含有碳酸根离子即可。
(7)①根据各元素化合价代数为0可推测离子个数比,已知晶体属于常式尖晶石型,结合晶胞结构可知,位于晶胞内部立方体的4个顶点,除位于晶胞的8个顶点,还有1个在晶胞内部,除位于晶胞内部立方体的4个顶点,还有4个在晶胞内部,符合离子个数比,则顶点上的离子为。
②将氧化,再和LiOH反应生成,结合得失电子守恒、原子守恒可书写化学方程式。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
物质的聚集状态与晶体的常识--2024-2025学年高中化学人教版选择性必修二课时作业
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H∶1 C∶12 N∶14 O∶16 Na∶23 S∶32
一、单选题(每题3分,共42分)
1.铁镁合金是目前储氢密度较高的材料之一,其晶胞结构如图所示,晶胞参数为a。下列说法正确的是( )
A.合金储氢的过程是物理变化
B.铁镁合金中存在金属键和离子键
C.晶体中Fe的配位数为4
D.晶胞中Fe与Mg的最短距离为
2.某离子型铁的氧化物立方晶胞如图所示(由X、Y组成),该离子型铁的氧化物晶体的晶胞参数为anm。设阿伏加德罗常数的值为,下列说法错误的是( )
A.基态Fe原子价层电子排布式为
B.该晶体中
C.该晶胞中有处于体心
D.该晶体的密度为
3.化学与人类生产、生活密切相关,下列说法中错误的是( )
A.歼-20上采用的氮化镓涂层,属于新型金属材料
B.液晶既有液体的流动性,又有类似晶体的各向异性
C.氯化钠不能使蛋白质变性,可用作食品防腐剂
D.碳酸氢铵、碳酸氢钠可用于制作面包等食品的膨松剂
4.具有双钙钠矿型氧化物通过掺杂改性可用作固体电解质材料,其晶体的一种完整结构单元如图所示,但真实的晶体中存在的O空位缺陷,下列说法错误的是( )
A.Ni原子与Mn原子的配位数相等
B.不考虑晶体缺陷,该晶体的化学式为
C.O空位的形成有利于的传导
D.考虑晶体缺陷,该晶体的+3价与+4价La原子个数比为4:1
5.过渡金属氮化物具有优良的性能,是当前材料科学研究的热点之一。Fe和N组成的一种立方晶胞如图所示,Fe原子和N原子都是紧密接触的刚性小球,Fe原子半径为,N原子半径为。下列说法正确的是( )
A.的核外电子填充了12个原子轨道
B.的空间构型为三角锥形
C.N原子位于Fe原子形成的六面体空隙中
D.该晶体的空间利用率为
6.Ce的某种氧化物具有良好的储氧放氧能力,可作为氧载体参与有机物氧化反应,其中Ce为面心立方堆积,O填充在Ce立方晶格所有的正四面体空隙中(如下图,未标注全部的O),下列说法错误的是( )
A.该氧化物化学式为
B.O原子周围等距且最近O原子个数为6
C.若反应后,晶胞中O脱离形成一个O的空位,则该物质中与的个数比为1:3
D.若顶点位置原子位于体心时,则面心原子位于棱心
7.某镁镍合金储氢后所得晶体的立方晶胞如图甲(为便于观察,省略了2个图乙的结构),晶胞边长为apm。下列说法正确的是( )
A.晶体的化学式为
B.晶胞中与1个Mg配位的Ni有6个
C.晶胞中2个Ni之间的最近距离为
D.镁镍合金中通过离子键结合
8.硼可用镁热还原制备,晶体硼硬度与金刚石相近。B与Mg形成超导材料X,B层与Mg层交替排列,结构如图。下列说法不正确的是( )
A.晶体硼为共价晶体 B.离子中的H-B-H键角为109.5°
C.分子中存在配位键 D.超导材料Ⅹ的化学式为
9.用铁和氨气在发生置换反应得到有磁性的,其晶胞结构如图甲所示。Cu可以完全替代该晶体中顶角位置Fe或者面心位置转化为两种Cu替代型产物的能量变化如图乙所示,下列说法正确的是( )
A.比稳定
B.晶胞中Fe周围距离最近的Fe有12个
C.基态N原子核外电子的空间运动状态有7种
D.可通过红外光谱仪来获取晶体结构信息
10.73号元素钽(Ta)与砷(As)形成的晶体在室温下拥有超高的空穴迁移率和较低的电子迁移率,其长方体晶胞结构如图所示。下列说法错误的是( )
A.基态As原子核外N层有4种空间运动状态不同的电子
B.该晶胞中As的配位数为4
C.该晶体的化学式为TaAs
D.TaAs的晶体密度
11.NiO与NaCl晶胞结构相似。在一定温度下,NiO晶体可以自发地分散并形成“单分子层”(如图所示),可以认为作密置单层排列,填充其中。设为阿伏加德罗常数的值,半径为。下列说法错误的是( )
A.Ni位于元素周期表第四周期第Ⅷ族
B.NiO晶体中、的配位数均为6
C.该“单分子层”面积密度为
D.NiO晶胞中与最近的有8个
12.LiZnAs晶体中的部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体。LiZnAs晶体的立方晶胞结构如图所示,a点原子分数坐标为,晶胞密度为。下列说法错误的是( )
A.b点原子分数坐标为
B.晶体中每个Zn周围距离最近的As原子共有4个
C.As原子与As原子之间的最短距离为
D.若Li的半径为rcm。则晶胞中Li的空间利用率为
13.砷化镉晶胞结构如图,图1中“①”和“②”位是“真空”,晶胞参数为apm,建立如图2,①号位的坐标为(,,)。已知:砷化镉的摩尔质量为,为阿伏加德罗常数的值,下列说法错误的是( )
A.砷化镉中与原子个数比为3∶2
B.两个原子间最短距离为0.5apm
C.③号位原子坐标参数为(,1,)
D.该晶胞的密度为
14.某镁铁合金是目前储氢密度最高的材料之一,其晶体的立方晶胞如图所示,晶胞边长为a pm。Mg原子占据Fe原子形成的所有四面体空隙。储氢后,分子占据Fe原子形成的八面体空隙,化学式为。下列说法正确的是( )
A.氢气储满后晶体的化学式为
B.该镁铁合金中Mg、Fe通过离子键结合
C.氢气储满后,分子和分子之间的最近距离为
D.该镁铁合金中,与1个Mg配位的Fe和与1个Fe配位的Mg均有4个
二、解答题(共4题,58分)
15.锡(Sn)是“五金”之一,粗锡电解精炼后的锡阳极泥中金属元素二次回收利用的部分工艺流程如图:
已知:①锡阳极泥中主要成分的质量分数如表所示:
成分 SnO Cu Sb
质量分数 44.81% 12.38% 8.13%
②常温下,锑(Sb)不溶于浓盐酸
③浸出液中主要存在的阳离子有和
(1)锡有多种同素异形体,其中灰锡的晶体结构与金刚石类似,灰锡属于__________晶体。
(2)锡阳极泥在“浸出”前,进行球磨、 分有利于__________________。
(3)“浸出”工序中,吹入适量空气的目的是__________________。
(4)“沉锡”时需在强酸性环境中进行,最适宜加入的试剂M为_________(填序号)。
A. B. C.
(5)“沉铜”工序中,加入海绵锑粉的作用是_________。
(6)“沉锑”工序中,生成的离子方程式为_______________________。
(7)回收得到的和可合成纳米锑掺杂二氧化锡(ATO)。二氧化锡的晶胞如图所示,其中位于晶胞体心的原子是_________(填元素符号);位于晶胞顶角的原子的配位数是______________。
16.钒是重要的战略资源,以硫酸工业产生的废钒催化剂为原料(含、、、以及少量的等),综合回收利用钒、硅、钾实现变废为宝、保护环境的目的,回收工艺流程如下:
已知:钒的氧化物在酸性条件下以、存在,增大时可转化为沉淀。
(1)“水浸”前,通常需要将催化剂粉碎,其目的是_________。
(2)“滤渣2”转化为的化学方程式是_________。
(3)“还原酸浸”时:
①硫酸的用量会影响钒的浸出率,需保持在1.2以下的原因是_________。
②过程中除了有被还原成,还涉及的反应离子方程式为_________。
③若以磷酸为介质处理废催化剂,可以提高钒的浸出率。一种钒磷配合物的结构如图所示,形成配位键时V提供_________(选填“孤对电子”或“空轨道”)。
(4)“萃取”时选择有机萃取剂,原理是:(有机层)(有机层),“反萃取”应选择在_________环境中进行(选填“酸性”、“中性”或“碱性”)。
(5)加氨水生成沉淀,若经焙烧得到产品,则消耗空气中_________。
(6)近年来,研究人员发现含钒的锑化物在超导方面表现出潜在的应用前景。某含钒的锑化物晶胞如图1所示,晶体中包含由V和组成的二维平面如图2。
该含钒的锑化物化学式为_________,钒原子周围紧邻的锑原子数为_________。
17.铅渣由多种氧化物及它们相互结合而形成的化合物、固溶体、共晶混合物所组成。对铅渣进行综合利用,回收其中的有价金属(Cu、Fe、Pb、Zn、Sb)的部分工艺流程如下:
已知:①常温下,,,。
②金属离子浓度等于时,可认为其恰好完全沉淀。
(1)Pb位于第六周期,与碳元素同主族,其价层电子排布式为____________。
(2)“还原焙烧”时,发生反应的化学方程式为____________。
(3)挥发烟尘中的主要氧化物为。
①区分挥发烟尘中的氧化物是晶体还是非晶体的最可靠的科学方法为____________。
②“转化”过程中,发生反应的化学方程式为____________。
(4)"氧化酸浸"过程中,若将物质的量为2 mol的合金(其中Cu与Sb物质的量之比为a:b)氧化,至少需要的物质的量为________mol(用含a、b的式子表示)。
(5)“过滤洗涤”过程中,加入酒石酸(表示为)发生如下配位反应:
①上述两个配合物中,提供空轨道的元素为____________(填元素符号)。
②“过滤洗涤”时,用酒石酸稀溶液洗涤滤渣而不用水。用酒石酸稀溶液洗涤可减少金属离子的损失原因为___________。
(6)“沉锑”过程中,锑恰好完全沉淀时,溶液中___________。
(7)一种铅卤基钙钛矿的晶胞结构如图所示,其中八面体体心为Pb,顶点为Br,晶体中各八面体顶点相连。
①该晶体的化学式为___________。
②若该晶体的晶胞以Cs为顶点,则Br在晶胞中的位置为___________。
18.钴属于稀缺金属。利用“微波辅助低共熔溶剂”浸取某废旧锂离子电池中钴酸锂粗品制备产品,实现资源的循环利用。主要工艺流程如下:
已知:①氯化胆碱是一种铵盐;
②在溶液中常以(蓝色)和(粉红色)形式存在;
③时,。
回答下列问题:
(1)中Li的化合价为___________。
(2)如图甲为“微波共熔”中氯化胆碱-草酸和粗品以不同的液固比在下微波处理10 min后锂和钴的浸取率图,则最佳液固比为________。
(3)“水浸”过程中溶液由蓝色变为粉红色,该变化的离子方程式为___________。
(4)时,“沉钴”反应完成后,溶液,此时_________。
(5)“滤饼2”在高温烧结前需要洗涤、干燥,检验“滤饼2”是否洗涤干净的操作及现象是__________。
(6)“高温烧结”中需要通入空气,其作用是__________。
(7)锂离子电池正极材料在多次充放电后由于可循环锂的损失,结构发生改变生成,导致电化学性能下降。
①晶体(常式尖晶石型)的晶胞示意图如图乙所示,则顶点上的离子为_______(用离子符号表示)。
②使用LiOH和30%溶液可以实现的修复,则修复过程中的化学反应方程式为_____________________。
参考答案
1.答案:D
解析:合金储氢的过程中形成了金属氢化物,为化学变化,A项错误;铁镁合金中存在金属键,不存在离子键,B项错误;以题给晶胞图中上方面心处Fe为研究对象,与其最近且距离相等的Mg有8个(上下两个晶胞各4个),故Fe的配位数为8,C项错误;晶胞中Fe与Mg的最短距离为晶胞体对角线长度的,即,D项正确。
2.答案:B
解析:Fe为26号元素,基态原子价层电子排布式为,A项正确;晶胞中共有,该晶体中,B项错误;将XY组装起来可知有处于体心,C项正确;晶体中:32,该晶体的密度为,D项正确
3.答案:A
解析:氮化镓属于化合物,属于新型非金属材料,A错误;液晶具有流动性、各向异性,B正确;氯化钠属于轻金属盐,能使蛋白质发生盐析,但不能使蛋白质变性,常见的食物防腐可通过盐渍实现,C正确;碳酸氢钠、碳酸氢铵受热均可以产生气体,可用作食品膨松剂,D正确。
4.答案:B
解析:该晶胞结构中,Ni原子与Mn原子均位于晶胞的顶点,周围最近且等距的O原子均为12个,则Ni原子与Mn原子的配位数均为12,A正确;根据均推法可得,该晶胞中含Ni原子的个数为,原子的个数为,La原子的个数为1,0原子的个数为,则该晶体的化学式为,B错误;O空位的形成有利于的传导,使该材料可用作固体电解质材料,C正确;根据题意及B项解题思路可知,真实的晶体中存在的0空位缺陷,当考虑晶体缺陷时,晶体的化学式转化为,根据化合物中各元素化合价代数和为0可得,La元素的平均化合价为+3.2,可用十字交叉法求解,即+3价La与+4价La的个数比为4:1,D正确。
5.答案:D
解析:基态的电子排布式为[Ar],其中、能级的所有轨道均有电子,每个s能级有1个原子轨道,每个p能级有3个原子轨道,d能级有5个原子轨道,因此电子共占据14个原子轨道,A错误;的中心原子N的成键电子对数为3,孤电子对数为,空间构型为平面三角形,B错误;晶胞中的N原子的上、下、前、后、左、右均存在最近且等距的Fe原子,因此N原子位于6个Fe原子构成的正八面体空隙中,C错误;该晶胞中,Fe位于棱心,N位于顶点,根据均推法,每个晶胞有个Fe原子和个N原子,因此晶胞中被占据的体积为,晶胞的一条棱长为N原子半径的2倍与Fe原子半径的2倍之和,则晶胞的总体积为,空间利用率为,D正确。
6.答案:C
解析:Ce为面心立方堆积,则晶胞中原子数与正四面体空隙数之比为1:2,若O原子填充在Ce立方晶格所有的正四面体空陌中,所得晶胞中Ce与O原子个数比为1:2,该Ce的氧化物的化学式为,A正确;将该立方体均分为8个小立方体,O原子位于每个小立方体的体心,O原子为简单立方堆积,则O原子周围等距且最近的O原子有6个,B正确;用均推法计算可知晶胞中Ce原子有个,O原子有8个,失去一个氧原子后晶体化学式为,为保证晶体呈电中性,有2个Ce原子的化合价从+4价降低至+3价,该物质中与的个数比为,C错误;顶点原子与面心原子的距离为晶胞面对角线长的一半,结合题图可知,若顶点位置原子位于体心时,则面心原子位于棱心,D正确。
7.答案:A
解析:由题图可知位于晶胞的顶点(8个)和面心(6个),所以平均每个晶胞含有个,而Mg位于晶胞的内部,有8个,所以该晶体的化学式为,A正确;由题图可知,Mg周围距离最近且相等的Ni有4个,则晶胞中与1个Mg配位的Ni有4个,B错误;晶胞中最近的2个Ni之间的距离为面对角线长度的一半,即为,C错误;镁镍合金中Mg、Ni通过金属键结合,D错误。
8.答案:D
解析:A.晶体硼硬度与金刚石相近,金刚石是共价晶体,所以晶体硼也属于共价晶体,A正确;
B.离子中中心原子B的价层电子对数为4,采取杂化,所以H-B-H键角为,B正确;
C.在中B原子为杂化,其中,1个B原子与3个H原子形成3个共价键,N提供孤电子对,B提供空轨道形成1个配位键,C正确;
D.观察图甲,由均摊法,晶胞中所含B原子个数为6,Mg原子个数为=3,则硼化镁的化学式为,D错误;
故选D。
9.答案:B
解析:结合图甲和题干内容可知,Cu替代面心Fe型产物为,替代顶角Fe型产物为,由图乙可知,能量高于,故比稳定,A错误;晶胞中Fe位于顶角和面心,Fe周围距离最近的Fe有12个,B正确;基态N原子核外电子排布式为,电子所占轨道数等于其空间运动状态种类数,故核外电子的空间运动状态有5种,C错误;可获取晶体结构信息的是X射线衍射仪,D错误。
10.答案:B
解析:基态As原子的价电子排布式为,空间运动状态数等于原子轨道数,N层电子共4种空间运动状态,A正确;该晶胞中As的配位数为6,B错误;根据均摊法,一个晶胞中有个Ta原子,有个As原子,该晶体的化学式为TaAs,C正确;m(晶胞)=,,则,D正确。
11.答案:D
解析:Ni是28号元素,基态原子核外电子排布式为,可知其位于第四周期第Ⅷ族,故A正确;NaCl晶体中离子的配位数均为6,与NaCl晶胞结构相似,则NiO晶体中的配位数均为6,故B正确;平面NiO基本结构单元为,每个结构单元含1个“NiO”,每个结构单元质量为,的半径为,则结构单元的面积为,则该“单分子层”面积密度为,故C正确;NiO与NaCl晶胞结构相似:,NiO晶胞中最近的有12个,故D错误。
12.答案:C
解析:b点原子分数坐标为,A正确;由图可知,晶体中每个周围距离最近的As原子共有4个,B正确,1个晶胞中有4个原子与原子之间的最短距离为晶胞面对角线长度的一半,设晶胞参数为,则,晶胞面对角线长度,则As原子与As原子之间的最短距离,C错误;1个的体积为,1个晶胞中有4个个的体积之和为,晶胞体积为,则晶胞中的空间利用率,D正确。
13.答案:D
解析:A.由晶胞结构可知,晶胞中位于体内的镉原子个数为6,位于顶点和面心的砷原子的个数为8×+6×=4,则镉与砷原子个数比为3:2,故A正确;
B.由晶胞结构可知,两个镉原子间最短距离为边长的,则最短距离为apm×=0.5apm,故B正确;
C.由位于体对角线处①号位的坐标为(,,)可知,晶胞的边长为1,则位于右侧面的面心上的③号位原子坐标参数为(,1,),故C正确;
D.由晶胞结构可知,晶胞中位于体内的镉原子个数为6,位于顶点和面心的砷原子的个数为8×+6×=4,设晶体的密度为dg/cm3,由晶胞的质量公式可得:=(10—10a)3d,解得d=,故D错误;故选D。
14.答案:A
解析:每个晶胞中含有4个Fe和8个Mg。晶胞中Fe原子形成的八面体空隙在晶胞的棱心和体心上,所以晶胞中Fe原子形成的八面体空隙的数目为,即每个晶胞中含有4个分子,故氢气储满后晶体的化学式为,A正确;
该镁铁合金中的元素均为金属元素,所以该镁铁合金中Mg、Fe通过金属键结合,B错误;
氢气储满后,分子和分子之间的最近距离为面对角线(pm)的二分之一,即pm,C错误;
该镁铁合金中,与1个Mg配位的Fe有4个,与1个Fe配位的Mg有8个,D错误。
15.答案:(1)共价
(2)增大接触面积,加快反应速率,提高浸出率
(3)氧化和SnO
(4)B
(5)将还原为,并减少沉淀剂的用量
(6)
(7)Sn;6
解析:(1)灰锡的晶体结构与金刚石类似,则灰锡属于共价晶体。
(7)该晶胞中白球位于上下底面和晶胞内,个数为,黑球位于顶点和体心,个数为,所以晶胞中位于体心的原子是Sn;以体心的Sn原子为解题思路对象,Sn原子的配位数为6。
16.答案:(1)增大催化剂与水的接触面积,提高反应速率与浸出率
(2)或
(3)水解程度增加或生成,影响钒的浸出率;,,,,;空轨道
(4)酸性
(5)0.5
(6);6
解析:(1)“水浸”前,通常需要将催化剂粉碎,其目的是增大催化剂与水的接触面积,提高反应速率与浸出率;
(2)“滤渣2”主要成分是,转化为的化学方程式是:或;
(3)①“还原酸浸”时,硫酸的用量会影响钒的浸出率,pH超过1.2时,成水解程度增加或生成,水解产物会进入滤渣中影响钒的浸出率;
②过程中除了有,被还原成成,还涉及的反应离子方程式为,,,,
③由图2可知,和V形成配位键的P、O、Cl均含有孤电子对,故V提供的是空轨道;
(4)“萃取”时选择有机萃取剂,原理是:(有机层)(有机层),“反萃取”应让平衡逆向移动,使进入水层,故选择在酸性环境中进行;
(5)沉淀经焙烧得到的方程式为:,若经焙烧得到1mol产品,则消耗空气中的物质的量为:mol=0.5mol;
(6)由该化合物的晶胞可知,Cs位于顶点,含有个,Sb位于棱上和晶胞内个,V位于面上和晶胞内,含有 个,所以锑化物M的化学式;晶胞中有4个面的面心由钒原子占据,这些钒原子填充在锑原子构成的八面体空隙中,周围紧邻的锑原子数为6;
17.答案:(1)
(2)(或)
(3)①X射线衍射法
②
(4)
(5)①Cu、Sh
②酒石酸与发生配位反应,形成配合物降低金属离子浓度,且溶液呈酸性,减小因水解生成难溶的氢氧化物造成的损失
(6)
(7)①
②面心
解析:(1)Pb是第六周期第ⅣA族元素,主族元素的价层电子即最外层电子,则其价层电子排布式为。
(2)可视为,还原焙烧时FeO被还原为不发生反应或与CaO反应生成,因为褐煤过量,所以氧化产物为CO,化学方程式为或。
(3)①可用X射线衍射法区分晶体和非晶体。
②该步骤中转化为,该反应的化学方程式为。
(4)Cu和Sb分别被在酸性条件下氧化的离子方程式为和。设合金中Cu和Sb的物质的量分别为和,则有,,由此得,,根据反应的离子方程式可知至少需要的物质的量为。
(5)①金属离子与酸根离子形成配合物时,金属离子提供空轨道。
②酒石酸可与形成配离子,使金属离子浓度降低,因此更有利于将沉淀中吸附的金属离子溶出,同时酒石酸稀溶液呈酸性,在一定程度上可以避免水解生成难溶的氢氧化物造成的损失。
(6)由已知信息②可知,当恰好完全沉淀时,,则,此时。
(7)①晶体中各八面体以顶点相连,则八面体顶点的Br位于题图所示晶胞的棱心,共有12个Br原子位于晶胞的12条棱的棱心,Pb位于晶胞的8个顶点,因此1个晶胞中有1个Cs原子、个Pb原子和个Br原子,该晶体的化学式为。
②若晶胞以Cs为顶点,则根据晶胞结构示意图将原晶胞中各原子平移后,Br原子位于晶胞6个面的面心。
18.答案:(1)+1
(2)60
(3)
(4)
(5)取最后一次洗涤液加入氯化钙(或氯化钡)溶液,无白色沉淀产生,则已洗净
(6)利用空气中的氧气将+2价Co氧化为+3价
(7)①
②
解析:(1)中Co为+3价,O为-2价,Li为+1价。
(2)图中信息显示当液固比为时钴的浸取率最高,锂的浸取率随液固比的增大变化不大,因此最佳液固比为。
(3)结合(3)的题干信息和已知信息②,可知“水浸”过程中存在转化为的过程,离子方程式为。
(4)时,已知,即溶液中,则此时溶液中氢氧根离子浓度为,。
(5)检验“滤饼2”是否洗涤干净只需要检验最后一次洗涤液中是否含有碳酸根离子即可。
(7)①根据各元素化合价代数为0可推测离子个数比,已知晶体属于常式尖晶石型,结合晶胞结构可知,位于晶胞内部立方体的4个顶点,除位于晶胞的8个顶点,还有1个在晶胞内部,除位于晶胞内部立方体的4个顶点,还有4个在晶胞内部,符合离子个数比,则顶点上的离子为。
②将氧化,再和LiOH反应生成,结合得失电子守恒、原子守恒可书写化学方程式。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
