1.1原子结构--2024-2025学年高中化学人教版选择性必修二课时作业
文档属性
| 名称 | 1.1原子结构--2024-2025学年高中化学人教版选择性必修二课时作业 |  | |
| 格式 | doc | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-25 09:31:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
原子结构--2024-2025学年高中化学人教版选择性必修二课时作业
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H∶1 C∶12 N∶14 O∶16 Na∶23 S∶32
一、单选题(每题3分,共42分)
1.下列各基态原子或离子的电子排布式书写正确的是( )
A. B.
C. D.
2.下列是一些基态原子的2p轨道和3d轨道中电子的排布情况,其中违反洪特规则的是( )
A.①②③ B.④⑤⑥ C.②④⑥ D.③④⑥
3.若将基态S原子的电子排布式写成,轨道表示式写成,则违背了( )
A.能量守恒原理、泡利不相容原理 B.泡利不相容原理、洪特规则
C.能量最低原理、洪特规则特例 D.洪特规则、泡利不相容原理
4.下列关于电子云或原子轨道的叙述中,正确的是( )
A.电子云图中的小点越密,表示原子核外单位体积内的电子越多
B.电子云表示电子运动的轨迹
C.原子轨道表示电子在空间各处出现的概率
D.电子云用小点的疏密程度来表示电子在原子核外单位体积内出现概率的大小
5.图1和图2分别是1s电子的概率密度分布图和电子云轮廓图。下列有关说法正确的是( )
A.图1中的每个小点都表示1个电子
B.图1中的小点表示电子在核外所处的位置
C.图2表明1s轨道呈球形,有无数条对称轴
D.图2表示1s电子只能在球体内出现
6.原子核外电子属于微观粒子范畴,运动规律具有与宏观粒子不同的特点。下列有关说法错误的是( )
A.原子核外每个电子的运动状态都不同,电子的一个空间运动状态称为一个原子轨道
B.离核越远的电子,能量越低
C.用电子云描述电子在原子核外空间出现的概率密度分布
D.各电子层中s轨道的形状相同,同一原子的电子层序数越大,s轨道的半径越大
7.1828年,德国化学家维勒在制备无机盐氰酸铵时得到了尿素,第一次通过人工的方法将无机物转变成有机物。下列关于尿素的叙述不正确的是( )
A.氰酸铵属于离子化合物,尿素属于共价化合物
B.尿素是人体新陈代谢的一种产物
C.工业上用氨气和二氧化碳在高温、高压下合成尿素的反应是氧化还原反应
D.尿素与氰酸铵()互为同分异构体
8.石油是一种重要的能源,我国面临着石油短缺的问题。从可持续发展的角度看,以下解决能源问题的做法不恰当的是( )
A.大量使用木材作燃料 B.用液氢代替汽油
C.开发风能 D.开发地热能
9.下列关于某些社会热点问题的说法中,不正确的是( )
A.禁止使用含铅汽油是为了提高汽油的燃烧效率
B.甲醇超标的酒不能饮用
C.进入大气的氟氯代烃会破坏高空臭氧层
D.光化学烟雾的产生与人为排放的烃、氨氧化物有关
10.某基态原子的第4电子层有3个电子,则第3电子层的电子数有( )
A.2个 B.8个 C.10个 D.18个
11.某基态原子的电子排布式为,下列说法中不正确的是( )
A.该元素基态原子中共有25个电子
B.该元素原子核外有4个电子层
C.该元素原子最外层共有2个电子
D.该元素原子M电子层共有8个电子
12.第4周期元素的原子中,未成对电子数最多可达( )
A.4个 B.5个 C.6个 D.7个
13.已知下列元素基态原子的最外层电子排布式,其中不一定能表示该元素为主族元素的是( )。
A. B. C. D.
14.下列说法中,正确的是( )。
A.处于最低能量状态的原子叫作基态原子
B.表示3p能级有两个轨道
C.同一原子中,电子的能量逐渐减小
D.同一原子中,能级的轨道数依次增多
二、解答题(共4题,58分)
15.有机化学研究与生命科学发展的关系如何?请查阅有关资料,阐述你对它们过去、现在以及未来关系的认识。
16.本章第1、2节主要讲述了原子核外电子的运动状态。请用图示的方法总结下列描述核外电子运动状态的概念间的关系:电子排布式、轨道表示式、电子层、能级、原子轨道、电子云图、自旋状态、能量最低原理、构造原理、泡利不相容原理、洪特规则。
17.原子轨道可以用波函数来表示,那么,又该如何理解波函数?怎样形象地描述电子在空间中的运动与分布呢?
18.现有七种元素,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息回答问题:
A 元素原子半径在周期表中最小,也是宇宙中最丰富的元素
B 元素原子的核外p轨道总电子数比s轨道总电子数少1
C 元素的第一至第四电离能分别是
D 原子核外所有p轨道全满或半满
E 元素主族序数与周期序数的差为4,原子半径在同周期中最小
F 是前四周期中电负性最小的元素
(1)B的元素符号为___________,基态原子价电子轨道表示式为___________。
(2)基态D原子中能量最高的电子所在的原子轨道的电子云在空间有___________个伸展方向,原子轨道呈___________形。
(3)某同学根据上述信息,推断C基态原子的核外电子轨道表示式为,该同学所写的轨道表示式违反了___________。
(4)E元素原子核外有___________种运动状态不同的电子。
(5)检验F元素的方法是___________。
参考答案
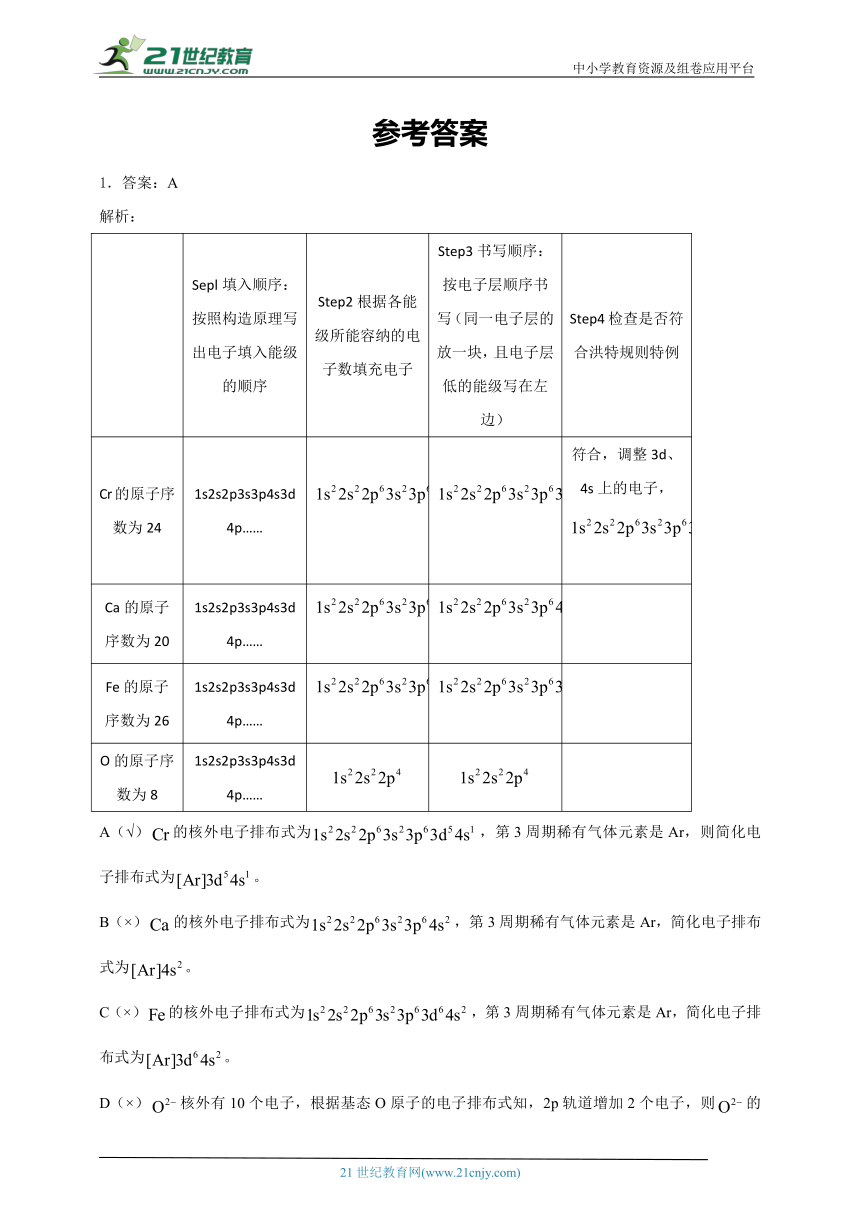
1.答案:A
解析:
Sepl填入顺序:按照构造原理写出电子填入能级的顺序 Step2根据各能级所能容纳的电子数填充电子 Step3书写顺序:按电子层顺序书写(同一电子层的放一块,且电子层低的能级写在左边) Step4检查是否符合洪特规则特例
Cr的原子序数为24 1s2s2p3s3p4s3d4p…… 符合,调整3d、4s上的电子,
Ca的原子序数为20 1s2s2p3s3p4s3d4p……
Fe的原子序数为26 1s2s2p3s3p4s3d4p……
O的原子序数为8 1s2s2p3s3p4s3d4p……
A(√)的核外电子排布式为,第3周期稀有气体元素是Ar,则简化电子排布式为。
B(×)的核外电子排布式为,第3周期稀有气体元素是Ar,简化电子排布式为。
C(×)的核外电子排布式为,第3周期稀有气体元素是Ar,简化电子排布式为。
D(×)核外有10个电子,根据基态O原子的电子排布式知,2p轨道增加2个电子,则的电子排布式为。
2.答案:C
解析:
题给信息 陷阱 原因解题思路 正确书写
①(√)
②(×) 陷阱3违反洪特规则 2p能级中的三个轨道是简并的,电子优先单独分占一个轨道且自旋平行,违反洪特规则
③(×) 陷阱2违反泡利不相容原理 同一个原子轨道中不可能有自旋方向相同的2个电子
④(×) 陷阱3违反洪特规则 3d能级中的五个轨道是简并的,电子优先单独分占一个轨道且自旋平行
⑤(√)
⑥(×) 陷阱3违反洪特规则 3d能级中的五个轨道是简并的,电子优先单独分占一个轨道且自旋平行
3.答案:D
解析:
题给信息 陷阱 原因解题思路 正确书写
陷阱3违反洪特规则 对于p能级的三个平行轨道,电子优先单独分占一个轨道且自旋平行 (或或)
S: 陷阱2违反泡利不相容原理 同一原子轨道中不可能有自旋平行的2个电子 S:
4.答案:D
解析:A(×)电子云图中的小点越密,表示电子在原子核外空间出现的机会越多。
B(×)电子云表示电子在原子核外空间某处出现机会的多少,不能表示电子的运动轨迹。
C(×)原子轨道表示电子出现概率最大的区域。
D(√)电子云表示电子在原子核外空间出现的概率分布,小点的疏密表示电子在单位体积空间内出现概率的大小。
5.答案:C
解析:A(×)B(×)题图1中的小点是1s电子在原子核外出现的概率密度的形象描述,不表示电子。小点越密,表明概率密度越大。
C(√)球形轨道沿剖面直径连线对称,所以有无数条对称轴。
D(×)题图2表示1s电子的电子云轮廓图,在该轮廓内出现电子的概率大于90%,轮廓外出现电子的概率不足10%,即1s电子也可能在球外出现。
6.答案:B
解析:A(√)原子核外每个电子所处电子层、原子轨道及其自旋方向均不完全相同,因此其运动状态不同;原子轨道就是电子在原子核外的一个空间运动状态,不同的原子轨道,空间运动状态不同。
B(×)电子能量越低,离核越近,电子能量越高,离核越远。
C(√)电子云就是用小点疏密来表示原子核外空间各电子出现概率大小的一种图形,即可用电子云描述电子在原子核外空间出现的概率密度分布。
D(√)s轨道呈球形,不同电子层中s轨道的形状相同,只是电子层序数越大,s轨道的半径越大。
7.答案:C
解析:氰酸铵属于离子化合物,尿素属于共价化合物,A项正确;人的尿液中含有尿素,尿素是人体新陈代谢的一种产物,B项正确;工业上用和合成尿素的化学方程式为,反应前后各元素的化合价均未发生变化,不属于氧化还原反应,C项错误;尿素与氰酸铵的分子式相同,而结构不同,二者互为同分异构体,D项正确。
8.答案:A
解析:石油短缺的问题可以通过开发清洁、可再生的新能源来解决。开发氢能、风能、地热能等都是很好的解决办法;大量使用木材作燃料,会破坏生态环境,加剧温室效应,故A项中做法不恰当。
9.答案:A
解析:铅是重金属,对人体有害,禁止使用含铅汽油是为了防止对环境造成污染,A项错误。
10.答案:D
解析:第4电子层有3个电子,则第4电子层的电子排布式为,轨道有电子填充,则3d轨道已充满电子,故第3电子层的电子排布式为,共18个电子。
11.答案:D
解析:由电子排布式可知,该元素的基态原子核外有4个电子层,共有25个电子,最外层为N层,有2个电子,M层有13个电子。
12.答案:C
解析:根据原子核外电子的排布原则,第4周期元素的原子中未成对电子数最多的是铬原子,其电子排布式为或,轨道和4s轨道上共有6个未成对电子。
13.答案:B
解析:最外层电子排布式为的元素处于第3周期ⅢA族,故A不符合题意;最外层电子排布式为的元素可能为Ca或部分过渡元素,故B符合题意;最外层电子排布式为的元素处于第2周期ⅡA族,故C不符合题意;最外层电子排布式为的元素处于第4周期ⅥA族,故D不符合题意。
14.答案:A
解析:处于最低能量状态的原子叫作基态原子,故A正确;表示3p能级上有2个电子,3p能级有3个轨道,故B错误;同一原子中,1s、2s、3s电子的能量逐渐增大,故C错误;同一原子中,2p、3p、4p能级都含有3个轨道,故D错误。
15.答案:有机化学研究与生命科学发展关系密切。在过去,对有机化学研究较少,与生命科学联系较少。现在,随着有机化学的发展,人类对DNA双螺旋结构和功能的认识不断深入,人类对自身的认知越来越清晰,运用基因工程技术治疗疾病已经不再是梦想。在未来,基因技术的发展将会对人类的未来产生更直接、更深远的影响。
解析:
16.答案:
解析:
17.答案:能通过对波函数进行数学处理计算出电子在什么地方出现的概率大、在什么地方出现的概率小。通常用单位体积内小点的疏密程度来表示电子在原子核外某处单位体积内出现概率的大小:点密集的地方,表示电子在此处单位体积内出现的概率大;点稀疏的地方,表示电子在此处单位体积内出现的概率小。
这种形象地描述电子在核外空间某处单位体积内的概率分布的图形称为电子云图。
解析:
18.答案:(1)①.N;②.
(2)①.3;②.哑铃
(3)泡利不相容原理
(4)17
(5)焰色试验
解析:
(1)B为N元素,其基态原子价电子排布式为,轨道表示式为;
(2)由解题思路可知,D为P元素,P的原子序数为15,基态原子价电子排布式为,原子中能量最高的电子所在的原子轨道是电子云为哑铃形的3p轨道,在空间有3个不同的伸展方向;
(3)由泡利不相容原理可知,1个原子轨道只能容纳2个自旋方向相反的电子,则轨道表示式违反了泡利不相容原理;
(4)由解题思路可知,E为Cl元素,Cl的原子序数为17,由泡利不相容原理可知,1个原子核外不可能存在运动状态完全相同的电子,则氯原子核外有17种运动状态不同的电子;
(5)由解题思路可知,F为K,实验室常用焰色试验检验K元素。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
原子结构--2024-2025学年高中化学人教版选择性必修二课时作业
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H∶1 C∶12 N∶14 O∶16 Na∶23 S∶32
一、单选题(每题3分,共42分)
1.下列各基态原子或离子的电子排布式书写正确的是( )
A. B.
C. D.
2.下列是一些基态原子的2p轨道和3d轨道中电子的排布情况,其中违反洪特规则的是( )
A.①②③ B.④⑤⑥ C.②④⑥ D.③④⑥
3.若将基态S原子的电子排布式写成,轨道表示式写成,则违背了( )
A.能量守恒原理、泡利不相容原理 B.泡利不相容原理、洪特规则
C.能量最低原理、洪特规则特例 D.洪特规则、泡利不相容原理
4.下列关于电子云或原子轨道的叙述中,正确的是( )
A.电子云图中的小点越密,表示原子核外单位体积内的电子越多
B.电子云表示电子运动的轨迹
C.原子轨道表示电子在空间各处出现的概率
D.电子云用小点的疏密程度来表示电子在原子核外单位体积内出现概率的大小
5.图1和图2分别是1s电子的概率密度分布图和电子云轮廓图。下列有关说法正确的是( )
A.图1中的每个小点都表示1个电子
B.图1中的小点表示电子在核外所处的位置
C.图2表明1s轨道呈球形,有无数条对称轴
D.图2表示1s电子只能在球体内出现
6.原子核外电子属于微观粒子范畴,运动规律具有与宏观粒子不同的特点。下列有关说法错误的是( )
A.原子核外每个电子的运动状态都不同,电子的一个空间运动状态称为一个原子轨道
B.离核越远的电子,能量越低
C.用电子云描述电子在原子核外空间出现的概率密度分布
D.各电子层中s轨道的形状相同,同一原子的电子层序数越大,s轨道的半径越大
7.1828年,德国化学家维勒在制备无机盐氰酸铵时得到了尿素,第一次通过人工的方法将无机物转变成有机物。下列关于尿素的叙述不正确的是( )
A.氰酸铵属于离子化合物,尿素属于共价化合物
B.尿素是人体新陈代谢的一种产物
C.工业上用氨气和二氧化碳在高温、高压下合成尿素的反应是氧化还原反应
D.尿素与氰酸铵()互为同分异构体
8.石油是一种重要的能源,我国面临着石油短缺的问题。从可持续发展的角度看,以下解决能源问题的做法不恰当的是( )
A.大量使用木材作燃料 B.用液氢代替汽油
C.开发风能 D.开发地热能
9.下列关于某些社会热点问题的说法中,不正确的是( )
A.禁止使用含铅汽油是为了提高汽油的燃烧效率
B.甲醇超标的酒不能饮用
C.进入大气的氟氯代烃会破坏高空臭氧层
D.光化学烟雾的产生与人为排放的烃、氨氧化物有关
10.某基态原子的第4电子层有3个电子,则第3电子层的电子数有( )
A.2个 B.8个 C.10个 D.18个
11.某基态原子的电子排布式为,下列说法中不正确的是( )
A.该元素基态原子中共有25个电子
B.该元素原子核外有4个电子层
C.该元素原子最外层共有2个电子
D.该元素原子M电子层共有8个电子
12.第4周期元素的原子中,未成对电子数最多可达( )
A.4个 B.5个 C.6个 D.7个
13.已知下列元素基态原子的最外层电子排布式,其中不一定能表示该元素为主族元素的是( )。
A. B. C. D.
14.下列说法中,正确的是( )。
A.处于最低能量状态的原子叫作基态原子
B.表示3p能级有两个轨道
C.同一原子中,电子的能量逐渐减小
D.同一原子中,能级的轨道数依次增多
二、解答题(共4题,58分)
15.有机化学研究与生命科学发展的关系如何?请查阅有关资料,阐述你对它们过去、现在以及未来关系的认识。
16.本章第1、2节主要讲述了原子核外电子的运动状态。请用图示的方法总结下列描述核外电子运动状态的概念间的关系:电子排布式、轨道表示式、电子层、能级、原子轨道、电子云图、自旋状态、能量最低原理、构造原理、泡利不相容原理、洪特规则。
17.原子轨道可以用波函数来表示,那么,又该如何理解波函数?怎样形象地描述电子在空间中的运动与分布呢?
18.现有七种元素,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息回答问题:
A 元素原子半径在周期表中最小,也是宇宙中最丰富的元素
B 元素原子的核外p轨道总电子数比s轨道总电子数少1
C 元素的第一至第四电离能分别是
D 原子核外所有p轨道全满或半满
E 元素主族序数与周期序数的差为4,原子半径在同周期中最小
F 是前四周期中电负性最小的元素
(1)B的元素符号为___________,基态原子价电子轨道表示式为___________。
(2)基态D原子中能量最高的电子所在的原子轨道的电子云在空间有___________个伸展方向,原子轨道呈___________形。
(3)某同学根据上述信息,推断C基态原子的核外电子轨道表示式为,该同学所写的轨道表示式违反了___________。
(4)E元素原子核外有___________种运动状态不同的电子。
(5)检验F元素的方法是___________。
参考答案
1.答案:A
解析:
Sepl填入顺序:按照构造原理写出电子填入能级的顺序 Step2根据各能级所能容纳的电子数填充电子 Step3书写顺序:按电子层顺序书写(同一电子层的放一块,且电子层低的能级写在左边) Step4检查是否符合洪特规则特例
Cr的原子序数为24 1s2s2p3s3p4s3d4p…… 符合,调整3d、4s上的电子,
Ca的原子序数为20 1s2s2p3s3p4s3d4p……
Fe的原子序数为26 1s2s2p3s3p4s3d4p……
O的原子序数为8 1s2s2p3s3p4s3d4p……
A(√)的核外电子排布式为,第3周期稀有气体元素是Ar,则简化电子排布式为。
B(×)的核外电子排布式为,第3周期稀有气体元素是Ar,简化电子排布式为。
C(×)的核外电子排布式为,第3周期稀有气体元素是Ar,简化电子排布式为。
D(×)核外有10个电子,根据基态O原子的电子排布式知,2p轨道增加2个电子,则的电子排布式为。
2.答案:C
解析:
题给信息 陷阱 原因解题思路 正确书写
①(√)
②(×) 陷阱3违反洪特规则 2p能级中的三个轨道是简并的,电子优先单独分占一个轨道且自旋平行,违反洪特规则
③(×) 陷阱2违反泡利不相容原理 同一个原子轨道中不可能有自旋方向相同的2个电子
④(×) 陷阱3违反洪特规则 3d能级中的五个轨道是简并的,电子优先单独分占一个轨道且自旋平行
⑤(√)
⑥(×) 陷阱3违反洪特规则 3d能级中的五个轨道是简并的,电子优先单独分占一个轨道且自旋平行
3.答案:D
解析:
题给信息 陷阱 原因解题思路 正确书写
陷阱3违反洪特规则 对于p能级的三个平行轨道,电子优先单独分占一个轨道且自旋平行 (或或)
S: 陷阱2违反泡利不相容原理 同一原子轨道中不可能有自旋平行的2个电子 S:
4.答案:D
解析:A(×)电子云图中的小点越密,表示电子在原子核外空间出现的机会越多。
B(×)电子云表示电子在原子核外空间某处出现机会的多少,不能表示电子的运动轨迹。
C(×)原子轨道表示电子出现概率最大的区域。
D(√)电子云表示电子在原子核外空间出现的概率分布,小点的疏密表示电子在单位体积空间内出现概率的大小。
5.答案:C
解析:A(×)B(×)题图1中的小点是1s电子在原子核外出现的概率密度的形象描述,不表示电子。小点越密,表明概率密度越大。
C(√)球形轨道沿剖面直径连线对称,所以有无数条对称轴。
D(×)题图2表示1s电子的电子云轮廓图,在该轮廓内出现电子的概率大于90%,轮廓外出现电子的概率不足10%,即1s电子也可能在球外出现。
6.答案:B
解析:A(√)原子核外每个电子所处电子层、原子轨道及其自旋方向均不完全相同,因此其运动状态不同;原子轨道就是电子在原子核外的一个空间运动状态,不同的原子轨道,空间运动状态不同。
B(×)电子能量越低,离核越近,电子能量越高,离核越远。
C(√)电子云就是用小点疏密来表示原子核外空间各电子出现概率大小的一种图形,即可用电子云描述电子在原子核外空间出现的概率密度分布。
D(√)s轨道呈球形,不同电子层中s轨道的形状相同,只是电子层序数越大,s轨道的半径越大。
7.答案:C
解析:氰酸铵属于离子化合物,尿素属于共价化合物,A项正确;人的尿液中含有尿素,尿素是人体新陈代谢的一种产物,B项正确;工业上用和合成尿素的化学方程式为,反应前后各元素的化合价均未发生变化,不属于氧化还原反应,C项错误;尿素与氰酸铵的分子式相同,而结构不同,二者互为同分异构体,D项正确。
8.答案:A
解析:石油短缺的问题可以通过开发清洁、可再生的新能源来解决。开发氢能、风能、地热能等都是很好的解决办法;大量使用木材作燃料,会破坏生态环境,加剧温室效应,故A项中做法不恰当。
9.答案:A
解析:铅是重金属,对人体有害,禁止使用含铅汽油是为了防止对环境造成污染,A项错误。
10.答案:D
解析:第4电子层有3个电子,则第4电子层的电子排布式为,轨道有电子填充,则3d轨道已充满电子,故第3电子层的电子排布式为,共18个电子。
11.答案:D
解析:由电子排布式可知,该元素的基态原子核外有4个电子层,共有25个电子,最外层为N层,有2个电子,M层有13个电子。
12.答案:C
解析:根据原子核外电子的排布原则,第4周期元素的原子中未成对电子数最多的是铬原子,其电子排布式为或,轨道和4s轨道上共有6个未成对电子。
13.答案:B
解析:最外层电子排布式为的元素处于第3周期ⅢA族,故A不符合题意;最外层电子排布式为的元素可能为Ca或部分过渡元素,故B符合题意;最外层电子排布式为的元素处于第2周期ⅡA族,故C不符合题意;最外层电子排布式为的元素处于第4周期ⅥA族,故D不符合题意。
14.答案:A
解析:处于最低能量状态的原子叫作基态原子,故A正确;表示3p能级上有2个电子,3p能级有3个轨道,故B错误;同一原子中,1s、2s、3s电子的能量逐渐增大,故C错误;同一原子中,2p、3p、4p能级都含有3个轨道,故D错误。
15.答案:有机化学研究与生命科学发展关系密切。在过去,对有机化学研究较少,与生命科学联系较少。现在,随着有机化学的发展,人类对DNA双螺旋结构和功能的认识不断深入,人类对自身的认知越来越清晰,运用基因工程技术治疗疾病已经不再是梦想。在未来,基因技术的发展将会对人类的未来产生更直接、更深远的影响。
解析:
16.答案:
解析:
17.答案:能通过对波函数进行数学处理计算出电子在什么地方出现的概率大、在什么地方出现的概率小。通常用单位体积内小点的疏密程度来表示电子在原子核外某处单位体积内出现概率的大小:点密集的地方,表示电子在此处单位体积内出现的概率大;点稀疏的地方,表示电子在此处单位体积内出现的概率小。
这种形象地描述电子在核外空间某处单位体积内的概率分布的图形称为电子云图。
解析:
18.答案:(1)①.N;②.
(2)①.3;②.哑铃
(3)泡利不相容原理
(4)17
(5)焰色试验
解析:
(1)B为N元素,其基态原子价电子排布式为,轨道表示式为;
(2)由解题思路可知,D为P元素,P的原子序数为15,基态原子价电子排布式为,原子中能量最高的电子所在的原子轨道是电子云为哑铃形的3p轨道,在空间有3个不同的伸展方向;
(3)由泡利不相容原理可知,1个原子轨道只能容纳2个自旋方向相反的电子,则轨道表示式违反了泡利不相容原理;
(4)由解题思路可知,E为Cl元素,Cl的原子序数为17,由泡利不相容原理可知,1个原子核外不可能存在运动状态完全相同的电子,则氯原子核外有17种运动状态不同的电子;
(5)由解题思路可知,F为K,实验室常用焰色试验检验K元素。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
