【浙江专练】2025年中考科学专项复习 第09节-质量守恒和化学方程式(含答案)
文档属性
| 名称 | 【浙江专练】2025年中考科学专项复习 第09节-质量守恒和化学方程式(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 594.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2025-02-28 00:00:00 | ||
图片预览




文档简介
第09节-质量守恒和化学方程式
一、单选题
1.如图是一款变色眼镜,在使用期限内眼镜质量保持不变。它的镜片内含有溴化银(AgBr)和氧化铜(CuO)。在室外强光照射下,溴化银转化成单质溴(Br)和银(Ag),镜片颜色变暗棕色;在室内光线较暗处,单质溴和银在氧化铜催化下重新生成溴化银,镜片颜色又变浅。在使用期限内小金佩戴该眼镜后( )
A.从室内走到室外,镜片中物质发生化合反应
B.从室外走进室内,银元素的化合价降低
C.室内生成溴化银的质量一定大于室外分解溴化银的质量
D.无论环境明暗如何变化,氧化铜的质量始终不变
2.机动车尾气排放物是空气污染的主要来源之一。“三效催化转换器”能将汽车尾气中的有毒气体转为无毒气体。图为其反应的微观示意图,下列说法正确的是( )
A.反应前后原子的种类发生了改变
B.该反应属于置换反应
C.该反应能将有毒的NO2和CO气体转化为N2和CO2
D.参加反应的NO2和CO的个数比为2:5
3.将氢氧化钠溶液溶液逐滴滴入100克硫酸和硫酸铜的混合溶液中,并根据观察到的现象绘制了生成沉淀的质量与加入氢氧化钠溶液质量的关系如图曲线根据图像描述中错误的是( )
A.0.49克沉淀是氢氧化铜
B.滴加的氢氧化钠溶液的质量分数是4%
C.混合溶液中硫酸铜的质量分数是0.8%
D.混合溶液中硫酸的质量分数是1.96%
4.氢能是公认的清洁能源。21世纪,我国被公认为最有可能率先实现氢燃料电池和氢能汽车产业化的国家。氢燃料电池反应的化学方程式为:2H2+O22H2O,从方程式中获取的信息不正确的是( )
A.反应前后,元素的种类没有变化
B.在常温下氢气与氧气混合就可以发生反应
C.4g氢气与32g氧气完全反应,可以生成36g水
D.反应前后,氢原子和氧原子的数目都没有改变
5.质量守恒定律是自然界基本的规律之一。下列装置及实验(天平未画出)能用来验证质量守恒定律的是( )
A. B.
C. D.
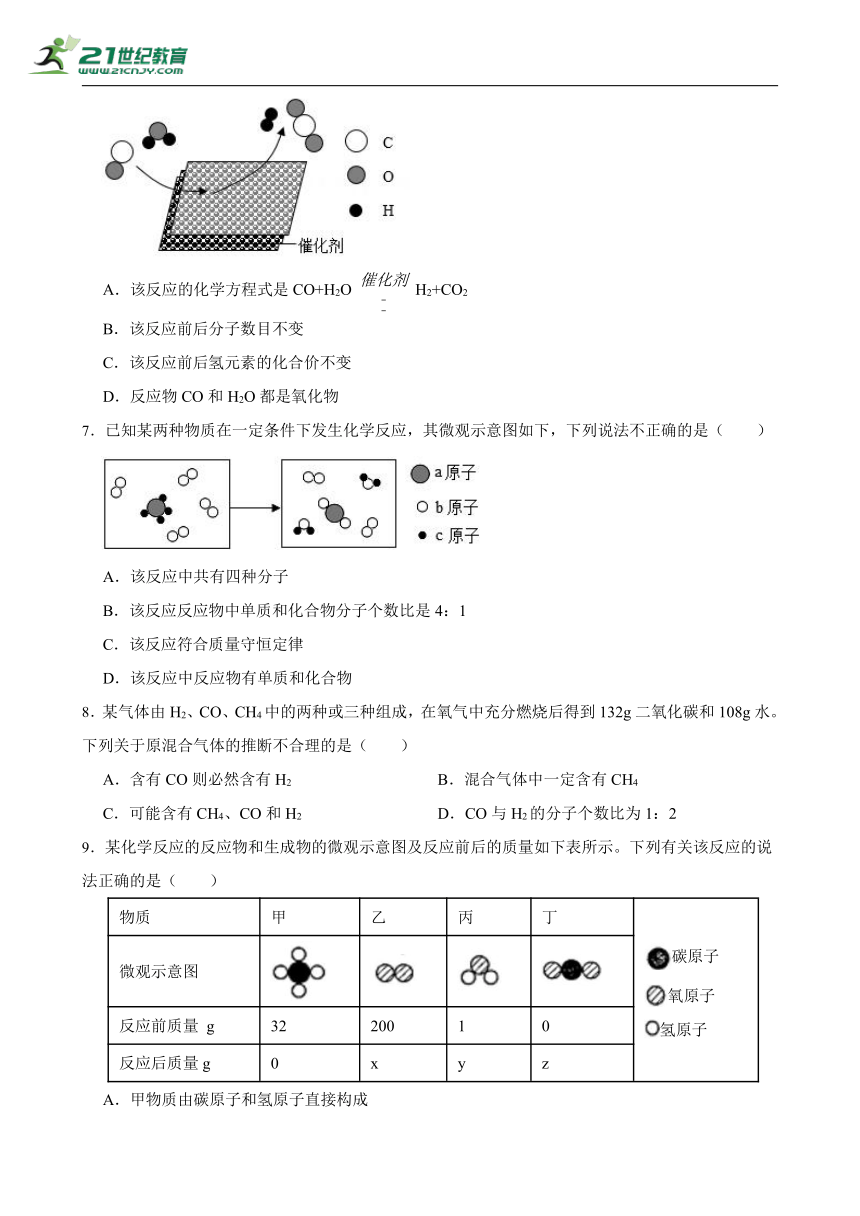
6.中国科学院首创室温制氢方案,其反应原理如图所示。下列说法错误的是( )
A.该反应的化学方程式是CO+H2O H2+CO2
B.该反应前后分子数目不变
C.该反应前后氢元素的化合价不变
D.反应物CO和H2O都是氧化物
7.已知某两种物质在一定条件下发生化学反应,其微观示意图如下,下列说法不正确的是( )
A.该反应中共有四种分子
B.该反应反应物中单质和化合物分子个数比是4:1
C.该反应符合质量守恒定律
D.该反应中反应物有单质和化合物
8.某气体由H2、CO、CH4中的两种或三种组成,在氧气中充分燃烧后得到132g二氧化碳和108g水。下列关于原混合气体的推断不合理的是( )
A.含有CO则必然含有H2 B.混合气体中一定含有CH4
C.可能含有CH4、CO和H2 D.CO与H2的分子个数比为1:2
9.某化学反应的反应物和生成物的微观示意图及反应前后的质量如下表所示。下列有关该反应的说法正确的是( )
物质 甲 乙 丙 丁 碳原子 氧原子 氢原子
微观示意图
反应前质量 g 32 200 1 0
反应后质量g 0 x y z
A.甲物质由碳原子和氢原子直接构成
B.该反应属于置换反应
C.参加反应的反应物分子个数比为1:1
D.x+y+z=233
10.下列说法中正确的是( )
A.足量的Fe、S、H2三种物质分别在氧气中完全燃烧,若消耗等质量的氧气,则消耗质量最多的是H2
B.现有FeO与Fe2O3两种纯净物,FeO中氧元素的质量分数大于Fe2O3中氧元素的质量分数
C.在某种氮的氧化物中,若氮元素与氧元素的质量比为7:4,该氧化物的化学式为NO
D.一氧化碳和二氧化碳组成的混合气体中,碳、氧原子的个数比可能是3:4
11.将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下。下列说法不正确的是( )
A.a和b是反应物,d可能是催化剂
B.反应后a的质量为3.84g
C.c中元素种类一定等于a、b两种物质中元素的种类之和
D.该反应属于分解反应
二、填空题
12.一种制备氢氧化镁的生产流程如图所示,MgCl2和NaOH按恰好完全反应的比例加料。
(1)写出步骤c中发生反应的化学方程式: 。
(2)x= 。
(3)过滤得到的粗产品还要经过洗涤,洗涤时主要除去的杂质是 。
(4)上述流程中若用下列物质代替氢氧化钠,也能制得氢氧化镁的是 。
①盐酸 ②氯化钙 ③氨水 ④硫酸镁
13.北宋沈括在《梦溪笔谈》中记载了用“苦泉水”制取铜的方法,其主要生产流程如图所示。
(1)①过程可通过冷却热饱和溶液获得晶体,该变化属于 (填“物理变化”或“化学变化”)。
(2)②过程变化的方程式为CuSO4+CCu+X+CO,则X的化学式为 。
(3)④过程中化学变化的反应类型为________(填字母)。
A.分解反应 B.化合反应 C.复分解反应 D.置换反应
14.以化合价为纵坐标,物质的类别为横坐标所绘制的图象叫价类图.如图为硫的价类图,请分析该图后填空:
(1)E点表示氧化物的物质化学式是 ;
(2)A点表示的物质类别是 ;
(3)写出由B点表示的氧化物与氢氧化钠溶液反应的化学方程式 。
15.配平下列方程式:
(1) Al+ H2SO4= Al2(SO4)3+ H2↑
(2) Mg+O2 MgO
(3)Fe+ HCl=FeCl2+H2↑
(4)CH4+ O2 CO2+ H2O
16.为控制日趋严重的温室效应,科学家正在研究一种消耗二氧化碳的有效方法:将和以一定比例混合,在特定的条件下发生反应,生成水和另外一种化工原料。请写出该原料的化学式: (系数为1)。
17.“零碳甲醇()”因作为杭州亚运会主火炬燃料而备受瞩目。如图所示为基于“绿氢”和生物质富氧燃烧技术的“零碳甲醇”合成系统,其中X为某种发电方式。
(1)“绿氢”是指利用可再生能源发电进行电解水制氢,则“X”可以是 。
A.光伏发电 B.风力发电 C.燃煤发电 D.核能发电
(2)在合成甲醇的反应中,参加反应的二氧化碳和氢气的分子个数比为 。“零碳甲醇”更准确的说是“零增碳甲醇”,“零增碳”是指 。
三、解答题
18.为测定实验室中氯酸钾样品(杂质不参与反应)的纯度,取一定量该样品进行加热,不同时刻固体质量数据如图所示。
(1)时刻产生的氧气质量是 。
(2)时段剩余固体质量不变的原因 。
(3)列式计算该样品中氯酸钾的纯度 。
19.随着汽车保有量的不断提高,环境和能源问题也日益突出,研制清洁能源汽车已成为解决上述问题的途径之一。
(1) 传统汽车的发动机多为汽油机。如图甲所示,汽油机的一个工作循环顺序是 (选填序号),此过程会排放出大气污染气体;如图乙所示为某汽油机在工作时的能量分配图。据图数据,该汽油机的效率为 。
(2)氢能源汽车是清洁能源汽车的一个研究方向,但氢的储存是一个需要解决的问题。
①目前常用的储氢方法是金属储氢法,如氢化钙(CaH2)是一种常用的生氢剂,遇水后生成氢气和一种碱,写出其反应的化学方程式 。
②2017年1月《科学》杂志报道,哈佛大学实验室在超高压条件下将氢气转变为金属氢(此过程为物理变化),为氢的储存提供了新方法。金属氢可能具有的化学性质是 (写出一点)。
(3)如图丙所示是负排放概念车——“叶子”。其车项上的大叶子能模拟自然界中叶片的光合作用,最终把太阳能转化为电能。 其中的“负排放”是指该车不但不排放,反而能吸收大气中的 ,从而减弱大气的温室效应。
20.请写出下列反应的化学方程式:
(1)澄清石灰水敞口久置变浑浊: ;
(2)铜在酒精灯火焰上加热变黑: 。
21.某同学从定量角度研究过氧化氢溶液制取氧气的过程,对原实验进行部分改进,增加了称量操作.具体做法是:取溶质质量分数为10%的过氧化氢溶液和少量的二氧化锰放入气体发生装置,并对反应前后混合物的质量进行称量,记录如下:
反应过程 反应前 反应后
质量变化(不含容器质量) 34.3g 32.7g
若反应后,双氧水分解完全且氧气全部逸出,试回答:
(1)制得氧气的质量为 克。
(2)请你列式计算所取过氧化氢溶液的质量为多少克?
22.多数火箭所用燃料燃烧时的化学方程式为,
(1)则R的化学式为 ;
(2)如果消耗1.2吨偏二甲肼则产生多少千克
答案解析部分
1.D
2.C
3.D
4.B
5.A
6.C
7.B
8.B
9.D
10.D
11.D
12.(1)MgCl2+2NaOH=Mg(OH)2↓+2NaCl
(2)280
(3)NaCl
(4)③
13.(1)化学变化
(2)SO3
(3)D
14.(1)SO2
(2)单质
(3)SO3+2NaOH=Na2SO4+H2O
15.(1)2;3;3
(2)2;2
(3)2
(4)2;1;2
16.C2H4
17.(1)AB
(2)1:3;甲醇燃烧产生CO2的量与合成甲醇消耗CO2的量相同,实现零碳排放
18.1.68g;氯酸钾已反应完全;由图可知,氯酸钾完全分解生成的氧气质量=5g+1.5g-4.58g=1.92g,设5g样品中含有氯酸钾的质量为x,x=4.9g氯酸钾的质量分数:×100%═98%;答:该样品中氯酸钾的纯度是98%。
19.③④②①;25%;CaH2+2H2O=Ca(OH)2+3H2↑;还原性等(合理即可);二氧化碳
20.(1)Ca(OH)2+CO2=CaCO3↓+H2O
(2)2Cu+O22CuO
21.1.6克;34克
22.(1)N2
(2)解:设消耗1.2吨C2H8N2产生CO2的质量为x。
C2H8N2+2N2O4=3N2↑+2CO2↑+4H2O↑
60 88
1.2t x
x=1.76t=1760kg
答:消耗1.2吨偏二甲肼(C2H8N2)则产生1760千克CO2。
一、单选题
1.如图是一款变色眼镜,在使用期限内眼镜质量保持不变。它的镜片内含有溴化银(AgBr)和氧化铜(CuO)。在室外强光照射下,溴化银转化成单质溴(Br)和银(Ag),镜片颜色变暗棕色;在室内光线较暗处,单质溴和银在氧化铜催化下重新生成溴化银,镜片颜色又变浅。在使用期限内小金佩戴该眼镜后( )
A.从室内走到室外,镜片中物质发生化合反应
B.从室外走进室内,银元素的化合价降低
C.室内生成溴化银的质量一定大于室外分解溴化银的质量
D.无论环境明暗如何变化,氧化铜的质量始终不变
2.机动车尾气排放物是空气污染的主要来源之一。“三效催化转换器”能将汽车尾气中的有毒气体转为无毒气体。图为其反应的微观示意图,下列说法正确的是( )
A.反应前后原子的种类发生了改变
B.该反应属于置换反应
C.该反应能将有毒的NO2和CO气体转化为N2和CO2
D.参加反应的NO2和CO的个数比为2:5
3.将氢氧化钠溶液溶液逐滴滴入100克硫酸和硫酸铜的混合溶液中,并根据观察到的现象绘制了生成沉淀的质量与加入氢氧化钠溶液质量的关系如图曲线根据图像描述中错误的是( )
A.0.49克沉淀是氢氧化铜
B.滴加的氢氧化钠溶液的质量分数是4%
C.混合溶液中硫酸铜的质量分数是0.8%
D.混合溶液中硫酸的质量分数是1.96%
4.氢能是公认的清洁能源。21世纪,我国被公认为最有可能率先实现氢燃料电池和氢能汽车产业化的国家。氢燃料电池反应的化学方程式为:2H2+O22H2O,从方程式中获取的信息不正确的是( )
A.反应前后,元素的种类没有变化
B.在常温下氢气与氧气混合就可以发生反应
C.4g氢气与32g氧气完全反应,可以生成36g水
D.反应前后,氢原子和氧原子的数目都没有改变
5.质量守恒定律是自然界基本的规律之一。下列装置及实验(天平未画出)能用来验证质量守恒定律的是( )
A. B.
C. D.
6.中国科学院首创室温制氢方案,其反应原理如图所示。下列说法错误的是( )
A.该反应的化学方程式是CO+H2O H2+CO2
B.该反应前后分子数目不变
C.该反应前后氢元素的化合价不变
D.反应物CO和H2O都是氧化物
7.已知某两种物质在一定条件下发生化学反应,其微观示意图如下,下列说法不正确的是( )
A.该反应中共有四种分子
B.该反应反应物中单质和化合物分子个数比是4:1
C.该反应符合质量守恒定律
D.该反应中反应物有单质和化合物
8.某气体由H2、CO、CH4中的两种或三种组成,在氧气中充分燃烧后得到132g二氧化碳和108g水。下列关于原混合气体的推断不合理的是( )
A.含有CO则必然含有H2 B.混合气体中一定含有CH4
C.可能含有CH4、CO和H2 D.CO与H2的分子个数比为1:2
9.某化学反应的反应物和生成物的微观示意图及反应前后的质量如下表所示。下列有关该反应的说法正确的是( )
物质 甲 乙 丙 丁 碳原子 氧原子 氢原子
微观示意图
反应前质量 g 32 200 1 0
反应后质量g 0 x y z
A.甲物质由碳原子和氢原子直接构成
B.该反应属于置换反应
C.参加反应的反应物分子个数比为1:1
D.x+y+z=233
10.下列说法中正确的是( )
A.足量的Fe、S、H2三种物质分别在氧气中完全燃烧,若消耗等质量的氧气,则消耗质量最多的是H2
B.现有FeO与Fe2O3两种纯净物,FeO中氧元素的质量分数大于Fe2O3中氧元素的质量分数
C.在某种氮的氧化物中,若氮元素与氧元素的质量比为7:4,该氧化物的化学式为NO
D.一氧化碳和二氧化碳组成的混合气体中,碳、氧原子的个数比可能是3:4
11.将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下。下列说法不正确的是( )
A.a和b是反应物,d可能是催化剂
B.反应后a的质量为3.84g
C.c中元素种类一定等于a、b两种物质中元素的种类之和
D.该反应属于分解反应
二、填空题
12.一种制备氢氧化镁的生产流程如图所示,MgCl2和NaOH按恰好完全反应的比例加料。
(1)写出步骤c中发生反应的化学方程式: 。
(2)x= 。
(3)过滤得到的粗产品还要经过洗涤,洗涤时主要除去的杂质是 。
(4)上述流程中若用下列物质代替氢氧化钠,也能制得氢氧化镁的是 。
①盐酸 ②氯化钙 ③氨水 ④硫酸镁
13.北宋沈括在《梦溪笔谈》中记载了用“苦泉水”制取铜的方法,其主要生产流程如图所示。
(1)①过程可通过冷却热饱和溶液获得晶体,该变化属于 (填“物理变化”或“化学变化”)。
(2)②过程变化的方程式为CuSO4+CCu+X+CO,则X的化学式为 。
(3)④过程中化学变化的反应类型为________(填字母)。
A.分解反应 B.化合反应 C.复分解反应 D.置换反应
14.以化合价为纵坐标,物质的类别为横坐标所绘制的图象叫价类图.如图为硫的价类图,请分析该图后填空:
(1)E点表示氧化物的物质化学式是 ;
(2)A点表示的物质类别是 ;
(3)写出由B点表示的氧化物与氢氧化钠溶液反应的化学方程式 。
15.配平下列方程式:
(1) Al+ H2SO4= Al2(SO4)3+ H2↑
(2) Mg+O2 MgO
(3)Fe+ HCl=FeCl2+H2↑
(4)CH4+ O2 CO2+ H2O
16.为控制日趋严重的温室效应,科学家正在研究一种消耗二氧化碳的有效方法:将和以一定比例混合,在特定的条件下发生反应,生成水和另外一种化工原料。请写出该原料的化学式: (系数为1)。
17.“零碳甲醇()”因作为杭州亚运会主火炬燃料而备受瞩目。如图所示为基于“绿氢”和生物质富氧燃烧技术的“零碳甲醇”合成系统,其中X为某种发电方式。
(1)“绿氢”是指利用可再生能源发电进行电解水制氢,则“X”可以是 。
A.光伏发电 B.风力发电 C.燃煤发电 D.核能发电
(2)在合成甲醇的反应中,参加反应的二氧化碳和氢气的分子个数比为 。“零碳甲醇”更准确的说是“零增碳甲醇”,“零增碳”是指 。
三、解答题
18.为测定实验室中氯酸钾样品(杂质不参与反应)的纯度,取一定量该样品进行加热,不同时刻固体质量数据如图所示。
(1)时刻产生的氧气质量是 。
(2)时段剩余固体质量不变的原因 。
(3)列式计算该样品中氯酸钾的纯度 。
19.随着汽车保有量的不断提高,环境和能源问题也日益突出,研制清洁能源汽车已成为解决上述问题的途径之一。
(1) 传统汽车的发动机多为汽油机。如图甲所示,汽油机的一个工作循环顺序是 (选填序号),此过程会排放出大气污染气体;如图乙所示为某汽油机在工作时的能量分配图。据图数据,该汽油机的效率为 。
(2)氢能源汽车是清洁能源汽车的一个研究方向,但氢的储存是一个需要解决的问题。
①目前常用的储氢方法是金属储氢法,如氢化钙(CaH2)是一种常用的生氢剂,遇水后生成氢气和一种碱,写出其反应的化学方程式 。
②2017年1月《科学》杂志报道,哈佛大学实验室在超高压条件下将氢气转变为金属氢(此过程为物理变化),为氢的储存提供了新方法。金属氢可能具有的化学性质是 (写出一点)。
(3)如图丙所示是负排放概念车——“叶子”。其车项上的大叶子能模拟自然界中叶片的光合作用,最终把太阳能转化为电能。 其中的“负排放”是指该车不但不排放,反而能吸收大气中的 ,从而减弱大气的温室效应。
20.请写出下列反应的化学方程式:
(1)澄清石灰水敞口久置变浑浊: ;
(2)铜在酒精灯火焰上加热变黑: 。
21.某同学从定量角度研究过氧化氢溶液制取氧气的过程,对原实验进行部分改进,增加了称量操作.具体做法是:取溶质质量分数为10%的过氧化氢溶液和少量的二氧化锰放入气体发生装置,并对反应前后混合物的质量进行称量,记录如下:
反应过程 反应前 反应后
质量变化(不含容器质量) 34.3g 32.7g
若反应后,双氧水分解完全且氧气全部逸出,试回答:
(1)制得氧气的质量为 克。
(2)请你列式计算所取过氧化氢溶液的质量为多少克?
22.多数火箭所用燃料燃烧时的化学方程式为,
(1)则R的化学式为 ;
(2)如果消耗1.2吨偏二甲肼则产生多少千克
答案解析部分
1.D
2.C
3.D
4.B
5.A
6.C
7.B
8.B
9.D
10.D
11.D
12.(1)MgCl2+2NaOH=Mg(OH)2↓+2NaCl
(2)280
(3)NaCl
(4)③
13.(1)化学变化
(2)SO3
(3)D
14.(1)SO2
(2)单质
(3)SO3+2NaOH=Na2SO4+H2O
15.(1)2;3;3
(2)2;2
(3)2
(4)2;1;2
16.C2H4
17.(1)AB
(2)1:3;甲醇燃烧产生CO2的量与合成甲醇消耗CO2的量相同,实现零碳排放
18.1.68g;氯酸钾已反应完全;由图可知,氯酸钾完全分解生成的氧气质量=5g+1.5g-4.58g=1.92g,设5g样品中含有氯酸钾的质量为x,x=4.9g氯酸钾的质量分数:×100%═98%;答:该样品中氯酸钾的纯度是98%。
19.③④②①;25%;CaH2+2H2O=Ca(OH)2+3H2↑;还原性等(合理即可);二氧化碳
20.(1)Ca(OH)2+CO2=CaCO3↓+H2O
(2)2Cu+O22CuO
21.1.6克;34克
22.(1)N2
(2)解:设消耗1.2吨C2H8N2产生CO2的质量为x。
C2H8N2+2N2O4=3N2↑+2CO2↑+4H2O↑
60 88
1.2t x
x=1.76t=1760kg
答:消耗1.2吨偏二甲肼(C2H8N2)则产生1760千克CO2。
