【浙江专练】2025年中考科学专项复习 第11节-酸碱盐(含答案)
文档属性
| 名称 | 【浙江专练】2025年中考科学专项复习 第11节-酸碱盐(含答案) |

|
|
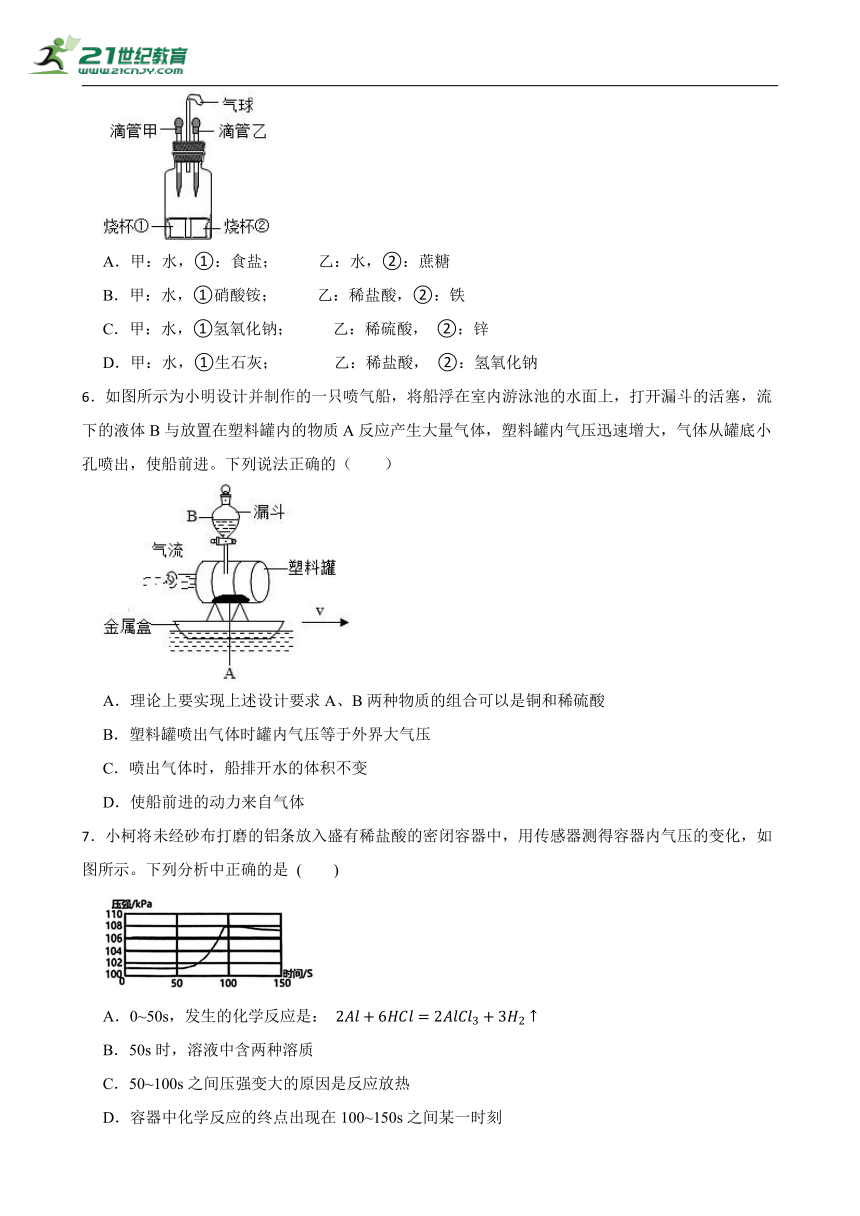
| 格式 | docx | ||
| 文件大小 | 538.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2025-02-28 00:00:00 | ||
图片预览




文档简介
酸碱盐和酸
一、单选题
1.除去下列物质中混有的少量杂质,下列方案不可行的是( )
物质 杂质 方案
A KCl 加水溶解、过滤、洗涤、蒸发
B CO气体 气体 通过足量的氢氧化钠溶液后干燥
C NaCl固体 固体 加入足量的稀盐酸后蒸发
D 固体 固体 加水溶解再通入足量二氧化碳后蒸发
A.A B.B C.C D.D
2.逆向推力是科学学习中的一种思维方法,下列的逆向推理正确的是( )
A.酸性溶液能使紫色石蕊试液变红,所以能使紫色石蕊试液变红的一定是酸性溶液
B.活泼金属与稀盐酸反应放出气体,所以能与稀盐酸反应放出气体的物质一定是活泼金属
C.从主动脉离开心脏的是动脉血,所以动脉血管中流动的一定是动脉血
D.使用杠杆可以省力,所以能省力的简单机械一定是杠杆
3.下列操作正确的是( )
A.氧气验满 B.过滤
C.稀释浓硫酸 D.测定溶液酸碱度
4.下列物质间的转化,只需通过一步反应就能实现的是( )
A.BaCO3→Ba(OH)2 B.Na2SO4→NaCl
C.Fe→Fe2(SO4)3 D.CuO→Cu(OH)2
5.如图所示,将滴管甲中的液体挤出,气球明显鼓起,一段时间后恢复原状,再将滴管乙中的液体挤出,气球又明显鼓起且不恢复原状。则滴管甲、乙和烧杯①②中的物质可能是( )
A.甲:水,①:食盐; 乙:水,②:蔗糖
B.甲:水,①硝酸铵; 乙:稀盐酸,②:铁
C.甲:水,①氢氧化钠; 乙:稀硫酸, ②:锌
D.甲:水,①生石灰; 乙:稀盐酸, ②:氢氧化钠
6.如图所示为小明设计并制作的一只喷气船,将船浮在室内游泳池的水面上,打开漏斗的活塞,流下的液体B与放置在塑料罐内的物质A反应产生大量气体,塑料罐内气压迅速增大,气体从罐底小孔喷出,使船前进。下列说法正确的( )
A.理论上要实现上述设计要求A、B两种物质的组合可以是铜和稀硫酸
B.塑料罐喷出气体时罐内气压等于外界大气压
C.喷出气体时,船排开水的体积不变
D.使船前进的动力来自气体
7.小柯将未经砂布打磨的铝条放入盛有稀盐酸的密闭容器中,用传感器测得容器内气压的变化,如图所示。下列分析中正确的是 ( )
A.0~50s,发生的化学反应是:
B.50s时,溶液中含两种溶质
C.50~100s之间压强变大的原因是反应放热
D.容器中化学反应的终点出现在100~150s之间某一时刻
8.分析推理是科学学习和研究中常用的思维方法。下列分析推理正确的是( )
A.中和反应有盐和水生成,因此有盐和水生成的反应一定是中和反应
B.碱溶液的pH都大于7,因此pH人于7的溶液一定是碱溶液
C.硫酸溶液与BaCl2溶液能反应产生白色风淀,因此能与BaCl2溶液反应产生白色沉淀的一定是硫酸溶液
D.酸滴入石浆试液后溶液变红色,因此盐酸滴入石蕊试液后溶液也变红色
9.归纳和演绎是重要的科学方法。下列归纳或演绎合理的是( )
A.金属Fe、Zn能与酸反应生成氢气,所以金属都能与酸反应生成氢气
B.硫酸、硝酸电离时都能产生,所以电离时只要能产生的化合物都是酸
C.氢氧化钠和氢氧化钙溶液都能使无色酚酞试液变红,所以能使无色酚酞试液变红的溶液都是碱溶液
D.有机物在空气中充分燃烧生成和,所以甲烷在空气中充分燃烧也能生成和
10.如图是稀硫酸与甲、乙、丙、丁、戊五种常见物质反应出现的现象。描述不正确的是( )
A.甲可能是无色酚酞试液
B.乙不一定是金属氧化物
C.稀硫酸与丙生成的白色沉淀属于盐类
D.稀硫酸与丁产生的无色气体可能是单质
11.从微观视角看物质的变化是化学特有的思维方式。如图描述了NaOH溶液与盐酸反应的微观实质,C处应填入的物质化学式( )
A.NaCl B.NaOH C.HCl D.H2O
12. 为研究碱的化学性质,小明进行了如下实验,实验中试管中溶液始终保持红色的是
A. B.
C. D.
13.不同品牌的洗手液pH一般不同,时四种洗手液的pH如图所示。下列说法错误的是( )
A.洗手液a用蒸馏水稀释后pH增大
B.洗手液b的酸性比a弱
C.洗手液c能使石蕊试液变蓝色
D.洗手液d和a混合液的pH一定等于7
14.往一定量的稀硫酸中加入过量的锌粒,如图是反应过程中某种量y随加入锌粒的质量变化的图像。由此可知,y不可能表示( )。
A.硫酸的质量分数 B.生成硫酸锌的质量
C.溶液的pH D.生成氢气的质量
15.等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,下列叙述正确的是( )
A.M、N两种金属中较活泼的是N B.生成H2的质量M<N
C.相对原子质量较大的是N D.产生H2的速率N>M
16.推理和归纳是科学学习和研究中常用的思维方法,下列推理正确的是( )
A.大多数物质燃烧需要氧气,所以氧气具有可燃性
B.碱溶液呈碱性,所以呈碱性的溶液一定是碱的溶液
C.酸性溶液的pH都小于7,所以酸溶液的pH一定小于7
D.氧化物中都含有氧元素,所以含氧元素的物质都是氧化物
17. 下列实验设计或操作正确,且能达到实验目的的是( )
序号 实验目的 实验方案
A 区分氢氧化钠溶液和氢氧化钙溶液 取样品,加入碳酸钠溶液
B 用pH试纸测定溶液的酸碱性 将pH试纸浸入待测液体
C 探究稀盐酸和氢氧化钠溶液是否完全反应 向反应后溶液中加入硝酸银溶液
D 区分盐酸和食盐 用酚酞
A.A B.B C.C D.D
18.下列图像与对应的叙述相符合的是( )
A.向盛有稀硫酸的烧杯中不断加水稀释
B.向一定量的和混合溶液中加入铁粉
C.向含有一定量的稀盐酸的烧杯中逐滴滴加碳酸钠溶液
D.向等质量的锌粉和铁粉中,分别加入相同质量分数的稀盐酸
19.某同学进行稀盐酸和氢氧化钠溶液反应的实验操作,记录并绘制了烧杯中溶液的pH随滴入液体体积的变化曲线。依据图中信息,下列说法正确的是( )
A.该实验是将氢氧化钠溶液滴入盛有稀盐酸的烧杯中
B.当滴入液体体积为5mL 时,所得溶液呈酸性
C.当滴入液体体积为7mL时,盐酸和氢氧化钠恰好完全反应
D.当滴入液体体积为9mL 时,溶液中的溶质为NaCl和NaOH
二、填空题
20.在学习酸碱的化学性质时常构建如图思维导图梳理知识,A、B、C、D是不同类别的化合物,“一”表示两种物质在一定条件下可以发生化学反应。请回答下列问题:
(1)的俗称是
(2)写出①或②的化学反应方程式 。(写一个方程式即可)
(3)物质C的化学式可以是 (选填)
三、实验探究题
21.小科取一包某食品包装袋内的“脱氧剂”,查阅资料发现其成分除铁粉外,可能含有碳粉、Na2CO3、NaCl、Fe2O3等。为确定其成分,进行了如下实验:
(1)操作①的名称是 ;
(2)写出用pH试纸测定滤液pH的方法: ;
(3)试剂X的名称是 ;
(4)根据实验,可推测“脱氧剂”中除铁粉外,一定含有的物质是 。
22.某兴趣小组对酸、碱、盐的性质进行探究(如图),请你参与。
(1)探究酸、碱、盐的部分性质
①实验甲中,观察到的现象为 。
②实验乙中,反应的化学方程式为 。
③实验丙中,将足量氢氧化钠溶液滴入锥形瓶后振荡,观察到的现象为 。
(2)探究废液成分
实验结束后,同学们将甲、乙、丙三个实验的废液和废渣倒入同一个干净的废液缸中,观察到固体消失,废液呈无色。
【资料卡片】氯化钙溶液呈中性。
【提出问题】无色废液中含有哪些溶质
【作出猜想】
猜想一:NaCl、CaCl2。
猜想二:NaCl、HCl。
猜想三:NaCl、HCl、CaCl2。
小组同学讨论后认为猜想二是不合理的,理由是 。
(3)【实验设计】小组同学对无色废液取样后,逐滴滴入碳酸钠溶液证明了猜想三是成立的。实验中应获取的证据为 ,发生的化学方程式为 。
(4)【反思总结】通过以上探究实验,可归纳出碱的化学性质有 °
四、解答题
23.在宏观、微观、符号之间建立联系,是化学学科特有的思维方式。
已知:氯化氢(HCl)是极易溶于水的无色气体,其水溶液俗称盐酸。
(1)在充满HCl气体的试管中放入用石蕊试液浸泡成紫色并晾干的纸条,无明显现象;再滴入水,现象是 。向盛有锌粉的试管中通入干燥的HCl气体,无明显现象;停止通气,再加入少量水,观察到有气泡产生,写出此时发生反应的化学方程式 。
(2)由(1)中现象可知,HCl气体和盐酸具有不同的化学性质。请根据图中HCl气体的微观示意图,完成右边盐酸的微观示意图,并进行必要的标注(水分子不用画出)。
24.某科学兴趣小组开展综合实践活动。参观电镀工厂并对镀铜液中的相关成分进行检测。
(1)若要通过置换反应在某铁块表面镀上一层铜,可以选择___________(填序号)。
A.Cu(NO3)2溶液 B.CuO C.Cu(OH)2
(2)镀铜的液体是以稀硫酸、硫酸铜为原料按一定比例配制而成。兴趣小组同学用如下方法测定二者的比例:取镀铜液于烧杯中,取300克的NaOH溶液,平均分三次滴入烧杯中,将每次所得沉淀过滤、洗涤、烘干、称量。三次实验数据见下表:
实验序号 NaOH溶液/g 沉淀质量/g
1 100 4.90
2 100 9.80
3 100 4.90
①第2次实验生成9.80克沉淀的过程中,有多少NaOH溶质参加反应?
②镀铜液中硫酸溶质的质量是___________。
答案解析部分
1.A,D
2.A
3.C
4.B
5.C
6.D
7.B
8.D
9.D
10.A
11.D
12.C
13.D
14.A
15.C
16.C
17.A
18.D
19.C
20.(1)熟石灰
(2)Fe + 2HCl = FeCl2+ H2↑
(3)K2CO3
21.(1)过滤
(2)用洁净的玻璃棒蘸取滤液,滴在pH试纸上,再与标准比色卡对比
(3)稀盐酸或稀硫酸或稀硝酸
(4)碳粉、Na2CO3、Fe2O3
22.(1)有气泡产生;Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;气球膨胀
(2)溶液中一定存在氯化钙
(3)先有气泡产生,后有白色沉淀生成;Na2CO3+2HCl=2NaCl+H2O+CO2↑、CaCl2+Na2CO3=CaCO3↓+2NaCl
(4)能与盐、非金属氧化物、酸反应
23.(1)石蕊试纸变红;Zn+2HCl=ZnCl2+H2↑
(2)如图(画多个离子也给分,但两种离子个数要相同)
24.(1)A
(2)①设参加反应的氢氧化钠质量为。
②设生成4.9g沉淀需要氢氧化钠的质量为
根据上一问可知氢氧化钠中与硫酸反应的质量为8g-4g=4g
设与4g氢氧化钠反应的硫酸中溶质质量为
答:①第2次实验生成9.80克沉淀的过程中,有8gNaOH溶质参加反应
②镀铜液中硫酸溶质的质量是4.9g。
一、单选题
1.除去下列物质中混有的少量杂质,下列方案不可行的是( )
物质 杂质 方案
A KCl 加水溶解、过滤、洗涤、蒸发
B CO气体 气体 通过足量的氢氧化钠溶液后干燥
C NaCl固体 固体 加入足量的稀盐酸后蒸发
D 固体 固体 加水溶解再通入足量二氧化碳后蒸发
A.A B.B C.C D.D
2.逆向推力是科学学习中的一种思维方法,下列的逆向推理正确的是( )
A.酸性溶液能使紫色石蕊试液变红,所以能使紫色石蕊试液变红的一定是酸性溶液
B.活泼金属与稀盐酸反应放出气体,所以能与稀盐酸反应放出气体的物质一定是活泼金属
C.从主动脉离开心脏的是动脉血,所以动脉血管中流动的一定是动脉血
D.使用杠杆可以省力,所以能省力的简单机械一定是杠杆
3.下列操作正确的是( )
A.氧气验满 B.过滤
C.稀释浓硫酸 D.测定溶液酸碱度
4.下列物质间的转化,只需通过一步反应就能实现的是( )
A.BaCO3→Ba(OH)2 B.Na2SO4→NaCl
C.Fe→Fe2(SO4)3 D.CuO→Cu(OH)2
5.如图所示,将滴管甲中的液体挤出,气球明显鼓起,一段时间后恢复原状,再将滴管乙中的液体挤出,气球又明显鼓起且不恢复原状。则滴管甲、乙和烧杯①②中的物质可能是( )
A.甲:水,①:食盐; 乙:水,②:蔗糖
B.甲:水,①硝酸铵; 乙:稀盐酸,②:铁
C.甲:水,①氢氧化钠; 乙:稀硫酸, ②:锌
D.甲:水,①生石灰; 乙:稀盐酸, ②:氢氧化钠
6.如图所示为小明设计并制作的一只喷气船,将船浮在室内游泳池的水面上,打开漏斗的活塞,流下的液体B与放置在塑料罐内的物质A反应产生大量气体,塑料罐内气压迅速增大,气体从罐底小孔喷出,使船前进。下列说法正确的( )
A.理论上要实现上述设计要求A、B两种物质的组合可以是铜和稀硫酸
B.塑料罐喷出气体时罐内气压等于外界大气压
C.喷出气体时,船排开水的体积不变
D.使船前进的动力来自气体
7.小柯将未经砂布打磨的铝条放入盛有稀盐酸的密闭容器中,用传感器测得容器内气压的变化,如图所示。下列分析中正确的是 ( )
A.0~50s,发生的化学反应是:
B.50s时,溶液中含两种溶质
C.50~100s之间压强变大的原因是反应放热
D.容器中化学反应的终点出现在100~150s之间某一时刻
8.分析推理是科学学习和研究中常用的思维方法。下列分析推理正确的是( )
A.中和反应有盐和水生成,因此有盐和水生成的反应一定是中和反应
B.碱溶液的pH都大于7,因此pH人于7的溶液一定是碱溶液
C.硫酸溶液与BaCl2溶液能反应产生白色风淀,因此能与BaCl2溶液反应产生白色沉淀的一定是硫酸溶液
D.酸滴入石浆试液后溶液变红色,因此盐酸滴入石蕊试液后溶液也变红色
9.归纳和演绎是重要的科学方法。下列归纳或演绎合理的是( )
A.金属Fe、Zn能与酸反应生成氢气,所以金属都能与酸反应生成氢气
B.硫酸、硝酸电离时都能产生,所以电离时只要能产生的化合物都是酸
C.氢氧化钠和氢氧化钙溶液都能使无色酚酞试液变红,所以能使无色酚酞试液变红的溶液都是碱溶液
D.有机物在空气中充分燃烧生成和,所以甲烷在空气中充分燃烧也能生成和
10.如图是稀硫酸与甲、乙、丙、丁、戊五种常见物质反应出现的现象。描述不正确的是( )
A.甲可能是无色酚酞试液
B.乙不一定是金属氧化物
C.稀硫酸与丙生成的白色沉淀属于盐类
D.稀硫酸与丁产生的无色气体可能是单质
11.从微观视角看物质的变化是化学特有的思维方式。如图描述了NaOH溶液与盐酸反应的微观实质,C处应填入的物质化学式( )
A.NaCl B.NaOH C.HCl D.H2O
12. 为研究碱的化学性质,小明进行了如下实验,实验中试管中溶液始终保持红色的是
A. B.
C. D.
13.不同品牌的洗手液pH一般不同,时四种洗手液的pH如图所示。下列说法错误的是( )
A.洗手液a用蒸馏水稀释后pH增大
B.洗手液b的酸性比a弱
C.洗手液c能使石蕊试液变蓝色
D.洗手液d和a混合液的pH一定等于7
14.往一定量的稀硫酸中加入过量的锌粒,如图是反应过程中某种量y随加入锌粒的质量变化的图像。由此可知,y不可能表示( )。
A.硫酸的质量分数 B.生成硫酸锌的质量
C.溶液的pH D.生成氢气的质量
15.等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,下列叙述正确的是( )
A.M、N两种金属中较活泼的是N B.生成H2的质量M<N
C.相对原子质量较大的是N D.产生H2的速率N>M
16.推理和归纳是科学学习和研究中常用的思维方法,下列推理正确的是( )
A.大多数物质燃烧需要氧气,所以氧气具有可燃性
B.碱溶液呈碱性,所以呈碱性的溶液一定是碱的溶液
C.酸性溶液的pH都小于7,所以酸溶液的pH一定小于7
D.氧化物中都含有氧元素,所以含氧元素的物质都是氧化物
17. 下列实验设计或操作正确,且能达到实验目的的是( )
序号 实验目的 实验方案
A 区分氢氧化钠溶液和氢氧化钙溶液 取样品,加入碳酸钠溶液
B 用pH试纸测定溶液的酸碱性 将pH试纸浸入待测液体
C 探究稀盐酸和氢氧化钠溶液是否完全反应 向反应后溶液中加入硝酸银溶液
D 区分盐酸和食盐 用酚酞
A.A B.B C.C D.D
18.下列图像与对应的叙述相符合的是( )
A.向盛有稀硫酸的烧杯中不断加水稀释
B.向一定量的和混合溶液中加入铁粉
C.向含有一定量的稀盐酸的烧杯中逐滴滴加碳酸钠溶液
D.向等质量的锌粉和铁粉中,分别加入相同质量分数的稀盐酸
19.某同学进行稀盐酸和氢氧化钠溶液反应的实验操作,记录并绘制了烧杯中溶液的pH随滴入液体体积的变化曲线。依据图中信息,下列说法正确的是( )
A.该实验是将氢氧化钠溶液滴入盛有稀盐酸的烧杯中
B.当滴入液体体积为5mL 时,所得溶液呈酸性
C.当滴入液体体积为7mL时,盐酸和氢氧化钠恰好完全反应
D.当滴入液体体积为9mL 时,溶液中的溶质为NaCl和NaOH
二、填空题
20.在学习酸碱的化学性质时常构建如图思维导图梳理知识,A、B、C、D是不同类别的化合物,“一”表示两种物质在一定条件下可以发生化学反应。请回答下列问题:
(1)的俗称是
(2)写出①或②的化学反应方程式 。(写一个方程式即可)
(3)物质C的化学式可以是 (选填)
三、实验探究题
21.小科取一包某食品包装袋内的“脱氧剂”,查阅资料发现其成分除铁粉外,可能含有碳粉、Na2CO3、NaCl、Fe2O3等。为确定其成分,进行了如下实验:
(1)操作①的名称是 ;
(2)写出用pH试纸测定滤液pH的方法: ;
(3)试剂X的名称是 ;
(4)根据实验,可推测“脱氧剂”中除铁粉外,一定含有的物质是 。
22.某兴趣小组对酸、碱、盐的性质进行探究(如图),请你参与。
(1)探究酸、碱、盐的部分性质
①实验甲中,观察到的现象为 。
②实验乙中,反应的化学方程式为 。
③实验丙中,将足量氢氧化钠溶液滴入锥形瓶后振荡,观察到的现象为 。
(2)探究废液成分
实验结束后,同学们将甲、乙、丙三个实验的废液和废渣倒入同一个干净的废液缸中,观察到固体消失,废液呈无色。
【资料卡片】氯化钙溶液呈中性。
【提出问题】无色废液中含有哪些溶质
【作出猜想】
猜想一:NaCl、CaCl2。
猜想二:NaCl、HCl。
猜想三:NaCl、HCl、CaCl2。
小组同学讨论后认为猜想二是不合理的,理由是 。
(3)【实验设计】小组同学对无色废液取样后,逐滴滴入碳酸钠溶液证明了猜想三是成立的。实验中应获取的证据为 ,发生的化学方程式为 。
(4)【反思总结】通过以上探究实验,可归纳出碱的化学性质有 °
四、解答题
23.在宏观、微观、符号之间建立联系,是化学学科特有的思维方式。
已知:氯化氢(HCl)是极易溶于水的无色气体,其水溶液俗称盐酸。
(1)在充满HCl气体的试管中放入用石蕊试液浸泡成紫色并晾干的纸条,无明显现象;再滴入水,现象是 。向盛有锌粉的试管中通入干燥的HCl气体,无明显现象;停止通气,再加入少量水,观察到有气泡产生,写出此时发生反应的化学方程式 。
(2)由(1)中现象可知,HCl气体和盐酸具有不同的化学性质。请根据图中HCl气体的微观示意图,完成右边盐酸的微观示意图,并进行必要的标注(水分子不用画出)。
24.某科学兴趣小组开展综合实践活动。参观电镀工厂并对镀铜液中的相关成分进行检测。
(1)若要通过置换反应在某铁块表面镀上一层铜,可以选择___________(填序号)。
A.Cu(NO3)2溶液 B.CuO C.Cu(OH)2
(2)镀铜的液体是以稀硫酸、硫酸铜为原料按一定比例配制而成。兴趣小组同学用如下方法测定二者的比例:取镀铜液于烧杯中,取300克的NaOH溶液,平均分三次滴入烧杯中,将每次所得沉淀过滤、洗涤、烘干、称量。三次实验数据见下表:
实验序号 NaOH溶液/g 沉淀质量/g
1 100 4.90
2 100 9.80
3 100 4.90
①第2次实验生成9.80克沉淀的过程中,有多少NaOH溶质参加反应?
②镀铜液中硫酸溶质的质量是___________。
答案解析部分
1.A,D
2.A
3.C
4.B
5.C
6.D
7.B
8.D
9.D
10.A
11.D
12.C
13.D
14.A
15.C
16.C
17.A
18.D
19.C
20.(1)熟石灰
(2)Fe + 2HCl = FeCl2+ H2↑
(3)K2CO3
21.(1)过滤
(2)用洁净的玻璃棒蘸取滤液,滴在pH试纸上,再与标准比色卡对比
(3)稀盐酸或稀硫酸或稀硝酸
(4)碳粉、Na2CO3、Fe2O3
22.(1)有气泡产生;Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;气球膨胀
(2)溶液中一定存在氯化钙
(3)先有气泡产生,后有白色沉淀生成;Na2CO3+2HCl=2NaCl+H2O+CO2↑、CaCl2+Na2CO3=CaCO3↓+2NaCl
(4)能与盐、非金属氧化物、酸反应
23.(1)石蕊试纸变红;Zn+2HCl=ZnCl2+H2↑
(2)如图(画多个离子也给分,但两种离子个数要相同)
24.(1)A
(2)①设参加反应的氢氧化钠质量为。
②设生成4.9g沉淀需要氢氧化钠的质量为
根据上一问可知氢氧化钠中与硫酸反应的质量为8g-4g=4g
设与4g氢氧化钠反应的硫酸中溶质质量为
答:①第2次实验生成9.80克沉淀的过程中,有8gNaOH溶质参加反应
②镀铜液中硫酸溶质的质量是4.9g。
