8.3碳酸氢钠和碳酸钠 第2课时 复分解反应的条件和实质课件(共25张PPT)
文档属性
| 名称 | 8.3碳酸氢钠和碳酸钠 第2课时 复分解反应的条件和实质课件(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-28 23:03:10 | ||
图片预览







文档简介
(共25张PPT)
第三节 碳酸氢钠和碳酸钠
—复分解反应的条件和实质
复分解反应的定义:
复分解反应表达式:
复分解书写方法:
前置诊断
由两种化合物互相交换成分,
生成另外两种化合物的反应。
AB + CD→ AD+ CB
双交换,价不变
学习目标
1.通过合作学习,知道酸碱盐之间发生的反应是复分解反应,能正确书写酸碱盐之间反应的化学方程式。
2.通过动画演示分析,理解说出复分解反应的实质,并能够总结分析能产生气体、沉淀和水的离子组。
目标达成的自我评价 评价
等级
达成全部目标并做对习题 (优) 达成部分目标做对部分习题 (良) 达成少部分目标 (中) 无法达成目标 (差)
任务一:构建酸碱盐之间反应的思维导图
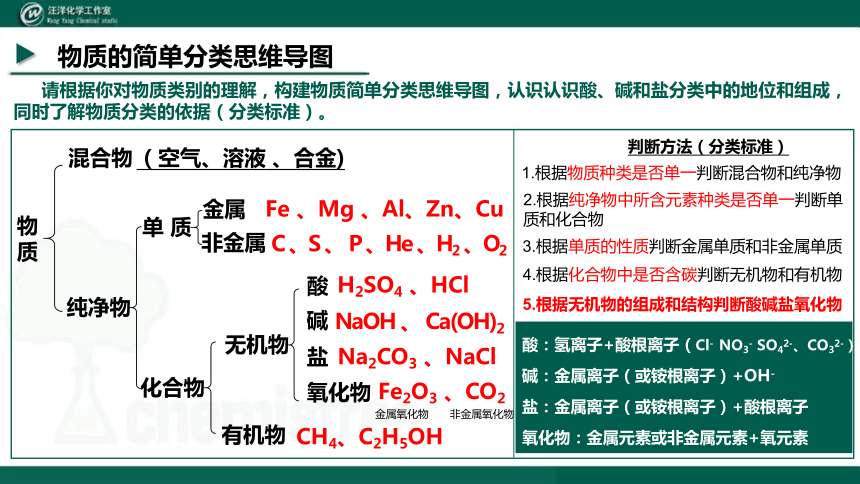
物质的简单分类思维导图
物质
请根据你对物质类别的理解,构建物质简单分类思维导图,认识认识酸、碱和盐分类中的地位和组成,同时了解物质分类的依据(分类标准)。
混合物
纯净物
(空气、溶液 、合金)
单 质
化合物
金属
非金属
Fe 、Mg 、Al、Zn、Cu
无机物
有机物
氧化物
酸
碱
盐
C 、S 、 P 、He 、H2 、O2
H2SO4 、HCl
CH4、C2H5OH
NaOH 、 Ca(OH)2
Na2CO3 、NaCl
Fe2O3 、CO2
金属氧化物 非金属氧化物
酸:氢离子+酸根离子(Cl- NO3- SO42-、CO32-)
碱:金属离子(或铵根离子)+OH-
盐:金属离子(或铵根离子)+酸根离子
氧化物:金属元素或非金属元素+氧元素
5.根据无机物的组成和结构判断酸碱盐氧化物
判断方法(分类标准)
1.根据物质种类是否单一判断混合物和纯净物
2.根据纯净物中所含元素种类是否单一判断单质和化合物
3.根据单质的性质判断金属单质和非金属单质
4.根据化合物中是否含碳判断无机物和有机物
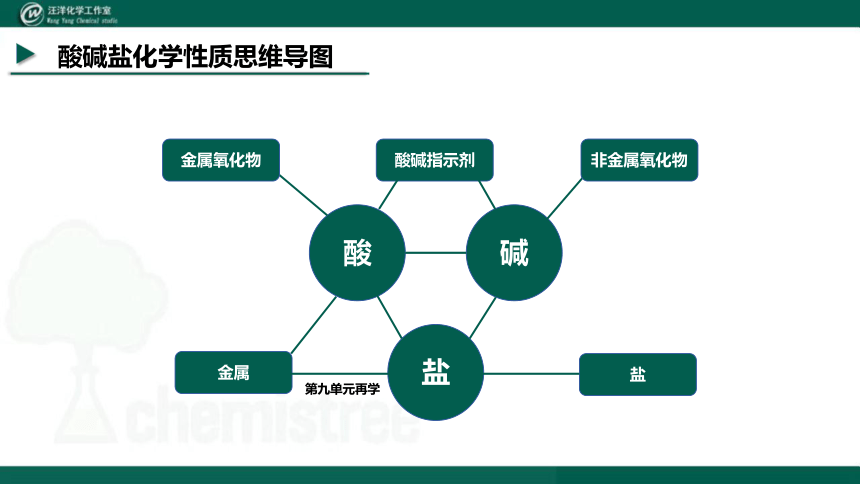
酸碱盐化学性质思维导图
酸
碱
盐
酸碱指示剂
金属
盐
金属氧化物
第九单元再学
非金属氧化物
初中化学复分解反应的范围
酸 + 金属氧化物 → 盐 + 水
酸 + 碱 → 盐 + 水
酸 + 盐 → 新酸 + 新盐
碱 + 盐 → 新碱 + 新盐
盐 + 盐 → 新盐 + 新盐
五个重
点反应
评价练习一 .
1.我校实验室的药品是按物质分类的方式存放,四个药品柜中已存入了下列药品,现学校实验室新购进一瓶石灰石,正确存放它的药品柜是( )
药品柜 甲柜 乙柜 丙柜 丁柜
药品 盐酸、硫酸 硫酸铜、硝酸锌 红磷、硫 氢氧化钠、氢氧化钙
A.甲柜 B.乙柜 C.丙柜 D.丁柜
B
2.下列几组物质按酸碱盐氧化物顺序排列的是( )
A.硝酸、火碱、生石灰、过氧化氢 B.醋酸、熟石灰、火碱、干冰
C.硫酸、火碱、碳酸钙、水 D.盐酸、氧化钙、氯化钠、氧化镁
C
石灰石主要成分为CaCO3,属于盐这类物质,乙柜是盐类物质
核
心
素
养
3. 下列四个反应,属于复分解反应类型的是( A )
A. CH4+2O2 CO2+2H2O
B. Fe+2AgNO3 2Ag+Fe (NO3)2
C. Ca(OH)2+CO2 CaCO3↓+H2O
D. Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
D
任务二:探索复分解反应的条件
正确书写下列酸碱盐之间化学反应
HCl + Fe2O3 =
H2SO4 + NaOH =
HCl + CaCO3 =
Ca(OH)2+ Na2CO3 =
CaCl2 + Na2CO3 =
Na2SO4 + KCl =
CuSO4 + Mg(OH)2 =
BaCl2 + CaCO3 =
K2SO4 + NaCl 无沉淀、水、气体生成
Mg(OH)2 → 这种物质是沉淀
CaCO3 →这种物质是沉淀
水
水
气体
沉淀
沉淀
复分解反应的条件
反应类型 反应物条件 生成物条件
1
2 3 4 5 碱 + 盐→新碱+新盐
盐 + 盐→新盐+新盐
酸 + 盐→新酸+新盐
酸 + 碱→盐+水
酸+金属氧化物→盐+水
须反应物
二者都可溶
有酸参加
反应物可不溶
有沉淀生成
或有气体放出
或有水生成
简单记忆方法 | 反应物 —— 有酸不看溶解性,盐盐、盐碱需可溶;
生成物 —— 必须有水、气体或沉淀生成。
评价练习二:判断下列复分解反应能否发生
KNO3 + NaCl —
Cu(OH)2 + H2SO4—
CaCO3 + HNO3—
Fe(OH)3+CuSO4—
Na2CO3+ BaSO4—
Ca(OH) 2+Na2CO3—
有水生成
√
×
√
×
×
√
有气体生成
有沉淀生成
碱不溶
盐不溶
无沉淀、气体和水生成
任务三:探索复分解反应的实质
看图探究
NaOH溶液和稀HNO3反应
Na+
OH-
H+
NO3-
H2O
结论:
有水生成的复分解反应实质是 H+和OH-反应
实质:
旁观者:
NO3-和Na+
看图探究
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
H2O
碳酸钠和稀盐酸反应
结论:
有co2生成的复分解反应实质是CO32-和H+反应
CO2
实质:
旁观者:
Cl-和Na+
CO2
看图探究
Ba2+
SO42-
Cl-
Cl-
Na+
Na+
BaSO4
氯化钡与硫酸钠反应
结论:
有BaSO4沉淀生成的复分解反应实质是
Ba2+和SO42-反应
实质:
旁观者:
Cl-和Na+
复分解反应发生的实质
酸碱盐中的两种物质在溶液中混合,反应物中的阴阳离子之间结合生成沉淀、气体和水的过程。
课本p131溶解性表
简要记忆口诀 .
钾、钠、铵、硝都易溶,
碱溶铵钾钠钡钙,
氯化物中银不溶,
硫酸盐中钡不溶,
碳酸盐只溶钾钠铵。
生成气体、沉淀 和水的离子组 (九白一蓝一红褐) 生成水 H+ + OH- = H2O 对应酸碱中和反应
生成气体
生成沉淀
2H++CO32- = H2O+ CO2↑
H++HCO3- = H2O + CO2↑
NH4+ + OH- = H2O + NH3↑
Ag+ +Cl- = AgCl↓ (白)
Ba2++SO42- = BaSO4 ↓ (白)
2Ag++CO32- = Ag2CO3↓ (白)
Ba2++CO32- = BaCO3 ↓ (白)
Ca2++CO32- = CaCO3 ↓ (白)
Mg2++2OH- = Mg(OH)2↓(白)
Al3+ +3OH- = Al(OH)3 ↓ (白)
Zn2+ +2OH- = Zn(OH)2↓ (白)
Fe2+ +2OH- = Fe(OH)2 ↓(白)
Cu2+ +2OH- = Cu(OH)2 ↓(蓝)Fe3+ +3OH- = Fe(OH)3 ↓(红褐)
鉴别碳酸盐的方法就是加入盐酸
不溶于水也不溶于酸
不溶于水但能溶于酸产生二氧化碳气体
不溶于水但能溶于酸不生成气体,生成水
1.下列物质能大量共存的是( )
A.HCl CuSO4 NaNO3 K2CO3 B.NaOH CaCl2 Mg(NO3)2 KOH
C.Ca(OH)2 KCl Na2CO3 Na2SO4 D.KNO3 NaCl NaOH BaCl2
评价练习三
D
3.能(一次操作就)区分氯化钠、盐酸、氢氧化钙三种溶液的一种试剂是( )
A.酚酞试液 B.K2CO3溶液 C.NaNO3溶液 D.K2SO4溶液
B
2.在PH=1的无色溶液中,能够大量共存的一组是( )
A. Cl-、 CO32- 、 Na+、 OH- B.NO3- 、 Cu2+、 Cl-、Fe3+ 、
C.NO3-、SO42-、 K+、Zn2+ D. SO42- 、 NH4+、 Ba2+、 Cl-
C
核心素养点:物质的共存
核心素养点:离子的共存
核心素养点:物质的鉴别
4.某同学发现,某化工厂甲、乙两个车间排出的废水中各含有K+、H+、Cu2+、OH-、NO3- 中的三种离子(两车间的废水中只含有一种相同的离子)。将甲、乙两车间的废水按适当的比例混合,沉淀后废水变为无色、澄清的中性溶液。下列分析不正确的是( )
C.Cu2+和H+来自不同车间
A.两车间的废水中均含有NO3-
D.沉淀废水得到的中性溶液中含有一种复合肥料(含有N P K元素中的两种或三种)
B.K+和OH-来自同一车间
C
核心素养点:离子共存及离子反应
5.选用何种试剂除去 NaNO3 溶液中混有的少量 Ba(NO3)2 杂质
分析:Ba(NO3)2和NaNO3 相比较真正的杂质是Ba2+,只需加入一种试剂既能除去Ba2+,又不带入新的杂质,它就是碳酸钠或者硫酸钠。
除杂原则 | 不增、 不减、 易分离
不增加
新杂质
不减少
有用物质
产生沉淀、气体
或水易分离出去
核心素养点:物质的除杂
重点提升.某化工厂排放的污水中,常溶有某些对人体有害的物质。通过目测,初步认为可能含有Fe3+、Ba2+、Na+、OH-、Cl-、CO32-、SO42-;为了进一步确认,进行实验检测:
(1)取污水仔细观察,呈无色、透明、均一状态。
(2)向取样的污水中,滴入稀硫酸,有大量白色沉淀产生,再加稀硝酸,白色沉淀不消失。
(3)用pH试纸测定污水的pH值,试纸显深蓝色。由此可知,该污水中,肯定含有离子是 ,肯定没有的离子是 ,可能含有的离子是 。
Ba2+、 OH-
Fe3+、 CO32-、SO42-
Na+、Cl-
×
×
×
√
√
核心素养点:推断题(离子的性质)
课程结束了,祝学习进步哦!
第三节 碳酸氢钠和碳酸钠
—复分解反应的条件和实质
复分解反应的定义:
复分解反应表达式:
复分解书写方法:
前置诊断
由两种化合物互相交换成分,
生成另外两种化合物的反应。
AB + CD→ AD+ CB
双交换,价不变
学习目标
1.通过合作学习,知道酸碱盐之间发生的反应是复分解反应,能正确书写酸碱盐之间反应的化学方程式。
2.通过动画演示分析,理解说出复分解反应的实质,并能够总结分析能产生气体、沉淀和水的离子组。
目标达成的自我评价 评价
等级
达成全部目标并做对习题 (优) 达成部分目标做对部分习题 (良) 达成少部分目标 (中) 无法达成目标 (差)
任务一:构建酸碱盐之间反应的思维导图
物质的简单分类思维导图
物质
请根据你对物质类别的理解,构建物质简单分类思维导图,认识认识酸、碱和盐分类中的地位和组成,同时了解物质分类的依据(分类标准)。
混合物
纯净物
(空气、溶液 、合金)
单 质
化合物
金属
非金属
Fe 、Mg 、Al、Zn、Cu
无机物
有机物
氧化物
酸
碱
盐
C 、S 、 P 、He 、H2 、O2
H2SO4 、HCl
CH4、C2H5OH
NaOH 、 Ca(OH)2
Na2CO3 、NaCl
Fe2O3 、CO2
金属氧化物 非金属氧化物
酸:氢离子+酸根离子(Cl- NO3- SO42-、CO32-)
碱:金属离子(或铵根离子)+OH-
盐:金属离子(或铵根离子)+酸根离子
氧化物:金属元素或非金属元素+氧元素
5.根据无机物的组成和结构判断酸碱盐氧化物
判断方法(分类标准)
1.根据物质种类是否单一判断混合物和纯净物
2.根据纯净物中所含元素种类是否单一判断单质和化合物
3.根据单质的性质判断金属单质和非金属单质
4.根据化合物中是否含碳判断无机物和有机物
酸碱盐化学性质思维导图
酸
碱
盐
酸碱指示剂
金属
盐
金属氧化物
第九单元再学
非金属氧化物
初中化学复分解反应的范围
酸 + 金属氧化物 → 盐 + 水
酸 + 碱 → 盐 + 水
酸 + 盐 → 新酸 + 新盐
碱 + 盐 → 新碱 + 新盐
盐 + 盐 → 新盐 + 新盐
五个重
点反应
评价练习一 .
1.我校实验室的药品是按物质分类的方式存放,四个药品柜中已存入了下列药品,现学校实验室新购进一瓶石灰石,正确存放它的药品柜是( )
药品柜 甲柜 乙柜 丙柜 丁柜
药品 盐酸、硫酸 硫酸铜、硝酸锌 红磷、硫 氢氧化钠、氢氧化钙
A.甲柜 B.乙柜 C.丙柜 D.丁柜
B
2.下列几组物质按酸碱盐氧化物顺序排列的是( )
A.硝酸、火碱、生石灰、过氧化氢 B.醋酸、熟石灰、火碱、干冰
C.硫酸、火碱、碳酸钙、水 D.盐酸、氧化钙、氯化钠、氧化镁
C
石灰石主要成分为CaCO3,属于盐这类物质,乙柜是盐类物质
核
心
素
养
3. 下列四个反应,属于复分解反应类型的是( A )
A. CH4+2O2 CO2+2H2O
B. Fe+2AgNO3 2Ag+Fe (NO3)2
C. Ca(OH)2+CO2 CaCO3↓+H2O
D. Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
D
任务二:探索复分解反应的条件
正确书写下列酸碱盐之间化学反应
HCl + Fe2O3 =
H2SO4 + NaOH =
HCl + CaCO3 =
Ca(OH)2+ Na2CO3 =
CaCl2 + Na2CO3 =
Na2SO4 + KCl =
CuSO4 + Mg(OH)2 =
BaCl2 + CaCO3 =
K2SO4 + NaCl 无沉淀、水、气体生成
Mg(OH)2 → 这种物质是沉淀
CaCO3 →这种物质是沉淀
水
水
气体
沉淀
沉淀
复分解反应的条件
反应类型 反应物条件 生成物条件
1
2 3 4 5 碱 + 盐→新碱+新盐
盐 + 盐→新盐+新盐
酸 + 盐→新酸+新盐
酸 + 碱→盐+水
酸+金属氧化物→盐+水
须反应物
二者都可溶
有酸参加
反应物可不溶
有沉淀生成
或有气体放出
或有水生成
简单记忆方法 | 反应物 —— 有酸不看溶解性,盐盐、盐碱需可溶;
生成物 —— 必须有水、气体或沉淀生成。
评价练习二:判断下列复分解反应能否发生
KNO3 + NaCl —
Cu(OH)2 + H2SO4—
CaCO3 + HNO3—
Fe(OH)3+CuSO4—
Na2CO3+ BaSO4—
Ca(OH) 2+Na2CO3—
有水生成
√
×
√
×
×
√
有气体生成
有沉淀生成
碱不溶
盐不溶
无沉淀、气体和水生成
任务三:探索复分解反应的实质
看图探究
NaOH溶液和稀HNO3反应
Na+
OH-
H+
NO3-
H2O
结论:
有水生成的复分解反应实质是 H+和OH-反应
实质:
旁观者:
NO3-和Na+
看图探究
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
H2O
碳酸钠和稀盐酸反应
结论:
有co2生成的复分解反应实质是CO32-和H+反应
CO2
实质:
旁观者:
Cl-和Na+
CO2
看图探究
Ba2+
SO42-
Cl-
Cl-
Na+
Na+
BaSO4
氯化钡与硫酸钠反应
结论:
有BaSO4沉淀生成的复分解反应实质是
Ba2+和SO42-反应
实质:
旁观者:
Cl-和Na+
复分解反应发生的实质
酸碱盐中的两种物质在溶液中混合,反应物中的阴阳离子之间结合生成沉淀、气体和水的过程。
课本p131溶解性表
简要记忆口诀 .
钾、钠、铵、硝都易溶,
碱溶铵钾钠钡钙,
氯化物中银不溶,
硫酸盐中钡不溶,
碳酸盐只溶钾钠铵。
生成气体、沉淀 和水的离子组 (九白一蓝一红褐) 生成水 H+ + OH- = H2O 对应酸碱中和反应
生成气体
生成沉淀
2H++CO32- = H2O+ CO2↑
H++HCO3- = H2O + CO2↑
NH4+ + OH- = H2O + NH3↑
Ag+ +Cl- = AgCl↓ (白)
Ba2++SO42- = BaSO4 ↓ (白)
2Ag++CO32- = Ag2CO3↓ (白)
Ba2++CO32- = BaCO3 ↓ (白)
Ca2++CO32- = CaCO3 ↓ (白)
Mg2++2OH- = Mg(OH)2↓(白)
Al3+ +3OH- = Al(OH)3 ↓ (白)
Zn2+ +2OH- = Zn(OH)2↓ (白)
Fe2+ +2OH- = Fe(OH)2 ↓(白)
Cu2+ +2OH- = Cu(OH)2 ↓(蓝)Fe3+ +3OH- = Fe(OH)3 ↓(红褐)
鉴别碳酸盐的方法就是加入盐酸
不溶于水也不溶于酸
不溶于水但能溶于酸产生二氧化碳气体
不溶于水但能溶于酸不生成气体,生成水
1.下列物质能大量共存的是( )
A.HCl CuSO4 NaNO3 K2CO3 B.NaOH CaCl2 Mg(NO3)2 KOH
C.Ca(OH)2 KCl Na2CO3 Na2SO4 D.KNO3 NaCl NaOH BaCl2
评价练习三
D
3.能(一次操作就)区分氯化钠、盐酸、氢氧化钙三种溶液的一种试剂是( )
A.酚酞试液 B.K2CO3溶液 C.NaNO3溶液 D.K2SO4溶液
B
2.在PH=1的无色溶液中,能够大量共存的一组是( )
A. Cl-、 CO32- 、 Na+、 OH- B.NO3- 、 Cu2+、 Cl-、Fe3+ 、
C.NO3-、SO42-、 K+、Zn2+ D. SO42- 、 NH4+、 Ba2+、 Cl-
C
核心素养点:物质的共存
核心素养点:离子的共存
核心素养点:物质的鉴别
4.某同学发现,某化工厂甲、乙两个车间排出的废水中各含有K+、H+、Cu2+、OH-、NO3- 中的三种离子(两车间的废水中只含有一种相同的离子)。将甲、乙两车间的废水按适当的比例混合,沉淀后废水变为无色、澄清的中性溶液。下列分析不正确的是( )
C.Cu2+和H+来自不同车间
A.两车间的废水中均含有NO3-
D.沉淀废水得到的中性溶液中含有一种复合肥料(含有N P K元素中的两种或三种)
B.K+和OH-来自同一车间
C
核心素养点:离子共存及离子反应
5.选用何种试剂除去 NaNO3 溶液中混有的少量 Ba(NO3)2 杂质
分析:Ba(NO3)2和NaNO3 相比较真正的杂质是Ba2+,只需加入一种试剂既能除去Ba2+,又不带入新的杂质,它就是碳酸钠或者硫酸钠。
除杂原则 | 不增、 不减、 易分离
不增加
新杂质
不减少
有用物质
产生沉淀、气体
或水易分离出去
核心素养点:物质的除杂
重点提升.某化工厂排放的污水中,常溶有某些对人体有害的物质。通过目测,初步认为可能含有Fe3+、Ba2+、Na+、OH-、Cl-、CO32-、SO42-;为了进一步确认,进行实验检测:
(1)取污水仔细观察,呈无色、透明、均一状态。
(2)向取样的污水中,滴入稀硫酸,有大量白色沉淀产生,再加稀硝酸,白色沉淀不消失。
(3)用pH试纸测定污水的pH值,试纸显深蓝色。由此可知,该污水中,肯定含有离子是 ,肯定没有的离子是 ,可能含有的离子是 。
Ba2+、 OH-
Fe3+、 CO32-、SO42-
Na+、Cl-
×
×
×
√
√
核心素养点:推断题(离子的性质)
课程结束了,祝学习进步哦!
同课章节目录
