第三章 第二节 3.2.2共价晶体 课件 (共29张PPT)
文档属性
| 名称 | 第三章 第二节 3.2.2共价晶体 课件 (共29张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 14.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-28 00:00:00 | ||
图片预览







文档简介
(共29张PPT)
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
第2课时 共价晶体
1.能辨识常见的共价晶体,并能从微观角度分析共价晶体中各构成微粒之间的作用对共价晶体物理性质的影响。
2.能利用共价晶体的通性推断常见的共价晶体,并能利用均摊法对晶胞进行分析。
学习目标
观看视频:金刚石
金刚石
单晶硅
SiO2
碳化硅
锗
锡
仔细观察下列固体,判断它们是否属于晶体,并说明理由,尝试从微粒组成上对这些固体进行分类。
一、分子晶体
1、概念:
2、粒子间作用力:原子
三态变化、化学反应都破坏它
三维的网状结构,不存在单个的小分子,是一个“巨分子”
一、共价晶体
相邻原子间以共价键相结合而形成空间网状结构的晶体叫做原子晶体。
3、相互作用:共价键
4、结构:空间网状
注意:
①共价晶体只含原子,原子种类可以不同
②只含原子的不一定是共价晶体
③共价晶体中没有分子间作用力
④有共价键的不一定是共价晶体
⑤整块晶体是一个三维的共价键网状结构,不存在单个的小分子,是一个“巨分子”。化学式表示原子个数比。
1、某些非金属单质:
硼(B)、硅(Si)、锗(Ge)、金刚石(C)等
2、某些非金属化合物:
SiC、BN、AlN、Si3N4等
3、某些氧化物:
SiO2、Al2O3等
二、常见的共价晶体
思考: 科学研究表明,30 亿年前,在地壳下 200 km 左右的地幔中,处在高温、高压岩浆中的碳元素逐渐形成了具有正四面体结构的金刚石。火山爆发时,金刚石夹在岩浆中上升到接近地表时冷却,形成含有少量金刚石的原生矿床。金刚石具有诸多不同凡响的优良性质∶ 熔点高,不导电,硬度极高。这些性质显然是由金刚石的结构决定的。那么,金刚石具有怎样的结构呢
金刚石磨头
金刚石钻石
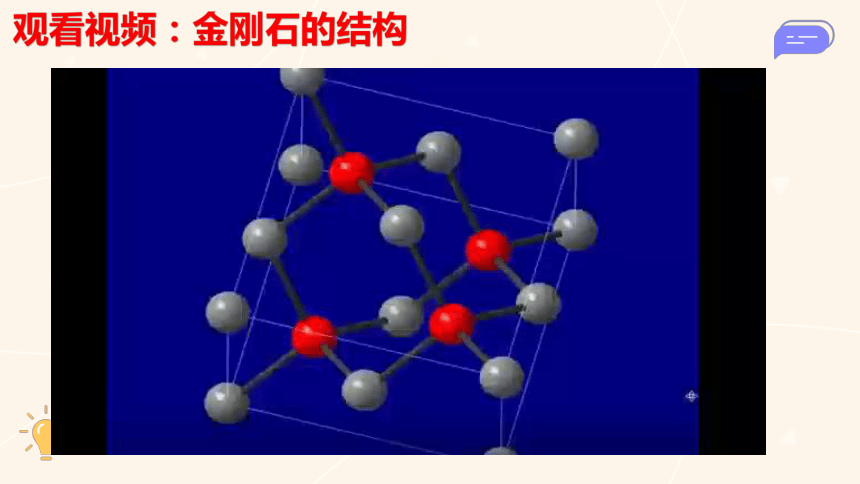
观看视频:金刚石的结构
1.金刚石的三维骨架结构
三、两种典型共价晶体的结构与组成特点
①在金刚石晶胞中含有 个C,每个碳与 个相邻碳以__________ 结合,形成___________结构。
②键角为_______,碳原子采取了______杂
③最小碳环由 个C组成且不在同一平面内, 每个C被 个最小环共用
④1mol金刚石中含有的C-C共价键数____mol
⑤晶体中每个C参与了4条C—C键的形成,而在每条键中的贡献只有一半,故C原子与C—C键数之比为 ____。
8
4
共价键
正四面体
109°28′
sp3
6
12
2
1:2
【思考】根据金刚石的结构,试分析金刚石熔点高、硬度大的原因?
C—C键 键长(pm) 键能 (kJ/mol) 熔点(℃) 硬度
154 347.7 >3500 天然最大
金刚石晶体中C-C键键长短,键能大,并且共价键的数目非常多,断键需要大量能量,因此金刚石的熔点很高,硬度很大。
SiO2是自然界含量最高的二元氧化物,熔点1713 ℃,有多种结构 ,最常见的是低温石英。遍布河岸的黄沙、带状的石英矿脉、花岗石里的白色晶体以及透明的水晶都低温石英。
黄沙
花岗岩
石英矿
水晶
SiO2在自然界分布:
低温石英的结构
其结构中有顶角相连的硅氧四面体形成螺旋上升的长链,而没有封闭的环状结构。这一结构决定了它具有手性,被广泛用作压电材料,如石英手表。
石英晶体中硅氧四面体相连构成的螺旋链
石英的左、右型晶体
SiO2用途:制造水泥、玻璃、人造红宝石、单晶硅、硅光电池、芯片和光导纤维的原料
2.二氧化硅晶体
把金刚石晶体中的碳原子换为硅原子,每两个硅原子之间增加一个氧原子,即形成SiO2的晶体结构。
①硅原子采取 杂化,正四面体内O—Si—O键角为 。
②每个硅原子与 个氧原子形成 个共价键, 原子位于正四面体
的中心, 原子位于正四面体的顶角,同时每个氧原子被 个硅氧
正四面体共用;每个氧原子与 个硅原子形成 个共价键,晶体中
硅原子和氧原子的个数比为 。
③最小环上有 个原子,包括 个氧原子和 个硅原子。
④共价键:1mol二氧化硅中含有____mol Si-O键。
⑤一个二氧化硅晶胞含有____个硅原子,____个氧原子。
sp3
109°28′
4
4
硅
氧
2
2
2
1:2
12
6
6
8
16
4
晶体SiO2的多种重要用途
SiO2具有很多重要用途,是制造水泥、玻璃、单晶硅、硅光电池、芯片和光导纤维的原料。
【课堂练习1】金刚石是典型的共价晶体,下列关于金刚石的说法错误的是( )
A.晶体中碳原子均采取sp3杂化
B.碳原子间以共价键相结合
C.金刚石是自然界中天然存在的硬度最大的物质
D.化学性质稳定,即使在高温下也不会与氧气发生反应
D
【课堂练习2】金刚石具有硬度大、熔点高等特点,大量用于制造钻头、金属切割刀具等。下列判断正确的是( )
A.金刚石中C—C的键角均为109°28′,所以金刚石和CH4的晶体类型相同
B.金刚石的熔点高与C—C的键能无关
C.金刚石中碳原子个数与C—C数目之比为1∶2
D.金刚石的熔点高,所以在打孔过程中不需要进行浇水冷却
C
【课堂练习3】下列关于SiO2晶体的叙述正确的是( )
A.在SiO2晶体中,Si—O—Si键角小于180°
B.60 g SiO2晶体含有2NA个Si—O
C.SiO2晶体中与同一硅原子相连的4个氧原子处于同一四面体的4个顶角
D.在SiO2晶体中,1个硅原子和2个氧原子形成2个共价键
C
某些共价晶体的熔点和硬度
观察比较下表中共价晶体熔点和硬度数据,它们有什么特点?
熔点很高;硬度很大
为什么共价晶体熔点很高?
熔化破坏共价键,需要很高的能量。
结构相似的共价晶体,原子半径越小,键长越短,键能越大,晶体的熔点越高。
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ >3 500 3 000 2 700 1 710 1 410 1 211
硬度* 10 9.5 9.5 7 6.5 6.0
四、共价晶体的物理性质
①熔点很高;
②硬度很大;
③一般不导电(晶体硅半导体);
④难溶于一般溶剂
(2)熔点和硬度的比较规律
(1)一般规律
结构相似的共价晶体,原子半径越小,键长越短,键能越大,晶体的熔点越高,硬度越大。
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ >3 500 3 000 2 700 1 710 1 410 1 211
硬度* 10 9.5 9.5 7 6.5 6.0
某些共价晶体的熔点和硬度
下表为部分共价晶体的物理性质,结合前面学过的分子晶体的一些性质思考问题。
问题1:与分子晶体相比,共价晶体的熔点普遍较高,为什么
分子晶体中分子间是以较弱的分子间作用力(部分含氢键)相互作用的,而共价晶体中原子间是通过较强的共价键相互作用的,并且形成空间网状结构,所以熔点普遍较高。
问题2:由表中数据可知,金刚石、硅和锗的熔点和硬度均依次降低,如何解释
三者的组成元素为同一主族元素,形成的晶体结构类似,结构相似的共价晶体,原子半径越小,键长越短,键能越大,晶体的熔点越高,硬度越大。
问题3:从哪些角度可以区分共价晶体与分子晶体
可以从构成微粒、微粒间作用力强弱、熔沸点、硬度等角度区分。
晶体类型 共价晶体 分子晶体
组成微粒
作用力
熔沸点
硬度
溶解性
导电性
原子
分子
共价键
分子间作用力
很大
较小
很大
较小
不溶于任何溶剂
部分溶于水
不导电,个别为半导体
固体和熔融状态都不导电,部分溶于水导电
归纳总结:分子晶体和共价晶体的比较
归纳总结:判断共价晶体和分子晶体类型的方法
(1)依据构成晶体的微粒和微粒间的作用力判断
构成共价晶体的微粒是原子,微粒间的作用力是共价键;构成分子晶体的微粒是分子或原子(稀有气体),微粒间的作用力是分子间作用力。
(2)依据晶体的熔点判断
共价晶体的熔点高,常在1 000 ℃以上;而分子晶体熔点低,常在数百摄氏度以下甚至更低。
(3)依据晶体的硬度与机械性能判断
共价晶体硬度大,分子晶体硬度小且较脆。
(4)依据导电性判断
分子晶体为非导体,但部分溶于水后能导电;原子晶体多数为非导体,但晶体硅、锗是半导体。
锗Ge硅Si
主要应用:低压、低频、中功率晶体管、光电探测器,取代了笨重的电子管,导致了集成电路的可能性
砷化镓GaAs 磷化铟InP
主要应用:毫米波器件、发光器件、卫星通讯、移动通讯、光通讯、GPS导航等,较好的电子迁移率、带隙等材料特性,资源稀缺,有毒性,污染环境
碳化硅Sic、氮化铝AlN、氮化镓GaN、氧化锌ZnO、金刚石C
主要应用:高温、高频、抗辐射、大功率器件;蓝、绿、紫光二极管、半导体激光器,更优的电子迁移率、带隙、击穿电压 、高频、高温特性
第一代
半导体
第二代
半导体
第三代
半导体
第三代半导体:中国半导体的希望!
拓展延伸
【课堂练习4】下列各组晶体物质中,化学键类型相同,晶体类型也相同的是( )
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石⑤晶体氖和晶体氮 ⑥硫黄和碘
A.①②③ B.④⑤⑥
C.③④⑥ D.①③⑤
C
【课堂练习5】下列有关物质的熔点高低顺序正确的是( )
A.HFB.金刚石<碳化硅<晶体硅
C.I2>SiO2
D.H2O>H2S,SO2【课堂练习6】根据下列性质判断,属于共价晶体的物质是( )
A.熔点为2700 ℃,导电性好,延展性强
B.无色晶体,熔点为3550 ℃,不导电,质硬,难溶于水和有机溶剂
C.无色晶体,能溶于水,质硬而脆,熔点为800 ℃,熔化时能导电
D.熔点为-56.6 ℃,微溶于水,硬度小,固态和液态时均不导电
D
B
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
第2课时 共价晶体
1.能辨识常见的共价晶体,并能从微观角度分析共价晶体中各构成微粒之间的作用对共价晶体物理性质的影响。
2.能利用共价晶体的通性推断常见的共价晶体,并能利用均摊法对晶胞进行分析。
学习目标
观看视频:金刚石
金刚石
单晶硅
SiO2
碳化硅
锗
锡
仔细观察下列固体,判断它们是否属于晶体,并说明理由,尝试从微粒组成上对这些固体进行分类。
一、分子晶体
1、概念:
2、粒子间作用力:原子
三态变化、化学反应都破坏它
三维的网状结构,不存在单个的小分子,是一个“巨分子”
一、共价晶体
相邻原子间以共价键相结合而形成空间网状结构的晶体叫做原子晶体。
3、相互作用:共价键
4、结构:空间网状
注意:
①共价晶体只含原子,原子种类可以不同
②只含原子的不一定是共价晶体
③共价晶体中没有分子间作用力
④有共价键的不一定是共价晶体
⑤整块晶体是一个三维的共价键网状结构,不存在单个的小分子,是一个“巨分子”。化学式表示原子个数比。
1、某些非金属单质:
硼(B)、硅(Si)、锗(Ge)、金刚石(C)等
2、某些非金属化合物:
SiC、BN、AlN、Si3N4等
3、某些氧化物:
SiO2、Al2O3等
二、常见的共价晶体
思考: 科学研究表明,30 亿年前,在地壳下 200 km 左右的地幔中,处在高温、高压岩浆中的碳元素逐渐形成了具有正四面体结构的金刚石。火山爆发时,金刚石夹在岩浆中上升到接近地表时冷却,形成含有少量金刚石的原生矿床。金刚石具有诸多不同凡响的优良性质∶ 熔点高,不导电,硬度极高。这些性质显然是由金刚石的结构决定的。那么,金刚石具有怎样的结构呢
金刚石磨头
金刚石钻石
观看视频:金刚石的结构
1.金刚石的三维骨架结构
三、两种典型共价晶体的结构与组成特点
①在金刚石晶胞中含有 个C,每个碳与 个相邻碳以__________ 结合,形成___________结构。
②键角为_______,碳原子采取了______杂
③最小碳环由 个C组成且不在同一平面内, 每个C被 个最小环共用
④1mol金刚石中含有的C-C共价键数____mol
⑤晶体中每个C参与了4条C—C键的形成,而在每条键中的贡献只有一半,故C原子与C—C键数之比为 ____。
8
4
共价键
正四面体
109°28′
sp3
6
12
2
1:2
【思考】根据金刚石的结构,试分析金刚石熔点高、硬度大的原因?
C—C键 键长(pm) 键能 (kJ/mol) 熔点(℃) 硬度
154 347.7 >3500 天然最大
金刚石晶体中C-C键键长短,键能大,并且共价键的数目非常多,断键需要大量能量,因此金刚石的熔点很高,硬度很大。
SiO2是自然界含量最高的二元氧化物,熔点1713 ℃,有多种结构 ,最常见的是低温石英。遍布河岸的黄沙、带状的石英矿脉、花岗石里的白色晶体以及透明的水晶都低温石英。
黄沙
花岗岩
石英矿
水晶
SiO2在自然界分布:
低温石英的结构
其结构中有顶角相连的硅氧四面体形成螺旋上升的长链,而没有封闭的环状结构。这一结构决定了它具有手性,被广泛用作压电材料,如石英手表。
石英晶体中硅氧四面体相连构成的螺旋链
石英的左、右型晶体
SiO2用途:制造水泥、玻璃、人造红宝石、单晶硅、硅光电池、芯片和光导纤维的原料
2.二氧化硅晶体
把金刚石晶体中的碳原子换为硅原子,每两个硅原子之间增加一个氧原子,即形成SiO2的晶体结构。
①硅原子采取 杂化,正四面体内O—Si—O键角为 。
②每个硅原子与 个氧原子形成 个共价键, 原子位于正四面体
的中心, 原子位于正四面体的顶角,同时每个氧原子被 个硅氧
正四面体共用;每个氧原子与 个硅原子形成 个共价键,晶体中
硅原子和氧原子的个数比为 。
③最小环上有 个原子,包括 个氧原子和 个硅原子。
④共价键:1mol二氧化硅中含有____mol Si-O键。
⑤一个二氧化硅晶胞含有____个硅原子,____个氧原子。
sp3
109°28′
4
4
硅
氧
2
2
2
1:2
12
6
6
8
16
4
晶体SiO2的多种重要用途
SiO2具有很多重要用途,是制造水泥、玻璃、单晶硅、硅光电池、芯片和光导纤维的原料。
【课堂练习1】金刚石是典型的共价晶体,下列关于金刚石的说法错误的是( )
A.晶体中碳原子均采取sp3杂化
B.碳原子间以共价键相结合
C.金刚石是自然界中天然存在的硬度最大的物质
D.化学性质稳定,即使在高温下也不会与氧气发生反应
D
【课堂练习2】金刚石具有硬度大、熔点高等特点,大量用于制造钻头、金属切割刀具等。下列判断正确的是( )
A.金刚石中C—C的键角均为109°28′,所以金刚石和CH4的晶体类型相同
B.金刚石的熔点高与C—C的键能无关
C.金刚石中碳原子个数与C—C数目之比为1∶2
D.金刚石的熔点高,所以在打孔过程中不需要进行浇水冷却
C
【课堂练习3】下列关于SiO2晶体的叙述正确的是( )
A.在SiO2晶体中,Si—O—Si键角小于180°
B.60 g SiO2晶体含有2NA个Si—O
C.SiO2晶体中与同一硅原子相连的4个氧原子处于同一四面体的4个顶角
D.在SiO2晶体中,1个硅原子和2个氧原子形成2个共价键
C
某些共价晶体的熔点和硬度
观察比较下表中共价晶体熔点和硬度数据,它们有什么特点?
熔点很高;硬度很大
为什么共价晶体熔点很高?
熔化破坏共价键,需要很高的能量。
结构相似的共价晶体,原子半径越小,键长越短,键能越大,晶体的熔点越高。
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ >3 500 3 000 2 700 1 710 1 410 1 211
硬度* 10 9.5 9.5 7 6.5 6.0
四、共价晶体的物理性质
①熔点很高;
②硬度很大;
③一般不导电(晶体硅半导体);
④难溶于一般溶剂
(2)熔点和硬度的比较规律
(1)一般规律
结构相似的共价晶体,原子半径越小,键长越短,键能越大,晶体的熔点越高,硬度越大。
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ >3 500 3 000 2 700 1 710 1 410 1 211
硬度* 10 9.5 9.5 7 6.5 6.0
某些共价晶体的熔点和硬度
下表为部分共价晶体的物理性质,结合前面学过的分子晶体的一些性质思考问题。
问题1:与分子晶体相比,共价晶体的熔点普遍较高,为什么
分子晶体中分子间是以较弱的分子间作用力(部分含氢键)相互作用的,而共价晶体中原子间是通过较强的共价键相互作用的,并且形成空间网状结构,所以熔点普遍较高。
问题2:由表中数据可知,金刚石、硅和锗的熔点和硬度均依次降低,如何解释
三者的组成元素为同一主族元素,形成的晶体结构类似,结构相似的共价晶体,原子半径越小,键长越短,键能越大,晶体的熔点越高,硬度越大。
问题3:从哪些角度可以区分共价晶体与分子晶体
可以从构成微粒、微粒间作用力强弱、熔沸点、硬度等角度区分。
晶体类型 共价晶体 分子晶体
组成微粒
作用力
熔沸点
硬度
溶解性
导电性
原子
分子
共价键
分子间作用力
很大
较小
很大
较小
不溶于任何溶剂
部分溶于水
不导电,个别为半导体
固体和熔融状态都不导电,部分溶于水导电
归纳总结:分子晶体和共价晶体的比较
归纳总结:判断共价晶体和分子晶体类型的方法
(1)依据构成晶体的微粒和微粒间的作用力判断
构成共价晶体的微粒是原子,微粒间的作用力是共价键;构成分子晶体的微粒是分子或原子(稀有气体),微粒间的作用力是分子间作用力。
(2)依据晶体的熔点判断
共价晶体的熔点高,常在1 000 ℃以上;而分子晶体熔点低,常在数百摄氏度以下甚至更低。
(3)依据晶体的硬度与机械性能判断
共价晶体硬度大,分子晶体硬度小且较脆。
(4)依据导电性判断
分子晶体为非导体,但部分溶于水后能导电;原子晶体多数为非导体,但晶体硅、锗是半导体。
锗Ge硅Si
主要应用:低压、低频、中功率晶体管、光电探测器,取代了笨重的电子管,导致了集成电路的可能性
砷化镓GaAs 磷化铟InP
主要应用:毫米波器件、发光器件、卫星通讯、移动通讯、光通讯、GPS导航等,较好的电子迁移率、带隙等材料特性,资源稀缺,有毒性,污染环境
碳化硅Sic、氮化铝AlN、氮化镓GaN、氧化锌ZnO、金刚石C
主要应用:高温、高频、抗辐射、大功率器件;蓝、绿、紫光二极管、半导体激光器,更优的电子迁移率、带隙、击穿电压 、高频、高温特性
第一代
半导体
第二代
半导体
第三代
半导体
第三代半导体:中国半导体的希望!
拓展延伸
【课堂练习4】下列各组晶体物质中,化学键类型相同,晶体类型也相同的是( )
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石⑤晶体氖和晶体氮 ⑥硫黄和碘
A.①②③ B.④⑤⑥
C.③④⑥ D.①③⑤
C
【课堂练习5】下列有关物质的熔点高低顺序正确的是( )
A.HF
C.I2>SiO2
D.H2O>H2S,SO2
A.熔点为2700 ℃,导电性好,延展性强
B.无色晶体,熔点为3550 ℃,不导电,质硬,难溶于水和有机溶剂
C.无色晶体,能溶于水,质硬而脆,熔点为800 ℃,熔化时能导电
D.熔点为-56.6 ℃,微溶于水,硬度小,固态和液态时均不导电
D
B
