1.2 课时1 有机化合物的分离、提纯 (共34张PPT)2024-2025学年人教版高中化学选择性必修3
文档属性
| 名称 | 1.2 课时1 有机化合物的分离、提纯 (共34张PPT)2024-2025学年人教版高中化学选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-02 18:50:25 | ||
图片预览










文档简介
(共34张PPT)
有机化合物的分离、提纯
第二节 研究有机化合物的一般方法
研究物质的性质是研究纯净物的性质
思考:
分离、提纯
粗品
纯品
→如果要以这瓶白酒为样品,研究乙醇的分子结构,你会先怎么研究?
度数: 白酒中含乙醇的“体积”百分比
52°:表示在100ml的酒中,含有乙醇52 ml(20 ℃)
一瓶从酒厂里生产出来的白酒,度数为 52°你知道度数的意思吗?
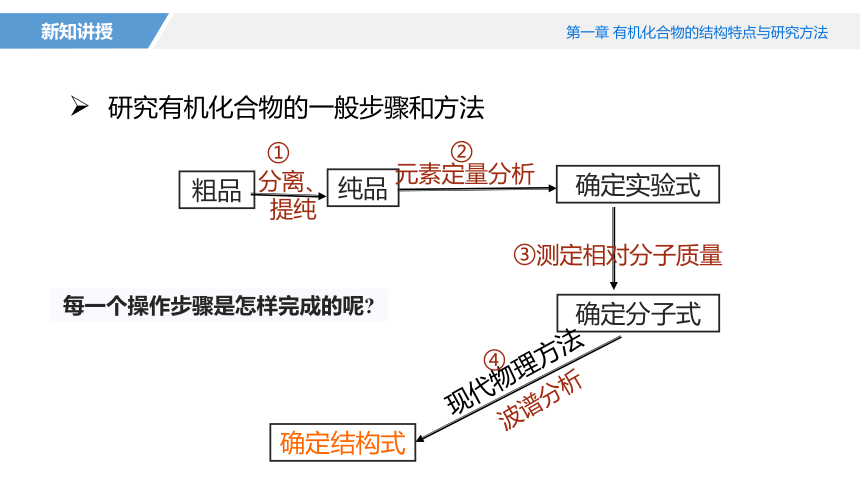
研究有机化合物的一般步骤和方法
粗品
纯品
确定实验式
确定分子式
确定结构式
分离、提纯
元素定量分析
测定相对分子质量
波谱分析
现代物理方法
①
②
③
④
每一个操作步骤是怎样完成的呢
一、有机化合物的分离、提纯
进行有机物组成、结构、性质和应用的研究
从天然资源中提取
工厂生产和实验室合成的
有机化合物粗品
纯净的有机化合物
分离、提纯
利用有机化合物与杂质物理性质的差异
物理方法:
化学方法:
一般加入或通过某种试剂进行化学反应。
利用有机物与杂质物理性质差异而将它们分开
密度、溶解度、溶解性、熔沸点等等
一般地,效果相同的情况下可用物理方法的,不用化学方法,可用低反应条件的不用高反应条件
化学上,有机物的分离常用的方法有:
蒸馏(分馏)法、萃取分液法、结晶(重结晶)法、洗气法、加热法、渗析法、盐析法等。
1.蒸馏
(1)适用范围:
蒸馏是分离、提纯液态有机化合物的常用方法。
③有机物与杂质的沸点相差较大(一般约大于30 ℃)
(2)适用条件:
①液体有机物中含有少量杂质
②有机物热稳定性较强
举例:
CH2Cl2(沸点40℃)
CHCl3(沸点62℃)
CCl4(沸点77℃)
液态混合物
用蒸馏法分离提纯
牛角管
气化
冷凝
接收
测量蒸汽的温度,温度计水银球的位置在蒸馏烧瓶支管口处
冷凝管中水的流向:
下口流入,上口流出
蒸馏烧瓶中液体量不得超过容积的2/3
投放沸石或碎瓷片防暴沸
烧瓶底垫陶土网
蒸馏烧瓶
用于冷凝回流液体。
用于冷凝回流液体。
多用于蒸馏操作。
直形冷凝管
球形冷凝管
蛇形冷凝管
三口烧瓶
注意区别
冷凝回流
恒压滴液漏斗
问题1:
77—79℃
提纯乙醇我们收集哪个温度的馏分?
(蒸馏所得的产品叫馏分。)
实验:含有杂质的工业乙醇的蒸馏
已知:工业酒精含水、甲醇和乙醇,根据各物质的性质(如表)
物质 沸点/ ℃
甲醇 64.7
乙醇 78.5
水 100
工业酒精
蒸馏
95.6%乙醇
无水乙醇
CaO
蒸馏
固液混合物分离为什么用蒸馏而不用过滤?
原因:①CaO与水反应生成的Ca(OH)2是糊状物,过滤时会堵塞滤纸孔;
②少量Ca2+、OH— 等离子会透过滤纸使乙醇不纯
能否通过直接蒸馏工业乙醇获得无水乙醇?
问题2:
不能。
2.萃取
液-液萃取
固-液萃取
利用待分离组分在两种互不相溶的溶剂中的溶解性不同,将其从一种溶剂转移到另一种溶剂的过程
利用溶剂从固体物质中溶解出待分离组分的过程
主要仪器:分液漏斗、烧杯
液-液萃取
可使用有机溶剂从水中萃取有机化合物。
萃取用的溶剂
(1)萃取剂
选择条件:
①萃取剂与原溶剂互不相溶、不发生化学反应
②溶质在两溶剂中的溶解度有较大差别(在萃取剂中的溶解度大)
③溶质不与萃取剂发生任何反应
常用萃取剂:
乙醚、乙酸乙酯、二氯甲烷等
乙醇
(×)
萃取碘水中的碘
(2)分液
液-液萃取
可使用有机溶剂从水中萃取有机化合物。
将萃取后两种互不相溶的液体分开的操作
主要实验仪器:
分液漏斗
烧杯
铁架台
分液漏斗
恒压滴液漏斗
操作过程:
静置→
分液
检漏→
装液→
①打开玻璃塞或使塞上的凹槽或小孔对准漏斗口上的小孔。
②下层液体从下口放出,上层液体从上口倒出。
注意事项:
①使用前先检查分液漏斗是否漏液
②分液漏斗内液体的总体积不超过容积的2/3。
③振荡时双手托住分液漏斗,右手按住玻璃塞,平放,用力振荡(振荡后注意放气)
④分液时,下层液体从下口放出,上层液体从上口倒出。
⑤分液漏斗下端尖嘴部分紧靠烧杯内壁。
记住常见溶液颜色
Br2水
I2水
( 色)
橙黄
( 色)
棕黄
Br2 /有机溶剂
色
橙红
色
紫红
I2 /有机溶剂
苯、CCl4萃取
苯、CCl4萃取
【思考交流】萃取与分液有什么区别
分液和萃取是两个不同的操作方法
→分液:是将两种互不相溶的液体混合物进行分离的操作。
分液可以单独进行,但萃取之后一般要进行分液
→萃取:是利用溶解性不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来的方法。
例如:苯[水] →分液
3.重结晶
利用被提纯物质与杂质在同一溶剂中的溶解度不同而将杂质除去。
(1)适用范围:
提纯固体有机化合物的常用方法
(2)提纯原理:
(3)溶剂要求:
②被提纯的有机化合物在此溶剂中的溶解度受温度影响较大,能够冷却结晶
重结晶要选择适当的溶剂
①杂质在此溶剂中溶解度很小或者很大,易于除去。
(4)常用方法:
蒸发结晶(如从NaCl溶液中获得NaCl晶体)
冷却结晶(如从CuSO4溶液中获得CuSO4 5H2O晶体)
溶解度很大,让它留在滤液里
溶解度很小,让它留在滤渣里
【探究实验】重结晶法提纯苯甲酸
【问题】某粗苯甲酸样品中含有少量氯化钠和泥沙,提纯苯甲酸需要经过哪些步骤?
温度/℃ 25 50 75
溶解度/g 0.34 0.85 2.2
【资料】苯甲酸可用作食品防腐剂。纯净的苯甲酸为无色结晶,
其结构可表示为
熔点122℃,沸点249℃。苯甲酸微溶于水,易溶于乙醇等有机溶剂。
苯甲酸在水中的溶解度如下
【探究实验】重结晶法提纯苯甲酸
(1)观察粗苯甲酸样品的状态。
(2)将1g粗苯甲酸放入100mL烧杯,加入50mL蒸馏水。加热,搅拌,使粗苯甲酸充分溶解。
(3)使用漏斗趁热将溶液过滤至另一烧杯中,将滤液静置,使其缓慢冷却结晶。
(4)待滤液完全冷却后滤出晶体,并用少量蒸馏水洗涤。将晶体铺在干燥的滤纸上,晾干后称其质量。
白色固体混有黑色或灰色固体
加热溶解
边加热边搅拌,
至固体溶解
冷却结晶
(缓慢冷却结晶,晶形好)
趁热过滤
一贴,二低,三靠;
避免烫伤
过滤、洗涤晶体
白色片状晶体
为什么要趁热过滤?
尽量减少苯甲酸损失
是不是温度越低越好
温度过低,杂质溶解度降低易析出,达不到提纯目的
化学实验中,如何洗涤晶体?如何检验晶体是否洗净?
【提示】加热:使苯甲酸溶解。
趁热过滤的目的:除去泥沙,并防止苯甲酸晶体低温析出。
(1)重结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?
【提示】泥沙难溶于水,氯化钠易溶于水,苯甲酸的溶解度受温度影响比较大。
【步骤】加少量热水溶解,趁热过滤,除去泥沙,冷却结晶,过滤。
(2)溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
【提示】取少量晶体溶于水,加入硝酸酸化的硝酸银溶液,若无白色沉淀生成,证明NaCl已经被除净。
(3)实验操作中多次使用了玻璃棒,分别起到了哪些作用?
【提示】玻璃棒:加热溶解——搅拌,加速苯甲酸溶解
过滤——引流
(4)如何检验提纯后的苯甲酸中氯化钠已经被除净?
【思维建模】重结晶法提纯苯甲酸
苯甲酸、泥沙和食盐
滤液
滤渣
滤液
苯甲酸
晶体
氯化钠
苯甲酸、
氯化钠
泥沙
冷却结晶
过滤
加水加热趁热过滤
不纯固体物质
残渣
(不溶性杂质)
滤液
母液
(可溶性杂质和部分被提纯物)
晶体(产品)
溶于溶剂,制成饱和溶液,趁热过滤
冷却,结晶,
过滤,洗涤
一:一种溶质
1.S随T变化小—蒸发结晶
2.
①S随T变化大
②含结晶水
③受热分解
蒸发浓缩、冷却结晶、过滤
(KNO3、Na2CO3·10H2O等)
二:二种溶质,其中一种为少量杂质
主物质
①S随T变化大—蒸发浓缩、冷却结晶、过滤(如KNO3中少量NaCl)
②S随T变化小—蒸发结晶、趁热过滤(NaCl中少量KNO3)
蒸发浓缩、趁热过滤
滤渣(S随T变化小的,NaCl)
滤液
冷却结晶、过滤
滤渣(S随T变化大的,KNO3)
三:二种溶质,大量共存
科学 技术 社会
俄国植物学家茨卫特
1906年,茨卫特在一根玻璃管的细端塞上一小团绵花,在管中充填碳酸钙粉末,让溶有绿色植物叶子色素的石油醚溶液自上而下地通过。结果植物色素便被碳酸钙吸附,分成三段不同颜色:绿色、黄色、黄绿色。再将碳酸钙吸附柱取出,并用乙醇洗脱,即得色素的溶液:叶绿素、叶黄素、胡萝卜素。
科学 技术 社会
德国化学家库恩
茨卫特的色谱实验当时并未引起人们的注意。直到25年后的1931年,德国化学家库恩在分离、提纯、确定胡萝卜素异构体和维生素的结构中,应用了色谱法,并获得1938年诺贝尔化学奖。
科学 技术 社会
(1)原理:利用吸附剂对不同有机物吸附作用的不同,分离、提纯有机物的方法叫色谱法。
色谱法是化学家分离、提纯有机物不可缺少的方法。
(2)常用的吸附剂:碳酸钙、硅胶、氧化铝、活性炭等。
(3)分类:根据物质在两相(气—液、液—液等)间溶解性或吸附能力不同,分为纸上色谱法、薄层色谱法、气相色谱法、液相色谱法等。
色谱法
方法 目的 主要仪器 实例
蒸馏 分离、提纯沸点相差很大的液态混合物 蒸馏烧瓶、 冷凝管 分离乙酸和乙醇
萃取 将有机物从一种溶剂中转移到另一种溶剂中 分液漏斗 用CCl4将碘水中的碘提取出来
分液 分离互不相溶的液态混合物 分液漏斗 分离汽油和水
重结晶 利用温度对溶解度的影响提纯有机物 烧杯、酒精灯、 蒸发皿、漏斗 提纯苯甲酸
洗气 分离提纯气体混合物 洗气瓶 除去甲烷中的乙烯
归纳小结
有机物分离、提纯的常用方法
括号内为杂质 试剂 操作方法
苯(苯甲酸)
苯(苯酚)
乙酸乙酯(乙酸)
溴苯(溴)
硝基苯(酸)
苯(乙苯)
乙醇(水)
乙醛(乙酸)
NaOH溶液
分液
NaOH溶液
分液
饱和Na2CO3溶液
分液
NaOH/NaHSO3
分液
H2O、NaOH溶液
分液
KMnO4/NaOH
分液
CaO(s)
蒸馏
NaOH溶液
蒸馏
另附:有机物除杂质一览表
另附:有机物除杂质一览表
括号内为杂质 试剂 操作方法
乙酸乙酯(少量水)
苯酚(苯甲酸)
肥皂(甘油)
淀粉(纯碱)
乙烷(乙烯)
溴乙烷(溴)
乙酸(乙醇)
溴化钠溶液(NaI)
Na2SO4/MgSO4
过滤
NaHCO3溶液
分液
NaCl
盐析
水
渗析
溴水
洗气
NaHSO3溶液
洗涤分液
NaOH、HCl
蒸馏
溴的CCl4溶液
洗涤、萃取、分液
有机化合物的分离、提纯
第二节 研究有机化合物的一般方法
研究物质的性质是研究纯净物的性质
思考:
分离、提纯
粗品
纯品
→如果要以这瓶白酒为样品,研究乙醇的分子结构,你会先怎么研究?
度数: 白酒中含乙醇的“体积”百分比
52°:表示在100ml的酒中,含有乙醇52 ml(20 ℃)
一瓶从酒厂里生产出来的白酒,度数为 52°你知道度数的意思吗?
研究有机化合物的一般步骤和方法
粗品
纯品
确定实验式
确定分子式
确定结构式
分离、提纯
元素定量分析
测定相对分子质量
波谱分析
现代物理方法
①
②
③
④
每一个操作步骤是怎样完成的呢
一、有机化合物的分离、提纯
进行有机物组成、结构、性质和应用的研究
从天然资源中提取
工厂生产和实验室合成的
有机化合物粗品
纯净的有机化合物
分离、提纯
利用有机化合物与杂质物理性质的差异
物理方法:
化学方法:
一般加入或通过某种试剂进行化学反应。
利用有机物与杂质物理性质差异而将它们分开
密度、溶解度、溶解性、熔沸点等等
一般地,效果相同的情况下可用物理方法的,不用化学方法,可用低反应条件的不用高反应条件
化学上,有机物的分离常用的方法有:
蒸馏(分馏)法、萃取分液法、结晶(重结晶)法、洗气法、加热法、渗析法、盐析法等。
1.蒸馏
(1)适用范围:
蒸馏是分离、提纯液态有机化合物的常用方法。
③有机物与杂质的沸点相差较大(一般约大于30 ℃)
(2)适用条件:
①液体有机物中含有少量杂质
②有机物热稳定性较强
举例:
CH2Cl2(沸点40℃)
CHCl3(沸点62℃)
CCl4(沸点77℃)
液态混合物
用蒸馏法分离提纯
牛角管
气化
冷凝
接收
测量蒸汽的温度,温度计水银球的位置在蒸馏烧瓶支管口处
冷凝管中水的流向:
下口流入,上口流出
蒸馏烧瓶中液体量不得超过容积的2/3
投放沸石或碎瓷片防暴沸
烧瓶底垫陶土网
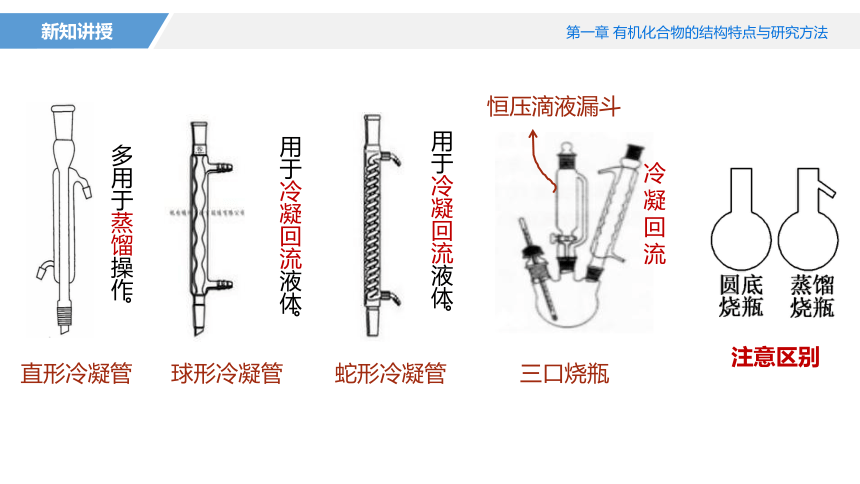
蒸馏烧瓶
用于冷凝回流液体。
用于冷凝回流液体。
多用于蒸馏操作。
直形冷凝管
球形冷凝管
蛇形冷凝管
三口烧瓶
注意区别
冷凝回流
恒压滴液漏斗
问题1:
77—79℃
提纯乙醇我们收集哪个温度的馏分?
(蒸馏所得的产品叫馏分。)
实验:含有杂质的工业乙醇的蒸馏
已知:工业酒精含水、甲醇和乙醇,根据各物质的性质(如表)
物质 沸点/ ℃
甲醇 64.7
乙醇 78.5
水 100
工业酒精
蒸馏
95.6%乙醇
无水乙醇
CaO
蒸馏
固液混合物分离为什么用蒸馏而不用过滤?
原因:①CaO与水反应生成的Ca(OH)2是糊状物,过滤时会堵塞滤纸孔;
②少量Ca2+、OH— 等离子会透过滤纸使乙醇不纯
能否通过直接蒸馏工业乙醇获得无水乙醇?
问题2:
不能。
2.萃取
液-液萃取
固-液萃取
利用待分离组分在两种互不相溶的溶剂中的溶解性不同,将其从一种溶剂转移到另一种溶剂的过程
利用溶剂从固体物质中溶解出待分离组分的过程
主要仪器:分液漏斗、烧杯
液-液萃取
可使用有机溶剂从水中萃取有机化合物。
萃取用的溶剂
(1)萃取剂
选择条件:
①萃取剂与原溶剂互不相溶、不发生化学反应
②溶质在两溶剂中的溶解度有较大差别(在萃取剂中的溶解度大)
③溶质不与萃取剂发生任何反应
常用萃取剂:
乙醚、乙酸乙酯、二氯甲烷等
乙醇
(×)
萃取碘水中的碘
(2)分液
液-液萃取
可使用有机溶剂从水中萃取有机化合物。
将萃取后两种互不相溶的液体分开的操作
主要实验仪器:
分液漏斗
烧杯
铁架台
分液漏斗
恒压滴液漏斗
操作过程:
静置→
分液
检漏→
装液→
①打开玻璃塞或使塞上的凹槽或小孔对准漏斗口上的小孔。
②下层液体从下口放出,上层液体从上口倒出。
注意事项:
①使用前先检查分液漏斗是否漏液
②分液漏斗内液体的总体积不超过容积的2/3。
③振荡时双手托住分液漏斗,右手按住玻璃塞,平放,用力振荡(振荡后注意放气)
④分液时,下层液体从下口放出,上层液体从上口倒出。
⑤分液漏斗下端尖嘴部分紧靠烧杯内壁。
记住常见溶液颜色
Br2水
I2水
( 色)
橙黄
( 色)
棕黄
Br2 /有机溶剂
色
橙红
色
紫红
I2 /有机溶剂
苯、CCl4萃取
苯、CCl4萃取
【思考交流】萃取与分液有什么区别
分液和萃取是两个不同的操作方法
→分液:是将两种互不相溶的液体混合物进行分离的操作。
分液可以单独进行,但萃取之后一般要进行分液
→萃取:是利用溶解性不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来的方法。
例如:苯[水] →分液
3.重结晶
利用被提纯物质与杂质在同一溶剂中的溶解度不同而将杂质除去。
(1)适用范围:
提纯固体有机化合物的常用方法
(2)提纯原理:
(3)溶剂要求:
②被提纯的有机化合物在此溶剂中的溶解度受温度影响较大,能够冷却结晶
重结晶要选择适当的溶剂
①杂质在此溶剂中溶解度很小或者很大,易于除去。
(4)常用方法:
蒸发结晶(如从NaCl溶液中获得NaCl晶体)
冷却结晶(如从CuSO4溶液中获得CuSO4 5H2O晶体)
溶解度很大,让它留在滤液里
溶解度很小,让它留在滤渣里
【探究实验】重结晶法提纯苯甲酸
【问题】某粗苯甲酸样品中含有少量氯化钠和泥沙,提纯苯甲酸需要经过哪些步骤?
温度/℃ 25 50 75
溶解度/g 0.34 0.85 2.2
【资料】苯甲酸可用作食品防腐剂。纯净的苯甲酸为无色结晶,
其结构可表示为
熔点122℃,沸点249℃。苯甲酸微溶于水,易溶于乙醇等有机溶剂。
苯甲酸在水中的溶解度如下
【探究实验】重结晶法提纯苯甲酸
(1)观察粗苯甲酸样品的状态。
(2)将1g粗苯甲酸放入100mL烧杯,加入50mL蒸馏水。加热,搅拌,使粗苯甲酸充分溶解。
(3)使用漏斗趁热将溶液过滤至另一烧杯中,将滤液静置,使其缓慢冷却结晶。
(4)待滤液完全冷却后滤出晶体,并用少量蒸馏水洗涤。将晶体铺在干燥的滤纸上,晾干后称其质量。
白色固体混有黑色或灰色固体
加热溶解
边加热边搅拌,
至固体溶解
冷却结晶
(缓慢冷却结晶,晶形好)
趁热过滤
一贴,二低,三靠;
避免烫伤
过滤、洗涤晶体
白色片状晶体
为什么要趁热过滤?
尽量减少苯甲酸损失
是不是温度越低越好
温度过低,杂质溶解度降低易析出,达不到提纯目的
化学实验中,如何洗涤晶体?如何检验晶体是否洗净?
【提示】加热:使苯甲酸溶解。
趁热过滤的目的:除去泥沙,并防止苯甲酸晶体低温析出。
(1)重结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?
【提示】泥沙难溶于水,氯化钠易溶于水,苯甲酸的溶解度受温度影响比较大。
【步骤】加少量热水溶解,趁热过滤,除去泥沙,冷却结晶,过滤。
(2)溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
【提示】取少量晶体溶于水,加入硝酸酸化的硝酸银溶液,若无白色沉淀生成,证明NaCl已经被除净。
(3)实验操作中多次使用了玻璃棒,分别起到了哪些作用?
【提示】玻璃棒:加热溶解——搅拌,加速苯甲酸溶解
过滤——引流
(4)如何检验提纯后的苯甲酸中氯化钠已经被除净?
【思维建模】重结晶法提纯苯甲酸
苯甲酸、泥沙和食盐
滤液
滤渣
滤液
苯甲酸
晶体
氯化钠
苯甲酸、
氯化钠
泥沙
冷却结晶
过滤
加水加热趁热过滤
不纯固体物质
残渣
(不溶性杂质)
滤液
母液
(可溶性杂质和部分被提纯物)
晶体(产品)
溶于溶剂,制成饱和溶液,趁热过滤
冷却,结晶,
过滤,洗涤
一:一种溶质
1.S随T变化小—蒸发结晶
2.
①S随T变化大
②含结晶水
③受热分解
蒸发浓缩、冷却结晶、过滤
(KNO3、Na2CO3·10H2O等)
二:二种溶质,其中一种为少量杂质
主物质
①S随T变化大—蒸发浓缩、冷却结晶、过滤(如KNO3中少量NaCl)
②S随T变化小—蒸发结晶、趁热过滤(NaCl中少量KNO3)
蒸发浓缩、趁热过滤
滤渣(S随T变化小的,NaCl)
滤液
冷却结晶、过滤
滤渣(S随T变化大的,KNO3)
三:二种溶质,大量共存
科学 技术 社会
俄国植物学家茨卫特
1906年,茨卫特在一根玻璃管的细端塞上一小团绵花,在管中充填碳酸钙粉末,让溶有绿色植物叶子色素的石油醚溶液自上而下地通过。结果植物色素便被碳酸钙吸附,分成三段不同颜色:绿色、黄色、黄绿色。再将碳酸钙吸附柱取出,并用乙醇洗脱,即得色素的溶液:叶绿素、叶黄素、胡萝卜素。
科学 技术 社会
德国化学家库恩
茨卫特的色谱实验当时并未引起人们的注意。直到25年后的1931年,德国化学家库恩在分离、提纯、确定胡萝卜素异构体和维生素的结构中,应用了色谱法,并获得1938年诺贝尔化学奖。
科学 技术 社会
(1)原理:利用吸附剂对不同有机物吸附作用的不同,分离、提纯有机物的方法叫色谱法。
色谱法是化学家分离、提纯有机物不可缺少的方法。
(2)常用的吸附剂:碳酸钙、硅胶、氧化铝、活性炭等。
(3)分类:根据物质在两相(气—液、液—液等)间溶解性或吸附能力不同,分为纸上色谱法、薄层色谱法、气相色谱法、液相色谱法等。
色谱法
方法 目的 主要仪器 实例
蒸馏 分离、提纯沸点相差很大的液态混合物 蒸馏烧瓶、 冷凝管 分离乙酸和乙醇
萃取 将有机物从一种溶剂中转移到另一种溶剂中 分液漏斗 用CCl4将碘水中的碘提取出来
分液 分离互不相溶的液态混合物 分液漏斗 分离汽油和水
重结晶 利用温度对溶解度的影响提纯有机物 烧杯、酒精灯、 蒸发皿、漏斗 提纯苯甲酸
洗气 分离提纯气体混合物 洗气瓶 除去甲烷中的乙烯
归纳小结
有机物分离、提纯的常用方法
括号内为杂质 试剂 操作方法
苯(苯甲酸)
苯(苯酚)
乙酸乙酯(乙酸)
溴苯(溴)
硝基苯(酸)
苯(乙苯)
乙醇(水)
乙醛(乙酸)
NaOH溶液
分液
NaOH溶液
分液
饱和Na2CO3溶液
分液
NaOH/NaHSO3
分液
H2O、NaOH溶液
分液
KMnO4/NaOH
分液
CaO(s)
蒸馏
NaOH溶液
蒸馏
另附:有机物除杂质一览表
另附:有机物除杂质一览表
括号内为杂质 试剂 操作方法
乙酸乙酯(少量水)
苯酚(苯甲酸)
肥皂(甘油)
淀粉(纯碱)
乙烷(乙烯)
溴乙烷(溴)
乙酸(乙醇)
溴化钠溶液(NaI)
Na2SO4/MgSO4
过滤
NaHCO3溶液
分液
NaCl
盐析
水
渗析
溴水
洗气
NaHSO3溶液
洗涤分液
NaOH、HCl
蒸馏
溴的CCl4溶液
洗涤、萃取、分液
