北京一七一中2024-2025学年高三下学期2月月考化学试卷(PDF版,含答案)
文档属性
| 名称 | 北京一七一中2024-2025学年高三下学期2月月考化学试卷(PDF版,含答案) |  | |
| 格式 | |||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-03 09:27:16 | ||
图片预览



文档简介
2024-2025学年度高三年级化学2月月考试卷
(考试时间: 90 分钟 总分:100 分) 2025.2
可能用到的相对原子质量: O-16 Mn-55
第一部分 选择题(共 42 分)
一、选择题(每小题只有一个选项符合题意,每小题 3分,共 42分)
1.氧化石墨烯在能源、材料等领域具有重要的应用前景。用强氧化剂在石墨层间引入大量基团(如
—OH、—COOH 等)削弱层间作用力得到氧化石墨烯。下列说法正确的是
A.氧化石墨烯有一定的亲水性 B.石墨是一种有机高分子材料
C.石墨层内导电性和层间导电性相同 D.石墨转化成氧化石墨烯是物理变化
2.下列化学用语或图示表达正确的是
A. H2O 的 VSEPR 模型: B. 顺-2-丁烯的结构简式:
C. 基态 Si 原子的价层电子轨道表示式:
D. Ca 的原子结构示意图:
3.下列比较不.正.确.的是
A. 沸点:HF > HBr > HCl B. 还原性:PH3 > H2S > HCl
C. 第一电离能:Al > Mg >Na D. 酸性:CF3COOH > CCl3COOH > CBr3COOH
4.能用下图所示装置完成气体制备、尾气处理(加热和夹持等装置略去)的是
气体 制备试剂 烧杯中试剂
A C2H2 电石与水 水
B NH3 浓氨水与碱石灰 水
C NO2 铜与浓硝酸 NaOH 溶液
D Cl2 MnO2与浓盐酸 饱和 NaCl 溶液
5.下列过程的化学用语表述不.正.确.的是
A. 铝溶于氢氧化钠溶液中,有无色气体产生:2Al + 2OH- +6H - 2O = 2[Al(OH)4] + 3H2↑
B. 用电子式表示 NaCl 的形成过程:
C.“吹出法”提取溴中,用 SO2 吸收溴蒸气:SO2 + Br2 +2H2O= H2SO4 + 2HBr
1
D. 向苯酚钠溶液中通入少量 CO2气体,溶液变浑浊:
2 + CO2 + H2O → 2 + CO 2- 3
6.关于下列实验的说法不.正.确.的是
A B C D
溶液的 pH 减小是 混合液中 c(CH3COO )
CH COO 3 的水 NH4Cl 可促进
CH3COO 水解平 和 c(CH3COOH)之和
解程度增大 CH3COO 的水解
衡移动的结果 大于 c(Na+)
7.下列实验装置能达到实验目的的是
A B C D
检验 1-溴丁烷消去反应的产物
实验室制备氯气 实验室制取乙烯 实验室在铁制钥匙上镀铜
8.根据下列实验操作和现象,能得到相应结论的是
选项 实验操作和现象 结论
将灼烧成红热的木炭放入浓硝酸中,
A 生成红棕色气体,可证明木炭与浓硝
产生红棕色气体 酸发生了反应
将铁锈溶于浓盐酸,滴入 KMnO4 溶液,紫色B 铁锈中含有二价铁
褪去
C 向淀粉水解液中,滴加少量碘水,溶液变蓝 淀粉未水解或水解未完全
D 常温下,测得饱和 Na2CO3 溶液的 pH 大于饱 2— —常温下水解程度:CO3 > HCO3
和 NaHCO3溶液
2
9.下列依据相关数据作出的推断中,不.正.确.的是
A. 依据金属逐级电离能数据,可推断金属元素的主要化合价
B. 依据 VIIA 相同温度下 X2与 H2反应平衡常数的大小,可判断反应的剧烈程度
C. 依据一元弱酸的电离常数的大小,比较同温同浓度其钠盐溶液的碱性强弱
D.依据气体的摩尔质量(不考虑分子间聚集的情况),可推断相同状况下不同气体密度的大小
10.高分子 P1 通过加入化合物 B 可得高分子 P2。其合成路线如下:
已知:
下列说法正确的是
A.反应①为加成聚合反应 B.有机物 A 与乙烯互为同系物
C.有机物 A 存在顺反异构 D.P2 只能是线型结构的高分子
11.一种可充电的锌锰分液电池,其结构如下图所示:
下列说法不.正.确.的是
A. 放电时,正极反应为:MnO + 2 + 4H + 2e- = Mn2+ + 2H2O
B. 充电时,Zn 作阴极:[Zn(OH) ]2-+2e-4 = Zn+ 4OH-
C. 充电过程中K2SO4 溶液的浓度逐渐降低
D. 离子交换膜 a 和 b 分别为阳离子交换膜和阴离子交换膜
12. 室温下,通过下列实验探究草酸(H2C2O4)的性质。
已知 Ka1(H2C2O4)=5.6×10-2,Ka2(H2C2O4)=1.5×10-4, Ksp(CoC2O4)=4×10-6。
实验 1:用 0.10 mol L-1NaOH 溶液滴定 25.00 mL 0.1 mol·L-1
H2C2O4溶液,滴定曲线如图所示。
实验 2:向 0.1 mol L-1 H2C2O4 溶液中滴加 CoSO4 溶液,产生沉淀。
实验 3:向酸性 KMnO4 溶液中滴加 0.1 mol L-1 H2C2O4溶液至溶液
恰好褪色。
3
下列说法正确的是
A.图中 X 点的溶液中:c(H2C2O4) >c(C2O 2-4 )
B.图中 Y 点的溶液中:c(Na+) = c(C O 2-2 4 ) + c(H -2C2O4) +c(HC2O4 )
C.实验 2 中发生反应 Co2+(aq)+ H C +2 2O4(aq) CoC2O4(s)+2H (aq)的平衡常数 K = 2.1
D.实验 3 中发生反应的离子方程式为: 5C 2- - + 2O4 +2 MnO4 +16 H = 2Mn2+ + 10CO2↑+8H2O
13. Fe3O4(s)与 CO(g)主要发生如下反应。
① Fe3O4(s) + CO(g) 3FeO(s) + CO2(g) ΔH1 = +19.3 kJ·mol-1
② Fe3O4(s) + 4CO(g) 3Fe(s) + 4CO2(g) ΔH2
反应的还原产物与温度密切相关。其它条件一定时,
Fe3O4(s)和 CO(g)反应达平衡时,CO(g)的体积分数随
温度的变化关系如下图所示。下列说法不.正.确.的是
1
A. 反应 FeO(s) + CO(g) Fe(s) + CO2(g)的焓变为 (ΔH2 -ΔH1)
3
B. 根据图像推测,ΔH2应当小于 0
C. 反应温度越高,Fe3O4主要还原产物中铁元素的价态越高
D. 温度高于 1040℃时,Fe3O4(s)和 CO(g)发生的主要反应的化学平衡常数 K 4
14.某小组同学为探究 Zn 与 FeCl3 溶液的反应,设计并完成了如下实验。
实验 条件 现象
无明显气泡,0.5 min 后有气体产生,一段时间
未酸化的 0.5mol/L ⅰ 18℃ 后,溶液颜色加深,存在丁达尔现象,向混合后
FeCl 溶液(pH=1.5) 的溶液中加铁氰化钾溶液有蓝色沉淀生成 3
65℃水 有气泡产生,12 s 后,气泡非常明显,溶液红棕
ⅱ
Zn 粒 浴 色加深,一段时间后产生红棕色沉淀
iii 18℃, 无明显气泡,3 min 后有明显的气泡产生,溶液
混合后 颜色加深,存在丁达尔现象,向混合后的溶液中
未酸化的 0.5mol/L
不振荡 加铁氰化钾溶液有蓝色沉淀生成
FeCl3 溶液(pH=1.5)
iv 18℃, 气泡不明显,红棕色褪色明显,存在丁达尔现象,
混合后 向混合后的溶液中加铁氰化钾溶液有蓝色沉淀
Zn 粉 振荡 生成
下列说法不.正.确.的是
A. 实验中产生的气体都为 H2
B. 对比 i、ii,气泡产生速度快可能原因是升高温度促进水解反应正向进行,增大了 c(H+)
C. 对比 i、iii、iv中产生气泡现象的差异,推测:ⅰ中氧化性 H+>Fe3+
D.该实验可体现温度、反应物浓度、反应物接触面积对反应速率的影响
4
第二部分
本部分共 5 题,共 58 分。
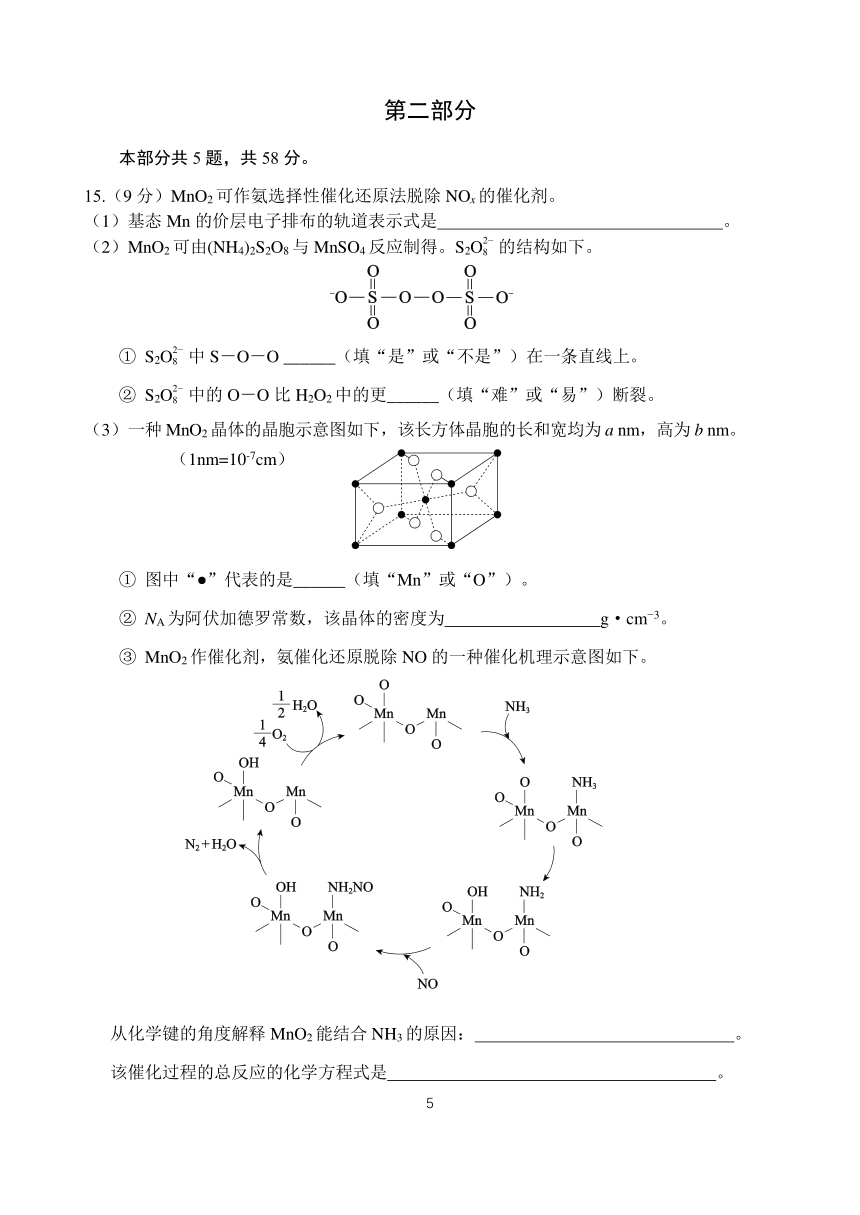
15.(9 分)MnO2 可作氨选择性催化还原法脱除 NOx的催化剂。
(1)基态 Mn 的价层电子排布的轨道表示式是 。
2
(2)MnO2 可由(NH4)2S2O8 与 MnSO4 反应制得。S2O8 的结构如下。
2
① S2O8 中 S-O-O ______(填“是”或“不是”)在一条直线上。
2
② S2O8 中的 O-O 比 H2O2中的更______(填“难”或“易”)断裂。
(3)一种 MnO2晶体的晶胞示意图如下,该长方体晶胞的长和宽均为 a nm,高为 b nm。
(1nm=10-7cm)
① 图中“●”代表的是______(填“Mn”或“O”)。
② NA为阿伏加德罗常数,该晶体的密度为 g·cm 3。
③ MnO2作催化剂,氨催化还原脱除 NO 的一种催化机理示意图如下。
从化学键的角度解释 MnO2 能结合 NH3 的原因: 。
该催化过程的总反应的化学方程式是 。
5
16.(14 分)工业上利用生产磷肥的副产品高磷镍铁制备硫酸镍晶体 NiSO4·6H2O。
(1)制备含 Ni2+溶液
已知:i.高磷镍铁和镍铁合金中元素的百分含量:
元素 / % Ni / % Fe / % P / % Co / % Cu / %
高磷镍铁 4.58 70.40 16.12 0.22 0.34
镍铁合金 52.49 38.30 5.58 1.73 1.52
ii.金属活动性:Fe>Co>Ni>H
① 依据数据,“转炉吹炼”的主要目的是:富集镍元素,除去部分 。
② “电解造液”时,用镍铁合金作阳极,H2SO4溶液作电解质溶液。电解过程中阴极产生
的气体是______。电解一段时间后,有少量 Ni 在阴极析出,为防止 Ni 析出降低
NiSO4·6H2O 的产率,从补加试剂和改进工艺的角度,可采取的方法有:
。
(2)制备 NiSO4·6H2O
已知:常温下,金属离子完全转化为氢氧化物沉淀的 pH:
金属离子 Fe3+ Fe2+ Cu2+ Co2+ Ni2+
完全沉淀的 pH 2.8 8.3 6.7 9.4 8.9
① 在酸性条件下,NaClO 和 Fe2+反应生成 Fe3+和 Cl 的离子方程式是
。
② 已知 Ni(OH)2的 Ksp 为 5.48×10 16,滤液 1 中 c(Ni2+)=1.37 mol/L。结合数据说明不能
通过调节溶液的 pH 除去 Cu2+的原因:
。(已知:lg5=0.7)
③滤液 2 中含有 Co2+,需要进行除杂分离。已知流程中的含钴滤渣是氢氧化物,结合表
格和流程中的信息及相关反应原理知识,分析推测含钴滤渣成分及其产生的可能原因
(资料表明 Co2+还原性很弱,氧化半反应 Co2+ - e- === Co3+ 一般很难发生。)
④从滤液 3 中获取 NiSO4·6H2O 的操作是 、洗涤、干燥。
6
17.(11 分)乌药内酯具有抗炎、镇痛作用。乌药内酯的中间体 X 合成路线如下图所示(部
分反应条件或试剂略去)。
(1)B的官能团名称是 。
(2)B→D的化学方程式是 。
(3)已知 2D→E+A,E 的结构简式是 。
(4)下列关于有机物 I的说法不正确的是________。(填序号)。
a.可以发生取代反应、加成反应、氧化反应
b.存在酚类同分异构体
c.可以用酸性 KMnO4溶液检验其中的碳碳双键
d.核磁共振氢谱中有 6种信号峰,是手性分子
(5)I→J的化学方程式是 。。
(6)已知:
①
②
G与 L可以在碱性条件下经过如下图所示的多步反应得到 X。
中间产物 1、中间产物 3的结构简式是 、 。
7
18.(12 分)用零价铁(Fe)去除含氮废水中的硝酸盐( NO 3 )是环境修复的重要方法。一
种去除 NO 3 的研究过程如下。
(1)Ⅱ中充分反应后,分离混合物的方法是 。
(2)Ⅱ中反应的离子方程式是 。
+
(3)实验发现,在Ⅱ中补充一定量的 Fe2 可以明显提高 NO 3 的去除率。向两份含氮废水
﹣
[n -(NO3 ) = 8.1×10
5 mol]中均加入足量 Fe 粉,做对比研究。
实验序号 ⅰ ⅱ
﹣
所加试剂 Fe 粉 Fe 粉、FeCl2(3.6×10 5 mol)
-
NO3 的去除率 ≈50% ≈100%
分析ⅱ中 -NO 3 去除率提高的原因:
+ -
a.Fe2 直接还原 NO3 。
通过计算说明电子得、失数量关系:
,证明该原因不合理。
b.研究发现:Fe3O4(导电)覆盖在铁粉表面;随着反应的进行,产生 FeO(OH)(不导
电),它覆盖在 Fe3O4 表面,形成钝化层,阻碍电子传输。
2
c.Fe 能与 FeO(OH)反应生成 Fe O 573 4。用 FeCl2 做同位素示踪实验,证明该原因合理。
-
d.Cl 破坏钝化层。
将ⅱ中的 替换为 , -FeCl2 NO 3 的去除率约为 50%,证明该原因不合理。
+ +
(4)ⅰ、ⅱ中均能发生 -Fe + 2H == Fe2 + H2↑。该反应明显有助于ⅰ中 NO3 的去除,结
合方程式解释原因: 。
(5)测定 -NO3 含量
-
步骤 1.取 v mL 含氮( -NO3 )水样,加入催化剂、v1 mL c1 mol·L
1 FeSO4 标准溶液(过
量),再加入稀 H2SO4。
- + +
步骤 2-2. 用 c2 mol·L 1 K2Cr2O7标准溶液滴定剩余的 Fe2 (Cr2O7 被还原为 Cr
3 ),终
点时消耗 v2 mL。
+ + +
已知: -3Fe2 + NO3 + 4H == NO↑ + 3Fe
3 + 2H2O
-
① 水样中 -NO 的含量为 mol·L 13 。
② 溶液中 O2影响测定。向步骤 1 中加入适量 NaHCO3,产生 CO2 驱赶 O2,否则会使测定
结果 (填“偏大”或“偏小”)。
8
19.(12分)工业上用铁粉还原 AgCl 制取银,某小组探究其过程和影响因素。
【实验 A】 在试管中加入 NaCl 溶液,然后滴入 AgNO3溶液,产生白色沉淀。滤出白色沉
淀,继续实验如下:
- - 3+ - -
【资料】 ① AgCl + Cl AgCl2 ② Fe + 4Cl FeCl4
(1)检验ⅱ中产物
2+
① 取ⅱ中上层清液,滴加 K3[Fe(CN)6]溶液, (填现象),说明溶液中含有 Fe 。
② 取ⅱ中少量灰黑色固体,洗涤后将固体等分两份。取其中一份,加入
(填试剂)溶解,再加入 NaCl 溶液生成白色沉淀,证明灰黑色固体中含有 Ag。向另一份加
入 KI 溶液,无明显现象。
(2)检验ⅲ中产物。
① 取ⅲ中灰白色固体,洗涤。进行如下实验,确认灰白色固体中含 AgCl。
【实验 B】
滤液加盐酸未产生沉淀,但加入硫酸后产生了白色沉淀,请结合离子方程式解释原因:
。
② 取 iii 中上层溶液,加几滴 KSCN 溶液。取样时间与溶液颜色如下表。
取样时间 10 分钟 12 小时 24 小时
溶液颜色 浅红色 红色 深红色
3+ -
用离子方程式表示溶液变红的原因 ,Fe + SCN Fe(SCN)3。
(3)小组同学认为不能排除 O2直接氧化 Ag 继而生成 AgCl,对此设计实验:
。
3+
结果发现,该实验产生 AgCl 所需的时间更长。说明 AgCl 的产生主要与 Fe 有关。
(4)实验 A 中的 i~iii 中,i 中 AgCl 溶解,iii 中又生成 AgCl 的原因是:
。
(5)乙组实验反思:铁粉还原 AgCl 制取银时应控制铁粉、盐酸的浓度和浸泡时间等因素。
9
高三化学 2月考答案
1 2 3 4 5 6 7 8 9 10
A B C C D B C C B A
11 12 13 14
D C D C
15.(9 分)
(1) (1 分) (2)① 不是(1 分) ② 易(1 分)
(3)① Mn(1 分)
23
1.74×10
②
N a2
(2 分)
A× b
③ NH3 中的 N 有孤电子对,MnO2 中的 Mn 有空轨道能接受孤电子对,形成配位键(1 分)
MnO2
4NH3 + 4NO + O2 ==== 4N2 + 6H2O(2 分)
16.(14 分)(1)① 铁元素和磷元素(2 分)
② H2(1 分) 加入 H2SO4溶液;使用阴离子交换膜(2 分)
(2)① ClO + 2Fe2+ + 2H+ == 2Fe3+ + Cl + H2O(2 分)
② 根据 c(Ni2+)×c2(OH )=5.48×10 16 可知,Ni2+ 开始沉淀的 c(OH )为 2.0×10 8
mol/L,即 Ni2+ 开始沉淀的 pH 为 6.3。Cu2+完全沉淀的 pH 为 6.7,调节溶液的
pH 除去 Cu2+时会使部分 Ni2+ 沉淀造成损失(2 分)
③ Co(OH)3(1 分)
从流程中可知,滤液 3 含有 Ni2+,说明加入 NiOOH 时,发生了氧化还原反应。结合表格信
息又知,当 Co2+完全沉淀时,Ni2+也已沉淀完全,不能实现除杂分离。所以滤渣中只能是
Co(OH) 。其能生成的原因可能是因为 NiOOH 消耗溶液中 H+3 ,使 c(OH-)升高,Co(OH)3 比
Co(OH)2更易沉淀,从而提高了+2 价 Co 的还原性,促进了+2 价 Co 被 NiOOH 氧化。(2 分)
④加热浓缩、冷却结晶、过滤(2 分)
17(11 分)(1)羧基(1 分)
(2) (2 分)
(3) (2 分)
1
(4)bcd(2 分)
碱
(5) + CH3Cl + HCl (2 分)
(6)中间产物 1:
中间产物 3: (各 1 分)
3Fe+NO- +2H+ +H O=Fe O +NH+
18.(12 分)(1)过滤; (1 分) (2) 3 2 3 4 4 ; (2 分)
(3)a. NO-还原 所需电子:3.24×10-4mol,Fe2+最多提供的电子:3.6×10-5mol。Fe2+3 失去的
-
电子数明显小于 NO3所需电子数; (2 分)
d. 7.2×10-5mol NaCl; (2 分)
(4) Fe2+ +2FeO(OH)=Fe3O4 +2H
+
,Fe2+破坏了钝化层; (2 分)
c v -6c v
(5) ①. 1 1 2 2 ; (2 分) ②. 偏大 (1 分)
3v
19.(12 分)(1)① 产生蓝色沉淀(1 分) ② 硝酸(1 分)
- + - + - +
(2)① 加盐酸时,溶液中 c(Cl )较大,发生 Ag(NH3)2 + 2Cl + 2H ==AgCl2 +2NH4 ,故未
- + - + +
产生沉淀;加硫酸时,溶液中 c(Cl )较小,发生 Ag(NH3)2 + Cl +2H ==AgCl↓+2NH4 ,
故产生沉淀。(3 分)
2+ + 3+
② 4Fe + O2 + 4H === 4Fe +2H2O (2 分)
(3)取少量银粉于试管中,加入盐酸,静置一段时间,观察现象(2 分)
2+ 3+ 3+ +
(4)ii 中 Fe 静置过程中生成的 c(Fe )逐渐增大,Fe 将 Ag 氧化为 Ag ,
3+ - - - - -
同时 Fe + 4Cl FeCl4 正向移动,c(Cl )逐渐减小,AgCl + Cl AgCl2 逆向移动,
AgCl 沉淀析出 (3 分)
2
(考试时间: 90 分钟 总分:100 分) 2025.2
可能用到的相对原子质量: O-16 Mn-55
第一部分 选择题(共 42 分)
一、选择题(每小题只有一个选项符合题意,每小题 3分,共 42分)
1.氧化石墨烯在能源、材料等领域具有重要的应用前景。用强氧化剂在石墨层间引入大量基团(如
—OH、—COOH 等)削弱层间作用力得到氧化石墨烯。下列说法正确的是
A.氧化石墨烯有一定的亲水性 B.石墨是一种有机高分子材料
C.石墨层内导电性和层间导电性相同 D.石墨转化成氧化石墨烯是物理变化
2.下列化学用语或图示表达正确的是
A. H2O 的 VSEPR 模型: B. 顺-2-丁烯的结构简式:
C. 基态 Si 原子的价层电子轨道表示式:
D. Ca 的原子结构示意图:
3.下列比较不.正.确.的是
A. 沸点:HF > HBr > HCl B. 还原性:PH3 > H2S > HCl
C. 第一电离能:Al > Mg >Na D. 酸性:CF3COOH > CCl3COOH > CBr3COOH
4.能用下图所示装置完成气体制备、尾气处理(加热和夹持等装置略去)的是
气体 制备试剂 烧杯中试剂
A C2H2 电石与水 水
B NH3 浓氨水与碱石灰 水
C NO2 铜与浓硝酸 NaOH 溶液
D Cl2 MnO2与浓盐酸 饱和 NaCl 溶液
5.下列过程的化学用语表述不.正.确.的是
A. 铝溶于氢氧化钠溶液中,有无色气体产生:2Al + 2OH- +6H - 2O = 2[Al(OH)4] + 3H2↑
B. 用电子式表示 NaCl 的形成过程:
C.“吹出法”提取溴中,用 SO2 吸收溴蒸气:SO2 + Br2 +2H2O= H2SO4 + 2HBr
1
D. 向苯酚钠溶液中通入少量 CO2气体,溶液变浑浊:
2 + CO2 + H2O → 2 + CO 2- 3
6.关于下列实验的说法不.正.确.的是
A B C D
溶液的 pH 减小是 混合液中 c(CH3COO )
CH COO 3 的水 NH4Cl 可促进
CH3COO 水解平 和 c(CH3COOH)之和
解程度增大 CH3COO 的水解
衡移动的结果 大于 c(Na+)
7.下列实验装置能达到实验目的的是
A B C D
检验 1-溴丁烷消去反应的产物
实验室制备氯气 实验室制取乙烯 实验室在铁制钥匙上镀铜
8.根据下列实验操作和现象,能得到相应结论的是
选项 实验操作和现象 结论
将灼烧成红热的木炭放入浓硝酸中,
A 生成红棕色气体,可证明木炭与浓硝
产生红棕色气体 酸发生了反应
将铁锈溶于浓盐酸,滴入 KMnO4 溶液,紫色B 铁锈中含有二价铁
褪去
C 向淀粉水解液中,滴加少量碘水,溶液变蓝 淀粉未水解或水解未完全
D 常温下,测得饱和 Na2CO3 溶液的 pH 大于饱 2— —常温下水解程度:CO3 > HCO3
和 NaHCO3溶液
2
9.下列依据相关数据作出的推断中,不.正.确.的是
A. 依据金属逐级电离能数据,可推断金属元素的主要化合价
B. 依据 VIIA 相同温度下 X2与 H2反应平衡常数的大小,可判断反应的剧烈程度
C. 依据一元弱酸的电离常数的大小,比较同温同浓度其钠盐溶液的碱性强弱
D.依据气体的摩尔质量(不考虑分子间聚集的情况),可推断相同状况下不同气体密度的大小
10.高分子 P1 通过加入化合物 B 可得高分子 P2。其合成路线如下:
已知:
下列说法正确的是
A.反应①为加成聚合反应 B.有机物 A 与乙烯互为同系物
C.有机物 A 存在顺反异构 D.P2 只能是线型结构的高分子
11.一种可充电的锌锰分液电池,其结构如下图所示:
下列说法不.正.确.的是
A. 放电时,正极反应为:MnO + 2 + 4H + 2e- = Mn2+ + 2H2O
B. 充电时,Zn 作阴极:[Zn(OH) ]2-+2e-4 = Zn+ 4OH-
C. 充电过程中K2SO4 溶液的浓度逐渐降低
D. 离子交换膜 a 和 b 分别为阳离子交换膜和阴离子交换膜
12. 室温下,通过下列实验探究草酸(H2C2O4)的性质。
已知 Ka1(H2C2O4)=5.6×10-2,Ka2(H2C2O4)=1.5×10-4, Ksp(CoC2O4)=4×10-6。
实验 1:用 0.10 mol L-1NaOH 溶液滴定 25.00 mL 0.1 mol·L-1
H2C2O4溶液,滴定曲线如图所示。
实验 2:向 0.1 mol L-1 H2C2O4 溶液中滴加 CoSO4 溶液,产生沉淀。
实验 3:向酸性 KMnO4 溶液中滴加 0.1 mol L-1 H2C2O4溶液至溶液
恰好褪色。
3
下列说法正确的是
A.图中 X 点的溶液中:c(H2C2O4) >c(C2O 2-4 )
B.图中 Y 点的溶液中:c(Na+) = c(C O 2-2 4 ) + c(H -2C2O4) +c(HC2O4 )
C.实验 2 中发生反应 Co2+(aq)+ H C +2 2O4(aq) CoC2O4(s)+2H (aq)的平衡常数 K = 2.1
D.实验 3 中发生反应的离子方程式为: 5C 2- - + 2O4 +2 MnO4 +16 H = 2Mn2+ + 10CO2↑+8H2O
13. Fe3O4(s)与 CO(g)主要发生如下反应。
① Fe3O4(s) + CO(g) 3FeO(s) + CO2(g) ΔH1 = +19.3 kJ·mol-1
② Fe3O4(s) + 4CO(g) 3Fe(s) + 4CO2(g) ΔH2
反应的还原产物与温度密切相关。其它条件一定时,
Fe3O4(s)和 CO(g)反应达平衡时,CO(g)的体积分数随
温度的变化关系如下图所示。下列说法不.正.确.的是
1
A. 反应 FeO(s) + CO(g) Fe(s) + CO2(g)的焓变为 (ΔH2 -ΔH1)
3
B. 根据图像推测,ΔH2应当小于 0
C. 反应温度越高,Fe3O4主要还原产物中铁元素的价态越高
D. 温度高于 1040℃时,Fe3O4(s)和 CO(g)发生的主要反应的化学平衡常数 K 4
14.某小组同学为探究 Zn 与 FeCl3 溶液的反应,设计并完成了如下实验。
实验 条件 现象
无明显气泡,0.5 min 后有气体产生,一段时间
未酸化的 0.5mol/L ⅰ 18℃ 后,溶液颜色加深,存在丁达尔现象,向混合后
FeCl 溶液(pH=1.5) 的溶液中加铁氰化钾溶液有蓝色沉淀生成 3
65℃水 有气泡产生,12 s 后,气泡非常明显,溶液红棕
ⅱ
Zn 粒 浴 色加深,一段时间后产生红棕色沉淀
iii 18℃, 无明显气泡,3 min 后有明显的气泡产生,溶液
混合后 颜色加深,存在丁达尔现象,向混合后的溶液中
未酸化的 0.5mol/L
不振荡 加铁氰化钾溶液有蓝色沉淀生成
FeCl3 溶液(pH=1.5)
iv 18℃, 气泡不明显,红棕色褪色明显,存在丁达尔现象,
混合后 向混合后的溶液中加铁氰化钾溶液有蓝色沉淀
Zn 粉 振荡 生成
下列说法不.正.确.的是
A. 实验中产生的气体都为 H2
B. 对比 i、ii,气泡产生速度快可能原因是升高温度促进水解反应正向进行,增大了 c(H+)
C. 对比 i、iii、iv中产生气泡现象的差异,推测:ⅰ中氧化性 H+>Fe3+
D.该实验可体现温度、反应物浓度、反应物接触面积对反应速率的影响
4
第二部分
本部分共 5 题,共 58 分。
15.(9 分)MnO2 可作氨选择性催化还原法脱除 NOx的催化剂。
(1)基态 Mn 的价层电子排布的轨道表示式是 。
2
(2)MnO2 可由(NH4)2S2O8 与 MnSO4 反应制得。S2O8 的结构如下。
2
① S2O8 中 S-O-O ______(填“是”或“不是”)在一条直线上。
2
② S2O8 中的 O-O 比 H2O2中的更______(填“难”或“易”)断裂。
(3)一种 MnO2晶体的晶胞示意图如下,该长方体晶胞的长和宽均为 a nm,高为 b nm。
(1nm=10-7cm)
① 图中“●”代表的是______(填“Mn”或“O”)。
② NA为阿伏加德罗常数,该晶体的密度为 g·cm 3。
③ MnO2作催化剂,氨催化还原脱除 NO 的一种催化机理示意图如下。
从化学键的角度解释 MnO2 能结合 NH3 的原因: 。
该催化过程的总反应的化学方程式是 。
5
16.(14 分)工业上利用生产磷肥的副产品高磷镍铁制备硫酸镍晶体 NiSO4·6H2O。
(1)制备含 Ni2+溶液
已知:i.高磷镍铁和镍铁合金中元素的百分含量:
元素 / % Ni / % Fe / % P / % Co / % Cu / %
高磷镍铁 4.58 70.40 16.12 0.22 0.34
镍铁合金 52.49 38.30 5.58 1.73 1.52
ii.金属活动性:Fe>Co>Ni>H
① 依据数据,“转炉吹炼”的主要目的是:富集镍元素,除去部分 。
② “电解造液”时,用镍铁合金作阳极,H2SO4溶液作电解质溶液。电解过程中阴极产生
的气体是______。电解一段时间后,有少量 Ni 在阴极析出,为防止 Ni 析出降低
NiSO4·6H2O 的产率,从补加试剂和改进工艺的角度,可采取的方法有:
。
(2)制备 NiSO4·6H2O
已知:常温下,金属离子完全转化为氢氧化物沉淀的 pH:
金属离子 Fe3+ Fe2+ Cu2+ Co2+ Ni2+
完全沉淀的 pH 2.8 8.3 6.7 9.4 8.9
① 在酸性条件下,NaClO 和 Fe2+反应生成 Fe3+和 Cl 的离子方程式是
。
② 已知 Ni(OH)2的 Ksp 为 5.48×10 16,滤液 1 中 c(Ni2+)=1.37 mol/L。结合数据说明不能
通过调节溶液的 pH 除去 Cu2+的原因:
。(已知:lg5=0.7)
③滤液 2 中含有 Co2+,需要进行除杂分离。已知流程中的含钴滤渣是氢氧化物,结合表
格和流程中的信息及相关反应原理知识,分析推测含钴滤渣成分及其产生的可能原因
(资料表明 Co2+还原性很弱,氧化半反应 Co2+ - e- === Co3+ 一般很难发生。)
④从滤液 3 中获取 NiSO4·6H2O 的操作是 、洗涤、干燥。
6
17.(11 分)乌药内酯具有抗炎、镇痛作用。乌药内酯的中间体 X 合成路线如下图所示(部
分反应条件或试剂略去)。
(1)B的官能团名称是 。
(2)B→D的化学方程式是 。
(3)已知 2D→E+A,E 的结构简式是 。
(4)下列关于有机物 I的说法不正确的是________。(填序号)。
a.可以发生取代反应、加成反应、氧化反应
b.存在酚类同分异构体
c.可以用酸性 KMnO4溶液检验其中的碳碳双键
d.核磁共振氢谱中有 6种信号峰,是手性分子
(5)I→J的化学方程式是 。。
(6)已知:
①
②
G与 L可以在碱性条件下经过如下图所示的多步反应得到 X。
中间产物 1、中间产物 3的结构简式是 、 。
7
18.(12 分)用零价铁(Fe)去除含氮废水中的硝酸盐( NO 3 )是环境修复的重要方法。一
种去除 NO 3 的研究过程如下。
(1)Ⅱ中充分反应后,分离混合物的方法是 。
(2)Ⅱ中反应的离子方程式是 。
+
(3)实验发现,在Ⅱ中补充一定量的 Fe2 可以明显提高 NO 3 的去除率。向两份含氮废水
﹣
[n -(NO3 ) = 8.1×10
5 mol]中均加入足量 Fe 粉,做对比研究。
实验序号 ⅰ ⅱ
﹣
所加试剂 Fe 粉 Fe 粉、FeCl2(3.6×10 5 mol)
-
NO3 的去除率 ≈50% ≈100%
分析ⅱ中 -NO 3 去除率提高的原因:
+ -
a.Fe2 直接还原 NO3 。
通过计算说明电子得、失数量关系:
,证明该原因不合理。
b.研究发现:Fe3O4(导电)覆盖在铁粉表面;随着反应的进行,产生 FeO(OH)(不导
电),它覆盖在 Fe3O4 表面,形成钝化层,阻碍电子传输。
2
c.Fe 能与 FeO(OH)反应生成 Fe O 573 4。用 FeCl2 做同位素示踪实验,证明该原因合理。
-
d.Cl 破坏钝化层。
将ⅱ中的 替换为 , -FeCl2 NO 3 的去除率约为 50%,证明该原因不合理。
+ +
(4)ⅰ、ⅱ中均能发生 -Fe + 2H == Fe2 + H2↑。该反应明显有助于ⅰ中 NO3 的去除,结
合方程式解释原因: 。
(5)测定 -NO3 含量
-
步骤 1.取 v mL 含氮( -NO3 )水样,加入催化剂、v1 mL c1 mol·L
1 FeSO4 标准溶液(过
量),再加入稀 H2SO4。
- + +
步骤 2-2. 用 c2 mol·L 1 K2Cr2O7标准溶液滴定剩余的 Fe2 (Cr2O7 被还原为 Cr
3 ),终
点时消耗 v2 mL。
+ + +
已知: -3Fe2 + NO3 + 4H == NO↑ + 3Fe
3 + 2H2O
-
① 水样中 -NO 的含量为 mol·L 13 。
② 溶液中 O2影响测定。向步骤 1 中加入适量 NaHCO3,产生 CO2 驱赶 O2,否则会使测定
结果 (填“偏大”或“偏小”)。
8
19.(12分)工业上用铁粉还原 AgCl 制取银,某小组探究其过程和影响因素。
【实验 A】 在试管中加入 NaCl 溶液,然后滴入 AgNO3溶液,产生白色沉淀。滤出白色沉
淀,继续实验如下:
- - 3+ - -
【资料】 ① AgCl + Cl AgCl2 ② Fe + 4Cl FeCl4
(1)检验ⅱ中产物
2+
① 取ⅱ中上层清液,滴加 K3[Fe(CN)6]溶液, (填现象),说明溶液中含有 Fe 。
② 取ⅱ中少量灰黑色固体,洗涤后将固体等分两份。取其中一份,加入
(填试剂)溶解,再加入 NaCl 溶液生成白色沉淀,证明灰黑色固体中含有 Ag。向另一份加
入 KI 溶液,无明显现象。
(2)检验ⅲ中产物。
① 取ⅲ中灰白色固体,洗涤。进行如下实验,确认灰白色固体中含 AgCl。
【实验 B】
滤液加盐酸未产生沉淀,但加入硫酸后产生了白色沉淀,请结合离子方程式解释原因:
。
② 取 iii 中上层溶液,加几滴 KSCN 溶液。取样时间与溶液颜色如下表。
取样时间 10 分钟 12 小时 24 小时
溶液颜色 浅红色 红色 深红色
3+ -
用离子方程式表示溶液变红的原因 ,Fe + SCN Fe(SCN)3。
(3)小组同学认为不能排除 O2直接氧化 Ag 继而生成 AgCl,对此设计实验:
。
3+
结果发现,该实验产生 AgCl 所需的时间更长。说明 AgCl 的产生主要与 Fe 有关。
(4)实验 A 中的 i~iii 中,i 中 AgCl 溶解,iii 中又生成 AgCl 的原因是:
。
(5)乙组实验反思:铁粉还原 AgCl 制取银时应控制铁粉、盐酸的浓度和浸泡时间等因素。
9
高三化学 2月考答案
1 2 3 4 5 6 7 8 9 10
A B C C D B C C B A
11 12 13 14
D C D C
15.(9 分)
(1) (1 分) (2)① 不是(1 分) ② 易(1 分)
(3)① Mn(1 分)
23
1.74×10
②
N a2
(2 分)
A× b
③ NH3 中的 N 有孤电子对,MnO2 中的 Mn 有空轨道能接受孤电子对,形成配位键(1 分)
MnO2
4NH3 + 4NO + O2 ==== 4N2 + 6H2O(2 分)
16.(14 分)(1)① 铁元素和磷元素(2 分)
② H2(1 分) 加入 H2SO4溶液;使用阴离子交换膜(2 分)
(2)① ClO + 2Fe2+ + 2H+ == 2Fe3+ + Cl + H2O(2 分)
② 根据 c(Ni2+)×c2(OH )=5.48×10 16 可知,Ni2+ 开始沉淀的 c(OH )为 2.0×10 8
mol/L,即 Ni2+ 开始沉淀的 pH 为 6.3。Cu2+完全沉淀的 pH 为 6.7,调节溶液的
pH 除去 Cu2+时会使部分 Ni2+ 沉淀造成损失(2 分)
③ Co(OH)3(1 分)
从流程中可知,滤液 3 含有 Ni2+,说明加入 NiOOH 时,发生了氧化还原反应。结合表格信
息又知,当 Co2+完全沉淀时,Ni2+也已沉淀完全,不能实现除杂分离。所以滤渣中只能是
Co(OH) 。其能生成的原因可能是因为 NiOOH 消耗溶液中 H+3 ,使 c(OH-)升高,Co(OH)3 比
Co(OH)2更易沉淀,从而提高了+2 价 Co 的还原性,促进了+2 价 Co 被 NiOOH 氧化。(2 分)
④加热浓缩、冷却结晶、过滤(2 分)
17(11 分)(1)羧基(1 分)
(2) (2 分)
(3) (2 分)
1
(4)bcd(2 分)
碱
(5) + CH3Cl + HCl (2 分)
(6)中间产物 1:
中间产物 3: (各 1 分)
3Fe+NO- +2H+ +H O=Fe O +NH+
18.(12 分)(1)过滤; (1 分) (2) 3 2 3 4 4 ; (2 分)
(3)a. NO-还原 所需电子:3.24×10-4mol,Fe2+最多提供的电子:3.6×10-5mol。Fe2+3 失去的
-
电子数明显小于 NO3所需电子数; (2 分)
d. 7.2×10-5mol NaCl; (2 分)
(4) Fe2+ +2FeO(OH)=Fe3O4 +2H
+
,Fe2+破坏了钝化层; (2 分)
c v -6c v
(5) ①. 1 1 2 2 ; (2 分) ②. 偏大 (1 分)
3v
19.(12 分)(1)① 产生蓝色沉淀(1 分) ② 硝酸(1 分)
- + - + - +
(2)① 加盐酸时,溶液中 c(Cl )较大,发生 Ag(NH3)2 + 2Cl + 2H ==AgCl2 +2NH4 ,故未
- + - + +
产生沉淀;加硫酸时,溶液中 c(Cl )较小,发生 Ag(NH3)2 + Cl +2H ==AgCl↓+2NH4 ,
故产生沉淀。(3 分)
2+ + 3+
② 4Fe + O2 + 4H === 4Fe +2H2O (2 分)
(3)取少量银粉于试管中,加入盐酸,静置一段时间,观察现象(2 分)
2+ 3+ 3+ +
(4)ii 中 Fe 静置过程中生成的 c(Fe )逐渐增大,Fe 将 Ag 氧化为 Ag ,
3+ - - - - -
同时 Fe + 4Cl FeCl4 正向移动,c(Cl )逐渐减小,AgCl + Cl AgCl2 逆向移动,
AgCl 沉淀析出 (3 分)
2
同课章节目录
