2024-2025学年高中化学鲁科版必修2 第2章 化学键 化学反应规律 章末训练(含解析)
文档属性
| 名称 | 2024-2025学年高中化学鲁科版必修2 第2章 化学键 化学反应规律 章末训练(含解析) |

|
|
| 格式 | doc | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-05 18:25:10 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2024-2025学年高中化学鲁科版必修2 第2章 化学键 化学反应规律 章末训练
本试卷满分100分,考试时间75分钟。
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H∶1 C∶12 N∶14 O∶16 Na∶23 S∶32
一、单选题(每题3分,共42分)
1.为了应对能源危机,满足不断增大的能源需求,当今国际能源研究的一个热点就是寻找新能源,下列有关新能源的叙述不正确的是( )
A.氢能燃烧热值高,资源丰富,无毒,无污染
B.风能是太阳能的一种转化形式,能量巨大
C.太阳能能量巨大,而且清洁、无污染,但需要开采、运输
D.物质的化学能可以在不同的条件下转化为热能、电能被人类利用
2.在298K时,实验测得溶液中的反应:在不同浓度时的化学反应速率如下表,由此可推知第6组实验中不可能为( )
实验编号 1 2 3 4 5 6
0.100 0.200 0.150 0.100 0.100 ?
0.100 0.100 0.150 0.200 0.300 ?
0.0076 0.0152 0.0171 0.0152 0.0228 0.152
A.0.500、0.400 B.0.400、0.500
C.1.00、0.200 D.0.100、1.00
3.3molA和2.5molB混合于2L密闭容器中,发生的反应如下:,5min后反应达到平衡状态,容器内压强变小,测得D的平均反应速率为,(反应物A的平衡转化率可表示为)下列结论正确的是( )
A.A的平均反应速率为0.1
B.平衡时,C的浓度为0.125mol/L
C.平衡时,B的转化率为20%
D.平衡时,容器内压强为原来的0.8倍
4.实验室制备气体时,向一定质量的(块状固体)中加入200mL2盐酸,反应进行到1min时共产生标准状况下的气体224mL,下列有关该反应速率的描述正确的是(忽略溶液体积的变化)( )
A.将2盐酸改为相同物质的量浓度的硫酸,反应速率一定更快
B.1min内,用表示的反应速率为0.05
C.再加入少量固体,生成的速率明显加快
D.1min末时,用表示的反应速率为0.1
5.燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极,下列叙述错误的是( )
A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是
C.电池总反应为
D.溶液中向负极移动,向正极移动
6.下列关于化学键的说法正确的是( )
①含有金属元素的化合物一定是离子化合物;
②第ⅠA族和第ⅦA族的元素化合时,一定有离子键生成;
③含有离子键的化合物一定是离子化合物;
④非极性键只存在于双原子单质分子中;
⑤离子化合物中可能含有共价键。
A.①④ B.③⑤ C.①③④ D.②④⑤
7.下列说法正确的是( )
A.共价化合物中可能含有离子键
B.离子化合物中只含有离子键
C.区别离子化合物和共价化合物的方法是看其水溶液是否能够导电
D.离子化合物在熔融状态能电离出可自由移动的离子,而共价化合物在熔融状态不能电离出自由移动的离子
8.碳单质可应用于脱硝。向容积为2L的密闭容器中加入炭(足量)和NO,模拟发生脱硝反应:,测得不同温度下,NO的物质的量随时间的变化如下图所示,时,下列条件能说明反应已经达到平衡状态的是( )
A.
B.气体的密度不再发生变化
C.容器内的气体的压强不变
D.和的物质的量之比不再发生变化
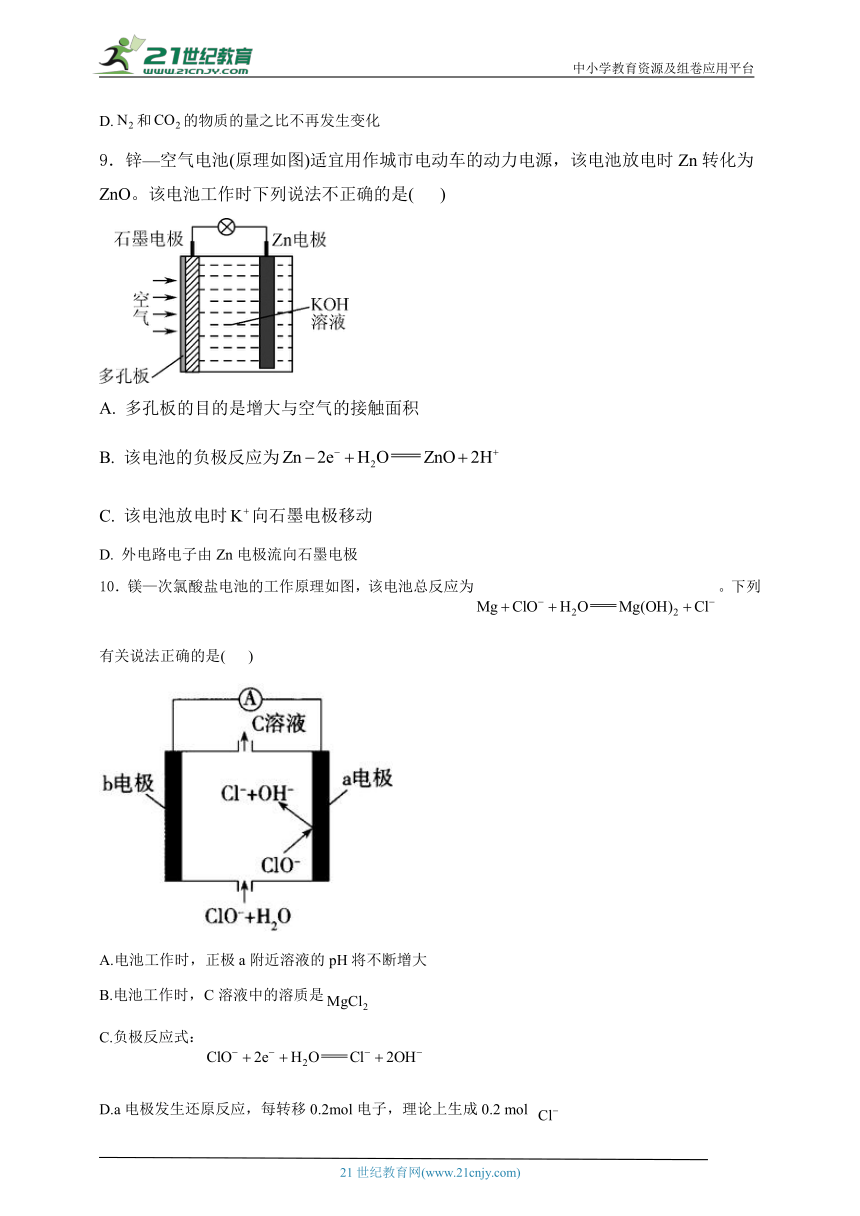
9.锌—空气电池(原理如图)适宜用作城市电动车的动力电源,该电池放电时Zn转化为ZnO。该电池工作时下列说法不正确的是( )
A. 多孔板的目的是增大与空气的接触面积
B. 该电池的负极反应为
C. 该电池放电时向石墨电极移动
D. 外电路电子由Zn电极流向石墨电极
10.镁—次氯酸盐电池的工作原理如图,该电池总反应为。下列有关说法正确的是( )
A.电池工作时,正极a附近溶液的pH将不断增大
B.电池工作时,C溶液中的溶质是
C.负极反应式:
D.a电极发生还原反应,每转移0.2mol电子,理论上生成0.2 mol
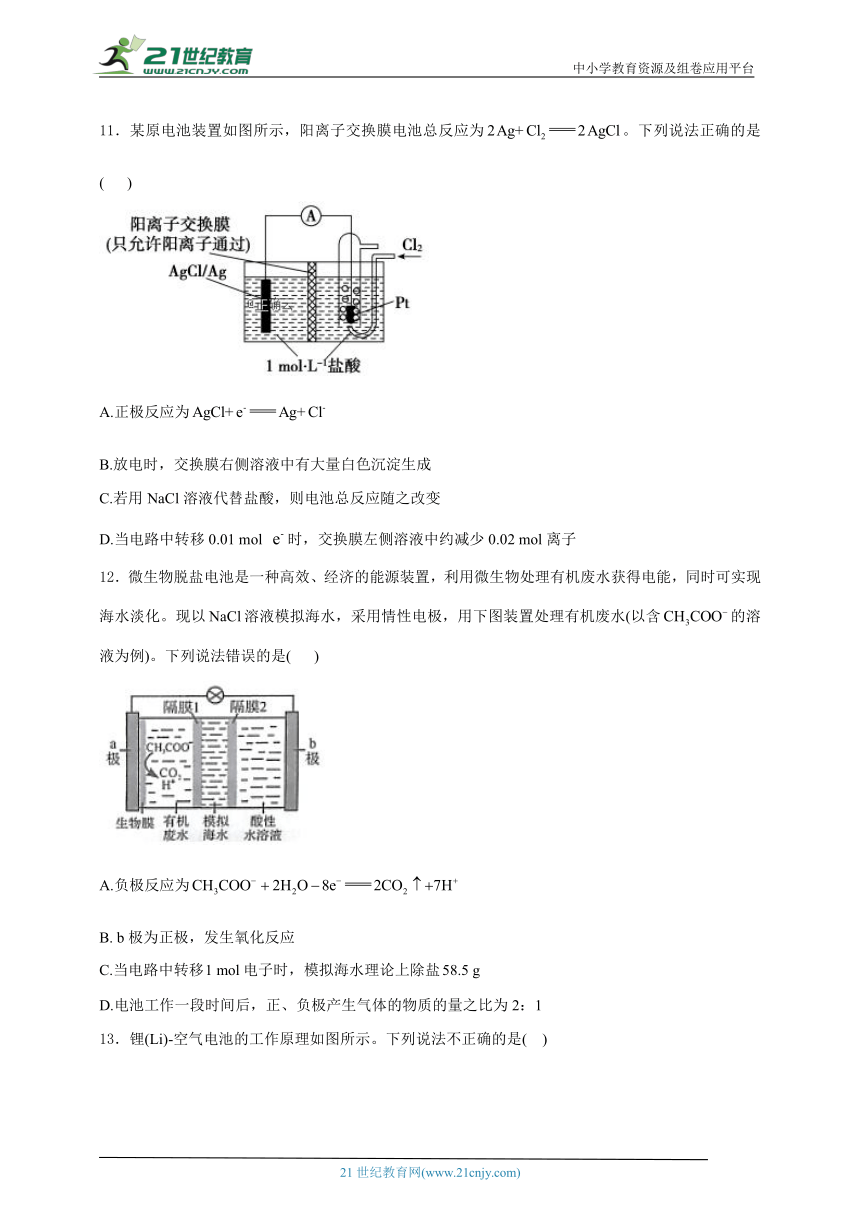
11.某原电池装置如图所示,阳离子交换膜电池总反应为。下列说法正确的是( )
A.正极反应为
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol 时,交换膜左侧溶液中约减少0.02 mol离子
12.微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以溶液模拟海水,采用情性电极,用下图装置处理有机废水(以含的溶液为例)。下列说法错误的是( )
A.负极反应为
B. b极为正极,发生氧化反应
C.当电路中转移电子时,模拟海水理论上除盐
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2:1
13.锂(Li)-空气电池的工作原理如图所示。下列说法不正确的是( )
A.金属锂作负极,发生氧化反应
B.通过有机电解质向水溶液处移动
C.正极的电极反应:
D.电池总反应:
14.我国科学家研发了一种室温下“可呼吸”的二次电池。将溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:。下列说法错误的是( )
A.放电时,向负极移动
B.放电时,向正极移动
C.放电时,正极反应为:
D. 放电时,正极反应为:
15.下列说法正确的是( )
A.,其他条件不变,缩小反应容器体积,正逆反应速率不变
B.,碳的质量不再改变说明反应已达平衡
C.若压强不再随时间变化能说明反应已达平衡,则A、C不能同时是气体
D.恒压条件下发生反应,当气体压强不再改变时,反应达到平衡状态
16.已知反应,下列叙述正确的是( )
A.达到化学平衡状态时,
B.若单位时间内生成 mol NO的同时,消耗mol ,则反应达到化学平衡状态
C.达到化学平衡状态时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D.化学反应速率的关系是:
二、多选题
17.恒温、恒压条件下,1 mol A和1 mol B在一个容积可变的容器中发生反应,一段时间后达到平衡状态,生成 mol C。下列说法错误的是( )
A.起始时和达到平衡状态时容器中的压强比为1:1
B.物质A、B的转化率之比不一定是1:2
C.达到平衡状态时A的物质的量为
D.当时,可断定反应达到平衡状态
18.下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )
A.Y、R两种元素的气态氢化物的稳定性:
B.简单离子的半径:
C.N的氧化物能与Z的最高价氧化物对应的水化物反应
D.Z与X两种元素形成的化合物都是碱性氧化物
三、填空题
19.Ⅰ.已知锌与稀盐酸反应放热,某学生为了探究反应过程中的速率变化,用排水集气法收集反应放出的氢气。每次实验稀盐酸的用量均为25.00mL,锌的用量均为6.50g。
(1)在实验目的一栏中填出对应的实验编号:
编号 锌规格 盐酸浓度/ 实验目的
① 298 粗颗粒 2.00 (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响;(Ⅱ)实验①和___探究温度对该反应速率的影响;(Ⅲ)实验①和____探究锌规格(粗、细)对该反应速率的影响。
② 298 粗颗粒 1.00
③ 308 粗颗粒 2.00
④ 298 细颗粒 2.00
(2)实验①记录如下(换算成标准状况):
时间(s) 10 20 30 40 50 60 70 80 90 100
氢气体积(mL) 16.8 39.2 67.2 224 420 492.8 520.8 543.2 554.4 560
①计算在30~40s范围内盐酸的平均反应速率__________(忽略溶液体积变化)。
②反应速率最大的时间段(如0~10s)为__________,可能的原因是__________,
③反应速率最小的时间段为__________,可能原因是__________。
(3)另一学生也做了同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在盐酸溶液中分别加入等体积的下列物质以减慢反应速率,在不影响产生总量的情况下,你认为可行的是__________(填相应字母)。
A.蒸馏水
B.溶液
C.NaCl溶液
D.溶液
E.溶液
Ⅱ.某化学研究小组的同学为比较和对分解的催化效果,分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性解题思路:如图甲可通过观察___________,定性比较得出结论。甲同学提出将改为更为合理,其理由是___________。受甲同学的启发乙同学提出了另一种方案,你猜想乙同学的方案是___________。
(2)定量解题思路:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中需要测量的数据是___________。
20.用硫酸酸化的草酸(,二元弱酸)溶液能将溶液中的转化为。某化学小组研究发现,少量可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,控制溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,请完成以下实验设计表。
实验编号 温度 初始pH 0.1mol/L草酸溶液/mL 0.01mol/L 溶液的体积/mL 蒸馏水体积/mL 待测数据(反应混合液褪色时间/s)
① 常温 1 20 50 30
② 常温 2 20 50 30
③ 常温 3 40
表中的值分别为=_____、=________。
(2)该反应的离子方程式为______。
(3)若,则根据实验①和②得到的结论是________。
(4)请你设计实验④验证对该反应起催化作用,完成表中内容。
实验方案(不要求写出具体操作过程) 预期实验结果和结论
________ 反应混合液褪色时间小于实验①中的,则对该反应起催化作用(若褪色时间相同,则对该反应无催化作用)
参考答案
1.答案:C
解析:氢气的燃烧产物是水,不污染环境,氢气的燃烧热值高,能从水中制取氢气,说明氢能资源丰富,故A正确;地面各处受太阳辐射后气温变化不同,空气中水蒸气的含量不同,因而引起各地气压的差异,从而形成风,所以风能是太阳能的一种转化形式,B正确;太阳能可以直接利用,无需开采、运输,故C不正确;物质燃烧释放热量,有些物质也能参与形成原电池,所以物质的化学能可以在不同的条件下转化为热能、电能被人类利用,D正确。
2.答案:D
解析:由表格数据可知,实验2与实验1比较,增大到原来的2倍,则反应速率也增大为原来的2倍,实验4与实验1比较, 增大到原来的2倍,则反应速率也增大为原来的2倍,实验3与实验1比较,和都增大为原来的1.5倍,则反应速率增大到原来的倍,则可以得出反应速率与和浓度变化成正比,所以实验6反应速率是实验1的倍,则和之积应该增大到原来的20倍,则A、B、C符合,只有D不符合。
3.答案:C
解析:5min后反应达到平衡状态,容器内压强变小,则有,则,D的平均反应速率为,生成,则列三段式如下:
,故A错误;平衡时C的浓度为,故B错误;平衡时,B的转化率,故C正确;恒温恒容下,压强之比等于气体物质总的物质的量之比,平衡时,容器内压强为原来的倍,故D错误。
4.答案:B
解析:碳酸钙与硫酸反应生成硫酸钙,硫酸钙是微溶物,能覆盖在碳酸钙表面,阻止反应进一步进行,即将盐酸改为相同物质的量浓度的硫酸时,反应速率将减慢,故A错误;,故B正确;加入少量固体不能改变反应物浓度,不能改变反应速率,故C错误;,该速率是用表示该反应在1min内的平均速率,不为瞬时速率,故D错误。
5.答案:B
解析:氢氧燃料电池工作时,通入氢气的一极(a极)为原电池的负极,发生氧化反应,故A正确;通入氧气的一极(b极)为原电池的正极,发生还原反应:,故B错误;氢氧燃料电池的总反应为,故C正确;溶液中向负极移动,向正极移动,故D正确。
6.答案:B
解析:含有金属元素的化合物不一定是离子化合物,如是共价化合物,故①错误;第ⅠA族和第ⅦA族的元素化合时,不一定形成离子键,也可能形成共价键,如HCl,故②错误;含有离子键的化合物为离子化合物,故③正确;共价化合物、离子化合物中也可能含有非极性键,如乙醇中的C一C键,过氧化钠中的O一O键,故④错误;离子化合物中一定含有离子键,可能含有共价键,故⑤正确;故B项正确。
7.答案:D
解析:共价化合物中不含离子键,故A错误;离子化合物中一定含有离子键,可能含有共价键,如NaOH,故B错误;有些共价化合物在水溶液里能电离出自由移动的阴、阳离子,如HCl,故C错误;离子化合物在熔融状态能电离出可自由移动的离子,而共价化合物在熔融状态不能电离出自由移动的离子,故D正确。
8.答案:B
解析:当=2时,反应达平衡状态,A项错误;恒容条件下,当气体质量不变时,反应达平衡状态,此时气体的密度不再发生变化,B项正确;该反应反应前后气体体积不变,在容器内的气体的压强不变,无法判断是否达平衡状态,C项错误;和均为产物,二者物质的量之比始终不变,D项错误。
9.答案:B
解析:B.Zn板的目的是增大与空气的接触面积,提高反应速率,故A正确;B.Zn电极为负极,由于是碱性环境,电极反应式为,故B错误;C.原电池工作时,阳离子向正极(石墨电极)移动,故C正确;D.外电路电子由负极经导线一电流表一正极,即电子由Zn电极流向石墨电极,故D正确;故选:B。
10.答案:A
解析:放电时,正极反应为,所以正极a附近溶液的pH将不断增大,A正确;根据电池总反应可知,C溶液中的溶质不含镁离子,故B错误;负极反应式为,故C错误;a电极发生还原反应,电极反应为,所以每转移0.2mol电子,理论上生成0.1mol ,故D错误。
11.答案:D
解析:正极上发生还原反应:电极反应式为,A项错误;由于电解质溶液中含有大量,故放电时,在交换膜左侧溶液中与反应生成大量AgCl沉淀,B项错误;用NaCl溶液代替盐酸,电池总反应不变,故C项错误;当电路中转移0.01 mol 时,交换膜左侧溶液中产生0.01 mol ,与盐酸反应产生0.01 mol AgCl沉淀,同时约有0.01 mol 通过阳离子交换膜转移到右侧溶液中,故左侧溶液中约减少0.02 mol离子,D项正确。
12.答案:B
解析:结合图示可知放电时负极的电极反应式为,A项正确;b极为正极,发生还原反应,B项错误;电路中转移1 mol电子时,向a极和b极分别移动1 mol 和1 mol ,则模拟海水理论上可除盐58.5 g,C项正确;电池工作时负极产生,正极产生,结合正、负极的电极反应知,一段时间后,正极和负极产生气体的物质的量之比为2:1,D项正确。
13.答案:C
解析:锂(Li)-空气电池中,锂为负极,发生氧化反应, A项正确;负极的电极反应式为,生成的向正极移动,B项正确;通入空气的一极为正极,正极的电极反应为,C项错误;把正、负极的电极反应相加可得电池总反应:,D项正确。
14.答案:D
解析:电池放电时,向负极移动,向正极移动,A、B项正确;放电时,正极得电子被还原生成单质C,即电极反应式为,C项正确、D项错误。
15.答案:B
解析:对于反应,反应前后气体分子数相等,缩小反应容器体积,平衡不移动,正逆反应速率增大相同的倍数,A项错误;碳的质量不变,说明正、逆反应速率相等,反应已达平衡状态,B项正确;恒温恒容条件下,若A、C同时为气体,当压强不变时,也能说明反应达到平衡状态,C项错误;反应在恒压条件下进行,则气体的压强始终不变,D项错误。
16.答案:A
解析:单位时间内生成 mol NO的同时,消耗mol ,均表示的是正反应速率,不能说明反应达到平衡状态,B项错误;达到化学平衡状态时,若增大容器的体积,各气体物质的浓度均减小,正、逆反应速率均减小,C项错误;不同物质表示化学反应速率之比等于对应物质的化学计量数之比,应为,D项错误。
17.答案:BD
解析:反应在恒温、恒压条件下进行,所以起始时和达到平衡状态时容器中的压强比为1:1,A项正确;A和B的起始的物质的量都是1 mol,所以A、B的转化率之比等于参加反应的物质的量之比,根据反应的化学方程式可知,物质A、B的转化率之比一定是1:2,B项错误;由化学方程式可知,生成mol C时,消耗 mol A,则达到平衡状态时A的物质的量为,C项正确;根据化学方程式可知,当时,正、逆反应速率不相等,反应没有达到平衡状态,D项错误。
18.答案:BC
解析:A.根据非金属性越强,其气态氢化物越稳定,则Y、R两种元素的气态氢化物的稳定性:,故A错误;
B.根据同电子层结构核多径小得到简单离子的半径:,故B正确;
C.N的氧化物为二氧化硅、Z的最高价氧化物对应的水化物为氢氧化钠,氢氧化钠和二氧化硅反应生成硅酸钠和水,故C正确;
D.Z与X两种元素形成的化合物中氧化钠是碱性氧化物,而过氧化钠是过氧化物,故D错误。
故选BC。
19.答案:Ⅰ.(1)③;④
(2)①②40~50s;该反应是放热反应,该段时间内温度较高③90~100s;盐酸浓度降低,反应速率减小
(3)AC
Ⅱ.(1)反应产生气泡快慢或反应完成的先后或试管壁的冷热程度使阴离子相同,排除阴离子不同造成的干扰通过活塞的移动观察,相同时间内产生气体量的多少
(2)收集40mL气体所需要的时间
解析:Ⅰ.(1)探究温度对该反应速率的影响,则锌规格以及盐酸的浓度应该是一样的,所以实验①和③作为对照;探究锌规格(粗、细)对该反应速率的影响,要求实验温度以及盐酸的浓度是相等的,所以实验①和④作为对照。
(2)①在30~40s范围内生成氢气的物质的量为,则消耗HCl的物质的量是0.014mol,其浓度是,所以在30~40s范围内盐酸的平均反应速率。②相同时间段内,产生的氢气的体积越大,反应速率越快,所以反应速率最大的时间段是40~50s,可能原因是反应放热,温度高,反应速率快。③相同时间段内,产生的氢气的体积越小,反应速率越慢,所以反应速率最小的时间段是90~100s,可能原因是反应进行过程中,盐酸浓度减小,反应速率变慢。
(3)在盐酸中加入蒸馏水,氢离子浓度降低,反应速率减小,但产生的氢气量不变,A正确;在盐酸中加入溶液,溶液中相当于有了硝酸,硝酸与锌反应生成NO,B错误;加入NaCl溶液相当于将盐酸稀释,盐酸中氢离子浓度减小,所以速率减慢,C正确;在反应中加入硫酸铜溶液,则金属锌会置换出金属铜,形成原电池,会加快反应速率,D错误;在盐酸中加入碳酸钠溶液,碳酸钠与盐酸发生反应,氢离子浓度降低,反应速率减小,且产生的氢气体积也减小,E错误。
Ⅱ.(1)定性解题思路:该反应中产生气体,所以可根据生成气泡的快慢判断。由于阴离子也可能会对反应速率产生影响,所以将改为可以控制阴离子相同,排除阴离子不同造成的干扰;同时,如利用乙图装置,通过测量相同时间内产生气体的量也可判断催化效果。(2)定量解题思路:实验中需要测量的数据是收集40mL气体所需要的时间。
20.答案:(1)50;10
(2)
(3)溶液的pH对该反应的反应速率有影响[或在一定条件下,越大,反应速率越快]
(4)往反应混合液中加入少量固体,控制其他反应条件与实验①相同,进行对比实验
解析:(1)溶液总体积为100mL,控制溶液初始浓度相同,则=50,=100-40-50=10。
(2)草酸与酸性高锰酸钾发生氧化还原反应,生成锰离子、二氧化碳和水,反应的离子方程式为。
(4)控制其他反应条件与实验①相同,往反应混合液中加入少量固体,若反应混合液褪色时间小于实验①中的,则对该反应起催化作用(若褪色时间相同,则对该反应无催化作用)。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
2024-2025学年高中化学鲁科版必修2 第2章 化学键 化学反应规律 章末训练
本试卷满分100分,考试时间75分钟。
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H∶1 C∶12 N∶14 O∶16 Na∶23 S∶32
一、单选题(每题3分,共42分)
1.为了应对能源危机,满足不断增大的能源需求,当今国际能源研究的一个热点就是寻找新能源,下列有关新能源的叙述不正确的是( )
A.氢能燃烧热值高,资源丰富,无毒,无污染
B.风能是太阳能的一种转化形式,能量巨大
C.太阳能能量巨大,而且清洁、无污染,但需要开采、运输
D.物质的化学能可以在不同的条件下转化为热能、电能被人类利用
2.在298K时,实验测得溶液中的反应:在不同浓度时的化学反应速率如下表,由此可推知第6组实验中不可能为( )
实验编号 1 2 3 4 5 6
0.100 0.200 0.150 0.100 0.100 ?
0.100 0.100 0.150 0.200 0.300 ?
0.0076 0.0152 0.0171 0.0152 0.0228 0.152
A.0.500、0.400 B.0.400、0.500
C.1.00、0.200 D.0.100、1.00
3.3molA和2.5molB混合于2L密闭容器中,发生的反应如下:,5min后反应达到平衡状态,容器内压强变小,测得D的平均反应速率为,(反应物A的平衡转化率可表示为)下列结论正确的是( )
A.A的平均反应速率为0.1
B.平衡时,C的浓度为0.125mol/L
C.平衡时,B的转化率为20%
D.平衡时,容器内压强为原来的0.8倍
4.实验室制备气体时,向一定质量的(块状固体)中加入200mL2盐酸,反应进行到1min时共产生标准状况下的气体224mL,下列有关该反应速率的描述正确的是(忽略溶液体积的变化)( )
A.将2盐酸改为相同物质的量浓度的硫酸,反应速率一定更快
B.1min内,用表示的反应速率为0.05
C.再加入少量固体,生成的速率明显加快
D.1min末时,用表示的反应速率为0.1
5.燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极,下列叙述错误的是( )
A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是
C.电池总反应为
D.溶液中向负极移动,向正极移动
6.下列关于化学键的说法正确的是( )
①含有金属元素的化合物一定是离子化合物;
②第ⅠA族和第ⅦA族的元素化合时,一定有离子键生成;
③含有离子键的化合物一定是离子化合物;
④非极性键只存在于双原子单质分子中;
⑤离子化合物中可能含有共价键。
A.①④ B.③⑤ C.①③④ D.②④⑤
7.下列说法正确的是( )
A.共价化合物中可能含有离子键
B.离子化合物中只含有离子键
C.区别离子化合物和共价化合物的方法是看其水溶液是否能够导电
D.离子化合物在熔融状态能电离出可自由移动的离子,而共价化合物在熔融状态不能电离出自由移动的离子
8.碳单质可应用于脱硝。向容积为2L的密闭容器中加入炭(足量)和NO,模拟发生脱硝反应:,测得不同温度下,NO的物质的量随时间的变化如下图所示,时,下列条件能说明反应已经达到平衡状态的是( )
A.
B.气体的密度不再发生变化
C.容器内的气体的压强不变
D.和的物质的量之比不再发生变化
9.锌—空气电池(原理如图)适宜用作城市电动车的动力电源,该电池放电时Zn转化为ZnO。该电池工作时下列说法不正确的是( )
A. 多孔板的目的是增大与空气的接触面积
B. 该电池的负极反应为
C. 该电池放电时向石墨电极移动
D. 外电路电子由Zn电极流向石墨电极
10.镁—次氯酸盐电池的工作原理如图,该电池总反应为。下列有关说法正确的是( )
A.电池工作时,正极a附近溶液的pH将不断增大
B.电池工作时,C溶液中的溶质是
C.负极反应式:
D.a电极发生还原反应,每转移0.2mol电子,理论上生成0.2 mol
11.某原电池装置如图所示,阳离子交换膜电池总反应为。下列说法正确的是( )
A.正极反应为
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol 时,交换膜左侧溶液中约减少0.02 mol离子
12.微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以溶液模拟海水,采用情性电极,用下图装置处理有机废水(以含的溶液为例)。下列说法错误的是( )
A.负极反应为
B. b极为正极,发生氧化反应
C.当电路中转移电子时,模拟海水理论上除盐
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2:1
13.锂(Li)-空气电池的工作原理如图所示。下列说法不正确的是( )
A.金属锂作负极,发生氧化反应
B.通过有机电解质向水溶液处移动
C.正极的电极反应:
D.电池总反应:
14.我国科学家研发了一种室温下“可呼吸”的二次电池。将溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:。下列说法错误的是( )
A.放电时,向负极移动
B.放电时,向正极移动
C.放电时,正极反应为:
D. 放电时,正极反应为:
15.下列说法正确的是( )
A.,其他条件不变,缩小反应容器体积,正逆反应速率不变
B.,碳的质量不再改变说明反应已达平衡
C.若压强不再随时间变化能说明反应已达平衡,则A、C不能同时是气体
D.恒压条件下发生反应,当气体压强不再改变时,反应达到平衡状态
16.已知反应,下列叙述正确的是( )
A.达到化学平衡状态时,
B.若单位时间内生成 mol NO的同时,消耗mol ,则反应达到化学平衡状态
C.达到化学平衡状态时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D.化学反应速率的关系是:
二、多选题
17.恒温、恒压条件下,1 mol A和1 mol B在一个容积可变的容器中发生反应,一段时间后达到平衡状态,生成 mol C。下列说法错误的是( )
A.起始时和达到平衡状态时容器中的压强比为1:1
B.物质A、B的转化率之比不一定是1:2
C.达到平衡状态时A的物质的量为
D.当时,可断定反应达到平衡状态
18.下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )
A.Y、R两种元素的气态氢化物的稳定性:
B.简单离子的半径:
C.N的氧化物能与Z的最高价氧化物对应的水化物反应
D.Z与X两种元素形成的化合物都是碱性氧化物
三、填空题
19.Ⅰ.已知锌与稀盐酸反应放热,某学生为了探究反应过程中的速率变化,用排水集气法收集反应放出的氢气。每次实验稀盐酸的用量均为25.00mL,锌的用量均为6.50g。
(1)在实验目的一栏中填出对应的实验编号:
编号 锌规格 盐酸浓度/ 实验目的
① 298 粗颗粒 2.00 (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响;(Ⅱ)实验①和___探究温度对该反应速率的影响;(Ⅲ)实验①和____探究锌规格(粗、细)对该反应速率的影响。
② 298 粗颗粒 1.00
③ 308 粗颗粒 2.00
④ 298 细颗粒 2.00
(2)实验①记录如下(换算成标准状况):
时间(s) 10 20 30 40 50 60 70 80 90 100
氢气体积(mL) 16.8 39.2 67.2 224 420 492.8 520.8 543.2 554.4 560
①计算在30~40s范围内盐酸的平均反应速率__________(忽略溶液体积变化)。
②反应速率最大的时间段(如0~10s)为__________,可能的原因是__________,
③反应速率最小的时间段为__________,可能原因是__________。
(3)另一学生也做了同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在盐酸溶液中分别加入等体积的下列物质以减慢反应速率,在不影响产生总量的情况下,你认为可行的是__________(填相应字母)。
A.蒸馏水
B.溶液
C.NaCl溶液
D.溶液
E.溶液
Ⅱ.某化学研究小组的同学为比较和对分解的催化效果,分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性解题思路:如图甲可通过观察___________,定性比较得出结论。甲同学提出将改为更为合理,其理由是___________。受甲同学的启发乙同学提出了另一种方案,你猜想乙同学的方案是___________。
(2)定量解题思路:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中需要测量的数据是___________。
20.用硫酸酸化的草酸(,二元弱酸)溶液能将溶液中的转化为。某化学小组研究发现,少量可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,控制溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,请完成以下实验设计表。
实验编号 温度 初始pH 0.1mol/L草酸溶液/mL 0.01mol/L 溶液的体积/mL 蒸馏水体积/mL 待测数据(反应混合液褪色时间/s)
① 常温 1 20 50 30
② 常温 2 20 50 30
③ 常温 3 40
表中的值分别为=_____、=________。
(2)该反应的离子方程式为______。
(3)若,则根据实验①和②得到的结论是________。
(4)请你设计实验④验证对该反应起催化作用,完成表中内容。
实验方案(不要求写出具体操作过程) 预期实验结果和结论
________ 反应混合液褪色时间小于实验①中的,则对该反应起催化作用(若褪色时间相同,则对该反应无催化作用)
参考答案
1.答案:C
解析:氢气的燃烧产物是水,不污染环境,氢气的燃烧热值高,能从水中制取氢气,说明氢能资源丰富,故A正确;地面各处受太阳辐射后气温变化不同,空气中水蒸气的含量不同,因而引起各地气压的差异,从而形成风,所以风能是太阳能的一种转化形式,B正确;太阳能可以直接利用,无需开采、运输,故C不正确;物质燃烧释放热量,有些物质也能参与形成原电池,所以物质的化学能可以在不同的条件下转化为热能、电能被人类利用,D正确。
2.答案:D
解析:由表格数据可知,实验2与实验1比较,增大到原来的2倍,则反应速率也增大为原来的2倍,实验4与实验1比较, 增大到原来的2倍,则反应速率也增大为原来的2倍,实验3与实验1比较,和都增大为原来的1.5倍,则反应速率增大到原来的倍,则可以得出反应速率与和浓度变化成正比,所以实验6反应速率是实验1的倍,则和之积应该增大到原来的20倍,则A、B、C符合,只有D不符合。
3.答案:C
解析:5min后反应达到平衡状态,容器内压强变小,则有,则,D的平均反应速率为,生成,则列三段式如下:
,故A错误;平衡时C的浓度为,故B错误;平衡时,B的转化率,故C正确;恒温恒容下,压强之比等于气体物质总的物质的量之比,平衡时,容器内压强为原来的倍,故D错误。
4.答案:B
解析:碳酸钙与硫酸反应生成硫酸钙,硫酸钙是微溶物,能覆盖在碳酸钙表面,阻止反应进一步进行,即将盐酸改为相同物质的量浓度的硫酸时,反应速率将减慢,故A错误;,故B正确;加入少量固体不能改变反应物浓度,不能改变反应速率,故C错误;,该速率是用表示该反应在1min内的平均速率,不为瞬时速率,故D错误。
5.答案:B
解析:氢氧燃料电池工作时,通入氢气的一极(a极)为原电池的负极,发生氧化反应,故A正确;通入氧气的一极(b极)为原电池的正极,发生还原反应:,故B错误;氢氧燃料电池的总反应为,故C正确;溶液中向负极移动,向正极移动,故D正确。
6.答案:B
解析:含有金属元素的化合物不一定是离子化合物,如是共价化合物,故①错误;第ⅠA族和第ⅦA族的元素化合时,不一定形成离子键,也可能形成共价键,如HCl,故②错误;含有离子键的化合物为离子化合物,故③正确;共价化合物、离子化合物中也可能含有非极性键,如乙醇中的C一C键,过氧化钠中的O一O键,故④错误;离子化合物中一定含有离子键,可能含有共价键,故⑤正确;故B项正确。
7.答案:D
解析:共价化合物中不含离子键,故A错误;离子化合物中一定含有离子键,可能含有共价键,如NaOH,故B错误;有些共价化合物在水溶液里能电离出自由移动的阴、阳离子,如HCl,故C错误;离子化合物在熔融状态能电离出可自由移动的离子,而共价化合物在熔融状态不能电离出自由移动的离子,故D正确。
8.答案:B
解析:当=2时,反应达平衡状态,A项错误;恒容条件下,当气体质量不变时,反应达平衡状态,此时气体的密度不再发生变化,B项正确;该反应反应前后气体体积不变,在容器内的气体的压强不变,无法判断是否达平衡状态,C项错误;和均为产物,二者物质的量之比始终不变,D项错误。
9.答案:B
解析:B.Zn板的目的是增大与空气的接触面积,提高反应速率,故A正确;B.Zn电极为负极,由于是碱性环境,电极反应式为,故B错误;C.原电池工作时,阳离子向正极(石墨电极)移动,故C正确;D.外电路电子由负极经导线一电流表一正极,即电子由Zn电极流向石墨电极,故D正确;故选:B。
10.答案:A
解析:放电时,正极反应为,所以正极a附近溶液的pH将不断增大,A正确;根据电池总反应可知,C溶液中的溶质不含镁离子,故B错误;负极反应式为,故C错误;a电极发生还原反应,电极反应为,所以每转移0.2mol电子,理论上生成0.1mol ,故D错误。
11.答案:D
解析:正极上发生还原反应:电极反应式为,A项错误;由于电解质溶液中含有大量,故放电时,在交换膜左侧溶液中与反应生成大量AgCl沉淀,B项错误;用NaCl溶液代替盐酸,电池总反应不变,故C项错误;当电路中转移0.01 mol 时,交换膜左侧溶液中产生0.01 mol ,与盐酸反应产生0.01 mol AgCl沉淀,同时约有0.01 mol 通过阳离子交换膜转移到右侧溶液中,故左侧溶液中约减少0.02 mol离子,D项正确。
12.答案:B
解析:结合图示可知放电时负极的电极反应式为,A项正确;b极为正极,发生还原反应,B项错误;电路中转移1 mol电子时,向a极和b极分别移动1 mol 和1 mol ,则模拟海水理论上可除盐58.5 g,C项正确;电池工作时负极产生,正极产生,结合正、负极的电极反应知,一段时间后,正极和负极产生气体的物质的量之比为2:1,D项正确。
13.答案:C
解析:锂(Li)-空气电池中,锂为负极,发生氧化反应, A项正确;负极的电极反应式为,生成的向正极移动,B项正确;通入空气的一极为正极,正极的电极反应为,C项错误;把正、负极的电极反应相加可得电池总反应:,D项正确。
14.答案:D
解析:电池放电时,向负极移动,向正极移动,A、B项正确;放电时,正极得电子被还原生成单质C,即电极反应式为,C项正确、D项错误。
15.答案:B
解析:对于反应,反应前后气体分子数相等,缩小反应容器体积,平衡不移动,正逆反应速率增大相同的倍数,A项错误;碳的质量不变,说明正、逆反应速率相等,反应已达平衡状态,B项正确;恒温恒容条件下,若A、C同时为气体,当压强不变时,也能说明反应达到平衡状态,C项错误;反应在恒压条件下进行,则气体的压强始终不变,D项错误。
16.答案:A
解析:单位时间内生成 mol NO的同时,消耗mol ,均表示的是正反应速率,不能说明反应达到平衡状态,B项错误;达到化学平衡状态时,若增大容器的体积,各气体物质的浓度均减小,正、逆反应速率均减小,C项错误;不同物质表示化学反应速率之比等于对应物质的化学计量数之比,应为,D项错误。
17.答案:BD
解析:反应在恒温、恒压条件下进行,所以起始时和达到平衡状态时容器中的压强比为1:1,A项正确;A和B的起始的物质的量都是1 mol,所以A、B的转化率之比等于参加反应的物质的量之比,根据反应的化学方程式可知,物质A、B的转化率之比一定是1:2,B项错误;由化学方程式可知,生成mol C时,消耗 mol A,则达到平衡状态时A的物质的量为,C项正确;根据化学方程式可知,当时,正、逆反应速率不相等,反应没有达到平衡状态,D项错误。
18.答案:BC
解析:A.根据非金属性越强,其气态氢化物越稳定,则Y、R两种元素的气态氢化物的稳定性:,故A错误;
B.根据同电子层结构核多径小得到简单离子的半径:,故B正确;
C.N的氧化物为二氧化硅、Z的最高价氧化物对应的水化物为氢氧化钠,氢氧化钠和二氧化硅反应生成硅酸钠和水,故C正确;
D.Z与X两种元素形成的化合物中氧化钠是碱性氧化物,而过氧化钠是过氧化物,故D错误。
故选BC。
19.答案:Ⅰ.(1)③;④
(2)①②40~50s;该反应是放热反应,该段时间内温度较高③90~100s;盐酸浓度降低,反应速率减小
(3)AC
Ⅱ.(1)反应产生气泡快慢或反应完成的先后或试管壁的冷热程度使阴离子相同,排除阴离子不同造成的干扰通过活塞的移动观察,相同时间内产生气体量的多少
(2)收集40mL气体所需要的时间
解析:Ⅰ.(1)探究温度对该反应速率的影响,则锌规格以及盐酸的浓度应该是一样的,所以实验①和③作为对照;探究锌规格(粗、细)对该反应速率的影响,要求实验温度以及盐酸的浓度是相等的,所以实验①和④作为对照。
(2)①在30~40s范围内生成氢气的物质的量为,则消耗HCl的物质的量是0.014mol,其浓度是,所以在30~40s范围内盐酸的平均反应速率。②相同时间段内,产生的氢气的体积越大,反应速率越快,所以反应速率最大的时间段是40~50s,可能原因是反应放热,温度高,反应速率快。③相同时间段内,产生的氢气的体积越小,反应速率越慢,所以反应速率最小的时间段是90~100s,可能原因是反应进行过程中,盐酸浓度减小,反应速率变慢。
(3)在盐酸中加入蒸馏水,氢离子浓度降低,反应速率减小,但产生的氢气量不变,A正确;在盐酸中加入溶液,溶液中相当于有了硝酸,硝酸与锌反应生成NO,B错误;加入NaCl溶液相当于将盐酸稀释,盐酸中氢离子浓度减小,所以速率减慢,C正确;在反应中加入硫酸铜溶液,则金属锌会置换出金属铜,形成原电池,会加快反应速率,D错误;在盐酸中加入碳酸钠溶液,碳酸钠与盐酸发生反应,氢离子浓度降低,反应速率减小,且产生的氢气体积也减小,E错误。
Ⅱ.(1)定性解题思路:该反应中产生气体,所以可根据生成气泡的快慢判断。由于阴离子也可能会对反应速率产生影响,所以将改为可以控制阴离子相同,排除阴离子不同造成的干扰;同时,如利用乙图装置,通过测量相同时间内产生气体的量也可判断催化效果。(2)定量解题思路:实验中需要测量的数据是收集40mL气体所需要的时间。
20.答案:(1)50;10
(2)
(3)溶液的pH对该反应的反应速率有影响[或在一定条件下,越大,反应速率越快]
(4)往反应混合液中加入少量固体,控制其他反应条件与实验①相同,进行对比实验
解析:(1)溶液总体积为100mL,控制溶液初始浓度相同,则=50,=100-40-50=10。
(2)草酸与酸性高锰酸钾发生氧化还原反应,生成锰离子、二氧化碳和水,反应的离子方程式为。
(4)控制其他反应条件与实验①相同,往反应混合液中加入少量固体,若反应混合液褪色时间小于实验①中的,则对该反应起催化作用(若褪色时间相同,则对该反应无催化作用)。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
