2024-2025学年高中化学鲁科版必修2课时作业 第一章第1节 原子结构与元素性质(含解析)
文档属性
| 名称 | 2024-2025学年高中化学鲁科版必修2课时作业 第一章第1节 原子结构与元素性质(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-05 18:43:49 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2024-2025学年高中化学鲁科版必修2课时作业 第1章第1节 原子结构与元素性质
一、单选题(每题3分,共42分)
1.Pu和均是放射性元素,下列有关同位素热源:和的说法错误的是( )
A.的中子数为126 B.的质量数为238
C.的核外电子数为210 D.与互为同位素
2.1996年科学家在宇宙深处发现了离子和分子,和具有不同的( )
A.原子数 B.质子数 C.电子数 D.中子数
3.是一种重要的核燃料,下列有关说法不正确的是( )
A.核电荷数为92 B.质量数为327
C.核外电子数为92 D.中子数143
4.化学上用符号表示原子的组成。已知和的核外电子排布完全相同,则下列关系正确的是( )
A. B.
C. D.
5.我国在可控核聚变研究上处于世界领先水平,其反应为。下列说法错误的是( )
A.原子符号可以表示为T B.是两种不同的核素
C.的中子数为2 D.粒子的质量相同
6.Se是人体必需的微量元素。下列关于和的说法正确的是( )
A.和都含有34个中子
B.和含有不同的电子数
C.和互为同位素
D.和分别含有44个和46个质子
7.下列关于和说法正确的是( )
A.和互称为同位素
B.和是同种核素
C.
D.通过化学变化可以实现与间的转化
8.下列关于电子排布的说法正确的是( )
A.核外电子总是先排满K层再排L层,排满L层再排M层
B.在多电子的原子中,能量高的电子通常在离核近的区域内运动
C.核外电子总是先排在能量高的电子层上
D.某原子M层电子数为L层电子数的4倍
9.下列各组是元素的原子结构示意图,有相似化学性质的一对元素是( )
A. B.
C. D.
10.下列关于核外电子排布的说法正确的是( )
A.除最外层外,原子各电子层上的电子数均已达
B.除氦外的稀有气体原子的最外层电子数均为8
C.微粒的最外层只能是8个电子才稳定
D.最多可容纳8个电子的电子层一定是第二电子层
11.A元素的原子最外层电子数是a,次外层电子数是b;B元素原子的M层(有电子)电子数是a-b,L层电子数是a+b,则A、B两元素形成物质的化学式可表示为( )
A.BA B. C. D.
12.下列叙述正确的是( )
A.若两粒子的核外电子排布完全相同,则其化学性质一定相同
B.凡是单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.如果两原子的核外电子排布相同,那么它们一定属于同种元素
D.非金属元素的最外层电子数一定不小于4
13.某粒子的结构示意图如图所示,下列关于该粒子的说法错误的是( )
A.核电荷数为16 B.核外有三个电子层
C.该粒子已形成相对稳定的结构 D.该粒子对应的元素为金属元素
14.最近,中国科学院核化学研究室科研人员自主研发出分离纯化工艺和发生器制备技术,并测得的半衰期为271天。已知:质量数相同,质子数不同的原子互为同量素;半衰期指质量减少一半所需要的时间。下列说法正确的是( )
A.和互为同位素
B.和互为同量素
C.的中子数与质子数之差为6
D.衰变813天时剩余的质量为
二、解答题(共4题,58分)
15.原子的表示。
(1)通常用表示一个原子,其中A表示_________,Z表示_________。
(2)补全下表。
微粒符号 质子数 中子数 质量数 核外电子数
8 8
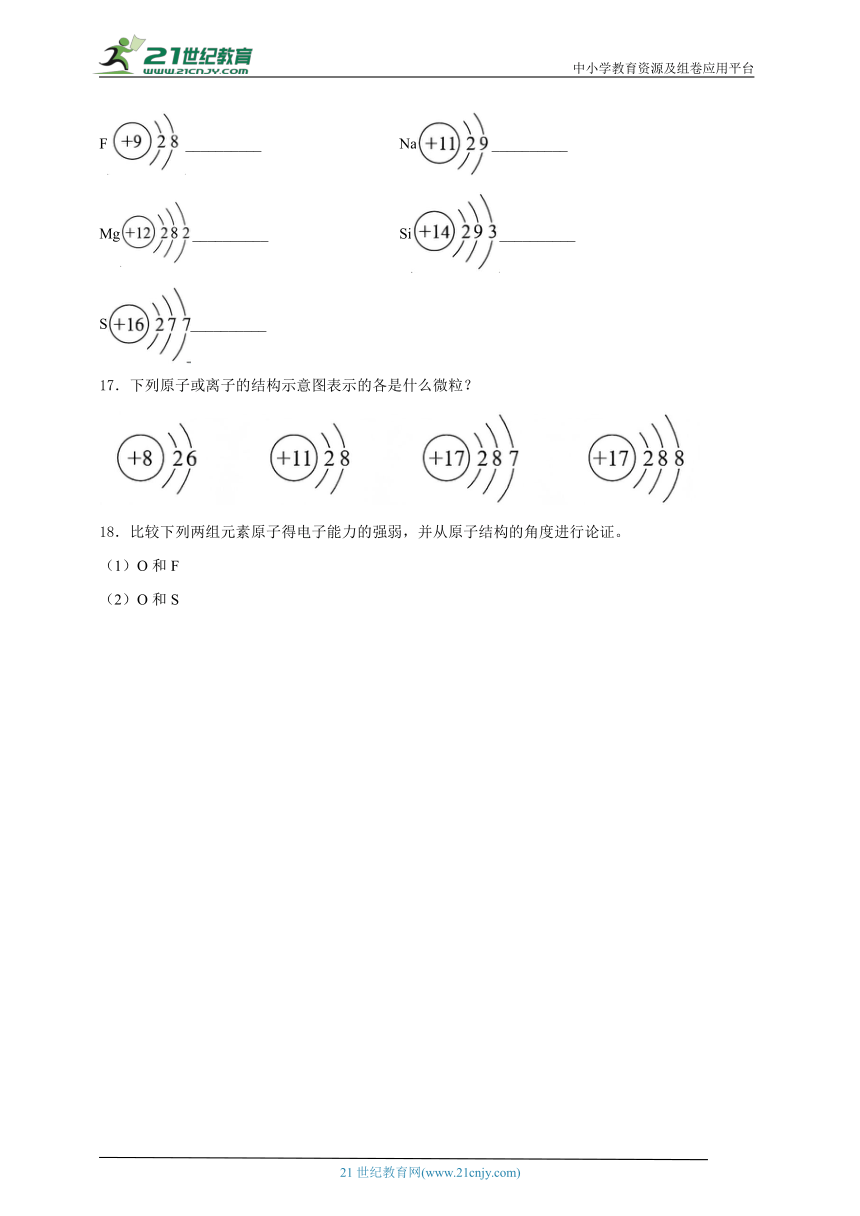
16.下列原子结构示意图是否正确?如有错误,指出错误的原因并改正。
F__________ Na__________
Mg__________ Si__________
S__________
17.下列原子或离子的结构示意图表示的各是什么微粒?
18.比较下列两组元素原子得电子能力的强弱,并从原子结构的角度进行论证。
(1)O和F
(2)O和S
参考答案
1.答案:C
解析:A.的中子数=210-84=126,A正确;
B.的质量数为238,B正确;
C.核外电子数为84,C错误;
D.与的质子数相同、质量数不同,互为同位素,D正确;
故选C。
2.答案:C
解析:1个氢原子含有1个质子、0个中子和1个电子,因此1个含有3个氢原子,并带有1个单位的正电荷,因此1个共带有3个质子、0个中子和2个电子,1个分子中带有3个原子、3个质子、0个中子和3个电子;则和具有不同电子数;
答案为C。
3.答案:B
解析:中质子数为92,且原子的质子数=原子序数=核电荷数=核外电子数,故原子序数=核电荷数=核外电子数=92,质量数为235,中子数=质量数-质子数=235-92=143,据此解题思路解答。
A.核电荷数为92,故A正确;
B.质量数为235,故B错误;
C.核外电子数为92,故C正确;
D.中子数为143,故D正确。
答案选B。
4.答案:C
解析:微粒符号左下角字母表示质子数,左上角字母表示质量数,则中质子数为a,质量数为b,阳离子的电子数=质子数-阳离子所带电荷数,则的电子数为;阴离子的电子数=质子数+阴离子所带电荷数的电子数为,又因为二者核外电子排布完全相同,即核外电子数相等,则有。
5.答案:D
解析:A(√)的中子数为,原子符号可以表示为T。
B(√)具有相同的质子数,但中子数不同,是两种不同的核素。
C(√)的质量数为4,质子数为2,中子数=质量数-质子数=4-2=2。
D(×)粒子的质量数分别为2、3,两者的质量不同。
6.答案:C
解析:A(×)D(×)微粒符号的左下角数字表示质子数,左上角数字表示质量数,则和的质子数均是34,质量数分别为78、80,中子数分别是。
B(×)原子的质于数等于核外电子数,和含有相同的电子数,均为34。
C(√)和的质子数相同,中子数不同,二者互为同位素。
7.答案:A
解析:A.与质子数相同,中子数不同,互为同位素,故A正确;
故答案选A。
8.答案:A
解析:A(√)核外电子一般总是先从内层排起,当一层充满后再填充下一层,用K、L、M、N、O、P、Q来表示从内到外的电子层,故核外电子总是先排满K层再排L层,排满L层再排M层。
B(×)在多电子的原子中,能量高的电子通常在离核远的区域内运动。
C(×)核外电子总是先排在能量低的电子层上。
D(×)若有M层,则L层一定排满电子,L层最多可以排8个电子,而M层最多容纳18个电子(不是L层电子数的4倍),若M层作为最外层,最多排8个电子(不是L层电子数的4倍)。
9.答案:A
解析:A(√)质子数为2的是氦原子,质子数为18的是氩原子,二者都是稀有气体元素,化学性质稳定,具有相似的化学性质。
B(×)质子数为2的是氦原子,化学性质稳定:而质子数为12的是镁原子,其最外层电子数为2,易失去最外层的2个电子形成稳定结构,二者化学性质不同。
C(×)质子数为9的是氟原子,其最外层有7个电子,极易得到1个电子而形成稳定结构:质子数为7的是氨原子,最外层有5个电子,易得到3个电子而形成稳定结构;二者化学性质不同。
D(×)质子数为10的原子是氖原子,最外层电子达到8电子稳定结构,性质稳定;质子数为8的是氧原子,最外层电子数为6,易得到2个电子形成稳定结构,二者化学性质不同。
10.答案:B
解析:A(×)原子各电子层上的电子数最多为,比如M层最多可以排18个电子,但不一定排满18。
B(√)氦的最外层电子数是2,其他稀有气体原子的最外层电子数均为8。
C(×)氢原子、氦原子的最外层达到2个电子时是稳定结构。
D(×)由于最外层电子数不超过8,因此最多可容纳8个电子的电子层不一定是第二电子层。
11.答案:B
解析:由“B元素原子的M层(有电子)电子数是”得,又“L层电子数是”,说明B元素原子排了三层,且。由“A元素的原子最外层电子数是a,次外层电子数是b”知b=2,则a=6。故A元素原子结构示意图为26,A是O;B元素原子结构示意图为,B是Si。A、B两元素形成的物质为,B符合题意。
12.答案:C
解析:A(×)两种微粒核外电子排布完全相同,可能是两种离子,如和,其化学性质不相同。
B(×)由单原子形成的离子,不一定具有稀有气体元素原子核外电子排布,如。
C(√)原子中电子数=质子数,又元素是具有相同质子数的一类原子,所以两原子如果核外电子排布相同,则一定属于同种元素。
D(×)一般非金属元素的最外层电子数都大于或等于4,但H的最外层电子数为1,B的最外层电子数为3。
13.答案:D
解析:A(√)该微粒的质子数=核电荷数=16。
B(√)根据粒子的结构示意图知,该粒子核外有三个电子层。
B(√)该粒子的最外层有8个电子,已形成相对稳定的结构。
D(×)该粒子对应的元素为16号元素S,属于非金属元素。
14.答案:C
解析:A(×)和的质量数相同,质子数不同,互为同量素。
B(×)和的质子数相同,质量数不同,即中子数不同,互为同位素。
C(√)的中子数为,则其中子数与质子数之差为。
D(×)的半衰期为271天,衰变813天时剩余的质量为。
15.答案:(1)质量数;质子数
(2)
微粒符号 质子数 中子数 质量数 核外电子数
6 6 12 6
16 8
8 10 18 8
解析:
16.答案:原子的质子数与其核外电子数相等,氟原子的结构示意图为:最外层电子数不超过8,钠原子的结构示意图为;镁原子结构示意图正确:每个电子层最多容纳的电子数为,第2层最多容纳8个电子,硅原子的结构示意图为;硫原子的结构示意图为。
解析:
17.答案:表示O;表示;表示Cl;表示。
解析:
18.答案:(1)原子得电子能力:O(2)原子得电子能力:O>S。因为虽然氧原子和硫原子的最外层电子数相同,均为6,但氧原子比硫原子少一个电子层,氧原子半径小于硫原子半径,氧原子核对最外层电子的吸引力比硫原子核对最外层电子的吸引力强,所以原子得电子能力:O>S。
解析:
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
2024-2025学年高中化学鲁科版必修2课时作业 第1章第1节 原子结构与元素性质
一、单选题(每题3分,共42分)
1.Pu和均是放射性元素,下列有关同位素热源:和的说法错误的是( )
A.的中子数为126 B.的质量数为238
C.的核外电子数为210 D.与互为同位素
2.1996年科学家在宇宙深处发现了离子和分子,和具有不同的( )
A.原子数 B.质子数 C.电子数 D.中子数
3.是一种重要的核燃料,下列有关说法不正确的是( )
A.核电荷数为92 B.质量数为327
C.核外电子数为92 D.中子数143
4.化学上用符号表示原子的组成。已知和的核外电子排布完全相同,则下列关系正确的是( )
A. B.
C. D.
5.我国在可控核聚变研究上处于世界领先水平,其反应为。下列说法错误的是( )
A.原子符号可以表示为T B.是两种不同的核素
C.的中子数为2 D.粒子的质量相同
6.Se是人体必需的微量元素。下列关于和的说法正确的是( )
A.和都含有34个中子
B.和含有不同的电子数
C.和互为同位素
D.和分别含有44个和46个质子
7.下列关于和说法正确的是( )
A.和互称为同位素
B.和是同种核素
C.
D.通过化学变化可以实现与间的转化
8.下列关于电子排布的说法正确的是( )
A.核外电子总是先排满K层再排L层,排满L层再排M层
B.在多电子的原子中,能量高的电子通常在离核近的区域内运动
C.核外电子总是先排在能量高的电子层上
D.某原子M层电子数为L层电子数的4倍
9.下列各组是元素的原子结构示意图,有相似化学性质的一对元素是( )
A. B.
C. D.
10.下列关于核外电子排布的说法正确的是( )
A.除最外层外,原子各电子层上的电子数均已达
B.除氦外的稀有气体原子的最外层电子数均为8
C.微粒的最外层只能是8个电子才稳定
D.最多可容纳8个电子的电子层一定是第二电子层
11.A元素的原子最外层电子数是a,次外层电子数是b;B元素原子的M层(有电子)电子数是a-b,L层电子数是a+b,则A、B两元素形成物质的化学式可表示为( )
A.BA B. C. D.
12.下列叙述正确的是( )
A.若两粒子的核外电子排布完全相同,则其化学性质一定相同
B.凡是单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.如果两原子的核外电子排布相同,那么它们一定属于同种元素
D.非金属元素的最外层电子数一定不小于4
13.某粒子的结构示意图如图所示,下列关于该粒子的说法错误的是( )
A.核电荷数为16 B.核外有三个电子层
C.该粒子已形成相对稳定的结构 D.该粒子对应的元素为金属元素
14.最近,中国科学院核化学研究室科研人员自主研发出分离纯化工艺和发生器制备技术,并测得的半衰期为271天。已知:质量数相同,质子数不同的原子互为同量素;半衰期指质量减少一半所需要的时间。下列说法正确的是( )
A.和互为同位素
B.和互为同量素
C.的中子数与质子数之差为6
D.衰变813天时剩余的质量为
二、解答题(共4题,58分)
15.原子的表示。
(1)通常用表示一个原子,其中A表示_________,Z表示_________。
(2)补全下表。
微粒符号 质子数 中子数 质量数 核外电子数
8 8
16.下列原子结构示意图是否正确?如有错误,指出错误的原因并改正。
F__________ Na__________
Mg__________ Si__________
S__________
17.下列原子或离子的结构示意图表示的各是什么微粒?
18.比较下列两组元素原子得电子能力的强弱,并从原子结构的角度进行论证。
(1)O和F
(2)O和S
参考答案
1.答案:C
解析:A.的中子数=210-84=126,A正确;
B.的质量数为238,B正确;
C.核外电子数为84,C错误;
D.与的质子数相同、质量数不同,互为同位素,D正确;
故选C。
2.答案:C
解析:1个氢原子含有1个质子、0个中子和1个电子,因此1个含有3个氢原子,并带有1个单位的正电荷,因此1个共带有3个质子、0个中子和2个电子,1个分子中带有3个原子、3个质子、0个中子和3个电子;则和具有不同电子数;
答案为C。
3.答案:B
解析:中质子数为92,且原子的质子数=原子序数=核电荷数=核外电子数,故原子序数=核电荷数=核外电子数=92,质量数为235,中子数=质量数-质子数=235-92=143,据此解题思路解答。
A.核电荷数为92,故A正确;
B.质量数为235,故B错误;
C.核外电子数为92,故C正确;
D.中子数为143,故D正确。
答案选B。
4.答案:C
解析:微粒符号左下角字母表示质子数,左上角字母表示质量数,则中质子数为a,质量数为b,阳离子的电子数=质子数-阳离子所带电荷数,则的电子数为;阴离子的电子数=质子数+阴离子所带电荷数的电子数为,又因为二者核外电子排布完全相同,即核外电子数相等,则有。
5.答案:D
解析:A(√)的中子数为,原子符号可以表示为T。
B(√)具有相同的质子数,但中子数不同,是两种不同的核素。
C(√)的质量数为4,质子数为2,中子数=质量数-质子数=4-2=2。
D(×)粒子的质量数分别为2、3,两者的质量不同。
6.答案:C
解析:A(×)D(×)微粒符号的左下角数字表示质子数,左上角数字表示质量数,则和的质子数均是34,质量数分别为78、80,中子数分别是。
B(×)原子的质于数等于核外电子数,和含有相同的电子数,均为34。
C(√)和的质子数相同,中子数不同,二者互为同位素。
7.答案:A
解析:A.与质子数相同,中子数不同,互为同位素,故A正确;
故答案选A。
8.答案:A
解析:A(√)核外电子一般总是先从内层排起,当一层充满后再填充下一层,用K、L、M、N、O、P、Q来表示从内到外的电子层,故核外电子总是先排满K层再排L层,排满L层再排M层。
B(×)在多电子的原子中,能量高的电子通常在离核远的区域内运动。
C(×)核外电子总是先排在能量低的电子层上。
D(×)若有M层,则L层一定排满电子,L层最多可以排8个电子,而M层最多容纳18个电子(不是L层电子数的4倍),若M层作为最外层,最多排8个电子(不是L层电子数的4倍)。
9.答案:A
解析:A(√)质子数为2的是氦原子,质子数为18的是氩原子,二者都是稀有气体元素,化学性质稳定,具有相似的化学性质。
B(×)质子数为2的是氦原子,化学性质稳定:而质子数为12的是镁原子,其最外层电子数为2,易失去最外层的2个电子形成稳定结构,二者化学性质不同。
C(×)质子数为9的是氟原子,其最外层有7个电子,极易得到1个电子而形成稳定结构:质子数为7的是氨原子,最外层有5个电子,易得到3个电子而形成稳定结构;二者化学性质不同。
D(×)质子数为10的原子是氖原子,最外层电子达到8电子稳定结构,性质稳定;质子数为8的是氧原子,最外层电子数为6,易得到2个电子形成稳定结构,二者化学性质不同。
10.答案:B
解析:A(×)原子各电子层上的电子数最多为,比如M层最多可以排18个电子,但不一定排满18。
B(√)氦的最外层电子数是2,其他稀有气体原子的最外层电子数均为8。
C(×)氢原子、氦原子的最外层达到2个电子时是稳定结构。
D(×)由于最外层电子数不超过8,因此最多可容纳8个电子的电子层不一定是第二电子层。
11.答案:B
解析:由“B元素原子的M层(有电子)电子数是”得,又“L层电子数是”,说明B元素原子排了三层,且。由“A元素的原子最外层电子数是a,次外层电子数是b”知b=2,则a=6。故A元素原子结构示意图为26,A是O;B元素原子结构示意图为,B是Si。A、B两元素形成的物质为,B符合题意。
12.答案:C
解析:A(×)两种微粒核外电子排布完全相同,可能是两种离子,如和,其化学性质不相同。
B(×)由单原子形成的离子,不一定具有稀有气体元素原子核外电子排布,如。
C(√)原子中电子数=质子数,又元素是具有相同质子数的一类原子,所以两原子如果核外电子排布相同,则一定属于同种元素。
D(×)一般非金属元素的最外层电子数都大于或等于4,但H的最外层电子数为1,B的最外层电子数为3。
13.答案:D
解析:A(√)该微粒的质子数=核电荷数=16。
B(√)根据粒子的结构示意图知,该粒子核外有三个电子层。
B(√)该粒子的最外层有8个电子,已形成相对稳定的结构。
D(×)该粒子对应的元素为16号元素S,属于非金属元素。
14.答案:C
解析:A(×)和的质量数相同,质子数不同,互为同量素。
B(×)和的质子数相同,质量数不同,即中子数不同,互为同位素。
C(√)的中子数为,则其中子数与质子数之差为。
D(×)的半衰期为271天,衰变813天时剩余的质量为。
15.答案:(1)质量数;质子数
(2)
微粒符号 质子数 中子数 质量数 核外电子数
6 6 12 6
16 8
8 10 18 8
解析:
16.答案:原子的质子数与其核外电子数相等,氟原子的结构示意图为:最外层电子数不超过8,钠原子的结构示意图为;镁原子结构示意图正确:每个电子层最多容纳的电子数为,第2层最多容纳8个电子,硅原子的结构示意图为;硫原子的结构示意图为。
解析:
17.答案:表示O;表示;表示Cl;表示。
解析:
18.答案:(1)原子得电子能力:O
解析:
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
