2024-2025学年高中化学人教版必修2课时作业 第五章第一节 硫及其化合物
文档属性
| 名称 | 2024-2025学年高中化学人教版必修2课时作业 第五章第一节 硫及其化合物 |  | |
| 格式 | doc | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-05 18:51:53 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024-2025学年高中化学人教版必修2课时作业 第五章第一节 硫及其化合物
一、单选题(每题3分,共42分)
1.某溶液中可能含有的阴离子有、、等。为了检验其中是否含有,除溶液外,还需要的溶液是( )
A.盐酸 B.硫酸 C.硝酸 D.硫酸钠溶液
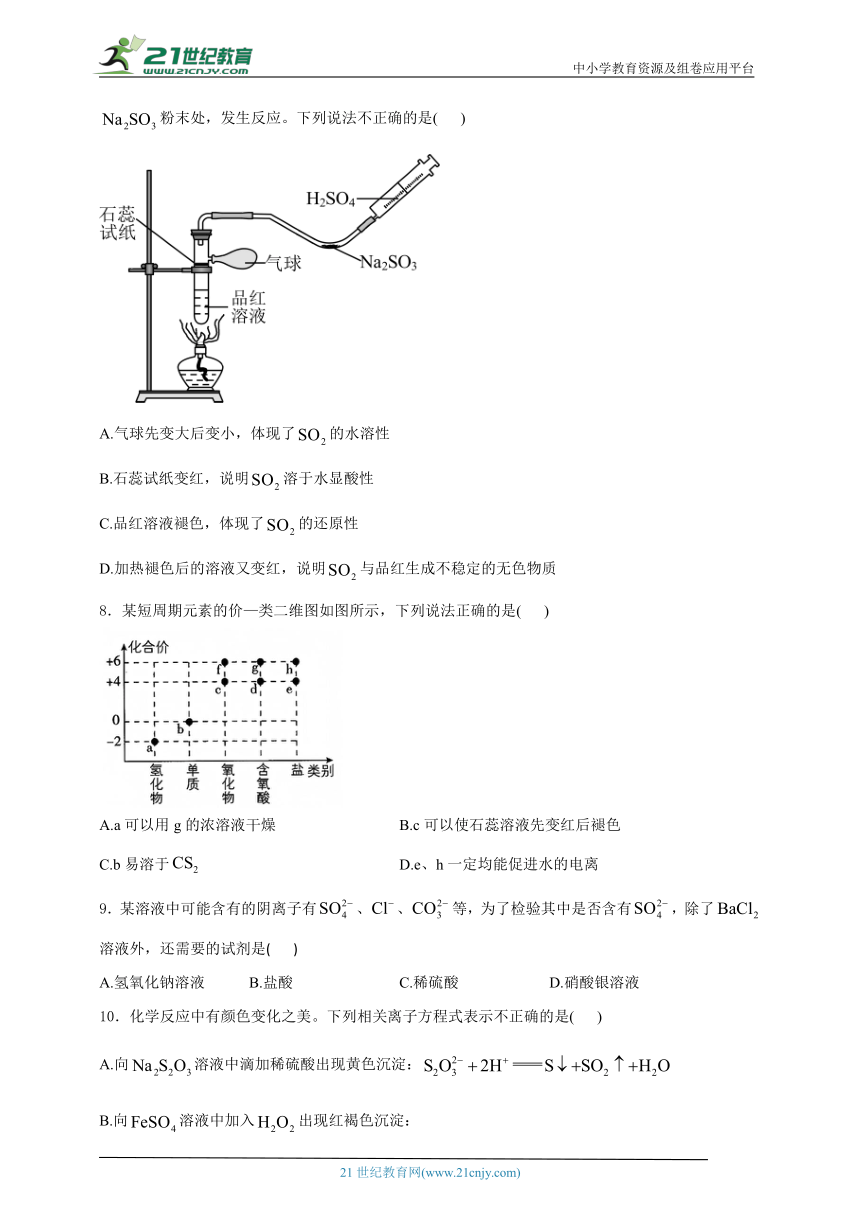
2.某小组同学探究与新制的反应的实验装置如图所示:
下列说法不正确的是( )
A.配制70%硫酸溶液需要用到的仪器有烧杯、量筒、玻璃棒、胶头滴管
B.装置B的作用是监控流速,其中试剂可以用饱和溶液
C.反应开始时装置C中出现砖红色沉淀,氧化剂和还原剂的物质的量之比为2:1
D.反应后向装置C的溶液中加入稀盐酸酸化后,再滴加溶液,有白色沉淀生成,证明反应中作还原剂
3.按如图装置进行实验。将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是( )
A.Ⅰ中试管内的反应,体现的氧化性
B.Ⅱ中品红溶液褪色,体现的还原性
C.在Ⅰ和Ⅲ的试管中,都出现了浑浊现象
D.撤掉水浴,重做实验,Ⅳ中红色更快褪去
4.关于硫的化合物的下列反应中,离子方程式正确的是( )
A.将通入NaClO溶液中:
B.向硫酸铜溶液中加入NaHS溶液生成黑色沉淀:
C.向硫代硫酸钠溶液中加入硫酸:
D.水垢中用溶液处理:
5.LiBr溶液可作为替代氟利昂的绿色制冷剂。合成工艺流程如下:
下列说法错误的是
A.还原工序逸出的用NaOH溶液吸收,吸收液不可直接返回还原工序
B.除杂工序中产生的滤渣可用进行组分分离
C.中和工序中生成的气体为酸性氧化物
D.若BaS和恰好完全反应,则理论上参与反应的为1:1:2
6.表示阿伏加德罗常数的值,关于硫代硫酸钠和稀硫酸的反应,下列说法中错误的是( )
A.1 mol硫代硫酸钠固体中阴阳离子总数为
B.的溶液中数目为
C.和混合物中硫原子数目为
D.标准状况下,生成时,理论上转移的电子数为
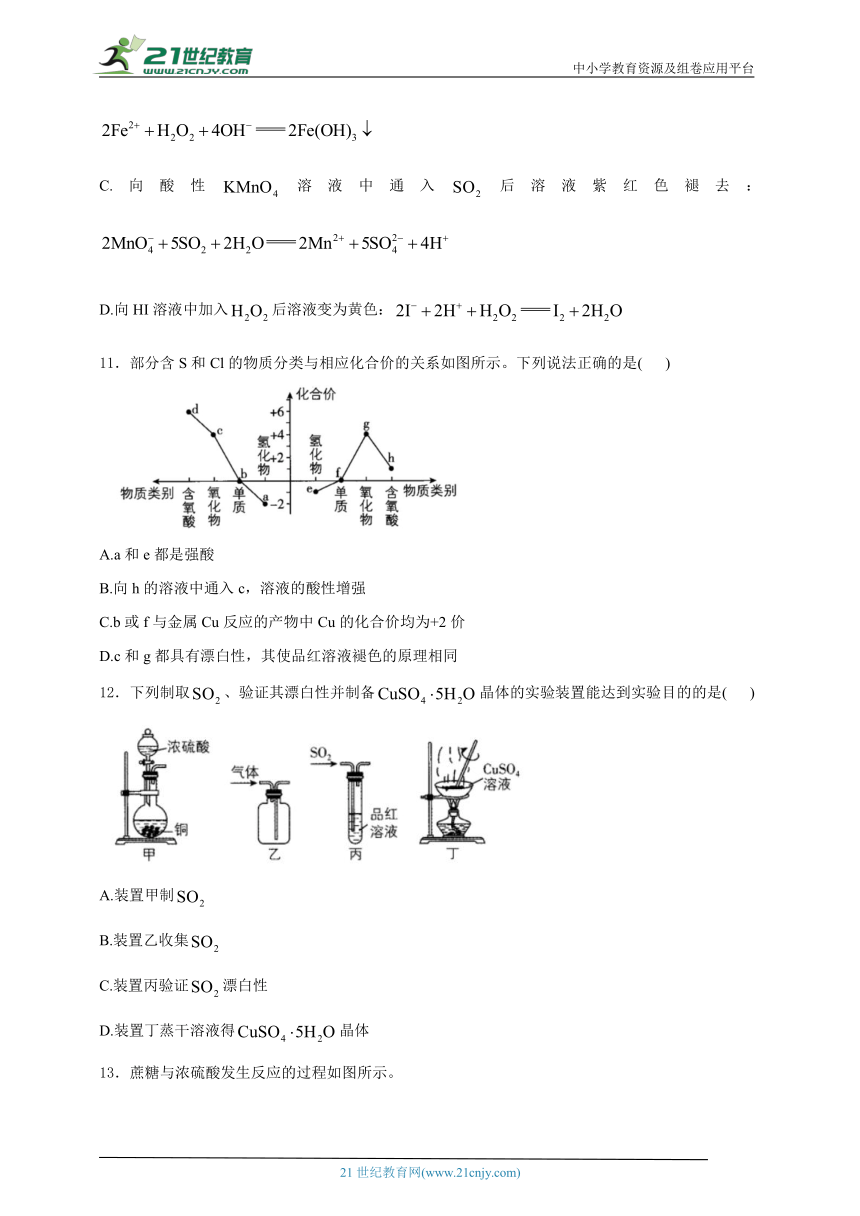
7.为研究二氧化硫的性质,某兴趣小组设计如图所示装置进行实验。将少量溶液缓慢推入粉末处,发生反应。下列说法不正确的是( )
A.气球先变大后变小,体现了的水溶性
B.石蕊试纸变红,说明溶于水显酸性
C.品红溶液褪色,体现了的还原性
D.加热褪色后的溶液又变红,说明与品红生成不稳定的无色物质
8.某短周期元素的价—类二维图如图所示,下列说法正确的是( )
A.a可以用g的浓溶液干燥 B.c可以使石蕊溶液先变红后褪色
C.b易溶于 D.e、h一定均能促进水的电离
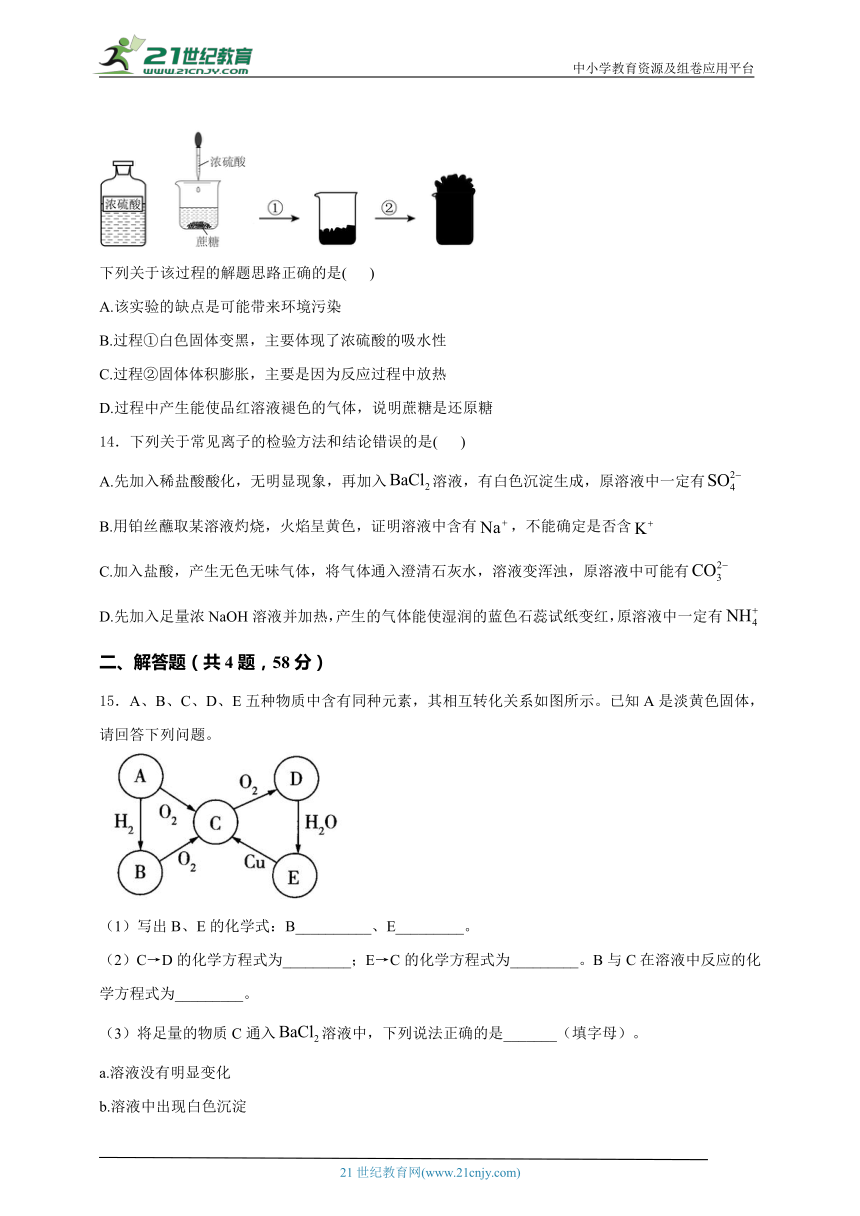
9.某溶液中可能含有的阴离子有、、等,为了检验其中是否含有,除了溶液外,还需要的试剂是( )
A.氢氧化钠溶液 B.盐酸 C.稀硫酸 D.硝酸银溶液
10.化学反应中有颜色变化之美。下列相关离子方程式表示不正确的是( )
A.向溶液中滴加稀硫酸出现黄色沉淀:
B.向溶液中加入出现红褐色沉淀:
C.向酸性溶液中通入后溶液紫红色褪去:
D.向HI溶液中加入后溶液变为黄色:
11.部分含S和Cl的物质分类与相应化合价的关系如图所示。下列说法正确的是( )
A.a和e都是强酸
B.向h的溶液中通入c,溶液的酸性增强
C.b或f与金属Cu反应的产物中Cu的化合价均为+2价
D.c和g都具有漂白性,其使品红溶液褪色的原理相同
12.下列制取、验证其漂白性并制备晶体的实验装置能达到实验目的的是( )
A.装置甲制
B.装置乙收集
C.装置丙验证漂白性
D.装置丁蒸干溶液得晶体
13.蔗糖与浓硫酸发生反应的过程如图所示。
下列关于该过程的解题思路正确的是( )
A.该实验的缺点是可能带来环境污染
B.过程①白色固体变黑,主要体现了浓硫酸的吸水性
C.过程②固体体积膨胀,主要是因为反应过程中放热
D.过程中产生能使品红溶液褪色的气体,说明蔗糖是还原糖
14.下列关于常见离子的检验方法和结论错误的是( )
A.先加入稀盐酸酸化,无明显现象,再加入溶液,有白色沉淀生成,原溶液中一定有
B.用铂丝蘸取某溶液灼烧,火焰呈黄色,证明溶液中含有,不能确定是否含
C.加入盐酸,产生无色无味气体,将气体通入澄清石灰水,溶液变浑浊,原溶液中可能有
D.先加入足量浓NaOH溶液并加热,产生的气体能使湿润的蓝色石蕊试纸变红,原溶液中一定有
二、解答题(共4题,58分)
15.A、B、C、D、E五种物质中含有同种元素,其相互转化关系如图所示。已知A是淡黄色固体,请回答下列问题。
(1)写出B、E的化学式:B__________、E_________。
(2)C→D的化学方程式为_________;E→C的化学方程式为_________。B与C在溶液中反应的化学方程式为_________。
(3)将足量的物质C通入溶液中,下列说法正确的是_______(填字母)。
a.溶液没有明显变化
b.溶液中出现白色沉淀
c.若继续通入,则溶液中出现白色沉淀
16.Ⅰ.浓硫酸具有:①难挥发性(高沸点);②酸性;③强氧化性;④吸水性;⑤脱水性
下列各项分别表现浓硫酸的什么性质,请将序号填于空白处:
(1)蔗糖中倒入浓硫酸,蔗糖变黑,体积膨胀,且有刺激性气味的气体产生,该实验现象表明浓硫酸具有_____。
(2)浓硫酸使蓝色的胆矾晶体变为白色,表现的性质是_____。
(3)浓硫酸与FeO反应,表现的性质是_____。
Ⅱ.(4)化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是 ________(填序号)
①过量的Zn与18硫酸溶液反应
②过量的氧气与少量的二氧化硫在催化剂存在和一定条件下充分反应
③过量的二氧化锰与浓盐酸反应
④过量的铜与浓硫酸反应
⑤过量的锌与稀盐酸反应
⑥过量的稀硫酸与块状石灰石反应
17.在化工生产中,硫资源应用广泛,利用含硫物质之间的转化有利于实现硫资源的综合利用。下图为硫及其化合物的“价—类”二维图。
请回答以下问题。
(1)从硫元素化合价变化的角度解题思路,图中既有氧化性又有还原性的物质有______,______(填化学式,任写两种)。
(2)写出Cu和Z的浓溶液发生反应的化学方程式__________________。
(3)将Y通入品红溶液中,可观察到的现象是______________________________。
(4)工业上处理废气时,通过步骤Ⅲ和步骤w将Y转化为再利用。
①实现步骤Ⅰ的转化所加试剂是______(写出一种即可)。
②实现步骤Ⅱ的转化可选择______试剂(填序号)。
A. B.KI C. D.
(5)欲制备,从氧化还原角度解题思路,合理的是______(填序号)。
A B. C. D.
(6)将与混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为______。
18.有一瓶澄清的无色溶液,其中可能含有、、、、、、、。取该溶液进行以下实验:
(1)由题干可知溶液中一定不存在___________(填离子符号,下同);用pH试纸检验,溶液呈强酸性,可以排除___________的存在。
(2)取出部分溶液滴加过量的NaOH溶液,只产生白色沉淀,则可证明___________(填离子符号)的存在,生成白色沉淀的离子方程式为___________。
(3)取出部分上述碱性溶液滴加溶液,有白色沉淀生成,证明___________(填离子符号,下同)的存在,同时可排除原溶液中___________的存在,产生白色沉淀的离子方程式为___________。
(4)根据上述实验事实可知原溶液中一定存在的离子有___________,不确定是否存在的离子有___________。
参考答案
1.答案:A
解析:硫酸根离子的检验原理:,先加入稀盐酸酸化,没有沉淀产生,然后加入溶液,产生白色沉淀,则证明有硫酸根离子,加稀盐酸酸化可以排除的干扰,因为也是一种不溶于水但能够与稀盐酸反应的白色沉淀;
故选A。
2.答案:D
解析:配制硫酸溶液需使用量筒和胶头滴管量取浓硫酸,需在烧杯中进行稀释,且稀释时需用玻璃棒搅拌,A项正确;装置B的作用是监控流速,由于在饱和溶液中的溶解度较小,故其中的试剂可以用饱和溶液,B项正确;反应开始时装置C中出现砖红色沉淀,说明发生反应生成了,其中为还原剂,被氧化为,为氧化剂,被还原为,结合得失电子守恒可知,氧化剂和还原剂的物质的量之比为2:1,C项正确;由于溶液能与稀盐酸酸化的溶液反应生成白色沉淀,故无法证明反应中作还原剂,D项错误。
3.答案:C
解析:Ⅰ中试管内发生反应,该反应中只有中硫元素的化合价发生变化,硫酸只体现酸性,没有体现氧化性,A项错误;二氧化硫使品红溶液褪色,体现的漂白性,B项错误;Ⅰ和Ⅱ中都反应生成硫沉淀,都会出现浑浊,C项正确;升高温度能加快反应速率,撤掉水浴,重做实验,温度降低,反应减慢,生成二氧化硫的速率减小,Ⅳ中红色褪去减慢,D项错误。
4.答案:D
解析:次氯酸具有强氧化性,生成物中S不会是+4价,A项错误;NaHS在离子方程式中用表示,正确的离子方程式是,B项错误;硫代硫酸钠为强电解质,正确的离子方程式是,C项错误;溶度积大的沉淀能转化为溶度积小的沉淀,微溶,离子方程式中用化学式表示,D项正确。
5.答案:D
解析:根据、知,参与反应的,D项错误。
6.答案:B
解析:的溶液,,则100 mL该溶液中,,B错误。
7.答案:C
解析:A.反应产生使气球变大,后来溶于水,气球变小,故气球先变大后变小,体现了的水溶性,A正确;
B.和水反应生成,电离出而使其溶液呈酸性使石蕊试纸变红,故B正确;
C.二氧化硫具有漂白性可以使品红溶液褪色,所以品红溶液中通入气体,品红溶液褪色,说明具有漂白性,但无法说明二氧化硫的还原性,C错误;
D.加热褪色后的溶液又变红,说明与品红生成不稳定的无色物质使品红褪色,加热后无色物质分解,溶液又变红,D正确;
本题选C。
8.答案:C
解析:a为,g为,浓硫酸可以氧化,不能干燥,A错误;c为,溶于水生成亚硫酸,可以使石蕊溶液变红,但不能漂白石蕊溶液,B错误;b为S单质,属于非极性分子,易溶于非极性溶剂,C正确;h为硫酸盐,当h为正盐时,硫酸根离子不水解,h不一定能促进水的电离,当h为酸式盐时,电离抑制水的电离,D错误。
9.答案:B
解析:硫酸根离子的检验原理:,先加入稀盐酸酸化,没有沉淀产生,然后加入溶液,产生白色沉淀,则证明有硫酸根离子,加稀盐酸酸化可以排除碳酸根离子的干扰,因为也是一种不溶于水但能够与稀盐酸反应的白色沉淀;氢氧化钠溶液与三种阴离子都不会反应,加稀硫酸会引入硫酸根,硝酸银与三种阴离子均产生白色沉淀,故ACD都不合题意;故选B。
10.答案:B
解析:在酸性条件下,会与反应生成和,离子方程式为,A正确;是强酸弱碱盐,其溶液呈弱酸性,因此离子方程式中不能出现,正确的离子方程式为,B错误;具有强还原性,能将还原为,自身被氧化为,根据氧化还原反应的基本规律可得离子方程式为,C正确;HI是强酸,在酸性条件下能将氧化为,离子方程式为,D正确。
11.答案:B
解析:a为,e为HCl,a是弱酸,e是强酸,A错误;h为,c为,溶液中通入发生反应:,溶液的酸性增强,B正确;b为S,f为,的氧化性较强,与Cu反应的产物为,的化合价为+2价,S的氧化性较弱,与Cu反应的产物为,的化合价为+1价,C错误;c为,g为,能与品红溶液反应生成无色物质,具有强氧化性,能将品红氧化,两者使品红溶液褪色的原理不同,D错误。
12.答案:C
解析:在加热条件下,Cu和浓硫酸才能反应生成,A错误;密度大于空气,应该用向上排空气法收集,气体应“长进短出”,B错误;与品红结合生成无色物质,体现了的漂白性,C正确;从硫酸铜溶液中获得晶体,应该采用蒸发浓缩、冷却结晶的方法,D错误。
13.答案:A
解析:浓硫酸具有脱水性,能够将蔗糖中H原子、O原子按2:1比例以的形式脱去,脱水过程中产生大量的热,同时还会发生反应:,产生的大量气体,使固体体积膨胀,据此解题思路解题。
A.由解题思路可知,该实验中可能产生,有毒,会污染环境,故该实验的缺点是可能带来环境污染,A正确;
B.过程①白色固体变黑,即浓硫酸将蔗糖中H原子、O原子按2∶1比例以的形式脱去,白色固体变黑,体现浓硫酸的脱水性,B错误;
C.浓硫酸脱水过程中产生大量的热,会发生反应:,产生的大量气体,使固体体积膨胀,故过程②固体体积膨胀,主要是因为反应过程中产生的大量气体,C错误;
D.由C项解题思路可知,过程中产生气体,该气体能使品红溶液褪色,但不能说明蔗糖是还原糖,D错误;
故答案为:A。
14.答案:D
解析:先加入稀盐酸酸化,无明显现象,排除了、等的干扰,再加入溶液,有白色沉淀生成,则原溶液中一定有,A正确;
的焰色呈黄色,的焰色呈紫色,紫色光会被黄色光遮盖,故B正确;
加入盐酸,产生无色无味气体,将气体通入澄清石灰水,溶液变浑浊,则原溶液中可能有,C正确;
先加入足量浓溶液并加热,若产生的气体能使湿润的红色石蕊试纸变蓝,则说明有氨气放出,原溶液中一定有,D错误。
15.答案:(1);
(2);;
(3)ac
解析:由A为淡黄色固体,并能与反应,可以判断A为硫单质,则B为,C为,D为,E为。
(3)与溶液不反应,通入后,将氧化成,与反应生成白色沉淀。
16.答案:(1)③⑤
(2)④
(3)②③
(4)②③④⑥
解析:
17.答案:(1)S;
(2)
(3)品红溶液褪色
(4)①CaO;②AC
(5)B
(6)1:2
解析:(1)从硫元素化合价变化的角度解题思路,图中既有氧化性又有还原性的物质应该处在S的中间价态,可以为S、;
(2)浓硫酸与Cu在加热条件下会发生氧化还原反应产生、、,化学方程式:;
(3)有漂白性,所以通入品红溶液中,可观察到的现象是:品红溶液褪色;
(4)①根据图示可知:步骤Ⅰ可以是被溶液吸收反应产生沉淀和,属于碱,也可以与CaO反应产生,CaO属于碱性氧化物;
②根据图示可知:步骤Ⅱ是转化为,在该转化过程中S元素化合价升高,失去电子被氧化,因此在转化过程中需要加入氧化剂,则:
A.与反应产生,A符合题意;
B.KI具有还原性,不能使转化为,B不符合题意;
C.具有还原性,具有强氧化性,可以使与反应产生、,C符合题意;
D.、都具有还原性,二者不能反应产生,D不符合题意;
故合理选项是AC;
(5)中硫的化合价为+2价,需要化合价高于+2价含硫的氧化剂和低于+2价含有硫的还原剂,只有B满足,故选B;
(6)与混合,可生成淡黄色固体,方程式为:,其中为氧化剂,为还原剂,则氧化剂与还原剂的物质的量之比为1:2。
18.答案:(1);
(2);
(3);;
(4);
解析:(1)由于是澄清的无色溶液,可排除黄色的的存在;用pH试纸检验,表明溶液呈强酸性,说明有氢离子,根据离子共存要求,则离子不能存在;
(2)取出部分溶液逐滴加入NaOH溶液,使溶液从酸性逐渐变为碱性,继续滴加NaOH溶液,有白色沉淀氢氧化镁产生,可证明的存在,产生白色沉淀的离子方程式为;
(3)取部分上述碱性溶液加溶液,有白色沉淀生成,证明的存在,因为原溶液为澄清溶液,又可以排除的存在,产生白色沉淀的离子方程式为;
(4)根据上述解题思路,溶液还应存在有阴离子,所以一定存在,根据上述解题思路和一定存在,无法确定的是,故答案为:;。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
2024-2025学年高中化学人教版必修2课时作业 第五章第一节 硫及其化合物
一、单选题(每题3分,共42分)
1.某溶液中可能含有的阴离子有、、等。为了检验其中是否含有,除溶液外,还需要的溶液是( )
A.盐酸 B.硫酸 C.硝酸 D.硫酸钠溶液
2.某小组同学探究与新制的反应的实验装置如图所示:
下列说法不正确的是( )
A.配制70%硫酸溶液需要用到的仪器有烧杯、量筒、玻璃棒、胶头滴管
B.装置B的作用是监控流速,其中试剂可以用饱和溶液
C.反应开始时装置C中出现砖红色沉淀,氧化剂和还原剂的物质的量之比为2:1
D.反应后向装置C的溶液中加入稀盐酸酸化后,再滴加溶液,有白色沉淀生成,证明反应中作还原剂
3.按如图装置进行实验。将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是( )
A.Ⅰ中试管内的反应,体现的氧化性
B.Ⅱ中品红溶液褪色,体现的还原性
C.在Ⅰ和Ⅲ的试管中,都出现了浑浊现象
D.撤掉水浴,重做实验,Ⅳ中红色更快褪去
4.关于硫的化合物的下列反应中,离子方程式正确的是( )
A.将通入NaClO溶液中:
B.向硫酸铜溶液中加入NaHS溶液生成黑色沉淀:
C.向硫代硫酸钠溶液中加入硫酸:
D.水垢中用溶液处理:
5.LiBr溶液可作为替代氟利昂的绿色制冷剂。合成工艺流程如下:
下列说法错误的是
A.还原工序逸出的用NaOH溶液吸收,吸收液不可直接返回还原工序
B.除杂工序中产生的滤渣可用进行组分分离
C.中和工序中生成的气体为酸性氧化物
D.若BaS和恰好完全反应,则理论上参与反应的为1:1:2
6.表示阿伏加德罗常数的值,关于硫代硫酸钠和稀硫酸的反应,下列说法中错误的是( )
A.1 mol硫代硫酸钠固体中阴阳离子总数为
B.的溶液中数目为
C.和混合物中硫原子数目为
D.标准状况下,生成时,理论上转移的电子数为
7.为研究二氧化硫的性质,某兴趣小组设计如图所示装置进行实验。将少量溶液缓慢推入粉末处,发生反应。下列说法不正确的是( )
A.气球先变大后变小,体现了的水溶性
B.石蕊试纸变红,说明溶于水显酸性
C.品红溶液褪色,体现了的还原性
D.加热褪色后的溶液又变红,说明与品红生成不稳定的无色物质
8.某短周期元素的价—类二维图如图所示,下列说法正确的是( )
A.a可以用g的浓溶液干燥 B.c可以使石蕊溶液先变红后褪色
C.b易溶于 D.e、h一定均能促进水的电离
9.某溶液中可能含有的阴离子有、、等,为了检验其中是否含有,除了溶液外,还需要的试剂是( )
A.氢氧化钠溶液 B.盐酸 C.稀硫酸 D.硝酸银溶液
10.化学反应中有颜色变化之美。下列相关离子方程式表示不正确的是( )
A.向溶液中滴加稀硫酸出现黄色沉淀:
B.向溶液中加入出现红褐色沉淀:
C.向酸性溶液中通入后溶液紫红色褪去:
D.向HI溶液中加入后溶液变为黄色:
11.部分含S和Cl的物质分类与相应化合价的关系如图所示。下列说法正确的是( )
A.a和e都是强酸
B.向h的溶液中通入c,溶液的酸性增强
C.b或f与金属Cu反应的产物中Cu的化合价均为+2价
D.c和g都具有漂白性,其使品红溶液褪色的原理相同
12.下列制取、验证其漂白性并制备晶体的实验装置能达到实验目的的是( )
A.装置甲制
B.装置乙收集
C.装置丙验证漂白性
D.装置丁蒸干溶液得晶体
13.蔗糖与浓硫酸发生反应的过程如图所示。
下列关于该过程的解题思路正确的是( )
A.该实验的缺点是可能带来环境污染
B.过程①白色固体变黑,主要体现了浓硫酸的吸水性
C.过程②固体体积膨胀,主要是因为反应过程中放热
D.过程中产生能使品红溶液褪色的气体,说明蔗糖是还原糖
14.下列关于常见离子的检验方法和结论错误的是( )
A.先加入稀盐酸酸化,无明显现象,再加入溶液,有白色沉淀生成,原溶液中一定有
B.用铂丝蘸取某溶液灼烧,火焰呈黄色,证明溶液中含有,不能确定是否含
C.加入盐酸,产生无色无味气体,将气体通入澄清石灰水,溶液变浑浊,原溶液中可能有
D.先加入足量浓NaOH溶液并加热,产生的气体能使湿润的蓝色石蕊试纸变红,原溶液中一定有
二、解答题(共4题,58分)
15.A、B、C、D、E五种物质中含有同种元素,其相互转化关系如图所示。已知A是淡黄色固体,请回答下列问题。
(1)写出B、E的化学式:B__________、E_________。
(2)C→D的化学方程式为_________;E→C的化学方程式为_________。B与C在溶液中反应的化学方程式为_________。
(3)将足量的物质C通入溶液中,下列说法正确的是_______(填字母)。
a.溶液没有明显变化
b.溶液中出现白色沉淀
c.若继续通入,则溶液中出现白色沉淀
16.Ⅰ.浓硫酸具有:①难挥发性(高沸点);②酸性;③强氧化性;④吸水性;⑤脱水性
下列各项分别表现浓硫酸的什么性质,请将序号填于空白处:
(1)蔗糖中倒入浓硫酸,蔗糖变黑,体积膨胀,且有刺激性气味的气体产生,该实验现象表明浓硫酸具有_____。
(2)浓硫酸使蓝色的胆矾晶体变为白色,表现的性质是_____。
(3)浓硫酸与FeO反应,表现的性质是_____。
Ⅱ.(4)化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是 ________(填序号)
①过量的Zn与18硫酸溶液反应
②过量的氧气与少量的二氧化硫在催化剂存在和一定条件下充分反应
③过量的二氧化锰与浓盐酸反应
④过量的铜与浓硫酸反应
⑤过量的锌与稀盐酸反应
⑥过量的稀硫酸与块状石灰石反应
17.在化工生产中,硫资源应用广泛,利用含硫物质之间的转化有利于实现硫资源的综合利用。下图为硫及其化合物的“价—类”二维图。
请回答以下问题。
(1)从硫元素化合价变化的角度解题思路,图中既有氧化性又有还原性的物质有______,______(填化学式,任写两种)。
(2)写出Cu和Z的浓溶液发生反应的化学方程式__________________。
(3)将Y通入品红溶液中,可观察到的现象是______________________________。
(4)工业上处理废气时,通过步骤Ⅲ和步骤w将Y转化为再利用。
①实现步骤Ⅰ的转化所加试剂是______(写出一种即可)。
②实现步骤Ⅱ的转化可选择______试剂(填序号)。
A. B.KI C. D.
(5)欲制备,从氧化还原角度解题思路,合理的是______(填序号)。
A B. C. D.
(6)将与混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为______。
18.有一瓶澄清的无色溶液,其中可能含有、、、、、、、。取该溶液进行以下实验:
(1)由题干可知溶液中一定不存在___________(填离子符号,下同);用pH试纸检验,溶液呈强酸性,可以排除___________的存在。
(2)取出部分溶液滴加过量的NaOH溶液,只产生白色沉淀,则可证明___________(填离子符号)的存在,生成白色沉淀的离子方程式为___________。
(3)取出部分上述碱性溶液滴加溶液,有白色沉淀生成,证明___________(填离子符号,下同)的存在,同时可排除原溶液中___________的存在,产生白色沉淀的离子方程式为___________。
(4)根据上述实验事实可知原溶液中一定存在的离子有___________,不确定是否存在的离子有___________。
参考答案
1.答案:A
解析:硫酸根离子的检验原理:,先加入稀盐酸酸化,没有沉淀产生,然后加入溶液,产生白色沉淀,则证明有硫酸根离子,加稀盐酸酸化可以排除的干扰,因为也是一种不溶于水但能够与稀盐酸反应的白色沉淀;
故选A。
2.答案:D
解析:配制硫酸溶液需使用量筒和胶头滴管量取浓硫酸,需在烧杯中进行稀释,且稀释时需用玻璃棒搅拌,A项正确;装置B的作用是监控流速,由于在饱和溶液中的溶解度较小,故其中的试剂可以用饱和溶液,B项正确;反应开始时装置C中出现砖红色沉淀,说明发生反应生成了,其中为还原剂,被氧化为,为氧化剂,被还原为,结合得失电子守恒可知,氧化剂和还原剂的物质的量之比为2:1,C项正确;由于溶液能与稀盐酸酸化的溶液反应生成白色沉淀,故无法证明反应中作还原剂,D项错误。
3.答案:C
解析:Ⅰ中试管内发生反应,该反应中只有中硫元素的化合价发生变化,硫酸只体现酸性,没有体现氧化性,A项错误;二氧化硫使品红溶液褪色,体现的漂白性,B项错误;Ⅰ和Ⅱ中都反应生成硫沉淀,都会出现浑浊,C项正确;升高温度能加快反应速率,撤掉水浴,重做实验,温度降低,反应减慢,生成二氧化硫的速率减小,Ⅳ中红色褪去减慢,D项错误。
4.答案:D
解析:次氯酸具有强氧化性,生成物中S不会是+4价,A项错误;NaHS在离子方程式中用表示,正确的离子方程式是,B项错误;硫代硫酸钠为强电解质,正确的离子方程式是,C项错误;溶度积大的沉淀能转化为溶度积小的沉淀,微溶,离子方程式中用化学式表示,D项正确。
5.答案:D
解析:根据、知,参与反应的,D项错误。
6.答案:B
解析:的溶液,,则100 mL该溶液中,,B错误。
7.答案:C
解析:A.反应产生使气球变大,后来溶于水,气球变小,故气球先变大后变小,体现了的水溶性,A正确;
B.和水反应生成,电离出而使其溶液呈酸性使石蕊试纸变红,故B正确;
C.二氧化硫具有漂白性可以使品红溶液褪色,所以品红溶液中通入气体,品红溶液褪色,说明具有漂白性,但无法说明二氧化硫的还原性,C错误;
D.加热褪色后的溶液又变红,说明与品红生成不稳定的无色物质使品红褪色,加热后无色物质分解,溶液又变红,D正确;
本题选C。
8.答案:C
解析:a为,g为,浓硫酸可以氧化,不能干燥,A错误;c为,溶于水生成亚硫酸,可以使石蕊溶液变红,但不能漂白石蕊溶液,B错误;b为S单质,属于非极性分子,易溶于非极性溶剂,C正确;h为硫酸盐,当h为正盐时,硫酸根离子不水解,h不一定能促进水的电离,当h为酸式盐时,电离抑制水的电离,D错误。
9.答案:B
解析:硫酸根离子的检验原理:,先加入稀盐酸酸化,没有沉淀产生,然后加入溶液,产生白色沉淀,则证明有硫酸根离子,加稀盐酸酸化可以排除碳酸根离子的干扰,因为也是一种不溶于水但能够与稀盐酸反应的白色沉淀;氢氧化钠溶液与三种阴离子都不会反应,加稀硫酸会引入硫酸根,硝酸银与三种阴离子均产生白色沉淀,故ACD都不合题意;故选B。
10.答案:B
解析:在酸性条件下,会与反应生成和,离子方程式为,A正确;是强酸弱碱盐,其溶液呈弱酸性,因此离子方程式中不能出现,正确的离子方程式为,B错误;具有强还原性,能将还原为,自身被氧化为,根据氧化还原反应的基本规律可得离子方程式为,C正确;HI是强酸,在酸性条件下能将氧化为,离子方程式为,D正确。
11.答案:B
解析:a为,e为HCl,a是弱酸,e是强酸,A错误;h为,c为,溶液中通入发生反应:,溶液的酸性增强,B正确;b为S,f为,的氧化性较强,与Cu反应的产物为,的化合价为+2价,S的氧化性较弱,与Cu反应的产物为,的化合价为+1价,C错误;c为,g为,能与品红溶液反应生成无色物质,具有强氧化性,能将品红氧化,两者使品红溶液褪色的原理不同,D错误。
12.答案:C
解析:在加热条件下,Cu和浓硫酸才能反应生成,A错误;密度大于空气,应该用向上排空气法收集,气体应“长进短出”,B错误;与品红结合生成无色物质,体现了的漂白性,C正确;从硫酸铜溶液中获得晶体,应该采用蒸发浓缩、冷却结晶的方法,D错误。
13.答案:A
解析:浓硫酸具有脱水性,能够将蔗糖中H原子、O原子按2:1比例以的形式脱去,脱水过程中产生大量的热,同时还会发生反应:,产生的大量气体,使固体体积膨胀,据此解题思路解题。
A.由解题思路可知,该实验中可能产生,有毒,会污染环境,故该实验的缺点是可能带来环境污染,A正确;
B.过程①白色固体变黑,即浓硫酸将蔗糖中H原子、O原子按2∶1比例以的形式脱去,白色固体变黑,体现浓硫酸的脱水性,B错误;
C.浓硫酸脱水过程中产生大量的热,会发生反应:,产生的大量气体,使固体体积膨胀,故过程②固体体积膨胀,主要是因为反应过程中产生的大量气体,C错误;
D.由C项解题思路可知,过程中产生气体,该气体能使品红溶液褪色,但不能说明蔗糖是还原糖,D错误;
故答案为:A。
14.答案:D
解析:先加入稀盐酸酸化,无明显现象,排除了、等的干扰,再加入溶液,有白色沉淀生成,则原溶液中一定有,A正确;
的焰色呈黄色,的焰色呈紫色,紫色光会被黄色光遮盖,故B正确;
加入盐酸,产生无色无味气体,将气体通入澄清石灰水,溶液变浑浊,则原溶液中可能有,C正确;
先加入足量浓溶液并加热,若产生的气体能使湿润的红色石蕊试纸变蓝,则说明有氨气放出,原溶液中一定有,D错误。
15.答案:(1);
(2);;
(3)ac
解析:由A为淡黄色固体,并能与反应,可以判断A为硫单质,则B为,C为,D为,E为。
(3)与溶液不反应,通入后,将氧化成,与反应生成白色沉淀。
16.答案:(1)③⑤
(2)④
(3)②③
(4)②③④⑥
解析:
17.答案:(1)S;
(2)
(3)品红溶液褪色
(4)①CaO;②AC
(5)B
(6)1:2
解析:(1)从硫元素化合价变化的角度解题思路,图中既有氧化性又有还原性的物质应该处在S的中间价态,可以为S、;
(2)浓硫酸与Cu在加热条件下会发生氧化还原反应产生、、,化学方程式:;
(3)有漂白性,所以通入品红溶液中,可观察到的现象是:品红溶液褪色;
(4)①根据图示可知:步骤Ⅰ可以是被溶液吸收反应产生沉淀和,属于碱,也可以与CaO反应产生,CaO属于碱性氧化物;
②根据图示可知:步骤Ⅱ是转化为,在该转化过程中S元素化合价升高,失去电子被氧化,因此在转化过程中需要加入氧化剂,则:
A.与反应产生,A符合题意;
B.KI具有还原性,不能使转化为,B不符合题意;
C.具有还原性,具有强氧化性,可以使与反应产生、,C符合题意;
D.、都具有还原性,二者不能反应产生,D不符合题意;
故合理选项是AC;
(5)中硫的化合价为+2价,需要化合价高于+2价含硫的氧化剂和低于+2价含有硫的还原剂,只有B满足,故选B;
(6)与混合,可生成淡黄色固体,方程式为:,其中为氧化剂,为还原剂,则氧化剂与还原剂的物质的量之比为1:2。
18.答案:(1);
(2);
(3);;
(4);
解析:(1)由于是澄清的无色溶液,可排除黄色的的存在;用pH试纸检验,表明溶液呈强酸性,说明有氢离子,根据离子共存要求,则离子不能存在;
(2)取出部分溶液逐滴加入NaOH溶液,使溶液从酸性逐渐变为碱性,继续滴加NaOH溶液,有白色沉淀氢氧化镁产生,可证明的存在,产生白色沉淀的离子方程式为;
(3)取部分上述碱性溶液加溶液,有白色沉淀生成,证明的存在,因为原溶液为澄清溶液,又可以排除的存在,产生白色沉淀的离子方程式为;
(4)根据上述解题思路,溶液还应存在有阴离子,所以一定存在,根据上述解题思路和一定存在,无法确定的是,故答案为:;。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
