7.3 乙醇与乙酸 同步巩固练 2024-2025学年化学人教版(2019) 必修第二册
文档属性
| 名称 | 7.3 乙醇与乙酸 同步巩固练 2024-2025学年化学人教版(2019) 必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 634.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-04 18:31:03 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
7.3 乙醇与乙酸 同步巩固练
2024-2025学年化学人教版(2019) 必修第二册
一、单选题
1.以下化学用语不正确的是
A.乙醇的空间填充模型为
B.乙醇的分子式为C2H6O
C.乙醇的结构简式为C2H5OH
D.羟基的电子式为
2.下列关于乙醇的物理性质的应用中不正确的是
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分
C.由于乙醇能够以任意比与水互溶,所以酒厂可以勾兑各种浓度的酒
D.从化学学科角度看,俗语“酒香不怕巷子深”中包含乙醇容易挥发的性质
3.乙醇分子中的化学键如图所示,乙醇与金属钠反应时断裂的键位于
A.①处 B.②和⑤处 C.③处 D.④处
4.向盛有乙醇的烧杯中投入一小块金属钠,下列对实验现象的描述中正确的是
①钠块沉入乙醇液面的下面
②钠块熔化成小球
③钠块在乙醇的液面上游动
④钠块表面有气体放出
A.①② B.②③ C.③④ D.①④
5.能证明乙醇分子中含有一个羟基的事实是 ( )
A.乙醇容易挥发 B.乙醇能与水以任意比例互溶
C.乙醇完全燃烧生成CO2和H2O D.0.1 mol乙醇与足量Na反应生成 0.05 mol H2
6.一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.2g,若其中水的质量为10.8g。则CO的质量是
A.2.1g B.2.6g C.3.8g D.5.1g
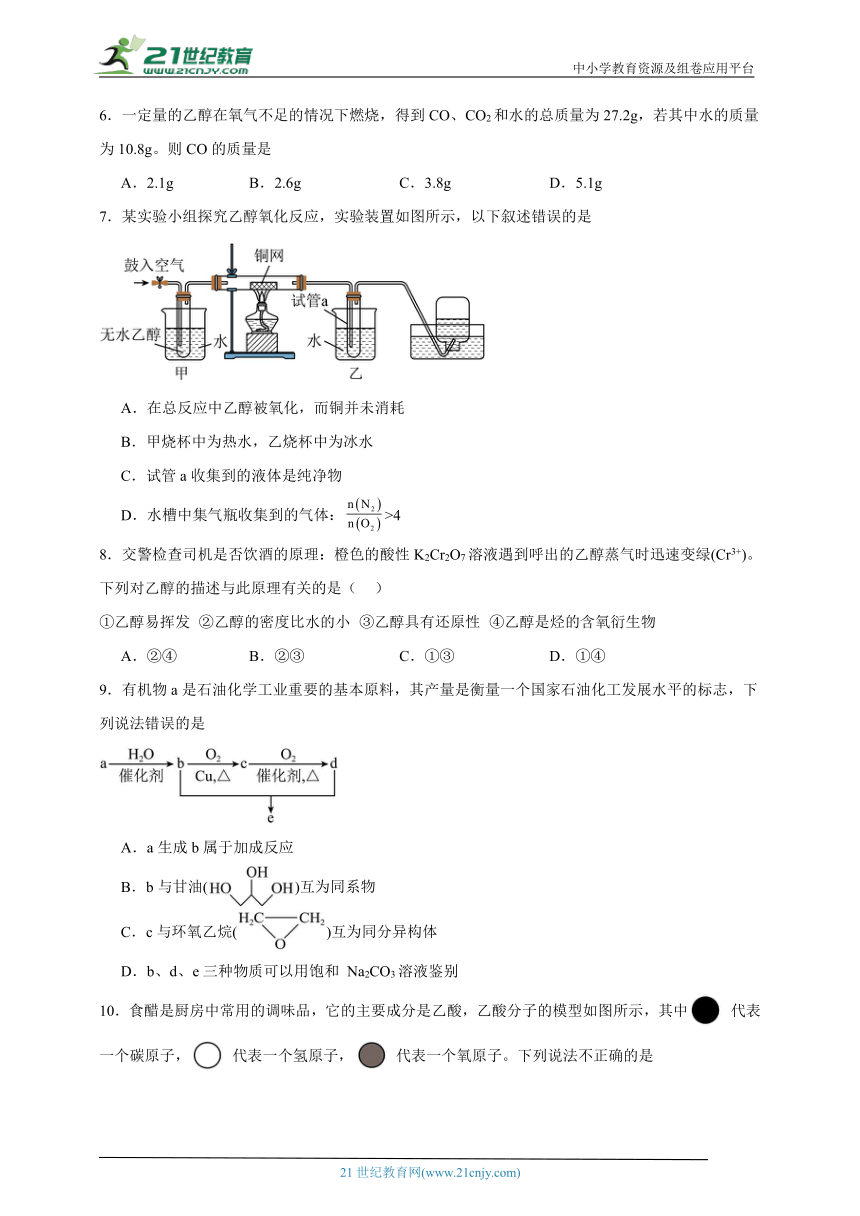
7.某实验小组探究乙醇氧化反应,实验装置如图所示,以下叙述错误的是
A.在总反应中乙醇被氧化,而铜并未消耗
B.甲烧杯中为热水,乙烧杯中为冰水
C.试管a收集到的液体是纯净物
D.水槽中集气瓶收集到的气体:>4
8.交警检查司机是否饮酒的原理:橙色的酸性K2Cr2O7溶液遇到呼出的乙醇蒸气时迅速变绿(Cr3+)。下列对乙醇的描述与此原理有关的是( )
①乙醇易挥发 ②乙醇的密度比水的小 ③乙醇具有还原性 ④乙醇是烃的含氧衍生物
A.②④ B.②③ C.①③ D.①④
9.有机物a是石油化学工业重要的基本原料,其产量是衡量一个国家石油化工发展水平的标志,下列说法错误的是
A.a生成b属于加成反应
B.b与甘油()互为同系物
C.c与环氧乙烷()互为同分异构体
D.b、d、e三种物质可以用饱和 Na2CO3溶液鉴别
10.食醋是厨房中常用的调味品,它的主要成分是乙酸,乙酸分子的模型如图所示,其中 代表一个碳原子, 代表一个氢原子, 代表一个氧原子。下列说法不正确的是
A.乙酸是一种化合物
B.乙酸的相对分子质量为60
C.乙酸中碳元素的质量分数为60%
D.乙酸分子中的碳原子、氢原子、氧原子的个数比为1:2:1
11.下列关于乙酸的说法不正确的是
A.乙酸是一种重要的有机酸,且具有强烈的刺激性气味
B.乙酸分子中含有4个H原子,所以乙酸不是一元酸
C.无水乙酸又称冰醋酸,它是纯净物
D.乙酸易溶于水和乙醇
12.下列说法不正确的是
A.乙醇、乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高
B.乙酸能和碳酸钠反应生成二氧化碳气体,说明乙酸的酸性强于碳酸
C.乙酸和乙醇生成乙酸乙酯的反应属于酸碱中和反应
D.乙酸分子中虽然有4个氢原子,但乙酸是一元酸
13.用乙醇与乙酸反应制备乙酸乙酯,反应装置如图所示(加热及加持装置未画出)。下列说法正确的是
A.该反应是可逆反应,且属于加成反应
B.a试管中要加入浓硫酸做催化剂,b试管中常加入NaOH溶液来分离酯
C.反应的化学方程式为:
D.该反应的有机产物所含官能团的名称是羧基
14.乙酸是生活中常见的有机物,其结构式如下图所示,下列关于乙酸的说法正确的是
A.乙酸与CaCO3反应,能证明酸性:乙酸﹥碳酸
B.乙酸与乙醇发生酯化反应是②键断裂
C.乙酸显酸性,发生电离是①键断裂
D.乙酸中的官能团是-COOH,叫羟基
15.我国科研人员提出了由小分子X、Y转化为高附加值产品M的催化反应历程。该历程可用示意图表示如下,下列说法不正确的是
A.①→②过程属于放热反应
B.由X、Y生成M的总反应原子利用率为100%
C.反应过程中有键的断裂和键、键的生成
D.X的键角为,Y的结构式为、M为乙醇()
二、填空题
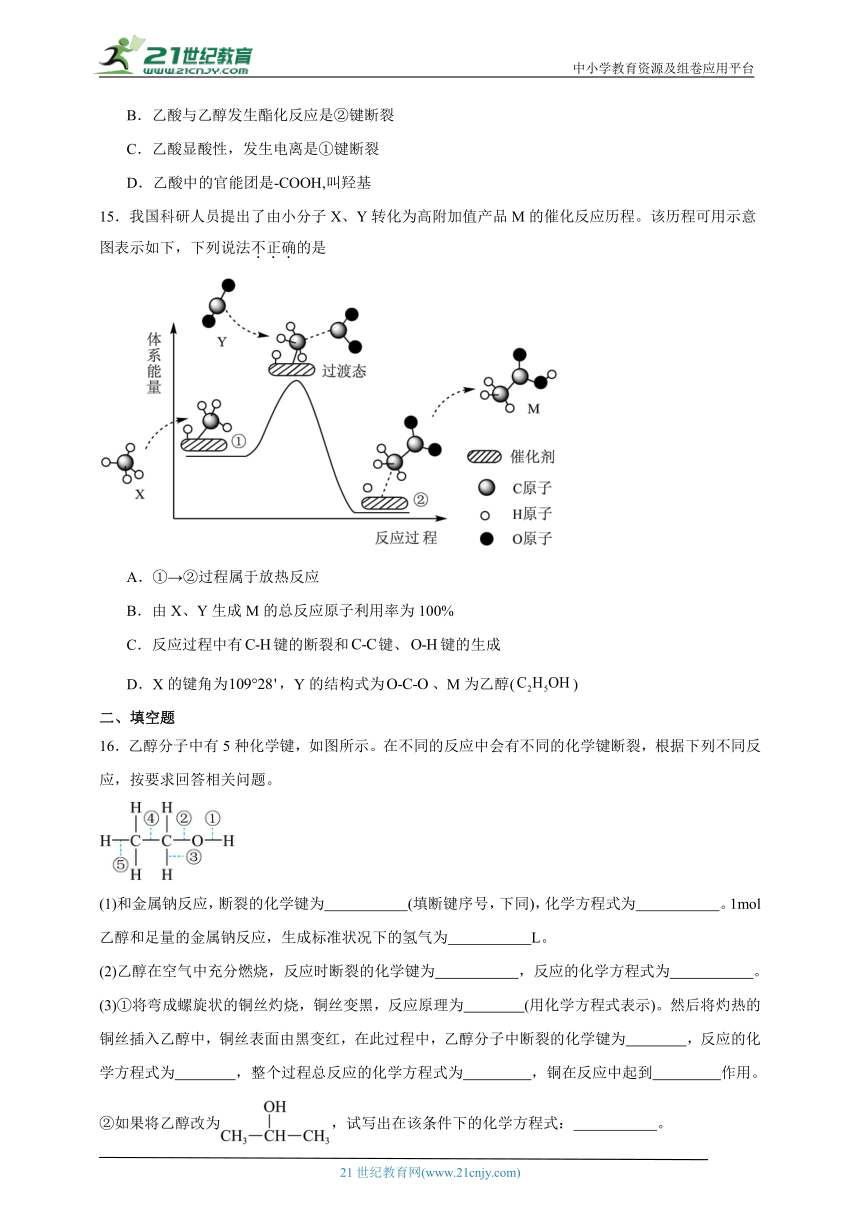
16.乙醇分子中有5种化学键,如图所示。在不同的反应中会有不同的化学键断裂,根据下列不同反应,按要求回答相关问题。
(1)和金属钠反应,断裂的化学键为 (填断键序号,下同),化学方程式为 。1mol乙醇和足量的金属钠反应,生成标准状况下的氢气为 L。
(2)乙醇在空气中充分燃烧,反应时断裂的化学键为 ,反应的化学方程式为 。
(3)①将弯成螺旋状的铜丝灼烧,铜丝变黑,反应原理为 (用化学方程式表示)。然后将灼热的铜丝插入乙醇中,铜丝表面由黑变红,在此过程中,乙醇分子中断裂的化学键为 ,反应的化学方程式为 ,整个过程总反应的化学方程式为 ,铜在反应中起到 作用。
②如果将乙醇改为,试写出在该条件下的化学方程式: 。
③如果醇为,在该条件下,醇还能被催化氧化吗? (填“能”或“不能”)。
17.A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,能进行如图所示的多种反应。
(1)A的官能团名称是 ;B的结构简式是 。
(2)反应②的反应类型为 。
(3)写出反应③的化学方程式: 。
(4)写出反应④的化学方程式: 。
(5)下列说法正确的是 。
a.一定条件下B发生加聚反应所得产物可以使溴的四氯化碳溶液褪色
b.③反应中浓硫酸的作用为催化剂和吸水剂
c.A的水溶液可用直接加热的方法得到纯净的A
d.③反应结束后加入饱和氢氧化钠溶液能除去杂质
三、解答题
18.某研究性学习小组设计实验制备乙酸乙酯,如图1:
(1)反应前加入三种药品(①乙醇②乙酸③98%浓硫酸)的先后顺序是 (填序号)。写出乙酸和乙醇反应制取乙酸乙酯的化学方程式: 。
(2)实验时向试管A中加几块碎瓷片,其作用是 。
(3)图1方案有明显缺陷,请提出改进建议: 。
(4)①能否用图2的C装置替代图1的B装置? (填“能”或“否”)。
②能否用图2的D装置替代图1的B装置? (填“能”或“否”),理由是 。
(5)分离乙酸乙酯的操作为分液,进行该操作需要图3中的仪器有 (填字母)。
(6)若实验所用乙酸的质量为6.0g,乙醇的质量为5.0g,得到纯净的产品质量为4.4g,则乙酸乙酯的产率是 。(产率指的是某种生成物的实际产量与理论产量的比值)
(7)若乙酸分子中的氧都是,乙醇分子中的氧都是,二者在浓作用下发生酯化反应,一段时间后,反应混合物中含有的分子有_______(填字母)。
A.1种 B.2种 C.3种 D.4种
参考答案
1.A
A.中图形为乙醇的球棍模型,故A错误;
B.乙醇的分子式为C2H6O,故B正确;
C.乙醇的结构简式为CH3CH2OH或C2H5OH,故C正确;
D.羟基的电子式为,故D正确。
答案选A。
2.A
A.乙醇能与水以任意比例互溶,不能分液的方法除去乙醇中的水,故A错误;
B.乙醇是良好的有机溶剂,能够溶解很多有机物和无机物,乙醇常用于提取中药的有效成分,故B正确;
C.乙醇能与水以任意比例互溶,酒厂常利用这个性质勾兑得到各种浓度的酒,故C正确;
D.乙醇具有挥发性,俗语“酒香不怕巷子深”中表达的化学意义就是乙醇容易挥发的性质,故D正确;
故A错误。
3.A
乙醇分子中氢氧键极性较强,与金属钠反应时氢氧键断裂,即①处断裂,A项正确。
4.D
①钠的密度大于乙醇,所以会沉在乙醇底部,故①正确;
②钠和乙醇的反应放热很少,不足以将钠熔化,故②错误;
③钠块沉在乙醇液面下,故③错误;
④乙醇中含有羟基,能与金属钠反应生成氢气,钠块表面有气体放出,故④正确;
故①④正确;
故选:D。
5.D
A.乙醇容易挥发是乙醇的物理性质,与是否含有羟基无关,故A不符合题意;
B.乙醇能和水以任意比互溶,是由于乙醇和水分子之间能形成氢键,不能说明乙醇中含几个羟基,故B不符合题意;
C.乙醇燃烧生成二氧化碳和水,只能说明其含碳元素和氢元素,不能确定是否含有氧元素;即不能确定是否含有羟基,故C不符合题意;
D.乙醇与生成的氢气的物质的量之比为0.1:0.05=2:1,说明乙醇分子中有一个活泼的氢原子可被金属钠取代(置换),即乙醇分子中有一个羟基,故D符合题意;
答案选D。
6.A
根据题意,水的物质的量是10.8g÷18g/mol=0.6mol,H元素的物质的量是1.2mol,乙醇的分子式为C2H6O,则C元素的物质的量是1.2mol÷3=0.4mol,完全燃烧生成0.4mol的二氧化碳,质量为0.4mol×44g/mol=17.6g,现在二氧化碳和CO的总质量为27.2g-10.8g=16.4g,少生成17.6g-16.4g=1.2g,比较二氧化碳与CO的化学式可知,每生成1molCO,则少生成16g气体,所以CO的物质的量是1.2g÷16g/mol=0.075mol,所以CO的质量是0.075mol×28g/mol=2.1g。
答案选A。
7.C
甲烧杯提供稳定的乙醇和空气混合气体,即甲烧杯中的水为热水,直玻璃管中发生2CH3CH2OH+O22CH3CHO+2H2O,乙装置收集CH3CHO,水应是冷水,使乙醛气体遇冷转化成乙醛液体。
A.乙醇催化氧化,发生的反应是2CH3CH2OH+O22CH3CHO+2H2O,Cu作催化剂,其质量保持不变,故A说法正确;
B.根据上述分析,甲烧杯中为热水,乙烧杯中为冰水,故B说法正确;
C.试管a收集到的液体除乙醛外,还含有未反应的乙醇,部分乙醛可能被氧化成乙酸,因此试管a中收集到的液体为乙醛、乙醇、乙酸,故C说法错误;
D.空气中氮气和氧气的体积比为4∶1,反应消耗氧气使集气瓶氮气和氧气的体积之比大于4∶1,相同条件下,气体物质的量之比等于体积之比,即>4,故D说法正确;
答案为C。
8.C
乙醇是由分子构成的物质,沸点低易挥发,并且具有还原性,可被酸性重铬酸钾(K2Cr2O7)溶液氧化为乙酸,K2Cr2O7则被乙醇还原为Cr3+,因此看到K2Cr2O7溶液由橙色变为绿色;检查时,人呼出乙醇蒸气就被K2Cr2O7氧化,乙醇探测仪器中物质颜色会逐渐由橙色变为绿色,根据颜色变化的深浅确定饮酒量的多少,故合理选项是C。
9.B
有机物a的产量是衡量一个国家石油工业发展水平的标志,则a为CH2═CH2,a与水发生加成反应生成b为CH3CH2OH,b发生催化氧化生成c为CH3CHO,c进一步氧化生成d为CH3COOH,乙酸与乙醇发生酯化反应生成e为CH3COOCH2CH3。
A.a与水发生加成反应生成b为CH3CH2OH,A正确;
B.b为CH3CH2OH,分子式为C2H6O,甘油的分子式为C3H8O3,两者分子式相差CH2O2,两者不是同系物,B错误;
C.c为CH3CHO,与环氧乙烷,分子式相同,结构式不同,互为同分异构体,C正确;
D.乙醇能够溶于水,不分层,乙酸与饱和Na2CO3溶液发生放出气体,有气泡产生,而乙酸乙酯与饱和Na2CO3溶液是互不相溶的两层液体,故可以用饱和Na2CO3溶液鉴别,D正确;
故选B。
10.C
由分子结构模型 可知,1个乙酸分子是由2个碳原子、2个氧原子和4个氢原子构成的,其化学式为C2H4O2;
A.由化学式C2H4O2可知,它是由C、H、O三种元素组成的纯净物,属于化合物,故A正确;
B.由化学式C2H4O2可知,乙酸的相对分子质量为12×2+1×4+16×2=60,故B正确;
C.由化学式C2H4O2可知,乙酸中碳元素的质量分数为×100%=40%,故C错误;
D.由化学式C2H4O2可知,1个乙酸分子是由2个碳原子、2个氧原子和4个氢原子构成的,即乙酸分子中的碳原子、氢原子、氧原子的个数比为2:4:2=1:2:1,故D正确;
答案为C。
11.B
化学上根据酸电离出的H+数目将酸分为一元酸、二元酸和多元酸,乙酸分子中—CH3中的氢原子不能电离出来,含有一个—COOH,只能电离出1个H+,故乙酸为一元酸,B错误,故答案为:B。
12.C
A.乙醇、乙酸的相对分子质量都比C2H6、C2H4大,且乙醇和乙酸中能形成分子间氢键,故乙醇、乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高,A正确;
B.根据酸与盐反应的一般规律:强酸制弱酸,故乙酸能和碳酸钠反应生成二氧化碳气体,说明乙酸的酸性强于碳酸,B正确;
C.有机酸或无机含氧酸与醇反应生成酯和水的反应是酯化反应而不是中和反应,故乙酸和乙醇生成乙酸乙酯的反应属于酯化反应或取代反应,C错误;
D.化学上根据酸中能够电离出的H+数目将酸分为一元酸、二元酸和多元酸,乙酸分子中虽然有4个氢原子,但乙酸只能电离出一个H+,故乙酸是一元酸,D正确;
故答案为:C。
13.C
A.酯化反应是可逆反应,属于取代反应,故A错误;
B.b试管中常加入饱和碳酸钠溶液分离酯,酯能和NaOH溶液反应,故B错误;
C.乙酸和乙醇发生酯化反应生成乙酸乙酯和水,故C正确;
D.生成的有机物乙酸乙酯的官能团为酯基,故D错误;
故选C。
14.A
A.乙酸与CaCO3反应,生成醋酸钙和水和二氧化碳,能证明乙酸酸性大于碳酸,A正确;
B.乙酸与乙醇发生酯化反应是脱下羟基,断裂的化学键是①,B错误;
C.乙酸显酸性,是能电离出氢离子,断裂的化学键是②,C错误;
D.乙酸中的官能团是-COOH,叫羧基,D错误;
故选A。
15.D
根据图中所示,反应物是CH4、CO2,生成物是CH3COOH,反应历程是:在催化剂作用下CH4断裂一个C-H键,CO2断裂一个C=O中的π键,然后发生加成反应,原子间重新组合生成CH3COOH。
A.①→②过程反应物总能量高于生成物总能量,属于放热反应,A正确;
B.X、Y生成M的总反应方程式为,原子利用率为100%,B正确;
C.根据反应的历程示意图和总反应方程式可知,反应过程中有键的断裂和键、键的生成,C正确;
D.X的分子结构是正四面体,键角为,Y的结构式为O=C=O、M为乙酸(),D错误;
故选D。
16.(1) ① 11.2
(2) ①②③④⑤
(3) ①③ 催化 22 不能
(1)乙醇和金属钠反应生成乙醇钠,则断裂的化学键为①,其反应的化学方程式为。1mol乙醇和足量的金属钠反应,生成0.5mol氢气,则生成标准状况下的氢气为0.5mol×22.4 L mol 1=11.2L;故答案为:①;;11.2。
(2)乙醇在空气中充分燃烧生成二氧化碳和水,则反应时断裂的化学键为①②③④⑤,反应的化学方程式为;故答案为:①②③④⑤;。
(3)①将弯成螺旋状的铜丝灼烧,铜丝变黑即铜和氧气反应生成氧化铜,其反应原理为。然后将灼热的铜丝插入乙醇中,铜丝表面由黑变红,乙醇变为乙醛,在此过程中,乙醇分子中断裂的化学键为①③,其反应的化学方程式为,整个过程总反应的化学方程式为,铜在反应前后质量不变,反应过程中参与了反应,因此铜在反应中起到催化作用;故答案为:;①③;;;催化。
②如果将乙醇改为,根据断键分析是断氧氢键和连羟基的碳上的碳氢键,碳与氧形成碳氧双键,则在该条件下的化学方程式:22;故答案为:22。
③如果醇为,在该条件下,由于连羟基的碳上没有碳氢键,因此该醇不能被催化氧化;故答案为:不能。
17.(1) 羟基
(2)加成反应
(3)
(4)
(5)b
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,A为,反应①为和活泼金属Na反应生成,反应②为和发生加成反应生成,反应③为和发生酯化反应生成,反应④为催化氧化生成。
(1)乙醇中含有的官能团为羟基;乙烯的结构简式为;故答案为:羟基;;
(2)乙烯与水发生加成反应生成乙醇;故答案为:加成反应。
(3)乙醇和乙酸反应生成乙酸乙酯,化学方程式为;故答案为:;
(4)乙醇在铜的催化作用下与氧气发生氧化反应生成乙醛,化学方程式为;故答案为:;
(5)a.乙烯加聚反应后产物不含碳碳双键不可以使溴的四氯化碳溶液褪色;
c.制备无水乙醇,应先加入生石灰,再蒸馏;
d.乙酸乙酯中除杂应选用饱和碳酸钠溶液,氢氧化钠能使乙酸乙酯水解。故选b。
18.(1) ①③②
(2)防止暴沸
(3)将试管B中水换成饱和碳酸钠溶液
(4) 否 否 乙酸乙酯在NaOH溶液中会水解生成乙酸钠和乙醇,使乙酸乙酯的量减少
(5)af
(6)50%
(7)C
乙酸与乙醇在浓硫酸和加热环境下发生酯化反应,乙酸脱去羟基、乙醇断裂出羟基中的氢原子,脱去水生成乙酸乙酯,用饱和碳酸钠溶液吸收挥发出的乙醇、反应出去乙酸,降低乙酸乙酯的溶解度,分液分离,得到乙酸乙酯。
(1)浓硫酸溶于放出大量的热,故应该首先加入乙醇,然后缓缓加入浓硫酸,最后加入乙酸,顺序为①③②;乙酸和乙醇在浓硫酸催化作用下生成乙酸乙酯和水,;
(2)实验时向试管A中加几块碎瓷片,其作用是液体防止暴沸;
(3)图1方案有明显缺陷,应该将试管B中水换成饱和碳酸钠溶液,以吸收挥发出的乙酸、乙醇,且便于乙酸乙酯分层;
(4)C中导管伸入液面以下,可能会导致液体倒吸,故不能用图2的C装置替代图1的B装置;
乙酸乙酯在NaOH溶液中会水解生成乙酸钠和乙醇,使乙酸乙酯的量减少,故不能用图2的D装置替代图1的B装置;
(5)分离乙酸乙酯的操作为分液,进行该操作需要分液漏斗、烧杯,故选af;
(6)乙酸的质量为6.0g,乙醇的质量为5.0g,两者物质的量分别为0.1mol、0.11mol,故乙醇过量,乙酸完全反应生成乙酸乙酯的质量为0.1mol×88g/mol=8.8g,故乙酸乙酯的产率是;
(7)乙酸和乙醇在浓硫酸催化作用下生成乙酸乙酯和水过程中酸脱去羟基、醇脱去氢生成水,故反应混合物中含有的分子有乙酸、乙酸乙酯、水3种;故选C。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
7.3 乙醇与乙酸 同步巩固练
2024-2025学年化学人教版(2019) 必修第二册
一、单选题
1.以下化学用语不正确的是
A.乙醇的空间填充模型为
B.乙醇的分子式为C2H6O
C.乙醇的结构简式为C2H5OH
D.羟基的电子式为
2.下列关于乙醇的物理性质的应用中不正确的是
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分
C.由于乙醇能够以任意比与水互溶,所以酒厂可以勾兑各种浓度的酒
D.从化学学科角度看,俗语“酒香不怕巷子深”中包含乙醇容易挥发的性质
3.乙醇分子中的化学键如图所示,乙醇与金属钠反应时断裂的键位于
A.①处 B.②和⑤处 C.③处 D.④处
4.向盛有乙醇的烧杯中投入一小块金属钠,下列对实验现象的描述中正确的是
①钠块沉入乙醇液面的下面
②钠块熔化成小球
③钠块在乙醇的液面上游动
④钠块表面有气体放出
A.①② B.②③ C.③④ D.①④
5.能证明乙醇分子中含有一个羟基的事实是 ( )
A.乙醇容易挥发 B.乙醇能与水以任意比例互溶
C.乙醇完全燃烧生成CO2和H2O D.0.1 mol乙醇与足量Na反应生成 0.05 mol H2
6.一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.2g,若其中水的质量为10.8g。则CO的质量是
A.2.1g B.2.6g C.3.8g D.5.1g
7.某实验小组探究乙醇氧化反应,实验装置如图所示,以下叙述错误的是
A.在总反应中乙醇被氧化,而铜并未消耗
B.甲烧杯中为热水,乙烧杯中为冰水
C.试管a收集到的液体是纯净物
D.水槽中集气瓶收集到的气体:>4
8.交警检查司机是否饮酒的原理:橙色的酸性K2Cr2O7溶液遇到呼出的乙醇蒸气时迅速变绿(Cr3+)。下列对乙醇的描述与此原理有关的是( )
①乙醇易挥发 ②乙醇的密度比水的小 ③乙醇具有还原性 ④乙醇是烃的含氧衍生物
A.②④ B.②③ C.①③ D.①④
9.有机物a是石油化学工业重要的基本原料,其产量是衡量一个国家石油化工发展水平的标志,下列说法错误的是
A.a生成b属于加成反应
B.b与甘油()互为同系物
C.c与环氧乙烷()互为同分异构体
D.b、d、e三种物质可以用饱和 Na2CO3溶液鉴别
10.食醋是厨房中常用的调味品,它的主要成分是乙酸,乙酸分子的模型如图所示,其中 代表一个碳原子, 代表一个氢原子, 代表一个氧原子。下列说法不正确的是
A.乙酸是一种化合物
B.乙酸的相对分子质量为60
C.乙酸中碳元素的质量分数为60%
D.乙酸分子中的碳原子、氢原子、氧原子的个数比为1:2:1
11.下列关于乙酸的说法不正确的是
A.乙酸是一种重要的有机酸,且具有强烈的刺激性气味
B.乙酸分子中含有4个H原子,所以乙酸不是一元酸
C.无水乙酸又称冰醋酸,它是纯净物
D.乙酸易溶于水和乙醇
12.下列说法不正确的是
A.乙醇、乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高
B.乙酸能和碳酸钠反应生成二氧化碳气体,说明乙酸的酸性强于碳酸
C.乙酸和乙醇生成乙酸乙酯的反应属于酸碱中和反应
D.乙酸分子中虽然有4个氢原子,但乙酸是一元酸
13.用乙醇与乙酸反应制备乙酸乙酯,反应装置如图所示(加热及加持装置未画出)。下列说法正确的是
A.该反应是可逆反应,且属于加成反应
B.a试管中要加入浓硫酸做催化剂,b试管中常加入NaOH溶液来分离酯
C.反应的化学方程式为:
D.该反应的有机产物所含官能团的名称是羧基
14.乙酸是生活中常见的有机物,其结构式如下图所示,下列关于乙酸的说法正确的是
A.乙酸与CaCO3反应,能证明酸性:乙酸﹥碳酸
B.乙酸与乙醇发生酯化反应是②键断裂
C.乙酸显酸性,发生电离是①键断裂
D.乙酸中的官能团是-COOH,叫羟基
15.我国科研人员提出了由小分子X、Y转化为高附加值产品M的催化反应历程。该历程可用示意图表示如下,下列说法不正确的是
A.①→②过程属于放热反应
B.由X、Y生成M的总反应原子利用率为100%
C.反应过程中有键的断裂和键、键的生成
D.X的键角为,Y的结构式为、M为乙醇()
二、填空题
16.乙醇分子中有5种化学键,如图所示。在不同的反应中会有不同的化学键断裂,根据下列不同反应,按要求回答相关问题。
(1)和金属钠反应,断裂的化学键为 (填断键序号,下同),化学方程式为 。1mol乙醇和足量的金属钠反应,生成标准状况下的氢气为 L。
(2)乙醇在空气中充分燃烧,反应时断裂的化学键为 ,反应的化学方程式为 。
(3)①将弯成螺旋状的铜丝灼烧,铜丝变黑,反应原理为 (用化学方程式表示)。然后将灼热的铜丝插入乙醇中,铜丝表面由黑变红,在此过程中,乙醇分子中断裂的化学键为 ,反应的化学方程式为 ,整个过程总反应的化学方程式为 ,铜在反应中起到 作用。
②如果将乙醇改为,试写出在该条件下的化学方程式: 。
③如果醇为,在该条件下,醇还能被催化氧化吗? (填“能”或“不能”)。
17.A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,能进行如图所示的多种反应。
(1)A的官能团名称是 ;B的结构简式是 。
(2)反应②的反应类型为 。
(3)写出反应③的化学方程式: 。
(4)写出反应④的化学方程式: 。
(5)下列说法正确的是 。
a.一定条件下B发生加聚反应所得产物可以使溴的四氯化碳溶液褪色
b.③反应中浓硫酸的作用为催化剂和吸水剂
c.A的水溶液可用直接加热的方法得到纯净的A
d.③反应结束后加入饱和氢氧化钠溶液能除去杂质
三、解答题
18.某研究性学习小组设计实验制备乙酸乙酯,如图1:
(1)反应前加入三种药品(①乙醇②乙酸③98%浓硫酸)的先后顺序是 (填序号)。写出乙酸和乙醇反应制取乙酸乙酯的化学方程式: 。
(2)实验时向试管A中加几块碎瓷片,其作用是 。
(3)图1方案有明显缺陷,请提出改进建议: 。
(4)①能否用图2的C装置替代图1的B装置? (填“能”或“否”)。
②能否用图2的D装置替代图1的B装置? (填“能”或“否”),理由是 。
(5)分离乙酸乙酯的操作为分液,进行该操作需要图3中的仪器有 (填字母)。
(6)若实验所用乙酸的质量为6.0g,乙醇的质量为5.0g,得到纯净的产品质量为4.4g,则乙酸乙酯的产率是 。(产率指的是某种生成物的实际产量与理论产量的比值)
(7)若乙酸分子中的氧都是,乙醇分子中的氧都是,二者在浓作用下发生酯化反应,一段时间后,反应混合物中含有的分子有_______(填字母)。
A.1种 B.2种 C.3种 D.4种
参考答案
1.A
A.中图形为乙醇的球棍模型,故A错误;
B.乙醇的分子式为C2H6O,故B正确;
C.乙醇的结构简式为CH3CH2OH或C2H5OH,故C正确;
D.羟基的电子式为,故D正确。
答案选A。
2.A
A.乙醇能与水以任意比例互溶,不能分液的方法除去乙醇中的水,故A错误;
B.乙醇是良好的有机溶剂,能够溶解很多有机物和无机物,乙醇常用于提取中药的有效成分,故B正确;
C.乙醇能与水以任意比例互溶,酒厂常利用这个性质勾兑得到各种浓度的酒,故C正确;
D.乙醇具有挥发性,俗语“酒香不怕巷子深”中表达的化学意义就是乙醇容易挥发的性质,故D正确;
故A错误。
3.A
乙醇分子中氢氧键极性较强,与金属钠反应时氢氧键断裂,即①处断裂,A项正确。
4.D
①钠的密度大于乙醇,所以会沉在乙醇底部,故①正确;
②钠和乙醇的反应放热很少,不足以将钠熔化,故②错误;
③钠块沉在乙醇液面下,故③错误;
④乙醇中含有羟基,能与金属钠反应生成氢气,钠块表面有气体放出,故④正确;
故①④正确;
故选:D。
5.D
A.乙醇容易挥发是乙醇的物理性质,与是否含有羟基无关,故A不符合题意;
B.乙醇能和水以任意比互溶,是由于乙醇和水分子之间能形成氢键,不能说明乙醇中含几个羟基,故B不符合题意;
C.乙醇燃烧生成二氧化碳和水,只能说明其含碳元素和氢元素,不能确定是否含有氧元素;即不能确定是否含有羟基,故C不符合题意;
D.乙醇与生成的氢气的物质的量之比为0.1:0.05=2:1,说明乙醇分子中有一个活泼的氢原子可被金属钠取代(置换),即乙醇分子中有一个羟基,故D符合题意;
答案选D。
6.A
根据题意,水的物质的量是10.8g÷18g/mol=0.6mol,H元素的物质的量是1.2mol,乙醇的分子式为C2H6O,则C元素的物质的量是1.2mol÷3=0.4mol,完全燃烧生成0.4mol的二氧化碳,质量为0.4mol×44g/mol=17.6g,现在二氧化碳和CO的总质量为27.2g-10.8g=16.4g,少生成17.6g-16.4g=1.2g,比较二氧化碳与CO的化学式可知,每生成1molCO,则少生成16g气体,所以CO的物质的量是1.2g÷16g/mol=0.075mol,所以CO的质量是0.075mol×28g/mol=2.1g。
答案选A。
7.C
甲烧杯提供稳定的乙醇和空气混合气体,即甲烧杯中的水为热水,直玻璃管中发生2CH3CH2OH+O22CH3CHO+2H2O,乙装置收集CH3CHO,水应是冷水,使乙醛气体遇冷转化成乙醛液体。
A.乙醇催化氧化,发生的反应是2CH3CH2OH+O22CH3CHO+2H2O,Cu作催化剂,其质量保持不变,故A说法正确;
B.根据上述分析,甲烧杯中为热水,乙烧杯中为冰水,故B说法正确;
C.试管a收集到的液体除乙醛外,还含有未反应的乙醇,部分乙醛可能被氧化成乙酸,因此试管a中收集到的液体为乙醛、乙醇、乙酸,故C说法错误;
D.空气中氮气和氧气的体积比为4∶1,反应消耗氧气使集气瓶氮气和氧气的体积之比大于4∶1,相同条件下,气体物质的量之比等于体积之比,即>4,故D说法正确;
答案为C。
8.C
乙醇是由分子构成的物质,沸点低易挥发,并且具有还原性,可被酸性重铬酸钾(K2Cr2O7)溶液氧化为乙酸,K2Cr2O7则被乙醇还原为Cr3+,因此看到K2Cr2O7溶液由橙色变为绿色;检查时,人呼出乙醇蒸气就被K2Cr2O7氧化,乙醇探测仪器中物质颜色会逐渐由橙色变为绿色,根据颜色变化的深浅确定饮酒量的多少,故合理选项是C。
9.B
有机物a的产量是衡量一个国家石油工业发展水平的标志,则a为CH2═CH2,a与水发生加成反应生成b为CH3CH2OH,b发生催化氧化生成c为CH3CHO,c进一步氧化生成d为CH3COOH,乙酸与乙醇发生酯化反应生成e为CH3COOCH2CH3。
A.a与水发生加成反应生成b为CH3CH2OH,A正确;
B.b为CH3CH2OH,分子式为C2H6O,甘油的分子式为C3H8O3,两者分子式相差CH2O2,两者不是同系物,B错误;
C.c为CH3CHO,与环氧乙烷,分子式相同,结构式不同,互为同分异构体,C正确;
D.乙醇能够溶于水,不分层,乙酸与饱和Na2CO3溶液发生放出气体,有气泡产生,而乙酸乙酯与饱和Na2CO3溶液是互不相溶的两层液体,故可以用饱和Na2CO3溶液鉴别,D正确;
故选B。
10.C
由分子结构模型 可知,1个乙酸分子是由2个碳原子、2个氧原子和4个氢原子构成的,其化学式为C2H4O2;
A.由化学式C2H4O2可知,它是由C、H、O三种元素组成的纯净物,属于化合物,故A正确;
B.由化学式C2H4O2可知,乙酸的相对分子质量为12×2+1×4+16×2=60,故B正确;
C.由化学式C2H4O2可知,乙酸中碳元素的质量分数为×100%=40%,故C错误;
D.由化学式C2H4O2可知,1个乙酸分子是由2个碳原子、2个氧原子和4个氢原子构成的,即乙酸分子中的碳原子、氢原子、氧原子的个数比为2:4:2=1:2:1,故D正确;
答案为C。
11.B
化学上根据酸电离出的H+数目将酸分为一元酸、二元酸和多元酸,乙酸分子中—CH3中的氢原子不能电离出来,含有一个—COOH,只能电离出1个H+,故乙酸为一元酸,B错误,故答案为:B。
12.C
A.乙醇、乙酸的相对分子质量都比C2H6、C2H4大,且乙醇和乙酸中能形成分子间氢键,故乙醇、乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高,A正确;
B.根据酸与盐反应的一般规律:强酸制弱酸,故乙酸能和碳酸钠反应生成二氧化碳气体,说明乙酸的酸性强于碳酸,B正确;
C.有机酸或无机含氧酸与醇反应生成酯和水的反应是酯化反应而不是中和反应,故乙酸和乙醇生成乙酸乙酯的反应属于酯化反应或取代反应,C错误;
D.化学上根据酸中能够电离出的H+数目将酸分为一元酸、二元酸和多元酸,乙酸分子中虽然有4个氢原子,但乙酸只能电离出一个H+,故乙酸是一元酸,D正确;
故答案为:C。
13.C
A.酯化反应是可逆反应,属于取代反应,故A错误;
B.b试管中常加入饱和碳酸钠溶液分离酯,酯能和NaOH溶液反应,故B错误;
C.乙酸和乙醇发生酯化反应生成乙酸乙酯和水,故C正确;
D.生成的有机物乙酸乙酯的官能团为酯基,故D错误;
故选C。
14.A
A.乙酸与CaCO3反应,生成醋酸钙和水和二氧化碳,能证明乙酸酸性大于碳酸,A正确;
B.乙酸与乙醇发生酯化反应是脱下羟基,断裂的化学键是①,B错误;
C.乙酸显酸性,是能电离出氢离子,断裂的化学键是②,C错误;
D.乙酸中的官能团是-COOH,叫羧基,D错误;
故选A。
15.D
根据图中所示,反应物是CH4、CO2,生成物是CH3COOH,反应历程是:在催化剂作用下CH4断裂一个C-H键,CO2断裂一个C=O中的π键,然后发生加成反应,原子间重新组合生成CH3COOH。
A.①→②过程反应物总能量高于生成物总能量,属于放热反应,A正确;
B.X、Y生成M的总反应方程式为,原子利用率为100%,B正确;
C.根据反应的历程示意图和总反应方程式可知,反应过程中有键的断裂和键、键的生成,C正确;
D.X的分子结构是正四面体,键角为,Y的结构式为O=C=O、M为乙酸(),D错误;
故选D。
16.(1) ① 11.2
(2) ①②③④⑤
(3) ①③ 催化 22 不能
(1)乙醇和金属钠反应生成乙醇钠,则断裂的化学键为①,其反应的化学方程式为。1mol乙醇和足量的金属钠反应,生成0.5mol氢气,则生成标准状况下的氢气为0.5mol×22.4 L mol 1=11.2L;故答案为:①;;11.2。
(2)乙醇在空气中充分燃烧生成二氧化碳和水,则反应时断裂的化学键为①②③④⑤,反应的化学方程式为;故答案为:①②③④⑤;。
(3)①将弯成螺旋状的铜丝灼烧,铜丝变黑即铜和氧气反应生成氧化铜,其反应原理为。然后将灼热的铜丝插入乙醇中,铜丝表面由黑变红,乙醇变为乙醛,在此过程中,乙醇分子中断裂的化学键为①③,其反应的化学方程式为,整个过程总反应的化学方程式为,铜在反应前后质量不变,反应过程中参与了反应,因此铜在反应中起到催化作用;故答案为:;①③;;;催化。
②如果将乙醇改为,根据断键分析是断氧氢键和连羟基的碳上的碳氢键,碳与氧形成碳氧双键,则在该条件下的化学方程式:22;故答案为:22。
③如果醇为,在该条件下,由于连羟基的碳上没有碳氢键,因此该醇不能被催化氧化;故答案为:不能。
17.(1) 羟基
(2)加成反应
(3)
(4)
(5)b
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,A为,反应①为和活泼金属Na反应生成,反应②为和发生加成反应生成,反应③为和发生酯化反应生成,反应④为催化氧化生成。
(1)乙醇中含有的官能团为羟基;乙烯的结构简式为;故答案为:羟基;;
(2)乙烯与水发生加成反应生成乙醇;故答案为:加成反应。
(3)乙醇和乙酸反应生成乙酸乙酯,化学方程式为;故答案为:;
(4)乙醇在铜的催化作用下与氧气发生氧化反应生成乙醛,化学方程式为;故答案为:;
(5)a.乙烯加聚反应后产物不含碳碳双键不可以使溴的四氯化碳溶液褪色;
c.制备无水乙醇,应先加入生石灰,再蒸馏;
d.乙酸乙酯中除杂应选用饱和碳酸钠溶液,氢氧化钠能使乙酸乙酯水解。故选b。
18.(1) ①③②
(2)防止暴沸
(3)将试管B中水换成饱和碳酸钠溶液
(4) 否 否 乙酸乙酯在NaOH溶液中会水解生成乙酸钠和乙醇,使乙酸乙酯的量减少
(5)af
(6)50%
(7)C
乙酸与乙醇在浓硫酸和加热环境下发生酯化反应,乙酸脱去羟基、乙醇断裂出羟基中的氢原子,脱去水生成乙酸乙酯,用饱和碳酸钠溶液吸收挥发出的乙醇、反应出去乙酸,降低乙酸乙酯的溶解度,分液分离,得到乙酸乙酯。
(1)浓硫酸溶于放出大量的热,故应该首先加入乙醇,然后缓缓加入浓硫酸,最后加入乙酸,顺序为①③②;乙酸和乙醇在浓硫酸催化作用下生成乙酸乙酯和水,;
(2)实验时向试管A中加几块碎瓷片,其作用是液体防止暴沸;
(3)图1方案有明显缺陷,应该将试管B中水换成饱和碳酸钠溶液,以吸收挥发出的乙酸、乙醇,且便于乙酸乙酯分层;
(4)C中导管伸入液面以下,可能会导致液体倒吸,故不能用图2的C装置替代图1的B装置;
乙酸乙酯在NaOH溶液中会水解生成乙酸钠和乙醇,使乙酸乙酯的量减少,故不能用图2的D装置替代图1的B装置;
(5)分离乙酸乙酯的操作为分液,进行该操作需要分液漏斗、烧杯,故选af;
(6)乙酸的质量为6.0g,乙醇的质量为5.0g,两者物质的量分别为0.1mol、0.11mol,故乙醇过量,乙酸完全反应生成乙酸乙酯的质量为0.1mol×88g/mol=8.8g,故乙酸乙酯的产率是;
(7)乙酸和乙醇在浓硫酸催化作用下生成乙酸乙酯和水过程中酸脱去羟基、醇脱去氢生成水,故反应混合物中含有的分子有乙酸、乙酸乙酯、水3种;故选C。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
