河南卷——2025届高考化学全真模拟卷(含解析)
文档属性
| 名称 | 河南卷——2025届高考化学全真模拟卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-06 16:29:58 | ||
图片预览



文档简介
河南卷——2025届高考化学全真模拟卷
(时间:75分钟,分值:100分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Cl-35.5 Ti-41Co-59
一、单项选择题:本题共14小题,每小题3分,共42分。每小题给出的四个选项中,只有一项是符合题目要求的。
1.[2024年广东高考真题]龙是中华民族重要的精神象征和文化符号。下列与龙有关的历史文物中,主要材质为有机高分子的是( )
A B C D
红山玉龙 鎏金铁芯铜龙 云龙纹丝绸 云龙纹瓷瓶
A.A B.B C.C D.D
2.[2023年湖南高考真题]下列化学用语表述错误的是( )
A.的电子式:
B.中子数为10的氧原子:
C.分子的VSEPR模型:
D.基态N原子的价层电子排布图:
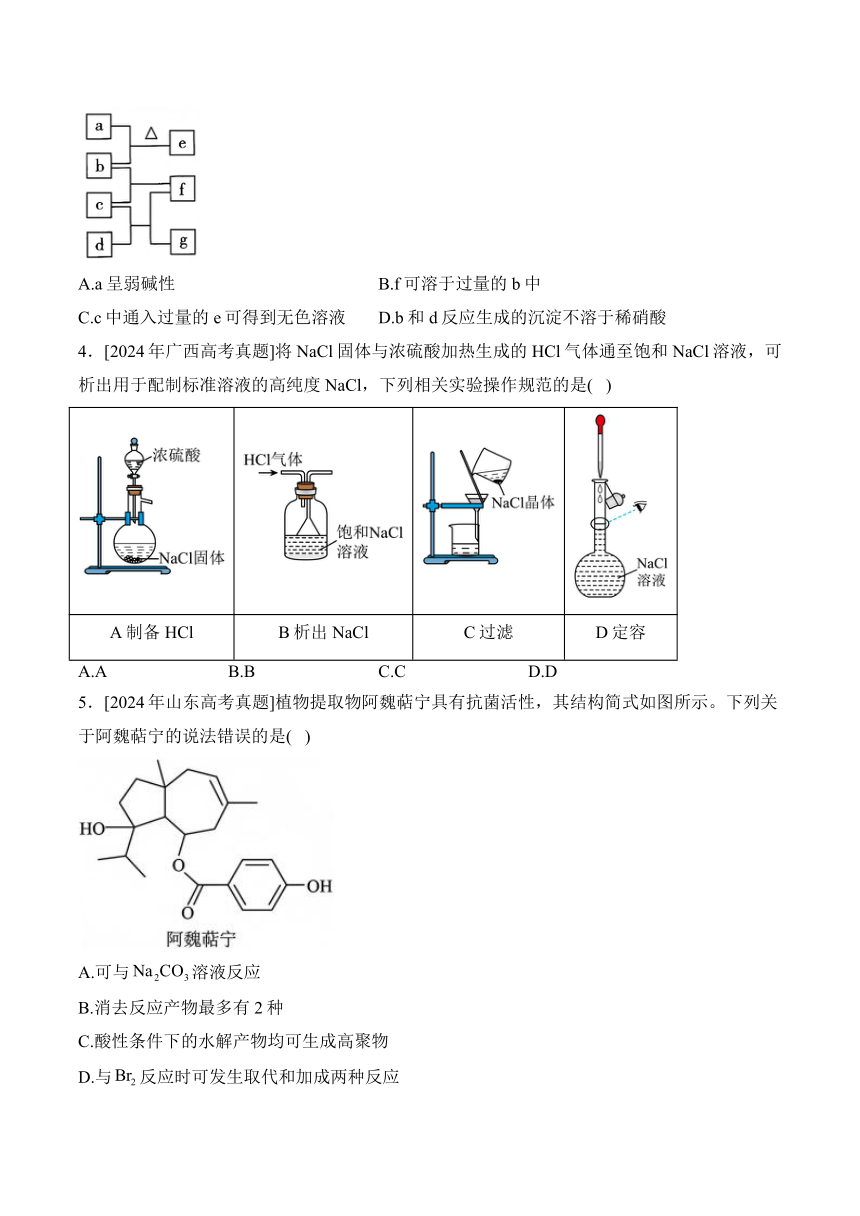
3.[2024年全国甲卷高考真题]四瓶无色溶液、,它们之间的反应关系如图所示。其中a、b、c、d代表四种溶液,e和g为无色气体,f为白色沉淀。下列叙述正确的是( )
A.a呈弱碱性 B.f可溶于过量的b中
C.c中通入过量的e可得到无色溶液 D.b和d反应生成的沉淀不溶于稀硝酸
4.[2024年广西高考真题]将NaCl固体与浓硫酸加热生成的HCl气体通至饱和NaCl溶液,可析出用于配制标准溶液的高纯度NaCl,下列相关实验操作规范的是( )
A制备HCl B析出NaCl C过滤 D定容
A.A B.B C.C D.D
5.[2024年山东高考真题]植物提取物阿魏萜宁具有抗菌活性,其结构简式如图所示。下列关于阿魏萜宁的说法错误的是( )
A.可与溶液反应
B.消去反应产物最多有2种
C.酸性条件下的水解产物均可生成高聚物
D.与反应时可发生取代和加成两种反应
6.[2024年辽宁高考真题]如下反应相关元素中,W、X、Y、Z为原子序数依次增大的短周期元素,基态X原子的核外电子有5种空间运动状态,基态Y、Z原子有两个未成对电子,Q是ds区元素,焰色试验呈绿色。下列说法错误的是( )
A.单质沸点:
B.简单氢化物键角:
C.反应过程中有蓝色沉淀产生
D.是配合物,配位原子是Y
7.[2024年浙江高考真题]下列离子方程式正确的是( )
A.用溶液除气体:
B.溶液中滴加溶液:
C.溶液中通入少量:
D.用溶液刻蚀覆铜板制作印刷电路板:
8.[2023年新课标综合卷高考真题]一种可吸附甲醇的材料,其化学式为,部分晶体结构如下图所示,其中为平面结构。
下列说法正确的是( )
A.该晶体中存在氢键
B.基态原子的第一电离能:
C.基态原子未成对电子数:
D.晶体中B、N和O原子轨道的杂化类型相同
9.[2024年福建高考真题]一种兼具合成功能的新型锂电池工作原理如图。电解质为含有机溶液。放电过程中产生,充电过程中电解LiCl产生。下列说法正确的是( )
A.交换膜为阴离子交换膜
B.电解质溶液可替换为LiCl水溶液
C.理论上每生成,需消耗2molLi
D.放电时总反应:
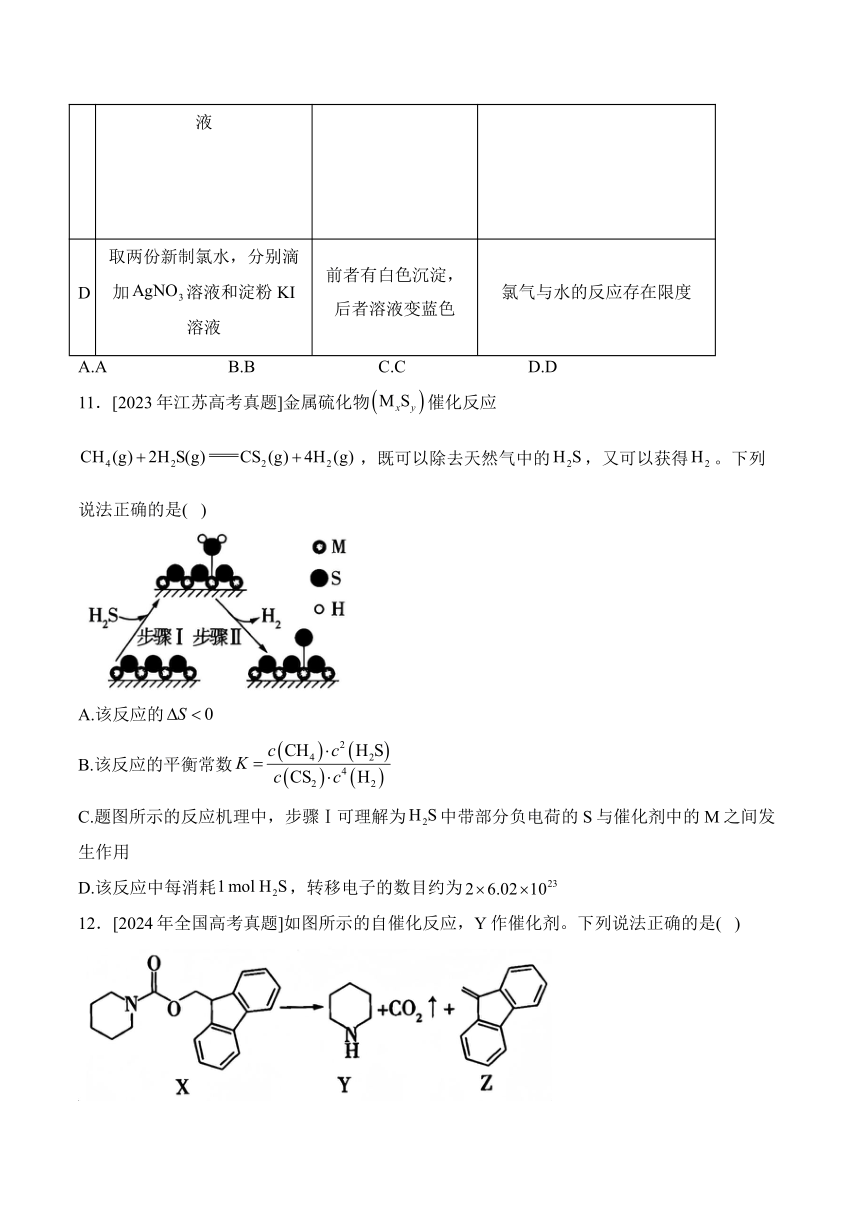
10.[2023年浙江高考真题]探究卤族元素单质及其化合物的性质,下列方案设计、现象和结论都正确的是( )
实验方案 现象 结论
A 往碘的溶液中加入等体积的浓KI溶液,振荡 分层,下层由紫红色变为浅粉红色,上层呈棕黄色 碘在浓KI溶液中的溶解能力大于在中的溶解能力
B 用玻璃棒蘸取次氯酸钠溶液点在pH试纸上 试纸变白 次氯酸钠溶液呈中性
C 向溶液中先滴加4滴溶液,再滴加4滴溶液 先产生白色沉淀,再产生黄色沉淀 AgCl转化为AgI,AgI溶解度小于AgCl溶解度
D 取两份新制氯水,分别滴加溶液和淀粉KI溶液 前者有白色沉淀,后者溶液变蓝色 氯气与水的反应存在限度
A.A B.B C.C D.D
11.[2023年江苏高考真题]金属硫化物催化反应,既可以除去天然气中的,又可以获得。下列说法正确的是( )
A.该反应的
B.该反应的平衡常数
C.题图所示的反应机理中,步骤Ⅰ可理解为中带部分负电荷的S与催化剂中的M之间发生作用
D.该反应中每消耗,转移电子的数目约为
12.[2024年全国高考真题]如图所示的自催化反应,Y作催化剂。下列说法正确的是( )
A.X不能发生水解反应
B.Y与盐酸反应的产物不溶于水
C.Z中碳原子均采用杂化
D.随增大,该反应速率不断增大
13.[2024年重庆高考真题]醋酸甲酯制乙醇的反应为:。三个恒容密闭容器中分别加入醋酸甲酯和氢气,在不同温度下,反应t分钟时醋酸甲酯物质的量n如图所示。下列说法正确的是( )
A.该反应的
B.容器甲中平均反应速率
C.容器乙中当前状态下反应速率
D.容器丙中乙醇的体积分数为
14.[2024年新课标综合卷高考真题]常温下和的两种溶液中,分布系数δ与pH的变化关系如图所示。[比如:]
下列叙述正确的是( )
A.曲线M表示的变化关系
B.若酸的初始浓度为,则a点对应的溶液中有
C.的电离常数
D.时,电离度
二、非选择题:本题共4小题,共58分。
15.[2023年河北高考真题]闭环循环有利于提高资源利用率和实现绿色化学的目标。利用氨法浸取可实现废弃物铜包钢的有效分离,同时得到的可用于催化、医药、冶金等重要领域。工艺流程如下:
已知:室温下的
回答下列问题:
(1)首次浸取所用深蓝色溶液①由铜毛丝、足量液氨、空气和盐酸反应得到,其主要成分为_______(填化学式)。
(2)滤渣的主要成分为_______(填化学式)。
(3)浸取工序的产物为,该工序发生反应的化学方程式为_______。浸取后滤液的一半经氧化工序可得深蓝色溶液①,氧化工序发生反应的离子方程式为_______。
(4)浸取工序宜在之间进行,当环境温度较低时,浸取液再生后不需额外加热即可进行浸取的原因是_______。
(5)补全中和工序中主反应的离子方程式_______+_______。
(6)真空干燥的目的为_______。
16.[2024年黑龙江省、吉林省、辽宁省高考真题]为实现氯资源循环利用,工业上采用催化氧化法处理废气:
将和分别以不同起始流速通入反应器中,在360 ℃、400 ℃和440 ℃下反应,通过检测流出气成分绘制转化率曲线,如图所示(较低流速下转化率可近似为平衡转化率)。
回答下列问题:
(1)__________0(填“>”或“<”);__________℃。
(2)结合以下信息,可知的燃烧热__________。
(3)下列措施可提高M点转化率的是__________(填标号)。
A.增大的流速 B.将温度升高40 ℃
C.增大 D.使用更高效的催化剂
(4)图中较高流速时,小于和,原因是______________________________。
(5)设N点的转化率为平衡转化率,则该温度下反应的平衡常数__________。(用平衡物质的量分数代替平衡浓度计算)
(6)负载在上的催化活性高,稳定性强,和的晶体结构均可用下图表示,二者晶胞体积近似相等,与的密度比为1.66,则的相对原子质量为__________(精确至1)。
17.[2024年江西高考真题]托伐普坦是一种治疗心血管疾病的药物,其前体(L)合成步骤如图(部分试剂和条件略去)。
已知:
回答下列问题:
(1)化合物A_______(填“能”或“不能”)形成分子内氢键。
(2)写出由C生成D的化学反应方程式_______。
(3)写出G的结构简式_______。
(4)H到I的反应类型是_______。
(5)参照上述合成路线,试剂X的化学式是_______。
(6)K完全水解后,有机产物的名称是_______。
(7)E的消去产物()的同分异构体中,同时满足下列条件a、b和c的可能结构有_______种(立体异构中只考虑顺反异构);写出只满足下列条件a和c,不满足条件b的结构简式_______(不考虑立体异构)。
a)能与饱和碳酸氢钠溶液反应产生;
b)红外光谱中有碳碳双键特征吸收峰;
c)核磁共振氢谱峰面积比例为3∶3∶2∶1∶1。
18.[2023年全国甲卷高考真题]钴配合物溶于热水,在冷水中微溶,可通过如下反应制备:
具体步骤如下:
Ⅰ.称取,用水溶解。
Ⅱ.分批加入后,将溶液温度降至以下,加入活性炭、浓氨水,搅拌下逐滴加入的双氧水。
Ⅲ.加热至反应。冷却,过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的沸水中,趁热过滤。
Ⅴ.滤液转入烧杯,加入浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
回答下列问题:
(1)步骤Ⅰ中使用的部分仪器如下。
仪器a的名称是________。加快溶解的操作有________。
(2)步骤Ⅱ中,将温度降至10 ℃以下以避免________、________;可选用________降低溶液温度。
(3)指出下列过滤操作中不规范之处:________。
(4)步骤Ⅳ中,趁热过滤,除掉的不溶物主要为________。
(5)步骤Ⅴ中加入浓盐酸的目的是________。
参考答案
1.答案:C
解析:A.红山玉龙主要成分为和硅酸盐,属于无机非金属材料,A不符合题意;B.鎏金铁芯铜龙主要成分为Cu,属于金属材料,B不符合题意;C.云龙纹丝绸主要成分为蛋白质,属于有机高分子材料,C符合题意;D.云龙纹瓷瓶主要成分为硅酸盐,属于传统无机非金属材料,D不符合题意;故选C。
2.答案:C
解析:HClO分子中O与H、Cl分别形成共价键,每个原子最外层均达到稳定结构,A项正确;中子数为10的氧原子,其质量数为,可表示为,B项正确;中N形成3个σ键,孤电子对数为,价层电子对数为4,故的VSEPR模型为四面体形,图示给出的是的空间结构,C项错误;基态N原子的价电子排布式为,2s轨道上的2个电子自旋方向相反,2p轨道上的3个电子分别占据3个轨道,自旋方向相同,D项正确。
3.答案:B
解析:由分析知,a为,水解使溶液呈酸性,A错误;可与强碱反应生成四羟基合铝酸根离子,故可溶于过量的中,B正确;与过量的反应生成白色沉淀,C错误;和反应生成,可以溶于稀硝酸生成二氧化碳和,D错误。
4.答案:C
解析:A.NaCl固体与浓硫酸加热生成的HCl气体,缺少加热装置,故A错误;
B.氯化氢易溶于水,为充分吸收氯化氢并防止倒吸,氯化氢气体应从连接倒置漏斗的导管通入,故B错误;
C.用过滤法分离出氯化钠晶体,故C正确;
D.配制氯化钠溶液,定容时眼睛平视刻度线,故D错误;
选C。
5.答案:B
解析:该有机物含有酚羟基,故又可看作是酚类物质,酚羟基能显示酸性,且酸性强于;溶液显碱性,故该有机物可与溶液反应,A正确;
由分子结构可知,与醇羟基相连的C原子共与3个不同化学环境的C原子相连,且这3个C原子上均连接了H原子,因此,该有机物发生消去反应时,其消去反应产物最多有3种,B不正确;
该有机物酸性条件下的水解产物有2种,其中一种含有碳碳双键和2个醇羟基,这种水解产物既能通过发生加聚反应生成高聚物,也能通过缩聚反应生成高聚物;另一种水解产物含有羧基和酚羟基,其可以发生缩聚反应生成高聚物,C正确;
该有机物分子中含有酚羟基且其邻位上有H原子,故其可与浓溴水发生取代反应;还含有碳碳双键,故其可发生加成,因此,该有机物与反应时可发生取代和加成两种反应,D正确;
故选B
6.答案:D
解析:常温下,单质S呈固态,均呈气态,且相对分子质量,则分子间作用力,故单质的沸点:,A正确;的中心原子均采取杂化,但上分别有1,2个孤电子对,孤电子对数越多,对成键电子对的斥力越大,键角越小,故简单氢化物的键角:,B正确;向溶液中逐渐通入,先生成蓝色沉淀,当过量时,沉淀溶解生成深蓝色的溶液,C正确;配合物中提供空轨道,N原子提供孤电子对形成配位键,即其中配位原子是N,D错误。
7.答案:D
解析:在离子方程式中应以化学式保留,正确的离子方程式为,A错误;酸性条件下会将氧化成,与形成沉淀,滴加少量时的离子方程式为,滴加足量时的离子方程式为,B错误;电离平衡常数:与水反应生成的HClO与不反应,正确的离子方程式为,C错误;Cu与溶液反应生成,反应的离子方程式为,D正确。
8.答案:A
解析:从结构图可看出,该晶体中存在氢键,A正确;N的价电子排布式为,2p能级处于半满稳定状态,其第一电离能大于O,B错误;根据的电子排布式,可知其未成对电子数分别为1、2、2、3,C错误;该晶体中B、O原子轨道的杂化类型均为,为平面结构,则其中N的杂化类型为,D错误。
9.答案:D
解析:A.放电过程中负极锂失去电子形成锂离子,锂离子通过阳离子交换膜进入左侧生成,A错误;
B.锂为活泼金属,会和水反应,故电解质溶液不能为水溶液,B错误;
C.充电过程中电解LiCl失去电子发生氧化反应产生:,锂离子在阴极得到电子发生还原生成锂单质:,则每生成1 mol,同时生成2 mol Li;放电过程中,消耗6 mol Li,同时生成4 mol LiCl,则整个充放电过程来看,理论上每生成1mol,需消耗1 mol Li,C错误;
D.由分析,放电过程中,正极氮气得到电子发生还原反应生成,又转化为和LiCl,负极锂失去电子发生氧化反应生成锂离子,总反应为,D正确;
故选D。
10.答案:A
解析:题中现象说明从中转移到了浓KI溶液中,可得出相应结论,A正确;NaClO溶液具有强氧化性,能漂白pH试纸,故不能用pH试纸测定其酸碱性,B错误;该实验中过量,加入KI溶液,KI与过量的反应生成黄色沉淀,C错误;有白色沉淀产生说明有均具有强氧化性,均可以氧化KI,溶液变蓝不能说明有,故D错误。
11.答案:C
解析:反应为气体物质的量增多的反应,故该反应的,A错误;化学反应的平衡常数为生成物浓度的幂之积比反应物浓度的幂之积,因此该反应的平衡常数表达式为,B错误;由图示可以看出,步骤Ⅰ为中带部分负电荷的S与催化剂中的M之间发生作用,C正确;由反应的化学方程式可知,反应过程中中-4价的C转化为中+4价的C,电子转移可表示为,故反应中每消耗,转移4 mol电子,即转移电子的数目约为,D错误。
12.答案:C
解析:X中含有酯基和酰胺基,能发生水解反应,A错误;Y中含有亚氨基,与盐酸反应生成盐,产物可溶于水,B错误;Z中碳原子形成碳碳双键及苯环,均为杂化,C正确;Y是催化剂,可提高反应速率,但随着反应进行,反应物浓度不断减小,反应速率变慢,故随增大,反应速率不一定增大,D错误。
13.答案:D
解析:A.由分析,该反应的,A错误;
B.容器甲中平均反应速率,B错误;
C.温度越高反应速率越快,比较乙丙可知,丙达到平衡状态,但不确定乙是否平衡,不能确定正逆反应速率相对大小,C错误;
D.对丙而言:
容器丙中乙醇的体积分数为,D正确;
故选D。
14.答案:D
解析:Cl为弱吸电子基,则的酸性弱于,故。调pH时,溶液中分布系数减小的趋势快,分布系数增大的趋势快,溶液中分布系数减小的趋势缓慢,分布系数增大的趋势缓慢,故曲线M表示的变化关系,A错误;和均为弱酸,若酸的初始浓度为,则溶液的,但a点溶液的,则有外加酸,,B错误;,当时,,同理,,C错误;,当时,,,故,D正确。
15.答案:(1)
(2)Fe
(3);
(4)盐酸和液氨反应放热
(5);
(6)防止干燥过程中被空气中的氧化
解析:(1)首次浸取所用深蓝色溶液①由铜毛丝、足量液氨、空气和盐酸反应得到,主要物质成分呈现深蓝色,结合教材中铜氨配离子的颜色,可判断其阳离子为,根据元素守恒可知其阴离子为,故主要成分化学式为。
(2)根据流程图给出的信息,原料铜包钢经过浸取处理,铜被氧化后转化为进入溶液,铁仍为固体,且由流程图可知,滤渣的主要用途为炼钢,则可判断滤渣的主要成分为铁。
(3)由题给条件可知,浸取工序的反应物为铜单质和,产物为,根据原子守恒和得失电子守恒得到反应的化学方程式为。浸取后滤液的一部分经氧化工序可得深蓝色溶液①,从流程图氧化工序提供的信息可知,反应物有和,产物为,Cu元素由+1价变为+2价,则应得电子得到-2价氧,产物中有生成,则氧化工序发生反应的离子方程式应为。
(4)由题意可知,氧化过程的原料有液氨和盐酸,两种物质接触会发生酸碱中和反应(反应放热),放出的热量可以维持浸取工序温度,因此当环境温度较低时,浸取液再生后不需额外加热即可进行浸取。
(5)由流程图可知,中和工序后的主要步骤是洗涤和干燥,故中和工序析出CuCl沉淀,根据元素守恒、电荷守恒可以确定产物为CuCl、,因此中和工序中主反应的离子方程式为。
(6)铜元素在化合物中的常见价态有+1和+2,溶液或湿润状态下,+2价铜化合物比+1价铜化合物更稳定,产品CuCl中铜为+1价,湿润状态下易被氧化,中和后得到的产物CuCl经过洗涤后,仍会含有少量水分,若常压下热风干燥,则CuCl会被空气中的氧化为+2价铜化合物,要避免干燥过程中遇到氧气,一般会采用真空干燥。
16.答案:(1)<;360
(2)-285.8
(3)BD
(4)反应未达到平衡,温度低,反应速率慢,且反应物在催化剂表面接触时间短,相同时间内HCl的转化率低
(5)6
(6)101
解析:(1)该反应反应后气体分子数减少,。该反应为放热反应,达到平衡后,其他条件不变时,升高温度,平衡逆向移动,HCl的平衡转化率降低,由题图知,较低流速下,时HCl的转化率最大,故。
(2)将题中已知反应依次编号为①、②、③,根据盖斯定律,由①-②+③可得: ,故的燃烧热。
(3)由题图可知,增大HCl的流速,HCl的转化率降低,A错误;将温度升高40 ℃,即升温至400 ℃,由题图可知,HCl的转化率增大,B正确;增大,HCl的转化率减小,C错误;M点该反应未达到平衡,使用更高效的催化剂,可以加快反应速率,提高HCl的转化率,D正确。
(4)图中较高流速时,反应未达到平衡状态,温度低,反应速率慢,且较高流速时,反应物在催化剂表面接触时间短,故HCl的转化率低。
(5)N点起始时,HCl的平衡转化率为80%,设起始时HCl、的物质的量均为1 mol,列三段式:
则该温度下反应的平衡常数。
(6)二者晶体结构相同,晶胞体积近似相等,则二者密度之比等于摩尔质量之比,设Ru的相对原子质量为,则,解得。
17.答案:(1)能
(2)+→+HCl
(3)
(4)取代反应
(5)
(6)邻甲基苯甲酸
(7)9;
解析:(1)根据化合物A的结构简式以及形成氢键的条件,A中的羟基与处于邻位,可形成分子内氢键,故答案为能;
(2)对比C、D的结构简式可知,C中氨基上的1个“N-H”断裂,另一反应物上的S-Cl键断裂,C→D的反应类型为取代反应,其化学反应方程式为,故答案为;
(3)采用对比的方法,如F的分子式为,G分子式为,少了1个C,4个个O,即去掉了1个,对比H的结构简式可知,可知G的结构简式为,故答案为。
(4)由H和I的结构简式可知,H到I的反应类型为取代反应;故答案为取代反应;
(5)均为,因此X化学式为,故答案为;
(6)对比J和L的结构简式以及K的分子式,可推知K的结构简式为,完全水解后生成得到,名称为邻甲基苯甲酸:故答案为邻甲基苯甲酸;
(7)E的消去产物为,满足条件a、b、c的同分异构体中含有1个,1个碳碳双键,2个不相同的,符合条件的同分异构体有(存在顺反异构)、(存在顺反异构),(存在顺反异构)、(存在顺反异构),共有9种结构;只满足条件a和c,不满足b的分子中不含碳碳双键,应含有1个,2个不相同的,1个碳环,结构简式为;故答案为9;。
18.答案:(1)锥形瓶;升温、搅拌等
(2)浓氨水分解和挥发;双氧水分解;冰水浴
(3)玻璃棒没有靠在3层滤纸处、漏斗末端较长出(尖嘴部分)没有紧贴在“盛滤液”烧杯内壁
(4)活性炭
(5)利用同离子效应,促进尽可能完全析出,提高产率
解析:(1)仪器a的名称为锥形瓶,根据题给步骤Ⅰ中使用的部分仪器可知,加快溶解所采用的操作有用玻璃棒搅拌、用酒精灯加热。
(2)根据所加试剂的性质可分析将溶液温度降至10 ℃以下的原因,可选用冰水浴降温。
(4)该反应中活性炭作催化剂(反应前后不变),在冷水中微溶,则步骤Ⅲ过滤得到的固体为和活性炭的混合物,步骤Ⅳ中溶于含有少量盐酸的沸水中,趁热过滤得到的固体为活性炭。
(5)根据同离子效应可知,向滤液中加入浓盐酸(提供),能抑制溶解,利于析出橙黄色晶体。
(时间:75分钟,分值:100分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Cl-35.5 Ti-41Co-59
一、单项选择题:本题共14小题,每小题3分,共42分。每小题给出的四个选项中,只有一项是符合题目要求的。
1.[2024年广东高考真题]龙是中华民族重要的精神象征和文化符号。下列与龙有关的历史文物中,主要材质为有机高分子的是( )
A B C D
红山玉龙 鎏金铁芯铜龙 云龙纹丝绸 云龙纹瓷瓶
A.A B.B C.C D.D
2.[2023年湖南高考真题]下列化学用语表述错误的是( )
A.的电子式:
B.中子数为10的氧原子:
C.分子的VSEPR模型:
D.基态N原子的价层电子排布图:
3.[2024年全国甲卷高考真题]四瓶无色溶液、,它们之间的反应关系如图所示。其中a、b、c、d代表四种溶液,e和g为无色气体,f为白色沉淀。下列叙述正确的是( )
A.a呈弱碱性 B.f可溶于过量的b中
C.c中通入过量的e可得到无色溶液 D.b和d反应生成的沉淀不溶于稀硝酸
4.[2024年广西高考真题]将NaCl固体与浓硫酸加热生成的HCl气体通至饱和NaCl溶液,可析出用于配制标准溶液的高纯度NaCl,下列相关实验操作规范的是( )
A制备HCl B析出NaCl C过滤 D定容
A.A B.B C.C D.D
5.[2024年山东高考真题]植物提取物阿魏萜宁具有抗菌活性,其结构简式如图所示。下列关于阿魏萜宁的说法错误的是( )
A.可与溶液反应
B.消去反应产物最多有2种
C.酸性条件下的水解产物均可生成高聚物
D.与反应时可发生取代和加成两种反应
6.[2024年辽宁高考真题]如下反应相关元素中,W、X、Y、Z为原子序数依次增大的短周期元素,基态X原子的核外电子有5种空间运动状态,基态Y、Z原子有两个未成对电子,Q是ds区元素,焰色试验呈绿色。下列说法错误的是( )
A.单质沸点:
B.简单氢化物键角:
C.反应过程中有蓝色沉淀产生
D.是配合物,配位原子是Y
7.[2024年浙江高考真题]下列离子方程式正确的是( )
A.用溶液除气体:
B.溶液中滴加溶液:
C.溶液中通入少量:
D.用溶液刻蚀覆铜板制作印刷电路板:
8.[2023年新课标综合卷高考真题]一种可吸附甲醇的材料,其化学式为,部分晶体结构如下图所示,其中为平面结构。
下列说法正确的是( )
A.该晶体中存在氢键
B.基态原子的第一电离能:
C.基态原子未成对电子数:
D.晶体中B、N和O原子轨道的杂化类型相同
9.[2024年福建高考真题]一种兼具合成功能的新型锂电池工作原理如图。电解质为含有机溶液。放电过程中产生,充电过程中电解LiCl产生。下列说法正确的是( )
A.交换膜为阴离子交换膜
B.电解质溶液可替换为LiCl水溶液
C.理论上每生成,需消耗2molLi
D.放电时总反应:
10.[2023年浙江高考真题]探究卤族元素单质及其化合物的性质,下列方案设计、现象和结论都正确的是( )
实验方案 现象 结论
A 往碘的溶液中加入等体积的浓KI溶液,振荡 分层,下层由紫红色变为浅粉红色,上层呈棕黄色 碘在浓KI溶液中的溶解能力大于在中的溶解能力
B 用玻璃棒蘸取次氯酸钠溶液点在pH试纸上 试纸变白 次氯酸钠溶液呈中性
C 向溶液中先滴加4滴溶液,再滴加4滴溶液 先产生白色沉淀,再产生黄色沉淀 AgCl转化为AgI,AgI溶解度小于AgCl溶解度
D 取两份新制氯水,分别滴加溶液和淀粉KI溶液 前者有白色沉淀,后者溶液变蓝色 氯气与水的反应存在限度
A.A B.B C.C D.D
11.[2023年江苏高考真题]金属硫化物催化反应,既可以除去天然气中的,又可以获得。下列说法正确的是( )
A.该反应的
B.该反应的平衡常数
C.题图所示的反应机理中,步骤Ⅰ可理解为中带部分负电荷的S与催化剂中的M之间发生作用
D.该反应中每消耗,转移电子的数目约为
12.[2024年全国高考真题]如图所示的自催化反应,Y作催化剂。下列说法正确的是( )
A.X不能发生水解反应
B.Y与盐酸反应的产物不溶于水
C.Z中碳原子均采用杂化
D.随增大,该反应速率不断增大
13.[2024年重庆高考真题]醋酸甲酯制乙醇的反应为:。三个恒容密闭容器中分别加入醋酸甲酯和氢气,在不同温度下,反应t分钟时醋酸甲酯物质的量n如图所示。下列说法正确的是( )
A.该反应的
B.容器甲中平均反应速率
C.容器乙中当前状态下反应速率
D.容器丙中乙醇的体积分数为
14.[2024年新课标综合卷高考真题]常温下和的两种溶液中,分布系数δ与pH的变化关系如图所示。[比如:]
下列叙述正确的是( )
A.曲线M表示的变化关系
B.若酸的初始浓度为,则a点对应的溶液中有
C.的电离常数
D.时,电离度
二、非选择题:本题共4小题,共58分。
15.[2023年河北高考真题]闭环循环有利于提高资源利用率和实现绿色化学的目标。利用氨法浸取可实现废弃物铜包钢的有效分离,同时得到的可用于催化、医药、冶金等重要领域。工艺流程如下:
已知:室温下的
回答下列问题:
(1)首次浸取所用深蓝色溶液①由铜毛丝、足量液氨、空气和盐酸反应得到,其主要成分为_______(填化学式)。
(2)滤渣的主要成分为_______(填化学式)。
(3)浸取工序的产物为,该工序发生反应的化学方程式为_______。浸取后滤液的一半经氧化工序可得深蓝色溶液①,氧化工序发生反应的离子方程式为_______。
(4)浸取工序宜在之间进行,当环境温度较低时,浸取液再生后不需额外加热即可进行浸取的原因是_______。
(5)补全中和工序中主反应的离子方程式_______+_______。
(6)真空干燥的目的为_______。
16.[2024年黑龙江省、吉林省、辽宁省高考真题]为实现氯资源循环利用,工业上采用催化氧化法处理废气:
将和分别以不同起始流速通入反应器中,在360 ℃、400 ℃和440 ℃下反应,通过检测流出气成分绘制转化率曲线,如图所示(较低流速下转化率可近似为平衡转化率)。
回答下列问题:
(1)__________0(填“>”或“<”);__________℃。
(2)结合以下信息,可知的燃烧热__________。
(3)下列措施可提高M点转化率的是__________(填标号)。
A.增大的流速 B.将温度升高40 ℃
C.增大 D.使用更高效的催化剂
(4)图中较高流速时,小于和,原因是______________________________。
(5)设N点的转化率为平衡转化率,则该温度下反应的平衡常数__________。(用平衡物质的量分数代替平衡浓度计算)
(6)负载在上的催化活性高,稳定性强,和的晶体结构均可用下图表示,二者晶胞体积近似相等,与的密度比为1.66,则的相对原子质量为__________(精确至1)。
17.[2024年江西高考真题]托伐普坦是一种治疗心血管疾病的药物,其前体(L)合成步骤如图(部分试剂和条件略去)。
已知:
回答下列问题:
(1)化合物A_______(填“能”或“不能”)形成分子内氢键。
(2)写出由C生成D的化学反应方程式_______。
(3)写出G的结构简式_______。
(4)H到I的反应类型是_______。
(5)参照上述合成路线,试剂X的化学式是_______。
(6)K完全水解后,有机产物的名称是_______。
(7)E的消去产物()的同分异构体中,同时满足下列条件a、b和c的可能结构有_______种(立体异构中只考虑顺反异构);写出只满足下列条件a和c,不满足条件b的结构简式_______(不考虑立体异构)。
a)能与饱和碳酸氢钠溶液反应产生;
b)红外光谱中有碳碳双键特征吸收峰;
c)核磁共振氢谱峰面积比例为3∶3∶2∶1∶1。
18.[2023年全国甲卷高考真题]钴配合物溶于热水,在冷水中微溶,可通过如下反应制备:
具体步骤如下:
Ⅰ.称取,用水溶解。
Ⅱ.分批加入后,将溶液温度降至以下,加入活性炭、浓氨水,搅拌下逐滴加入的双氧水。
Ⅲ.加热至反应。冷却,过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的沸水中,趁热过滤。
Ⅴ.滤液转入烧杯,加入浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
回答下列问题:
(1)步骤Ⅰ中使用的部分仪器如下。
仪器a的名称是________。加快溶解的操作有________。
(2)步骤Ⅱ中,将温度降至10 ℃以下以避免________、________;可选用________降低溶液温度。
(3)指出下列过滤操作中不规范之处:________。
(4)步骤Ⅳ中,趁热过滤,除掉的不溶物主要为________。
(5)步骤Ⅴ中加入浓盐酸的目的是________。
参考答案
1.答案:C
解析:A.红山玉龙主要成分为和硅酸盐,属于无机非金属材料,A不符合题意;B.鎏金铁芯铜龙主要成分为Cu,属于金属材料,B不符合题意;C.云龙纹丝绸主要成分为蛋白质,属于有机高分子材料,C符合题意;D.云龙纹瓷瓶主要成分为硅酸盐,属于传统无机非金属材料,D不符合题意;故选C。
2.答案:C
解析:HClO分子中O与H、Cl分别形成共价键,每个原子最外层均达到稳定结构,A项正确;中子数为10的氧原子,其质量数为,可表示为,B项正确;中N形成3个σ键,孤电子对数为,价层电子对数为4,故的VSEPR模型为四面体形,图示给出的是的空间结构,C项错误;基态N原子的价电子排布式为,2s轨道上的2个电子自旋方向相反,2p轨道上的3个电子分别占据3个轨道,自旋方向相同,D项正确。
3.答案:B
解析:由分析知,a为,水解使溶液呈酸性,A错误;可与强碱反应生成四羟基合铝酸根离子,故可溶于过量的中,B正确;与过量的反应生成白色沉淀,C错误;和反应生成,可以溶于稀硝酸生成二氧化碳和,D错误。
4.答案:C
解析:A.NaCl固体与浓硫酸加热生成的HCl气体,缺少加热装置,故A错误;
B.氯化氢易溶于水,为充分吸收氯化氢并防止倒吸,氯化氢气体应从连接倒置漏斗的导管通入,故B错误;
C.用过滤法分离出氯化钠晶体,故C正确;
D.配制氯化钠溶液,定容时眼睛平视刻度线,故D错误;
选C。
5.答案:B
解析:该有机物含有酚羟基,故又可看作是酚类物质,酚羟基能显示酸性,且酸性强于;溶液显碱性,故该有机物可与溶液反应,A正确;
由分子结构可知,与醇羟基相连的C原子共与3个不同化学环境的C原子相连,且这3个C原子上均连接了H原子,因此,该有机物发生消去反应时,其消去反应产物最多有3种,B不正确;
该有机物酸性条件下的水解产物有2种,其中一种含有碳碳双键和2个醇羟基,这种水解产物既能通过发生加聚反应生成高聚物,也能通过缩聚反应生成高聚物;另一种水解产物含有羧基和酚羟基,其可以发生缩聚反应生成高聚物,C正确;
该有机物分子中含有酚羟基且其邻位上有H原子,故其可与浓溴水发生取代反应;还含有碳碳双键,故其可发生加成,因此,该有机物与反应时可发生取代和加成两种反应,D正确;
故选B
6.答案:D
解析:常温下,单质S呈固态,均呈气态,且相对分子质量,则分子间作用力,故单质的沸点:,A正确;的中心原子均采取杂化,但上分别有1,2个孤电子对,孤电子对数越多,对成键电子对的斥力越大,键角越小,故简单氢化物的键角:,B正确;向溶液中逐渐通入,先生成蓝色沉淀,当过量时,沉淀溶解生成深蓝色的溶液,C正确;配合物中提供空轨道,N原子提供孤电子对形成配位键,即其中配位原子是N,D错误。
7.答案:D
解析:在离子方程式中应以化学式保留,正确的离子方程式为,A错误;酸性条件下会将氧化成,与形成沉淀,滴加少量时的离子方程式为,滴加足量时的离子方程式为,B错误;电离平衡常数:与水反应生成的HClO与不反应,正确的离子方程式为,C错误;Cu与溶液反应生成,反应的离子方程式为,D正确。
8.答案:A
解析:从结构图可看出,该晶体中存在氢键,A正确;N的价电子排布式为,2p能级处于半满稳定状态,其第一电离能大于O,B错误;根据的电子排布式,可知其未成对电子数分别为1、2、2、3,C错误;该晶体中B、O原子轨道的杂化类型均为,为平面结构,则其中N的杂化类型为,D错误。
9.答案:D
解析:A.放电过程中负极锂失去电子形成锂离子,锂离子通过阳离子交换膜进入左侧生成,A错误;
B.锂为活泼金属,会和水反应,故电解质溶液不能为水溶液,B错误;
C.充电过程中电解LiCl失去电子发生氧化反应产生:,锂离子在阴极得到电子发生还原生成锂单质:,则每生成1 mol,同时生成2 mol Li;放电过程中,消耗6 mol Li,同时生成4 mol LiCl,则整个充放电过程来看,理论上每生成1mol,需消耗1 mol Li,C错误;
D.由分析,放电过程中,正极氮气得到电子发生还原反应生成,又转化为和LiCl,负极锂失去电子发生氧化反应生成锂离子,总反应为,D正确;
故选D。
10.答案:A
解析:题中现象说明从中转移到了浓KI溶液中,可得出相应结论,A正确;NaClO溶液具有强氧化性,能漂白pH试纸,故不能用pH试纸测定其酸碱性,B错误;该实验中过量,加入KI溶液,KI与过量的反应生成黄色沉淀,C错误;有白色沉淀产生说明有均具有强氧化性,均可以氧化KI,溶液变蓝不能说明有,故D错误。
11.答案:C
解析:反应为气体物质的量增多的反应,故该反应的,A错误;化学反应的平衡常数为生成物浓度的幂之积比反应物浓度的幂之积,因此该反应的平衡常数表达式为,B错误;由图示可以看出,步骤Ⅰ为中带部分负电荷的S与催化剂中的M之间发生作用,C正确;由反应的化学方程式可知,反应过程中中-4价的C转化为中+4价的C,电子转移可表示为,故反应中每消耗,转移4 mol电子,即转移电子的数目约为,D错误。
12.答案:C
解析:X中含有酯基和酰胺基,能发生水解反应,A错误;Y中含有亚氨基,与盐酸反应生成盐,产物可溶于水,B错误;Z中碳原子形成碳碳双键及苯环,均为杂化,C正确;Y是催化剂,可提高反应速率,但随着反应进行,反应物浓度不断减小,反应速率变慢,故随增大,反应速率不一定增大,D错误。
13.答案:D
解析:A.由分析,该反应的,A错误;
B.容器甲中平均反应速率,B错误;
C.温度越高反应速率越快,比较乙丙可知,丙达到平衡状态,但不确定乙是否平衡,不能确定正逆反应速率相对大小,C错误;
D.对丙而言:
容器丙中乙醇的体积分数为,D正确;
故选D。
14.答案:D
解析:Cl为弱吸电子基,则的酸性弱于,故。调pH时,溶液中分布系数减小的趋势快,分布系数增大的趋势快,溶液中分布系数减小的趋势缓慢,分布系数增大的趋势缓慢,故曲线M表示的变化关系,A错误;和均为弱酸,若酸的初始浓度为,则溶液的,但a点溶液的,则有外加酸,,B错误;,当时,,同理,,C错误;,当时,,,故,D正确。
15.答案:(1)
(2)Fe
(3);
(4)盐酸和液氨反应放热
(5);
(6)防止干燥过程中被空气中的氧化
解析:(1)首次浸取所用深蓝色溶液①由铜毛丝、足量液氨、空气和盐酸反应得到,主要物质成分呈现深蓝色,结合教材中铜氨配离子的颜色,可判断其阳离子为,根据元素守恒可知其阴离子为,故主要成分化学式为。
(2)根据流程图给出的信息,原料铜包钢经过浸取处理,铜被氧化后转化为进入溶液,铁仍为固体,且由流程图可知,滤渣的主要用途为炼钢,则可判断滤渣的主要成分为铁。
(3)由题给条件可知,浸取工序的反应物为铜单质和,产物为,根据原子守恒和得失电子守恒得到反应的化学方程式为。浸取后滤液的一部分经氧化工序可得深蓝色溶液①,从流程图氧化工序提供的信息可知,反应物有和,产物为,Cu元素由+1价变为+2价,则应得电子得到-2价氧,产物中有生成,则氧化工序发生反应的离子方程式应为。
(4)由题意可知,氧化过程的原料有液氨和盐酸,两种物质接触会发生酸碱中和反应(反应放热),放出的热量可以维持浸取工序温度,因此当环境温度较低时,浸取液再生后不需额外加热即可进行浸取。
(5)由流程图可知,中和工序后的主要步骤是洗涤和干燥,故中和工序析出CuCl沉淀,根据元素守恒、电荷守恒可以确定产物为CuCl、,因此中和工序中主反应的离子方程式为。
(6)铜元素在化合物中的常见价态有+1和+2,溶液或湿润状态下,+2价铜化合物比+1价铜化合物更稳定,产品CuCl中铜为+1价,湿润状态下易被氧化,中和后得到的产物CuCl经过洗涤后,仍会含有少量水分,若常压下热风干燥,则CuCl会被空气中的氧化为+2价铜化合物,要避免干燥过程中遇到氧气,一般会采用真空干燥。
16.答案:(1)<;360
(2)-285.8
(3)BD
(4)反应未达到平衡,温度低,反应速率慢,且反应物在催化剂表面接触时间短,相同时间内HCl的转化率低
(5)6
(6)101
解析:(1)该反应反应后气体分子数减少,。该反应为放热反应,达到平衡后,其他条件不变时,升高温度,平衡逆向移动,HCl的平衡转化率降低,由题图知,较低流速下,时HCl的转化率最大,故。
(2)将题中已知反应依次编号为①、②、③,根据盖斯定律,由①-②+③可得: ,故的燃烧热。
(3)由题图可知,增大HCl的流速,HCl的转化率降低,A错误;将温度升高40 ℃,即升温至400 ℃,由题图可知,HCl的转化率增大,B正确;增大,HCl的转化率减小,C错误;M点该反应未达到平衡,使用更高效的催化剂,可以加快反应速率,提高HCl的转化率,D正确。
(4)图中较高流速时,反应未达到平衡状态,温度低,反应速率慢,且较高流速时,反应物在催化剂表面接触时间短,故HCl的转化率低。
(5)N点起始时,HCl的平衡转化率为80%,设起始时HCl、的物质的量均为1 mol,列三段式:
则该温度下反应的平衡常数。
(6)二者晶体结构相同,晶胞体积近似相等,则二者密度之比等于摩尔质量之比,设Ru的相对原子质量为,则,解得。
17.答案:(1)能
(2)+→+HCl
(3)
(4)取代反应
(5)
(6)邻甲基苯甲酸
(7)9;
解析:(1)根据化合物A的结构简式以及形成氢键的条件,A中的羟基与处于邻位,可形成分子内氢键,故答案为能;
(2)对比C、D的结构简式可知,C中氨基上的1个“N-H”断裂,另一反应物上的S-Cl键断裂,C→D的反应类型为取代反应,其化学反应方程式为,故答案为;
(3)采用对比的方法,如F的分子式为,G分子式为,少了1个C,4个个O,即去掉了1个,对比H的结构简式可知,可知G的结构简式为,故答案为。
(4)由H和I的结构简式可知,H到I的反应类型为取代反应;故答案为取代反应;
(5)均为,因此X化学式为,故答案为;
(6)对比J和L的结构简式以及K的分子式,可推知K的结构简式为,完全水解后生成得到,名称为邻甲基苯甲酸:故答案为邻甲基苯甲酸;
(7)E的消去产物为,满足条件a、b、c的同分异构体中含有1个,1个碳碳双键,2个不相同的,符合条件的同分异构体有(存在顺反异构)、(存在顺反异构),(存在顺反异构)、(存在顺反异构),共有9种结构;只满足条件a和c,不满足b的分子中不含碳碳双键,应含有1个,2个不相同的,1个碳环,结构简式为;故答案为9;。
18.答案:(1)锥形瓶;升温、搅拌等
(2)浓氨水分解和挥发;双氧水分解;冰水浴
(3)玻璃棒没有靠在3层滤纸处、漏斗末端较长出(尖嘴部分)没有紧贴在“盛滤液”烧杯内壁
(4)活性炭
(5)利用同离子效应,促进尽可能完全析出,提高产率
解析:(1)仪器a的名称为锥形瓶,根据题给步骤Ⅰ中使用的部分仪器可知,加快溶解所采用的操作有用玻璃棒搅拌、用酒精灯加热。
(2)根据所加试剂的性质可分析将溶液温度降至10 ℃以下的原因,可选用冰水浴降温。
(4)该反应中活性炭作催化剂(反应前后不变),在冷水中微溶,则步骤Ⅲ过滤得到的固体为和活性炭的混合物,步骤Ⅳ中溶于含有少量盐酸的沸水中,趁热过滤得到的固体为活性炭。
(5)根据同离子效应可知,向滤液中加入浓盐酸(提供),能抑制溶解,利于析出橙黄色晶体。
同课章节目录
