2025年中考化学复习提升训练:流程题(含答案)
文档属性
| 名称 | 2025年中考化学复习提升训练:流程题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 10.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-07 10:45:34 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
中小学教育资源及组卷应用平台
2025年中考化学复习提升训练:流程题
1.氧化钇()被广泛用于航空航天涂层材料,以富钇稀土矿(主要成分为,含有少量的、CuO、等杂质)生产氧化钇的工艺流程如下:
(1)钇的原子结构示意图如图所示。钇的原子核内质子数为 , 。
(2)中Y的化合价为 ,“酸浸”过程中,氧化钇()溶于盐酸的化学方程式是 。
(3)“调pH”时,通入使溶液呈碱性,“滤渣”的主要成分是 。
(4)加入发生“沉钇”的化学反应为,X的化学式为 ,写出X在农业生产中的一种用途: 。
(5)“焙烧”的反应原理与煅烧相似,焙烧生成的化学方程式是 。
2.某种手机电路板中含有Fe、Cu、Ag、Ni等金属,如图是某工厂回收部分金属的流程图:
资料信息:,硫酸镍的化学式为。
(1)金属中加入足量稀硫酸的目的是 ,操作①的名称是 。
(2)滤液②中所含溶质的化学式为 。
(3)滤渣①中所含金属的化学式为 。
(4)滤液③和铁粉反应的化学方程式为 。
(5)Cu、Ag、Ni在溶液中的活动性顺序由强到弱依次是 。
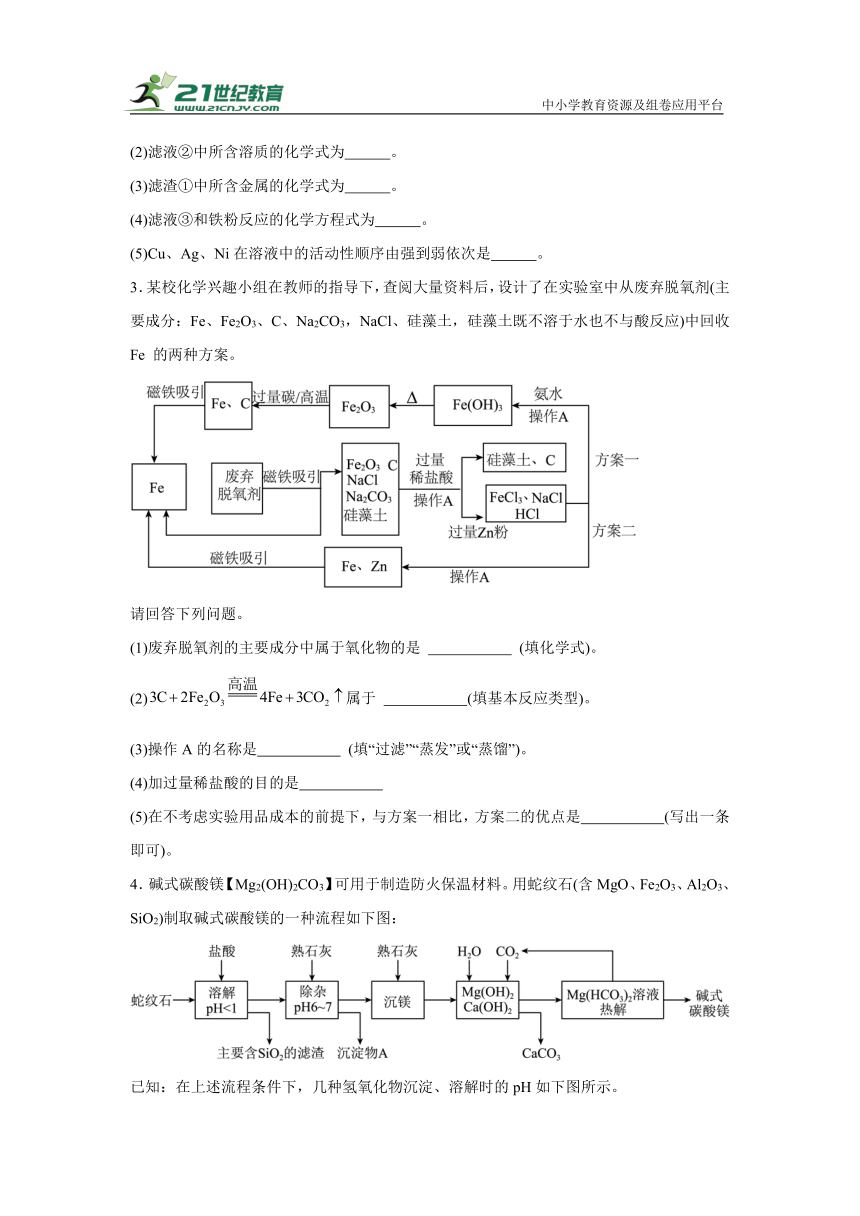
3.某校化学兴趣小组在教师的指导下,查阅大量资料后,设计了在实验室中从废弃脱氧剂(主要成分:Fe、Fe2O3、C、Na2CO3,NaCl、硅藻土,硅藻土既不溶于水也不与酸反应)中回收 Fe 的两种方案。
请回答下列问题。
(1)废弃脱氧剂的主要成分中属于氧化物的是 (填化学式)。
(2)属于 (填基本反应类型)。
(3)操作A的名称是 (填“过滤”“蒸发”或“蒸馏”)。
(4)加过量稀盐酸的目的是
(5)在不考虑实验用品成本的前提下,与方案一相比,方案二的优点是 (写出一条即可)。
4.碱式碳酸镁【Mg2(OH)2CO3】可用于制造防火保温材料。用蛇纹石(含MgO、Fe2O3、Al2O3、SiO2)制取碱式碳酸镁的一种流程如下图:
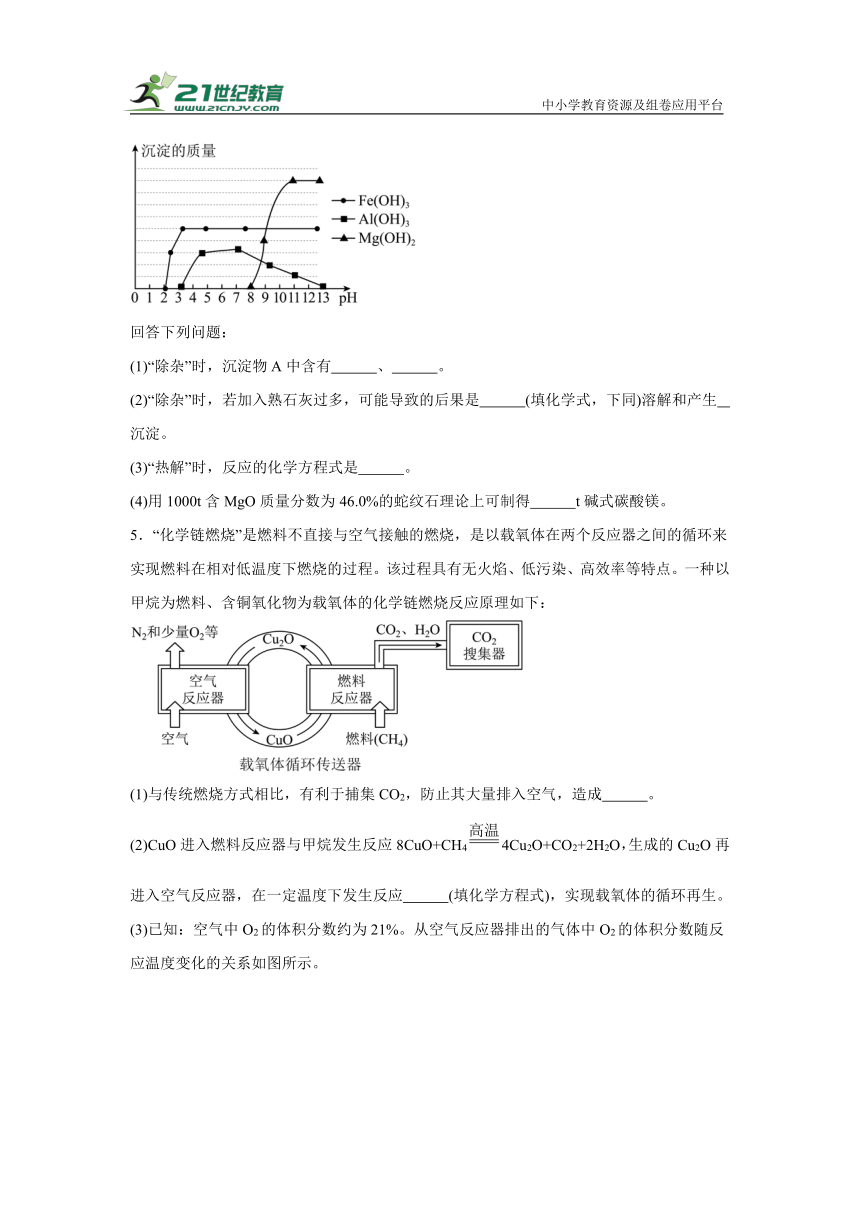
已知:在上述流程条件下,几种氢氧化物沉淀、溶解时的pH如下图所示。
回答下列问题:
(1)“除杂”时,沉淀物A中含有 、 。
(2)“除杂”时,若加入熟石灰过多,可能导致的后果是 (填化学式,下同)溶解和产生 沉淀。
(3)“热解”时,反应的化学方程式是 。
(4)用1000t含MgO质量分数为46.0%的蛇纹石理论上可制得 t碱式碳酸镁。
5.“化学链燃烧”是燃料不直接与空气接触的燃烧,是以载氧体在两个反应器之间的循环来实现燃料在相对低温度下燃烧的过程。该过程具有无火焰、低污染、高效率等特点。一种以甲烷为燃料、含铜氧化物为载氧体的化学链燃烧反应原理如下:
(1)与传统燃烧方式相比,有利于捕集CO2,防止其大量排入空气,造成 。
(2)CuO进入燃料反应器与甲烷发生反应8CuO+CH44Cu2O+CO2+2H2O,生成的Cu2O再进入空气反应器,在一定温度下发生反应 (填化学方程式),实现载氧体的循环再生。
(3)已知:空气中O2的体积分数约为21%。从空气反应器排出的气体中O2的体积分数随反应温度变化的关系如图所示。
①随着温度的升高,排出的气体中N2的体积分数 (选填“增大”或“减小”)。
②空气反应器中最适宜的反应温度范围是 (填选项)。
A.800~900℃ B.900~1000℃ C.1000~1030℃
6.以黄铜废料为原料制备石绿[Cu2(OH)2CO3]的一种流程如下:
【查阅资料】
①黄铜废料中含铜84%~86%,含锌14%~16%,杂质总量≤0.3%。
②59℃时,向5%的碳酸钠溶液中加入8%的硫酸铜溶液,可制得产率较高的石绿固体。
(1)“预处理”包括粉碎、酸浸等过程。“粉碎”的目的是 。使用稀硫酸酸浸的目的是 。
(2)写出铜与稀硫酸、过氧化氢溶液反应生成硫酸铜和水的化学方程式: 。
(3)步骤2获得的溶液中含有的阳离子有Cu2+和 (填离子符号)。
(4)“系列操作”包括过滤、洗涤、干燥等。干燥时温度过高会发生如下反应:,R的化学式为 。
(5)本实验中,提高石绿产率采取的措施有① ;② 。
7.金属材料在生产、生活中有着广泛的用途,金属资源应得到有效的利用和保护。
(1)利用金属矿产冶炼金属是获得金属材料的主要途径。工业上炼铁常用的原料有赤铁矿(主要成分为Fe2O3)。焦炭(主要成分为碳)、石灰石和空气。其主要反应过程如下:
①上述流程中X的化学式是 。写出反应Ⅱ的化学方程式: 。
②反应Ⅲ为炼铁的主要反应,其反应的化学方程式为 。
(2)为了从某废旧电子产品中提炼贵重金属,并得到硫酸铜溶液。有如下流程:
①“步骤二”中能与稀硫酸反应的是粗铜中的 (填化学式,下同),“步骤三”是滤渣Ⅰ中的 与空气中的氧气发生反应。
②写出“步骤四”中发生反应的化学方程式: 。。
8.铝的应用涉及生产、生活的各个方面。工业上用铝土矿(主要成分为Al2O3,含沙石等杂质)制备铝的主要流程如图所示:
(1)过程①、②都包含固液分离的操作,该操作名称是 。
(2)为加快铝土矿与NaOH溶液反应的速率,可采取的措施是 。
(3)生成Al(OH)3的反应中,反应物除了有NaAlO2,CO2,还有一种氧化物为 。
(4)写出电解氧化铝获得铝的化学方程式: 。
9.硫酸镁晶体(MgSO4·7H2O) 可用于炸药、瓷器、肥料等工业中。一种利用菱苦土(主要成分为氧化镁)制备高纯度硫酸镁晶体的工艺流程如下:
(1)X为常见的酸,X是 ;
(2)步骤②加入碳酸镁的目的是 ;
(3)通过操作Ⅱ可将活性炭等不溶物与溶液2分离,则操作Ⅱ的名称是 。
(4)经测定得到的硫酸镁晶体中MgSO4的质量分数为48.48%,
则晶体的纯度为 。(计算结果保留小数点后两位。纯度指样品中含主要成分的质量分数。)
10.氧化铁红是常见的含铁颜料。工业上可利用硫酸亚铁、氨水、空气等物质制取氧化铁红,主要流程如图所示:
已知:“合成”时发生的主要反应为
(1)的物质类别是 (填“盐”或“氧化物”)。
(2)“合成”过程中不断加入氨水,溶液的pH仍然保持基本不变,原因是 。
(3)“操作a”的名称是 。
(4)FeOOH在加热条件下分解,生成和一种常见物质,该反应的化学方程式为 。
11.酥油茶色泽淡黄,味道鲜美,香气扑鼻,既能止渴,又能充饥,还能暖身,确是高原佳饮。酥油茶制作流程如图,请完成下列问题。
(1)操作①在化学实验操作中的名称: 。
(2)酥油茶属于 (填“纯净物”或“混合物”)。
(3)生活中将硬水软化的方法是 。
(4)用洗涤剂清洗茶杯除去残余油污,这是利用洗涤剂的 作用。
(5)下列物质加入水中能形成溶液的是_____。
A.糌粑 B.白糖 C.酥油
12.金属钼(Mo)制成的合金有良好的机械性能,利用钼矿石(主要成分为MoS2)制备金属钼的简易流程如图所示。
回答下列问题:
(1)“灼烧”时,MoS2发生反应的化学方程式为 .
(2)中间产物(NH4)2MoO4中钼元素的化合价为 。
(3)“高温”发生反应所属的化学反应类型是 (填标号)。
a.化合反应 b.分解反应
c.置换反应 d.复分解反应
13.有一包白色粉末,可能含有、、、、中的一种或几种,某同学为了探究其成分,进行实验如下图。
参考资料:微溶于水,易溶于稀硝酸
请回答:
(1)根据步骤Ⅰ、步骤Ⅱ、步骤Ⅲ可知,白色粉末一定不含 (写化学式);
(2)写出步骤Ⅲ发生反应的化学方程式 ;
(3)由实验现象综合判断,无色溶液A溶质的组成中存在 种可能的组合。
14.某化学兴趣小组模拟工厂苛化法制备烧碱的流程如下
请回答:
(1)X常用作食品干燥剂,其化学式为 ;
(2)写出反应池中发生反应的化学方程式 ;
(3)实验室中将滤液A盛装在 仪器中完成操作2;
(4)滤液B可加入反应池中循环利用,目的是 。
15.海洋是一个巨大的资源宝库。广泛应用于火箭、导弹和飞机制造业的金属镁,就是利用从海水中提取的镁盐制取的。下图是模拟从海水中制取镁的简易流程。
根据流程回答下列问题:
(1)步骤①得到的母液是氯化钠的 (选填“饱和”或“不饱和”)溶液。
(2)步骤②操作中用到的玻璃仪器有烧杯、玻璃棒和 。
(3)步骤②中加入氢氧化钠溶液需过量的目的是 。
(4)写出步骤③中反应的化学方程式 。
(5)市场调研发现,的价格远低于NaOH,更适用于实际工业生产。在步骤②中,若要制得580t,理论上至少需要加入的质量是多少?(写出计算过程)
16.作为基建强国,我国在建筑和水利工程中大量使用到水泥。生产水泥时,加入适量可调节水泥硬化速率。工厂利用电石渣[主要成分为、MgO]制备的主要流程如下:
已知:MgO难溶,易溶,微溶。
(1)电石渣粉碎的目的是 。
(2)加入反应器中的试剂X的名称是 。
(3)反应器中发生的主要反应为 (写1个方程式即可),反应的基本类型是 。
(4)上述流程中,用于分离提纯的设备有 和洗涤槽。
17.实验室以一种工业废渣(主要成分为MgCO3,含少量FeO、Fe2O3、Al2O3)为原料制备MgCO3。实验过程如下:
已知:①在溶液中,pH=5.0时AlCl3完全转化为Al(OH)3沉淀,pH=8.5时MgCl2开始生成Mg(OH)2沉淀。
②MgCl2在过量Na2CO3溶液中会生成Mg(OH)2沉淀。
(1)“酸溶”时,MgCO3与稀盐酸反应的化学方程式为 。
(2)“氧化”时发生的反应为2FeCl2+2HCl+H2O2═2FeCl3+2H2O。
①反应前后化合价发生变化的元素有O、 。
②“酸溶”时需加入稍过量的稀盐酸,原因可能是 (写一条)。
(3)“调pH”时,需控制溶液pH为 。
(4)“沉镁”时,为提高MgCO3的纯度,试剂加入顺序为 (填“a”或“b”)。
a.向Na2CO3溶液中逐滴加入MgCl2溶液 b.向MgCl2溶液中逐滴加入Na2CO3溶液
18.硫化钠()广泛应用于染料、造纸等工业、以为原料制备的部分流程如图所示。
已知:为副产物,直接排放会造成环境污染。
(1)配平化学方程式:
(2)中S的化合价为 。
(3)图中标示出的物质中,属于单质的是 。
(4)设备2中,加入NaOH溶液的目的是 。
19.实验室中对某河水的水样进行净化处理,设计流程如图所示。
回答下列问题:
(1)明矾的作用是 。
(2)操作1的名称是 ,用到的玻璃仪器有 (填一种即可)。
(3)加活性炭是利用其 性除去水样中的异味等。
(4)净化水属于 (填“纯净物”或“混合物”)。
20.热电厂燃烧煤产生含有大量的烟气,某石膏板企业采用“碱—石灰”的方法使烟气脱硫,再生产石膏。其主要生产流程如下图所示。
(提示:①与的某些化学性质相似;②难溶于水)
(1)在实验室中,操作a使用的玻璃仪器有:烧杯和 。
(2)吸收塔内发生反应的化学方程式是 。
(3)流程中,可以循环利用的物质是 (填化学式)。
(4)理论上只需不断加入 (填化学式),便可持续实现烟气的脱硫处理。
(5)氧化塔中,反应前后化合价升高的元素是 。
21.钼(Mo)是制作特种钢的重要添加剂。工业以辉钼矿(主要成分为及少量的)为原料制备金属钼的主要流程如下。回答下列问题。
(1)在焙烧炉中,矿石要粉碎处理并从上部加入,其目的是 。炉内主要反应,X的化学式为 。
(2)反应器1中浓氨水可以溶解粗产品。搅拌器相当于实验室中的 (填一种仪器名称)。要实现废渣和溶液的分离,需要进行的主要操作是 (填操作名称)。
(3)反应器2中发生复分解反应,Y溶液中溶质的主要成分为 (填化学式)。
(4)反应器3中发生反应的化学方程式为 。
(5)为减少废气X对环境的影响,可用上述流程中的 溶液进行吸收。
22.海洋是巨大的资源宝库,海水综合利用的部分工艺流程图如图。请回答以下问题:
(1)粗盐含有的主要杂质为MgCl2、CaCl2,则固体B的主要成分是 和CaCO3.
(2)步骤①加入适量盐酸的目的是 。
(3)用NaCl制取纯碱(Na2CO3)。从元素守恒的角度,还需要含有 、氧元素的物质参加反应。
(4)步骤②中加入石灰乳充分反应后,还需进行的操作是 。
(5)步骤③中试剂D为 。
(6)钛(T)被称为航空金属,常用于建造空间站。工业上利用步骤④制备金属钛,其反应的化学方程式为 。
23.碳酸锂(Li2CO3)广泛应用于电池、陶瓷和医药等领域。利用浓缩后的盐湖卤水(含有NaCl、LiCl、Li2SO4和MgCl2)制备Li2CO3的工艺流程如下:
回答下列问题:
(1)浓缩后的盐湖卤水中含有的金属阳离子除Li+外,还有 (填离子符号)。
(2)“除杂1”所得滤渣的主要成分除CaSO4外,还有 。
(3)“除杂2”中加入Na2CO3溶液的目的是 。
(4)“滤液2”显 性(填“酸”、“中”或“碱”)。
(5)结合下图分析:
①“调pH”至溶液显中性,“操作1”为 。
②若未加盐酸“调pH”而直接进行“操作1”,析出的NaCl固体中可能含有LiOH,原因是 。
(6)“滤液3”一定是 (填化学式)的饱和溶液。
(7)“沉锂”时发生反应的化学方程式为 。
24.镁被誉为“21世纪最具开发应用潜力、绿色的战略性原材料”。用海水晒盐得到苦卤(含、NaCl等物质),从苦卤中提取镁的部分流程如下图所示。
回答下列问题:
(1)“苦卤”属于 (填“纯净物”或“混合物”)。
(2)写出中和池中反应的化学方程式: 。
(3)上述获取金属镁的整个流程中,涉及到的化学反应的基本类型共有 种。
(4)该流程中循环使用的物质是 。
(5)镁用于火箭、飞机等领域,体现了镁的哪些物理性质? (答一点)。
中小学教育资源及组卷应用平台
中小学教育资源及组卷应用平台
《2025年中考化学复习提升训练:流程题》参考答案
1.(1) 39 9
(2) +3/+3价
(3)、
(4) 作氮肥
(5)
2.(1) 使铁、镍与稀硫酸完全反应/将固体中的铁、镍全部除去 过滤
(2)
(3)、
(4)
(5)
3.(1)Fe2O3
(2)置换
(3)过滤
(4)使Fe2O3、Na2CO3完全反应
(5)节约能源
4.(1) Fe(OH)3 Al(OH)3
(2) Al(OH)3 Mg(OH)2
(3)2Mg(HCO3)2Mg2(OH)2CO3+H2O+3CO2
(4)816.5
5.(1)温室效应
(2)
(3) 减小 A
6.(1) 增大接触面积,使反应更充分 除锌
(2)
(3)H+
(4)CuO
(5) 控制温度 选择合适浓度的碳酸钠溶液和硫酸铜溶液
7.(1) CO2
(2) Al、Mg Cu
8.(1)过滤
(2)将铝土矿粉碎(搅拌、增大碱溶液的浓度、加热等)
(3)H2O/水
(4)
9.(1)硫酸/H2SO4
(2)将硫酸转化为硫酸镁,提纯硫酸镁
(3)过滤
(4)解:硫酸镁的化学式量=24+32+16×4=120,硫酸镁晶体的化学式量=24+32+16×4+18×7=246,硫酸镁晶体中MgSO4的质量分数为48.48%
设晶体的纯度为x
=
x≈99.4%
答:晶体的纯度为99.4%。
10.(1)氧化物
(2)合成时生成与氨水发生中和反应
(3)过滤
(4)
11.(1)过滤
(2)混合物
(3)煮沸
(4)乳化
(5)B
12.(1)
(2)+6价
(3)c
13.(1)、NaCl
(2)
(3)五/5
14.(1)CaO
(2)
(3)蒸发皿
(4)降低成本、减少污染
15.(1)饱和
(2)漏斗
(3)使MgCl2全部反应
(4)Mg(OH)2+2HCl=MgCl2+2H2O
(5)解:设至少需要Ca(OH)2的质量为x;
x=740t
答:至少需要Ca(OH)2的质量为740t。
16.(1)使反应完充分接触从而使反应更充分
(2)稀硫酸
(3) / 复分解反应
(4)过滤器
17.(1)MgCO3+2HCl=MgCl2+CO2↑+H2O;
(2) Fe 废渣溶解充分,提高原料的浸出率
(3)5.0≤pH<8.5
(4)b
18.(1)
(2)-2
(3)氢气/H2
(4)吸收H2S,防止污染环境同时生成硫化钠
19.(1)加速沉降(沉降等)
(2) 过滤 漏斗/玻璃棒/烧杯等
(3)吸附
(4)混合物
20.(1)漏斗、玻璃棒
(2)
(3)
(4)
(5)S
21.(1) 增大反应物的接触面积,使反应更充分 SO2
(2) 玻璃棒 过滤
(3)NH4Cl
(4)
(5)浓氨水
22.(1)Mg(OH)2
(2)除去氢氧化钠和碳酸钠
(3)碳
(4)过滤
(5)稀盐酸
(6)2Mg+TiCl4Ti+2MgCl2
23.(1)Na+、Mg2+
(2)Mg(OH)2
(3)除去“除杂1”中加入过量的Ca(OH)2
(4)碱
(5) 蒸发结晶,趁热过滤 溶液中含OH-(LiOH),LiOH溶解度小于NaCl溶解度
(6)NaCl
(7)
24.(1)混合物
(2)
(3)3/三
(4)氯气/Cl2
(5)轻质或延展性或良好的导电性和导热性等(合理即可)
中小学教育资源及组卷应用平台
2025年中考化学复习提升训练:流程题
1.氧化钇()被广泛用于航空航天涂层材料,以富钇稀土矿(主要成分为,含有少量的、CuO、等杂质)生产氧化钇的工艺流程如下:
(1)钇的原子结构示意图如图所示。钇的原子核内质子数为 , 。
(2)中Y的化合价为 ,“酸浸”过程中,氧化钇()溶于盐酸的化学方程式是 。
(3)“调pH”时,通入使溶液呈碱性,“滤渣”的主要成分是 。
(4)加入发生“沉钇”的化学反应为,X的化学式为 ,写出X在农业生产中的一种用途: 。
(5)“焙烧”的反应原理与煅烧相似,焙烧生成的化学方程式是 。
2.某种手机电路板中含有Fe、Cu、Ag、Ni等金属,如图是某工厂回收部分金属的流程图:
资料信息:,硫酸镍的化学式为。
(1)金属中加入足量稀硫酸的目的是 ,操作①的名称是 。
(2)滤液②中所含溶质的化学式为 。
(3)滤渣①中所含金属的化学式为 。
(4)滤液③和铁粉反应的化学方程式为 。
(5)Cu、Ag、Ni在溶液中的活动性顺序由强到弱依次是 。
3.某校化学兴趣小组在教师的指导下,查阅大量资料后,设计了在实验室中从废弃脱氧剂(主要成分:Fe、Fe2O3、C、Na2CO3,NaCl、硅藻土,硅藻土既不溶于水也不与酸反应)中回收 Fe 的两种方案。
请回答下列问题。
(1)废弃脱氧剂的主要成分中属于氧化物的是 (填化学式)。
(2)属于 (填基本反应类型)。
(3)操作A的名称是 (填“过滤”“蒸发”或“蒸馏”)。
(4)加过量稀盐酸的目的是
(5)在不考虑实验用品成本的前提下,与方案一相比,方案二的优点是 (写出一条即可)。
4.碱式碳酸镁【Mg2(OH)2CO3】可用于制造防火保温材料。用蛇纹石(含MgO、Fe2O3、Al2O3、SiO2)制取碱式碳酸镁的一种流程如下图:
已知:在上述流程条件下,几种氢氧化物沉淀、溶解时的pH如下图所示。
回答下列问题:
(1)“除杂”时,沉淀物A中含有 、 。
(2)“除杂”时,若加入熟石灰过多,可能导致的后果是 (填化学式,下同)溶解和产生 沉淀。
(3)“热解”时,反应的化学方程式是 。
(4)用1000t含MgO质量分数为46.0%的蛇纹石理论上可制得 t碱式碳酸镁。
5.“化学链燃烧”是燃料不直接与空气接触的燃烧,是以载氧体在两个反应器之间的循环来实现燃料在相对低温度下燃烧的过程。该过程具有无火焰、低污染、高效率等特点。一种以甲烷为燃料、含铜氧化物为载氧体的化学链燃烧反应原理如下:
(1)与传统燃烧方式相比,有利于捕集CO2,防止其大量排入空气,造成 。
(2)CuO进入燃料反应器与甲烷发生反应8CuO+CH44Cu2O+CO2+2H2O,生成的Cu2O再进入空气反应器,在一定温度下发生反应 (填化学方程式),实现载氧体的循环再生。
(3)已知:空气中O2的体积分数约为21%。从空气反应器排出的气体中O2的体积分数随反应温度变化的关系如图所示。
①随着温度的升高,排出的气体中N2的体积分数 (选填“增大”或“减小”)。
②空气反应器中最适宜的反应温度范围是 (填选项)。
A.800~900℃ B.900~1000℃ C.1000~1030℃
6.以黄铜废料为原料制备石绿[Cu2(OH)2CO3]的一种流程如下:
【查阅资料】
①黄铜废料中含铜84%~86%,含锌14%~16%,杂质总量≤0.3%。
②59℃时,向5%的碳酸钠溶液中加入8%的硫酸铜溶液,可制得产率较高的石绿固体。
(1)“预处理”包括粉碎、酸浸等过程。“粉碎”的目的是 。使用稀硫酸酸浸的目的是 。
(2)写出铜与稀硫酸、过氧化氢溶液反应生成硫酸铜和水的化学方程式: 。
(3)步骤2获得的溶液中含有的阳离子有Cu2+和 (填离子符号)。
(4)“系列操作”包括过滤、洗涤、干燥等。干燥时温度过高会发生如下反应:,R的化学式为 。
(5)本实验中,提高石绿产率采取的措施有① ;② 。
7.金属材料在生产、生活中有着广泛的用途,金属资源应得到有效的利用和保护。
(1)利用金属矿产冶炼金属是获得金属材料的主要途径。工业上炼铁常用的原料有赤铁矿(主要成分为Fe2O3)。焦炭(主要成分为碳)、石灰石和空气。其主要反应过程如下:
①上述流程中X的化学式是 。写出反应Ⅱ的化学方程式: 。
②反应Ⅲ为炼铁的主要反应,其反应的化学方程式为 。
(2)为了从某废旧电子产品中提炼贵重金属,并得到硫酸铜溶液。有如下流程:
①“步骤二”中能与稀硫酸反应的是粗铜中的 (填化学式,下同),“步骤三”是滤渣Ⅰ中的 与空气中的氧气发生反应。
②写出“步骤四”中发生反应的化学方程式: 。。
8.铝的应用涉及生产、生活的各个方面。工业上用铝土矿(主要成分为Al2O3,含沙石等杂质)制备铝的主要流程如图所示:
(1)过程①、②都包含固液分离的操作,该操作名称是 。
(2)为加快铝土矿与NaOH溶液反应的速率,可采取的措施是 。
(3)生成Al(OH)3的反应中,反应物除了有NaAlO2,CO2,还有一种氧化物为 。
(4)写出电解氧化铝获得铝的化学方程式: 。
9.硫酸镁晶体(MgSO4·7H2O) 可用于炸药、瓷器、肥料等工业中。一种利用菱苦土(主要成分为氧化镁)制备高纯度硫酸镁晶体的工艺流程如下:
(1)X为常见的酸,X是 ;
(2)步骤②加入碳酸镁的目的是 ;
(3)通过操作Ⅱ可将活性炭等不溶物与溶液2分离,则操作Ⅱ的名称是 。
(4)经测定得到的硫酸镁晶体中MgSO4的质量分数为48.48%,
则晶体的纯度为 。(计算结果保留小数点后两位。纯度指样品中含主要成分的质量分数。)
10.氧化铁红是常见的含铁颜料。工业上可利用硫酸亚铁、氨水、空气等物质制取氧化铁红,主要流程如图所示:
已知:“合成”时发生的主要反应为
(1)的物质类别是 (填“盐”或“氧化物”)。
(2)“合成”过程中不断加入氨水,溶液的pH仍然保持基本不变,原因是 。
(3)“操作a”的名称是 。
(4)FeOOH在加热条件下分解,生成和一种常见物质,该反应的化学方程式为 。
11.酥油茶色泽淡黄,味道鲜美,香气扑鼻,既能止渴,又能充饥,还能暖身,确是高原佳饮。酥油茶制作流程如图,请完成下列问题。
(1)操作①在化学实验操作中的名称: 。
(2)酥油茶属于 (填“纯净物”或“混合物”)。
(3)生活中将硬水软化的方法是 。
(4)用洗涤剂清洗茶杯除去残余油污,这是利用洗涤剂的 作用。
(5)下列物质加入水中能形成溶液的是_____。
A.糌粑 B.白糖 C.酥油
12.金属钼(Mo)制成的合金有良好的机械性能,利用钼矿石(主要成分为MoS2)制备金属钼的简易流程如图所示。
回答下列问题:
(1)“灼烧”时,MoS2发生反应的化学方程式为 .
(2)中间产物(NH4)2MoO4中钼元素的化合价为 。
(3)“高温”发生反应所属的化学反应类型是 (填标号)。
a.化合反应 b.分解反应
c.置换反应 d.复分解反应
13.有一包白色粉末,可能含有、、、、中的一种或几种,某同学为了探究其成分,进行实验如下图。
参考资料:微溶于水,易溶于稀硝酸
请回答:
(1)根据步骤Ⅰ、步骤Ⅱ、步骤Ⅲ可知,白色粉末一定不含 (写化学式);
(2)写出步骤Ⅲ发生反应的化学方程式 ;
(3)由实验现象综合判断,无色溶液A溶质的组成中存在 种可能的组合。
14.某化学兴趣小组模拟工厂苛化法制备烧碱的流程如下
请回答:
(1)X常用作食品干燥剂,其化学式为 ;
(2)写出反应池中发生反应的化学方程式 ;
(3)实验室中将滤液A盛装在 仪器中完成操作2;
(4)滤液B可加入反应池中循环利用,目的是 。
15.海洋是一个巨大的资源宝库。广泛应用于火箭、导弹和飞机制造业的金属镁,就是利用从海水中提取的镁盐制取的。下图是模拟从海水中制取镁的简易流程。
根据流程回答下列问题:
(1)步骤①得到的母液是氯化钠的 (选填“饱和”或“不饱和”)溶液。
(2)步骤②操作中用到的玻璃仪器有烧杯、玻璃棒和 。
(3)步骤②中加入氢氧化钠溶液需过量的目的是 。
(4)写出步骤③中反应的化学方程式 。
(5)市场调研发现,的价格远低于NaOH,更适用于实际工业生产。在步骤②中,若要制得580t,理论上至少需要加入的质量是多少?(写出计算过程)
16.作为基建强国,我国在建筑和水利工程中大量使用到水泥。生产水泥时,加入适量可调节水泥硬化速率。工厂利用电石渣[主要成分为、MgO]制备的主要流程如下:
已知:MgO难溶,易溶,微溶。
(1)电石渣粉碎的目的是 。
(2)加入反应器中的试剂X的名称是 。
(3)反应器中发生的主要反应为 (写1个方程式即可),反应的基本类型是 。
(4)上述流程中,用于分离提纯的设备有 和洗涤槽。
17.实验室以一种工业废渣(主要成分为MgCO3,含少量FeO、Fe2O3、Al2O3)为原料制备MgCO3。实验过程如下:
已知:①在溶液中,pH=5.0时AlCl3完全转化为Al(OH)3沉淀,pH=8.5时MgCl2开始生成Mg(OH)2沉淀。
②MgCl2在过量Na2CO3溶液中会生成Mg(OH)2沉淀。
(1)“酸溶”时,MgCO3与稀盐酸反应的化学方程式为 。
(2)“氧化”时发生的反应为2FeCl2+2HCl+H2O2═2FeCl3+2H2O。
①反应前后化合价发生变化的元素有O、 。
②“酸溶”时需加入稍过量的稀盐酸,原因可能是 (写一条)。
(3)“调pH”时,需控制溶液pH为 。
(4)“沉镁”时,为提高MgCO3的纯度,试剂加入顺序为 (填“a”或“b”)。
a.向Na2CO3溶液中逐滴加入MgCl2溶液 b.向MgCl2溶液中逐滴加入Na2CO3溶液
18.硫化钠()广泛应用于染料、造纸等工业、以为原料制备的部分流程如图所示。
已知:为副产物,直接排放会造成环境污染。
(1)配平化学方程式:
(2)中S的化合价为 。
(3)图中标示出的物质中,属于单质的是 。
(4)设备2中,加入NaOH溶液的目的是 。
19.实验室中对某河水的水样进行净化处理,设计流程如图所示。
回答下列问题:
(1)明矾的作用是 。
(2)操作1的名称是 ,用到的玻璃仪器有 (填一种即可)。
(3)加活性炭是利用其 性除去水样中的异味等。
(4)净化水属于 (填“纯净物”或“混合物”)。
20.热电厂燃烧煤产生含有大量的烟气,某石膏板企业采用“碱—石灰”的方法使烟气脱硫,再生产石膏。其主要生产流程如下图所示。
(提示:①与的某些化学性质相似;②难溶于水)
(1)在实验室中,操作a使用的玻璃仪器有:烧杯和 。
(2)吸收塔内发生反应的化学方程式是 。
(3)流程中,可以循环利用的物质是 (填化学式)。
(4)理论上只需不断加入 (填化学式),便可持续实现烟气的脱硫处理。
(5)氧化塔中,反应前后化合价升高的元素是 。
21.钼(Mo)是制作特种钢的重要添加剂。工业以辉钼矿(主要成分为及少量的)为原料制备金属钼的主要流程如下。回答下列问题。
(1)在焙烧炉中,矿石要粉碎处理并从上部加入,其目的是 。炉内主要反应,X的化学式为 。
(2)反应器1中浓氨水可以溶解粗产品。搅拌器相当于实验室中的 (填一种仪器名称)。要实现废渣和溶液的分离,需要进行的主要操作是 (填操作名称)。
(3)反应器2中发生复分解反应,Y溶液中溶质的主要成分为 (填化学式)。
(4)反应器3中发生反应的化学方程式为 。
(5)为减少废气X对环境的影响,可用上述流程中的 溶液进行吸收。
22.海洋是巨大的资源宝库,海水综合利用的部分工艺流程图如图。请回答以下问题:
(1)粗盐含有的主要杂质为MgCl2、CaCl2,则固体B的主要成分是 和CaCO3.
(2)步骤①加入适量盐酸的目的是 。
(3)用NaCl制取纯碱(Na2CO3)。从元素守恒的角度,还需要含有 、氧元素的物质参加反应。
(4)步骤②中加入石灰乳充分反应后,还需进行的操作是 。
(5)步骤③中试剂D为 。
(6)钛(T)被称为航空金属,常用于建造空间站。工业上利用步骤④制备金属钛,其反应的化学方程式为 。
23.碳酸锂(Li2CO3)广泛应用于电池、陶瓷和医药等领域。利用浓缩后的盐湖卤水(含有NaCl、LiCl、Li2SO4和MgCl2)制备Li2CO3的工艺流程如下:
回答下列问题:
(1)浓缩后的盐湖卤水中含有的金属阳离子除Li+外,还有 (填离子符号)。
(2)“除杂1”所得滤渣的主要成分除CaSO4外,还有 。
(3)“除杂2”中加入Na2CO3溶液的目的是 。
(4)“滤液2”显 性(填“酸”、“中”或“碱”)。
(5)结合下图分析:
①“调pH”至溶液显中性,“操作1”为 。
②若未加盐酸“调pH”而直接进行“操作1”,析出的NaCl固体中可能含有LiOH,原因是 。
(6)“滤液3”一定是 (填化学式)的饱和溶液。
(7)“沉锂”时发生反应的化学方程式为 。
24.镁被誉为“21世纪最具开发应用潜力、绿色的战略性原材料”。用海水晒盐得到苦卤(含、NaCl等物质),从苦卤中提取镁的部分流程如下图所示。
回答下列问题:
(1)“苦卤”属于 (填“纯净物”或“混合物”)。
(2)写出中和池中反应的化学方程式: 。
(3)上述获取金属镁的整个流程中,涉及到的化学反应的基本类型共有 种。
(4)该流程中循环使用的物质是 。
(5)镁用于火箭、飞机等领域,体现了镁的哪些物理性质? (答一点)。
中小学教育资源及组卷应用平台
中小学教育资源及组卷应用平台
《2025年中考化学复习提升训练:流程题》参考答案
1.(1) 39 9
(2) +3/+3价
(3)、
(4) 作氮肥
(5)
2.(1) 使铁、镍与稀硫酸完全反应/将固体中的铁、镍全部除去 过滤
(2)
(3)、
(4)
(5)
3.(1)Fe2O3
(2)置换
(3)过滤
(4)使Fe2O3、Na2CO3完全反应
(5)节约能源
4.(1) Fe(OH)3 Al(OH)3
(2) Al(OH)3 Mg(OH)2
(3)2Mg(HCO3)2Mg2(OH)2CO3+H2O+3CO2
(4)816.5
5.(1)温室效应
(2)
(3) 减小 A
6.(1) 增大接触面积,使反应更充分 除锌
(2)
(3)H+
(4)CuO
(5) 控制温度 选择合适浓度的碳酸钠溶液和硫酸铜溶液
7.(1) CO2
(2) Al、Mg Cu
8.(1)过滤
(2)将铝土矿粉碎(搅拌、增大碱溶液的浓度、加热等)
(3)H2O/水
(4)
9.(1)硫酸/H2SO4
(2)将硫酸转化为硫酸镁,提纯硫酸镁
(3)过滤
(4)解:硫酸镁的化学式量=24+32+16×4=120,硫酸镁晶体的化学式量=24+32+16×4+18×7=246,硫酸镁晶体中MgSO4的质量分数为48.48%
设晶体的纯度为x
=
x≈99.4%
答:晶体的纯度为99.4%。
10.(1)氧化物
(2)合成时生成与氨水发生中和反应
(3)过滤
(4)
11.(1)过滤
(2)混合物
(3)煮沸
(4)乳化
(5)B
12.(1)
(2)+6价
(3)c
13.(1)、NaCl
(2)
(3)五/5
14.(1)CaO
(2)
(3)蒸发皿
(4)降低成本、减少污染
15.(1)饱和
(2)漏斗
(3)使MgCl2全部反应
(4)Mg(OH)2+2HCl=MgCl2+2H2O
(5)解:设至少需要Ca(OH)2的质量为x;
x=740t
答:至少需要Ca(OH)2的质量为740t。
16.(1)使反应完充分接触从而使反应更充分
(2)稀硫酸
(3) / 复分解反应
(4)过滤器
17.(1)MgCO3+2HCl=MgCl2+CO2↑+H2O;
(2) Fe 废渣溶解充分,提高原料的浸出率
(3)5.0≤pH<8.5
(4)b
18.(1)
(2)-2
(3)氢气/H2
(4)吸收H2S,防止污染环境同时生成硫化钠
19.(1)加速沉降(沉降等)
(2) 过滤 漏斗/玻璃棒/烧杯等
(3)吸附
(4)混合物
20.(1)漏斗、玻璃棒
(2)
(3)
(4)
(5)S
21.(1) 增大反应物的接触面积,使反应更充分 SO2
(2) 玻璃棒 过滤
(3)NH4Cl
(4)
(5)浓氨水
22.(1)Mg(OH)2
(2)除去氢氧化钠和碳酸钠
(3)碳
(4)过滤
(5)稀盐酸
(6)2Mg+TiCl4Ti+2MgCl2
23.(1)Na+、Mg2+
(2)Mg(OH)2
(3)除去“除杂1”中加入过量的Ca(OH)2
(4)碱
(5) 蒸发结晶,趁热过滤 溶液中含OH-(LiOH),LiOH溶解度小于NaCl溶解度
(6)NaCl
(7)
24.(1)混合物
(2)
(3)3/三
(4)氯气/Cl2
(5)轻质或延展性或良好的导电性和导热性等(合理即可)
同课章节目录
