2025年中考化学第一轮专题复习课题二 空气和氧气(无答案)
文档属性
| 名称 | 2025年中考化学第一轮专题复习课题二 空气和氧气(无答案) | 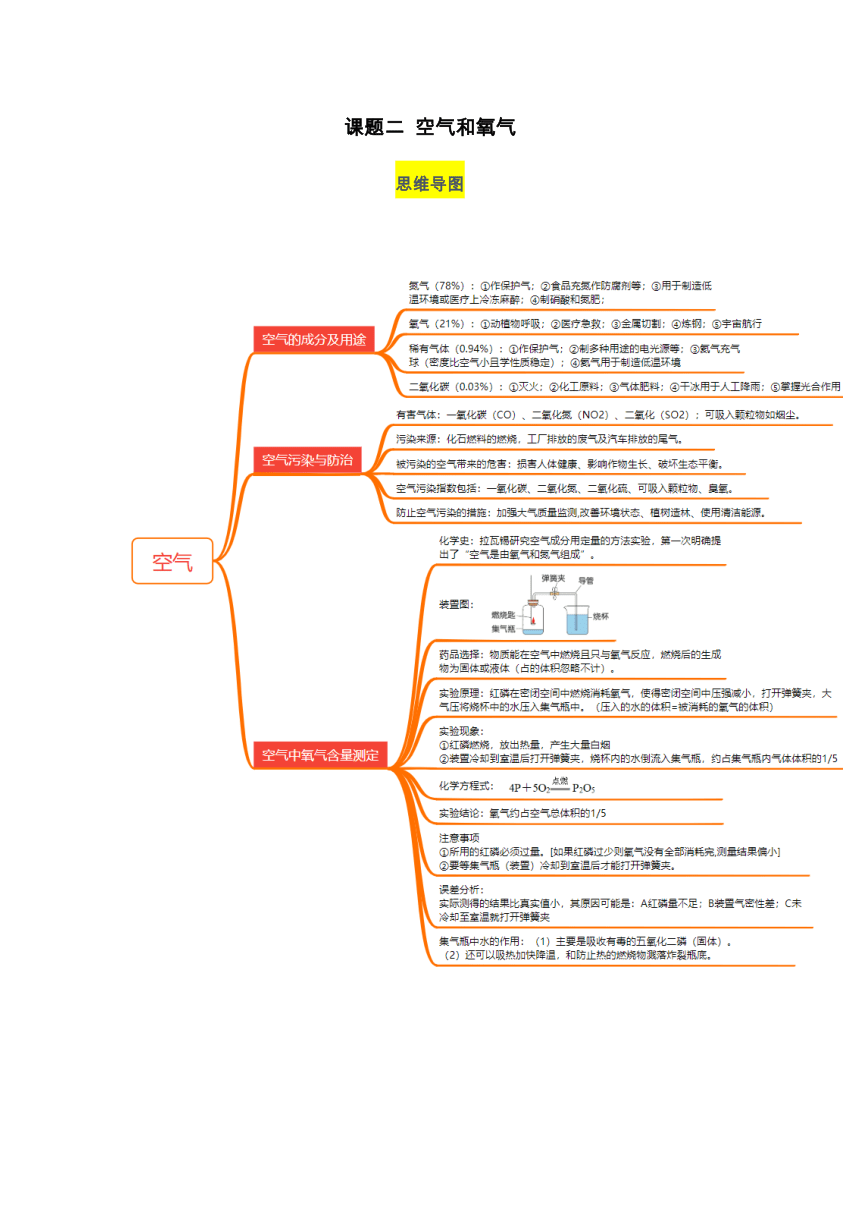 | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-08 23:02:45 | ||
图片预览





文档简介
课题二 空气和氧气
思维导图
知识清单
知识点一 空气的成分及用途
一、空气的成分及体积分数
1.空气是混合物,主要成分(______________):氮气(N2)_______,氧气(O2)_______(氮气与氧气体积比约为4比1),稀有气体_______,二氧化碳(CO2)_______,其它气体和杂质_______。
2. 空气成分口诀:氮78,氧21,0.94是稀气,两个0.03分别是CO2和杂气。
二、各成分的用途
1.氧气
性质 对应的用途
氧气 能供给呼吸 供______________、______________、_______、_______等
能支持燃烧 _______、_______、气割、航空航天
2.氮气
性质 对应的用途
氮气 与某些物质反应 制硝酸和_______
化学性质_______ 作_______: ①食品充氮防_______ ②灯泡充氮防_______ ③在氮气氛围中焊接金属防止______________
液氮温度_______ 用于制造_______环境: ①医疗上_______ ②超导材料在低温环境下显示超导性能
3.稀有气体
性质 对应的用途
稀有气体 物理 性质 无色、无味气体
通电时_________________ _____________________ 如:航标灯、照明灯、闪光灯和霓虹灯
化学性质______________ 作_______
氦气 ①氦气充气球(密度比空气小且______________) ②氦气用于制造低温环境
知识点二 空气的污染与防治
1.空气污染物:①烟尘:可吸入颗粒物;②有毒气体:一氧化碳、二氧化氮和二氧化硫等,这三种气体都是有毒气体。③臭氧O3.
2.目前计入空气质量评价的主要污染物有:___________、___________、___________、_________________、___________________、___________。
3.空气污染物来源:化石燃料的燃烧,工厂排放的废气,汽车排放的尾气。
4.空气污染造成的危害:损害___________、影响作物生长、破坏___________。
5.存在的环境问题:___________(___________含量过多引起,其他如甲烷等也能造成)、___________(飞机的尾气、制冷剂氟里昂的排放)、___________(由___________、___________引起)。
6.防止空气污染的措施:使用___________,加强___________________,积极___________、___________。
注意:二氧化碳能造成温室效应加剧,但不是空气污染物和有害气体。
知识点三 空气中氧气含量的测定
一.拉瓦锡用定量的方法研究空气的成分
实验装置 实验现象 实验结论
一部分银白色的液态汞变成_________色粉末,容器里空气的体积大约减少了________…… 空气由______和_______组成, 其中氧气约占空气总体积的___________。
二、空气中氧气含量的测定
1.红磷燃烧法测定空气中氧气的含量
实验装置
实验原理 红磷燃烧消耗集气瓶内的氧气,瓶内气体___________,压强___________,冷却后打开弹簧夹,烧杯内的水会被压入集气瓶,进入水的体积即为瓶内消耗___________的体积。
实验现象 ①红磷燃烧,产生___________,并放出热量; ②冷却后打开弹簧夹,烧杯中的水_______________,瓶内液面上升约___________。
实验结论 氧气约占空气总体积的___________。
化学方程式 ______________________
误差分析 进入水的体积小于集气瓶总体积的1/5的原因 ①红磷的量不足 ②装置漏气,塞子没塞紧 ③红磷熄灭后未冷却至室温 ④有部分水留在导管中未进入集气瓶 ⑤燃烧到一定程度时,瓶内氧气含量小,红磷不能继续燃烧
进入水的体积大于集气瓶总体积的1/5的原因 ①红磷点燃后伸入瓶内过慢,使装置内气体受热逸出,导致进入瓶内的水的体积偏大 ②弹簧夹未夹紧,红磷燃烧时集气瓶内气体受热从导管逸出
药品选择 选择原则 ①能在空气中燃烧 ②只与空气中的氧气反应 ③生成物最好为固体或液体(如果有气体,该气体要能被水或某溶液完全吸收)
红磷替代品的选择 ①若装置不变,判断下列药品能否代替红磷进行实验,并说明原因: 铁丝:不能,因为铁丝在空气中不能燃烧
镁条:不能,因为镁能与空气中的氮气、二氧化碳反应
木炭:不能,因为木炭在空气中燃烧生成二氧化碳和一氧化碳气体,装置内压强变化不明显
②若将集气瓶中的水换为氢氧化钠溶液,则硫粉可以替代红磷进行实验
2.其他的测量装置
装置改进的目的:污染更小,数据误差更小,操作更简便,现象更明显,更环保,更节约药品材料等。
3.测定空气中氧气含量的数字化实验
实验装置 实验步骤
将氧气传感器与数据采集器、计算机连接; 把氧气传感器插入盛有空气的容器,采集数据; 通过相关软件处理数据,并在计算机屏幕上显示空气中氧气的含量。
数字化实验的优点:直观、可视。能够将压强、浓度等,通过传感器转化为电信号,然后通过数据采集器进入电脑,将实验过程中的各种变化量,用数据图像等直观形式表现出来。
知识点四 氧气的性质
一、氧气的物理性质
标准状况下,氧气是________________的气体;密度比空气___________(可用向上排空气法收集);_________溶于水(可用排水法收集)。降温后,氧气可以变为_________色的液体,甚至___________。
二、氧气的化学性质
氧气的化学性质___________,氧气具有___________。
1.氧气能支持燃烧
(1)操作:把带有火星的木条伸到盛有氧气的集气瓶中。
(2)现象及结论:___________,说明氧气能___________。
(3)应用:用于检验氧气:将_________________________________,若复燃则是氧气。
【名师拓展】
(1)在空气中,带火星的木条不能复燃,并渐渐熄灭;在氧气中,带火星的木条复燃,并剧烈燃烧。
(2)若带火星的木条不复燃,有两种可能:气体中不含氧气或含有的氧气量较少。
(3)鉴别两种气体(其中有一种是氧气):用带火星的木条;鉴别三种气体(其中有一种是氧气):用燃着的木条。
2.氧气与非金属(碳、硫、磷)的反应
(1)木炭(黑色固体)燃烧
现象:空气中发出红光,放出热量,生成____________________________________________。
氧气中发出____,放出热量,生成____________________________________________。
化学方程式:_________________________________
(2)硫粉(淡黄色)燃烧
现象:空气中______________________,放出热量,_________________________________。
氧气中______________________,放出热量,_________________________________。
化学方程式 :_________________________________注意事项:实验时,要在______________________(_________________________________)。
(3)红磷(暗红色固体)燃烧
现象:氧气中剧烈燃烧,放出热量,__________________化学方程式:_________________________________注意:五氧化二磷(P2O5)是固体,不是气体
3.氧气与金属(铁)的反应
铁丝(银白色固体)燃烧
现象:
空气中:______________________;氧气中:___________,___________,___________,___________。
化学方程式:_________________________________【注意事项】
① 用砂纸把细铁丝磨成光亮的银白色,是为了_________________________________。
② 将细铁丝盘成螺旋状,是为了_________________________________。
③ 把细铁丝绕在火柴上,是为了_________________________________。
④ 待火柴快燃尽时才缓慢插入盛有氧气的集气瓶中,是为了_________________________。
⑤ 由上向下缓慢伸进盛有氧气的集气瓶中,是为了_________________________________。
⑥ 集气瓶里要预先装少量水或在瓶底铺上一薄层细沙,是为了_______________________。
4.缓慢氧化
某些物质在一些条件下,与_________发生缓慢的氧化反应,称为缓慢氧化。缓慢氧化也_________热。
如:___________,___________,___________,___________,___________等。
5.总结
(1)氧气是一种化学性质比较活泼的气体,在一定的条件下,能与许多物质发生反应并放出大量的热。在这些反应中,氧气提供氧,具有氧化性。
(2)物质在氧气中燃烧程度比空气中剧烈,说明____________________________________________。
(3)物质燃烧时的现象
一般气体燃烧会产生火焰;固体直接燃烧产生光或者火星;生成物有固体时,一般都会产生烟。
【归纳总结】
氧气与常见物质发生的反应
物质 反应现象 化学方程式(表达式)
磷 产生大量白烟、放热 4P+5O22P2O5
木炭 ① 木炭在空气中燃烧时持续红热,无烟无焰;木炭在氧气中剧烈燃烧,并发出白光 ② 放热、生成能使澄清石灰水变浑浊的气体 C+O2CO2
硫 ① 在空气中燃烧发出淡蓝色火焰,在氧气中燃烧发出蓝紫色火焰 ② 放热、生成有刺激性气味的气体 S+ O2SO2
氢气 ① 纯净的氢气在空气中燃烧,产生淡蓝色火焰 ② 放热、生成能使无水硫酸铜变蓝的液体 2H2+O22H2O
铁 铁在氧气中剧烈燃烧,火星四射,放热,生成黑色固体 3Fe+2O2Fe3O4
铝 铝在氧气中燃烧,发出耀眼的白光,放热,生成白色固体 4Al+3O22Al2O3
铝在空气中与氧气反应,表面形成致密的氧化膜 4Al+3O2=2Al2O3
镁 镁在空气中燃烧,发出耀眼的白光、放热、生成白色粉末 2Mg+O22MgO
铜 红色的固体逐渐变成黑色 2Cu+O22CuO
汞 银白色液体逐渐变成红色 2Hg+O22HgO
一氧化碳 产生蓝色火焰,放热,生成能使澄清石灰水变浑浊的气体 2CO+O22CO2
甲烷 产生明亮的蓝色火焰,放热,产生能使无水硫酸铜变蓝的液体,生成能使澄清石灰水变浑浊的气体 CH4+2O2CO2+2H2O
蜡烛 火焰发出白光,放热,产生能使无水硫酸铜变蓝的液体,生成能使澄清石灰水变浑浊的气体 石蜡+氧气水+二氧化碳
知识点五 氧气的实验室制法
一、氧气的工业制法
1.方法:______________________
2.原理:利用_________________________________不同。
3.具体过程:在低温下加压,使空气___________,然后___________,液态氮的沸点比液态氧的沸点___________,___________先蒸发出来,剩下主要是___________。
二、氧气的实验室制法
在实验室中,常采用___________或___________分解等方法制氧气。
【名师拓展】实验室制氧气选择药品和反应时需考虑的因素:
1.制氧气的原料须是含氧的物质;
2.利用比较简单的实验条件就能较快得到氧气;
3.生成的气体成分单一,便于收集 。
三、加热高锰酸钾制氧气
1.药品:高锰酸钾(___________色固体)
2.原理:____________________________________________
3.装置:
(1)发生装置:加热固体制气体(___________型装置)
(2)收集装置:
①排水法收集:依据氧气___________溶于水且不与水反应。
②向上排空气法收集:依据氧气的______________________。
4.主要实验步骤:
(1)查:组装仪器,检查______________________;
(2)装:把药品装入试管内,平铺在试管底部,管口塞______________________,用带导管的单孔橡皮塞塞紧试管口;
(3)定:用铁夹夹持试管,并固定在铁架台上;
(4)点:点燃酒精灯加热(记得先___________,防止试管受热不均破裂);
(5)收:用排水法收集氧气;
(6)移:实验完毕,先把导气管从水槽中移出水面(防止_________________________________);
(7)熄:熄灭酒精灯。
可简记为:“茶庄定点收利息”(每个字代表一个步骤:①查②装③定④点⑤收⑥移⑦熄)。
四、过氧化氢分解制取氧气
1.药品:过氧化氢(H2O2)溶液和二氧化锰(MnO2)
过氧化氢溶液俗名 “___________”,是一种________色溶液,过氧化氢在___________下可以分解放出氧气;二氧化锰是一种___________色粉末。
2.原理:_________________________________
3.实验装置:
发生装置:_________________装置(固体与液体反应类型,不需加热)
收集装置:排水法、向上排空气法
4.实验步骤
(1)检查装置的气密性。
(2)向锥形瓶中加入___________固体。
(3)塞好带有分液漏斗(或长颈漏斗)和导管的双孔橡胶塞。
(4)向分液漏斗(或长颈漏斗)中加入过氧化氢溶液。
(5)用_________(或________排空气法)收集气体。
【名师拓展】
固液不加热型不同装置的优点:
A B C
(1)装置A简单,所用仪器少
(2)装置B方便添加液体药品
(3)装置C可以控制液体药品的滴加速度,从而产生平稳的气流;其中分液漏斗可以用注射器代替。
5.验满方法
(1)用排水法收集:当观察到集气瓶中的水排完,集气瓶口有大量气泡冒出时,证明已收集满。
(2)用向上排空气法收集:将___________木条放在___________,若木条复燃,证明已收集满。
6.放置方法:___________在桌子上,并盖上___________。
知识点六 催化剂
1.概念:在化学反应中能___________其他物质的___________,但___________和___________在反应前后___________的物质。
2.特点:一变(改变反应速率,___________);两不变(质量、化学性质不变)
3.理解:①催化剂不能改变生成物的质量。
②催化剂不是反应物也不是生成物(写在反应条件上)。
③一种催化剂只针对某一反应,不同的反应,催化剂可能相同,某一反应的催化剂可能不只一种。
4.证明某物质是催化剂:
①______________________:相同条件下,加或者不加药品对比实验;
②______________________:实验前称量一次,实验后分离出来再称量一次;
③______________________:将分离出来的物质再进行实验①的操作,
观察是否还能改变反应速率。
5.拓展:影响某反应的反应速率的因素
___________、___________、___________、___________、___________、___________等等。
思维导图
知识清单
知识点一 空气的成分及用途
一、空气的成分及体积分数
1.空气是混合物,主要成分(______________):氮气(N2)_______,氧气(O2)_______(氮气与氧气体积比约为4比1),稀有气体_______,二氧化碳(CO2)_______,其它气体和杂质_______。
2. 空气成分口诀:氮78,氧21,0.94是稀气,两个0.03分别是CO2和杂气。
二、各成分的用途
1.氧气
性质 对应的用途
氧气 能供给呼吸 供______________、______________、_______、_______等
能支持燃烧 _______、_______、气割、航空航天
2.氮气
性质 对应的用途
氮气 与某些物质反应 制硝酸和_______
化学性质_______ 作_______: ①食品充氮防_______ ②灯泡充氮防_______ ③在氮气氛围中焊接金属防止______________
液氮温度_______ 用于制造_______环境: ①医疗上_______ ②超导材料在低温环境下显示超导性能
3.稀有气体
性质 对应的用途
稀有气体 物理 性质 无色、无味气体
通电时_________________ _____________________ 如:航标灯、照明灯、闪光灯和霓虹灯
化学性质______________ 作_______
氦气 ①氦气充气球(密度比空气小且______________) ②氦气用于制造低温环境
知识点二 空气的污染与防治
1.空气污染物:①烟尘:可吸入颗粒物;②有毒气体:一氧化碳、二氧化氮和二氧化硫等,这三种气体都是有毒气体。③臭氧O3.
2.目前计入空气质量评价的主要污染物有:___________、___________、___________、_________________、___________________、___________。
3.空气污染物来源:化石燃料的燃烧,工厂排放的废气,汽车排放的尾气。
4.空气污染造成的危害:损害___________、影响作物生长、破坏___________。
5.存在的环境问题:___________(___________含量过多引起,其他如甲烷等也能造成)、___________(飞机的尾气、制冷剂氟里昂的排放)、___________(由___________、___________引起)。
6.防止空气污染的措施:使用___________,加强___________________,积极___________、___________。
注意:二氧化碳能造成温室效应加剧,但不是空气污染物和有害气体。
知识点三 空气中氧气含量的测定
一.拉瓦锡用定量的方法研究空气的成分
实验装置 实验现象 实验结论
一部分银白色的液态汞变成_________色粉末,容器里空气的体积大约减少了________…… 空气由______和_______组成, 其中氧气约占空气总体积的___________。
二、空气中氧气含量的测定
1.红磷燃烧法测定空气中氧气的含量
实验装置
实验原理 红磷燃烧消耗集气瓶内的氧气,瓶内气体___________,压强___________,冷却后打开弹簧夹,烧杯内的水会被压入集气瓶,进入水的体积即为瓶内消耗___________的体积。
实验现象 ①红磷燃烧,产生___________,并放出热量; ②冷却后打开弹簧夹,烧杯中的水_______________,瓶内液面上升约___________。
实验结论 氧气约占空气总体积的___________。
化学方程式 ______________________
误差分析 进入水的体积小于集气瓶总体积的1/5的原因 ①红磷的量不足 ②装置漏气,塞子没塞紧 ③红磷熄灭后未冷却至室温 ④有部分水留在导管中未进入集气瓶 ⑤燃烧到一定程度时,瓶内氧气含量小,红磷不能继续燃烧
进入水的体积大于集气瓶总体积的1/5的原因 ①红磷点燃后伸入瓶内过慢,使装置内气体受热逸出,导致进入瓶内的水的体积偏大 ②弹簧夹未夹紧,红磷燃烧时集气瓶内气体受热从导管逸出
药品选择 选择原则 ①能在空气中燃烧 ②只与空气中的氧气反应 ③生成物最好为固体或液体(如果有气体,该气体要能被水或某溶液完全吸收)
红磷替代品的选择 ①若装置不变,判断下列药品能否代替红磷进行实验,并说明原因: 铁丝:不能,因为铁丝在空气中不能燃烧
镁条:不能,因为镁能与空气中的氮气、二氧化碳反应
木炭:不能,因为木炭在空气中燃烧生成二氧化碳和一氧化碳气体,装置内压强变化不明显
②若将集气瓶中的水换为氢氧化钠溶液,则硫粉可以替代红磷进行实验
2.其他的测量装置
装置改进的目的:污染更小,数据误差更小,操作更简便,现象更明显,更环保,更节约药品材料等。
3.测定空气中氧气含量的数字化实验
实验装置 实验步骤
将氧气传感器与数据采集器、计算机连接; 把氧气传感器插入盛有空气的容器,采集数据; 通过相关软件处理数据,并在计算机屏幕上显示空气中氧气的含量。
数字化实验的优点:直观、可视。能够将压强、浓度等,通过传感器转化为电信号,然后通过数据采集器进入电脑,将实验过程中的各种变化量,用数据图像等直观形式表现出来。
知识点四 氧气的性质
一、氧气的物理性质
标准状况下,氧气是________________的气体;密度比空气___________(可用向上排空气法收集);_________溶于水(可用排水法收集)。降温后,氧气可以变为_________色的液体,甚至___________。
二、氧气的化学性质
氧气的化学性质___________,氧气具有___________。
1.氧气能支持燃烧
(1)操作:把带有火星的木条伸到盛有氧气的集气瓶中。
(2)现象及结论:___________,说明氧气能___________。
(3)应用:用于检验氧气:将_________________________________,若复燃则是氧气。
【名师拓展】
(1)在空气中,带火星的木条不能复燃,并渐渐熄灭;在氧气中,带火星的木条复燃,并剧烈燃烧。
(2)若带火星的木条不复燃,有两种可能:气体中不含氧气或含有的氧气量较少。
(3)鉴别两种气体(其中有一种是氧气):用带火星的木条;鉴别三种气体(其中有一种是氧气):用燃着的木条。
2.氧气与非金属(碳、硫、磷)的反应
(1)木炭(黑色固体)燃烧
现象:空气中发出红光,放出热量,生成____________________________________________。
氧气中发出____,放出热量,生成____________________________________________。
化学方程式:_________________________________
(2)硫粉(淡黄色)燃烧
现象:空气中______________________,放出热量,_________________________________。
氧气中______________________,放出热量,_________________________________。
化学方程式 :_________________________________注意事项:实验时,要在______________________(_________________________________)。
(3)红磷(暗红色固体)燃烧
现象:氧气中剧烈燃烧,放出热量,__________________化学方程式:_________________________________注意:五氧化二磷(P2O5)是固体,不是气体
3.氧气与金属(铁)的反应
铁丝(银白色固体)燃烧
现象:
空气中:______________________;氧气中:___________,___________,___________,___________。
化学方程式:_________________________________【注意事项】
① 用砂纸把细铁丝磨成光亮的银白色,是为了_________________________________。
② 将细铁丝盘成螺旋状,是为了_________________________________。
③ 把细铁丝绕在火柴上,是为了_________________________________。
④ 待火柴快燃尽时才缓慢插入盛有氧气的集气瓶中,是为了_________________________。
⑤ 由上向下缓慢伸进盛有氧气的集气瓶中,是为了_________________________________。
⑥ 集气瓶里要预先装少量水或在瓶底铺上一薄层细沙,是为了_______________________。
4.缓慢氧化
某些物质在一些条件下,与_________发生缓慢的氧化反应,称为缓慢氧化。缓慢氧化也_________热。
如:___________,___________,___________,___________,___________等。
5.总结
(1)氧气是一种化学性质比较活泼的气体,在一定的条件下,能与许多物质发生反应并放出大量的热。在这些反应中,氧气提供氧,具有氧化性。
(2)物质在氧气中燃烧程度比空气中剧烈,说明____________________________________________。
(3)物质燃烧时的现象
一般气体燃烧会产生火焰;固体直接燃烧产生光或者火星;生成物有固体时,一般都会产生烟。
【归纳总结】
氧气与常见物质发生的反应
物质 反应现象 化学方程式(表达式)
磷 产生大量白烟、放热 4P+5O22P2O5
木炭 ① 木炭在空气中燃烧时持续红热,无烟无焰;木炭在氧气中剧烈燃烧,并发出白光 ② 放热、生成能使澄清石灰水变浑浊的气体 C+O2CO2
硫 ① 在空气中燃烧发出淡蓝色火焰,在氧气中燃烧发出蓝紫色火焰 ② 放热、生成有刺激性气味的气体 S+ O2SO2
氢气 ① 纯净的氢气在空气中燃烧,产生淡蓝色火焰 ② 放热、生成能使无水硫酸铜变蓝的液体 2H2+O22H2O
铁 铁在氧气中剧烈燃烧,火星四射,放热,生成黑色固体 3Fe+2O2Fe3O4
铝 铝在氧气中燃烧,发出耀眼的白光,放热,生成白色固体 4Al+3O22Al2O3
铝在空气中与氧气反应,表面形成致密的氧化膜 4Al+3O2=2Al2O3
镁 镁在空气中燃烧,发出耀眼的白光、放热、生成白色粉末 2Mg+O22MgO
铜 红色的固体逐渐变成黑色 2Cu+O22CuO
汞 银白色液体逐渐变成红色 2Hg+O22HgO
一氧化碳 产生蓝色火焰,放热,生成能使澄清石灰水变浑浊的气体 2CO+O22CO2
甲烷 产生明亮的蓝色火焰,放热,产生能使无水硫酸铜变蓝的液体,生成能使澄清石灰水变浑浊的气体 CH4+2O2CO2+2H2O
蜡烛 火焰发出白光,放热,产生能使无水硫酸铜变蓝的液体,生成能使澄清石灰水变浑浊的气体 石蜡+氧气水+二氧化碳
知识点五 氧气的实验室制法
一、氧气的工业制法
1.方法:______________________
2.原理:利用_________________________________不同。
3.具体过程:在低温下加压,使空气___________,然后___________,液态氮的沸点比液态氧的沸点___________,___________先蒸发出来,剩下主要是___________。
二、氧气的实验室制法
在实验室中,常采用___________或___________分解等方法制氧气。
【名师拓展】实验室制氧气选择药品和反应时需考虑的因素:
1.制氧气的原料须是含氧的物质;
2.利用比较简单的实验条件就能较快得到氧气;
3.生成的气体成分单一,便于收集 。
三、加热高锰酸钾制氧气
1.药品:高锰酸钾(___________色固体)
2.原理:____________________________________________
3.装置:
(1)发生装置:加热固体制气体(___________型装置)
(2)收集装置:
①排水法收集:依据氧气___________溶于水且不与水反应。
②向上排空气法收集:依据氧气的______________________。
4.主要实验步骤:
(1)查:组装仪器,检查______________________;
(2)装:把药品装入试管内,平铺在试管底部,管口塞______________________,用带导管的单孔橡皮塞塞紧试管口;
(3)定:用铁夹夹持试管,并固定在铁架台上;
(4)点:点燃酒精灯加热(记得先___________,防止试管受热不均破裂);
(5)收:用排水法收集氧气;
(6)移:实验完毕,先把导气管从水槽中移出水面(防止_________________________________);
(7)熄:熄灭酒精灯。
可简记为:“茶庄定点收利息”(每个字代表一个步骤:①查②装③定④点⑤收⑥移⑦熄)。
四、过氧化氢分解制取氧气
1.药品:过氧化氢(H2O2)溶液和二氧化锰(MnO2)
过氧化氢溶液俗名 “___________”,是一种________色溶液,过氧化氢在___________下可以分解放出氧气;二氧化锰是一种___________色粉末。
2.原理:_________________________________
3.实验装置:
发生装置:_________________装置(固体与液体反应类型,不需加热)
收集装置:排水法、向上排空气法
4.实验步骤
(1)检查装置的气密性。
(2)向锥形瓶中加入___________固体。
(3)塞好带有分液漏斗(或长颈漏斗)和导管的双孔橡胶塞。
(4)向分液漏斗(或长颈漏斗)中加入过氧化氢溶液。
(5)用_________(或________排空气法)收集气体。
【名师拓展】
固液不加热型不同装置的优点:
A B C
(1)装置A简单,所用仪器少
(2)装置B方便添加液体药品
(3)装置C可以控制液体药品的滴加速度,从而产生平稳的气流;其中分液漏斗可以用注射器代替。
5.验满方法
(1)用排水法收集:当观察到集气瓶中的水排完,集气瓶口有大量气泡冒出时,证明已收集满。
(2)用向上排空气法收集:将___________木条放在___________,若木条复燃,证明已收集满。
6.放置方法:___________在桌子上,并盖上___________。
知识点六 催化剂
1.概念:在化学反应中能___________其他物质的___________,但___________和___________在反应前后___________的物质。
2.特点:一变(改变反应速率,___________);两不变(质量、化学性质不变)
3.理解:①催化剂不能改变生成物的质量。
②催化剂不是反应物也不是生成物(写在反应条件上)。
③一种催化剂只针对某一反应,不同的反应,催化剂可能相同,某一反应的催化剂可能不只一种。
4.证明某物质是催化剂:
①______________________:相同条件下,加或者不加药品对比实验;
②______________________:实验前称量一次,实验后分离出来再称量一次;
③______________________:将分离出来的物质再进行实验①的操作,
观察是否还能改变反应速率。
5.拓展:影响某反应的反应速率的因素
___________、___________、___________、___________、___________、___________等等。
同课章节目录
