人教版高中化学选择性必修3第三章烃的衍生物实验活动1乙酸乙酯的制备与性质课件(13页ppt)
文档属性
| 名称 | 人教版高中化学选择性必修3第三章烃的衍生物实验活动1乙酸乙酯的制备与性质课件(13页ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 570.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-09 20:46:54 | ||
图片预览




文档简介
(共13张PPT)
实验活动1 乙酸乙酯的制备与性质
第三章 烃的衍生物
实验目的
1.学习制备乙酸乙酯的方法。
2.加深对酯化反应和酯的水解的认识。
实验用品
试管、试管夹、烧杯、量筒、胶头滴管、玻璃导管、乳胶管、橡胶塞、铁架台、酒精灯、火柴、秒表、碎瓷片。
乙醇、乙酸、浓硫酸、饱和Na2CO3溶液、乙酸乙酯、蒸馏水、3 mol·L-1 H2SO4溶液、6 mol·L-1 NaOH溶液。
实验步骤
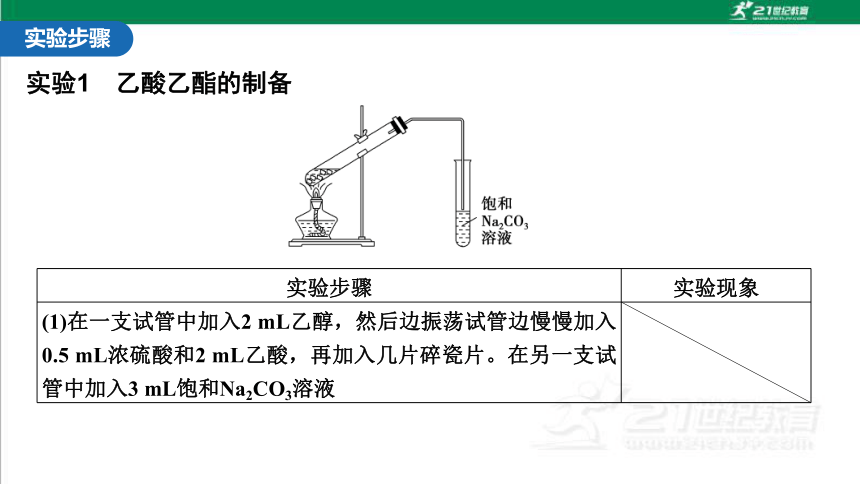
实验1 乙酸乙酯的制备
实验步骤 实验现象
(1)在一支试管中加入2 mL乙醇,然后边振荡试管边慢慢加入0.5 mL浓硫酸和2 mL乙酸,再加入几片碎瓷片。在另一支试管中加入3 mL饱和Na2CO3溶液
实验步骤 实验现象
(2)用小火加热试管里的混合物,将产生的蒸气经导管通到饱和Na2CO3溶液的上方约0.5 cm处,注意观察试管内的变化。反应一段时间后,取下盛有Na2CO3溶液的试管,并停止加热 饱和碳酸钠溶液的液面上有无色透明的难溶于水的油状液体产生
(3)振荡盛有Na2CO3溶液的试管,静置。待溶液分层后,观察上层的油状液体,并注意闻气味 可闻到香味
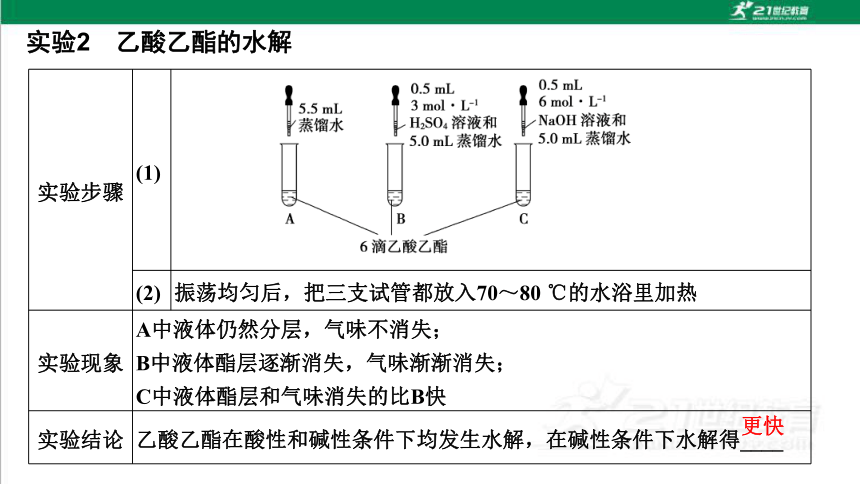
实验2 乙酸乙酯的水解
实验步骤 (1)
(2) 振荡均匀后,把三支试管都放入70~80 ℃的水浴里加热
实验现象 A中液体仍然分层,气味不消失;
B中液体酯层逐渐消失,气味渐渐消失;
C中液体酯层和气味消失的比B快
实验结论 乙酸乙酯在酸性和碱性条件下均发生水解,在碱性条件下水解得____
更快
交流研讨
1.乙酸乙酯的水解实验,除了通过乙酸乙酯气味消失的快慢来比较酯的水解速率外,还有什么方法可用来比较乙酸乙酯在不同条件下水解速率的差异?
提示:间隔相同时间测量并比较剩余乙酸乙酯层的高度。
2.(1)乙酸乙酯在酸性和碱性条件下的水解速率和水解程度不同的原因是什么?
提示:乙酸乙酯水解产生乙酸和乙醇的反应是可逆的,如果是在酸性环境水解就会受到抑制,速度变慢;如果在碱性环境中,因为产物乙酸和碱反应,可使反应不断进行下去,则反应进行比较彻底。
(2)酯化反应中哪些措施可以提高乙酸的转化率?
提示:增加乙醇的量;适当加热使生成的乙酸乙酯及时蒸出;及时移走生成的水等。
应用体验
1.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是
√
A是生成乙酸乙酯的操作,B是收集乙酸乙酯的操作,C是分离乙酸乙酯的操作,D是蒸发操作,在生成和纯化乙酸乙酯的实验过程中未涉及。
2.实验室中用乙酸和乙醇制备乙酸乙酯,为除去所得的乙酸乙酯中残留的乙酸,应选用的试剂是
A.饱和食盐水 B.饱和碳酸钠溶液
C.饱和NaOH溶液 D.浓硫酸
√
乙酸能与碳酸钠反应,乙醇能溶于水,乙酸乙酯不溶于水,所以选用饱和碳酸钠溶液可以溶解乙醇,吸收乙酸,降低酯在水中的溶解度,有利于其析出。
3.如图所示为实验室制取少量乙酸乙酯的装置
图,下列关于该实验的叙述错误的是
A.向试管a中先加入浓硫酸,然后边摇动试管
边慢慢加入乙醇,再加入冰醋酸
B.试管b中导气管下端管口不能浸入液面以下的目的是防止实验过程中产生倒吸现象
C.实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动
D.饱和Na2CO3溶液可以降低乙酸乙酯的溶解度,并吸收蒸出的乙酸和乙醇
√
4.实验室制取乙酸乙酯的装置如图所示:
实验步骤 问题
① 向A中的蒸馏烧瓶中注入少量乙醇和浓硫酸后摇匀,再将剩下的所有乙醇和乙酸注入分液漏斗中待用。这时分液漏斗中乙酸和乙醇的物质的量之比约为5∶7 (1)浓硫酸的主要作用是 ;
(2)用饱和Na2CO3溶液洗涤粗酯的目的是____
______________________________________;
② 加热油浴保温约135~145 ℃
③ 将分液漏斗中的液体缓缓滴入蒸馏烧瓶,调节滴加速率使蒸出酯的速率与进料速率大体相等,直到加料完成
④ 保持油浴温度一段时间,至不再有液体馏出后,停止加热
催化剂和吸水剂
吸收乙酸、溶解乙醇、降低乙酸乙酯的溶解度
实验步骤 问题
⑤ 取下B中的锥形瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边振荡,至无气泡产生为止 (3)如果用NaOH溶液代替Na2CO3溶液将引起的后果是
____________________________;
(4)用饱和CaCl2溶液洗涤粗酯的目的是除去______;
(5)步骤⑧所得的粗酯里还含有的杂质是_____
⑥ 将⑤的液体混合物分液,弃去水层
⑦ 将饱和CaCl2溶液(适量)加入分液漏斗中,振荡一段时间后静置,放出水层(废液)
⑧ 分液漏斗中得到的是初步提纯的乙酸乙酯粗品
使乙酸乙酯水解而使实验失败
乙醇
水
实验活动1 乙酸乙酯的制备与性质
第三章 烃的衍生物
实验目的
1.学习制备乙酸乙酯的方法。
2.加深对酯化反应和酯的水解的认识。
实验用品
试管、试管夹、烧杯、量筒、胶头滴管、玻璃导管、乳胶管、橡胶塞、铁架台、酒精灯、火柴、秒表、碎瓷片。
乙醇、乙酸、浓硫酸、饱和Na2CO3溶液、乙酸乙酯、蒸馏水、3 mol·L-1 H2SO4溶液、6 mol·L-1 NaOH溶液。
实验步骤
实验1 乙酸乙酯的制备
实验步骤 实验现象
(1)在一支试管中加入2 mL乙醇,然后边振荡试管边慢慢加入0.5 mL浓硫酸和2 mL乙酸,再加入几片碎瓷片。在另一支试管中加入3 mL饱和Na2CO3溶液
实验步骤 实验现象
(2)用小火加热试管里的混合物,将产生的蒸气经导管通到饱和Na2CO3溶液的上方约0.5 cm处,注意观察试管内的变化。反应一段时间后,取下盛有Na2CO3溶液的试管,并停止加热 饱和碳酸钠溶液的液面上有无色透明的难溶于水的油状液体产生
(3)振荡盛有Na2CO3溶液的试管,静置。待溶液分层后,观察上层的油状液体,并注意闻气味 可闻到香味
实验2 乙酸乙酯的水解
实验步骤 (1)
(2) 振荡均匀后,把三支试管都放入70~80 ℃的水浴里加热
实验现象 A中液体仍然分层,气味不消失;
B中液体酯层逐渐消失,气味渐渐消失;
C中液体酯层和气味消失的比B快
实验结论 乙酸乙酯在酸性和碱性条件下均发生水解,在碱性条件下水解得____
更快
交流研讨
1.乙酸乙酯的水解实验,除了通过乙酸乙酯气味消失的快慢来比较酯的水解速率外,还有什么方法可用来比较乙酸乙酯在不同条件下水解速率的差异?
提示:间隔相同时间测量并比较剩余乙酸乙酯层的高度。
2.(1)乙酸乙酯在酸性和碱性条件下的水解速率和水解程度不同的原因是什么?
提示:乙酸乙酯水解产生乙酸和乙醇的反应是可逆的,如果是在酸性环境水解就会受到抑制,速度变慢;如果在碱性环境中,因为产物乙酸和碱反应,可使反应不断进行下去,则反应进行比较彻底。
(2)酯化反应中哪些措施可以提高乙酸的转化率?
提示:增加乙醇的量;适当加热使生成的乙酸乙酯及时蒸出;及时移走生成的水等。
应用体验
1.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是
√
A是生成乙酸乙酯的操作,B是收集乙酸乙酯的操作,C是分离乙酸乙酯的操作,D是蒸发操作,在生成和纯化乙酸乙酯的实验过程中未涉及。
2.实验室中用乙酸和乙醇制备乙酸乙酯,为除去所得的乙酸乙酯中残留的乙酸,应选用的试剂是
A.饱和食盐水 B.饱和碳酸钠溶液
C.饱和NaOH溶液 D.浓硫酸
√
乙酸能与碳酸钠反应,乙醇能溶于水,乙酸乙酯不溶于水,所以选用饱和碳酸钠溶液可以溶解乙醇,吸收乙酸,降低酯在水中的溶解度,有利于其析出。
3.如图所示为实验室制取少量乙酸乙酯的装置
图,下列关于该实验的叙述错误的是
A.向试管a中先加入浓硫酸,然后边摇动试管
边慢慢加入乙醇,再加入冰醋酸
B.试管b中导气管下端管口不能浸入液面以下的目的是防止实验过程中产生倒吸现象
C.实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动
D.饱和Na2CO3溶液可以降低乙酸乙酯的溶解度,并吸收蒸出的乙酸和乙醇
√
4.实验室制取乙酸乙酯的装置如图所示:
实验步骤 问题
① 向A中的蒸馏烧瓶中注入少量乙醇和浓硫酸后摇匀,再将剩下的所有乙醇和乙酸注入分液漏斗中待用。这时分液漏斗中乙酸和乙醇的物质的量之比约为5∶7 (1)浓硫酸的主要作用是 ;
(2)用饱和Na2CO3溶液洗涤粗酯的目的是____
______________________________________;
② 加热油浴保温约135~145 ℃
③ 将分液漏斗中的液体缓缓滴入蒸馏烧瓶,调节滴加速率使蒸出酯的速率与进料速率大体相等,直到加料完成
④ 保持油浴温度一段时间,至不再有液体馏出后,停止加热
催化剂和吸水剂
吸收乙酸、溶解乙醇、降低乙酸乙酯的溶解度
实验步骤 问题
⑤ 取下B中的锥形瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边振荡,至无气泡产生为止 (3)如果用NaOH溶液代替Na2CO3溶液将引起的后果是
____________________________;
(4)用饱和CaCl2溶液洗涤粗酯的目的是除去______;
(5)步骤⑧所得的粗酯里还含有的杂质是_____
⑥ 将⑤的液体混合物分液,弃去水层
⑦ 将饱和CaCl2溶液(适量)加入分液漏斗中,振荡一段时间后静置,放出水层(废液)
⑧ 分液漏斗中得到的是初步提纯的乙酸乙酯粗品
使乙酸乙酯水解而使实验失败
乙醇
水
