人教版高中化学选择性必修2第三章晶体结构与性质第一节物质的聚集状态与晶体的常识课件(73页ppt)
文档属性
| 名称 | 人教版高中化学选择性必修2第三章晶体结构与性质第一节物质的聚集状态与晶体的常识课件(73页ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-09 00:00:00 | ||
图片预览










文档简介
(共73张PPT)
第一节 物质的聚集状态与晶体的常识
第三章 晶体结构与性质
任务一 物质的聚集状态
材料1:气态物质在高温或者在外加电场激发下,分子发生分解,产生电子和阳离子等。这种由电子、阳离子和电中性粒子组成的整体上呈电中性的物质聚集体称为等离子体。等离子体中的微粒带有电荷且能自由运动,使等离子体具有良好的导电性,加之具有很高的温度和流动性,使得等离子体用途十分广泛。
情境探究
材料2:1888年,奥地利人莱尼采尔发现,苯甲酸胆甾酯加热达到熔点后,先呈浑浊态,再加热达一定温度时,浑浊态变透明清亮态。1889年,德国人莱曼将上述熔点至澄清点温度范围内的物质状态命名为液晶,后称热致液晶。目前,液晶已有广泛的应用。
问题1:等离子体就是液态电解质吗?其存在状态及构成微粒是什么?
提示:不是。等离子体是一种特殊的气态物质,由电子、阳离子和电中性粒子(分子或原子)构成,整体呈电中性,而液态电解质由阴离子和阳离子或分子构成。
问题2:液晶是“液”(液态)还是“晶”(固态)
提示:液晶不是晶态也不是液态,是介于液态和晶态之间的物质状态。
问题3:液晶有什么特殊的性质?
提示:液晶既具有液体的流动性、黏度、形变性,又具有晶体的某些物理性质,如导热性、光学性质等。
问题4:说说你知道的在生产生活中等离子体、液晶的用途。
提示:等离子体可用于制造显示器、进行化学合成等,液晶用于显示器、合成高强度的液晶纤维用于航空和国防等。
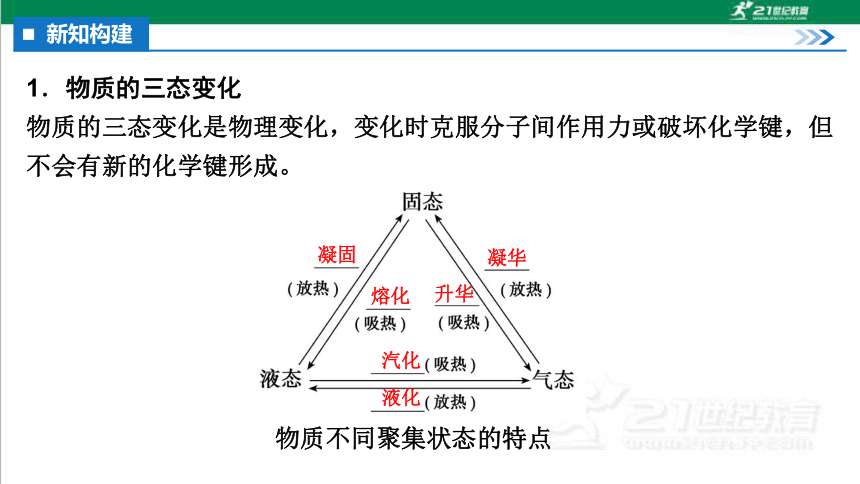
1.物质的三态变化
物质的三态变化是物理变化,变化时克服分子间作用力或破坏化学键,但不会有新的化学键形成。
新知构建
物质不同聚集状态的特点
凝固
凝华
熔化
升华
汽化
液化
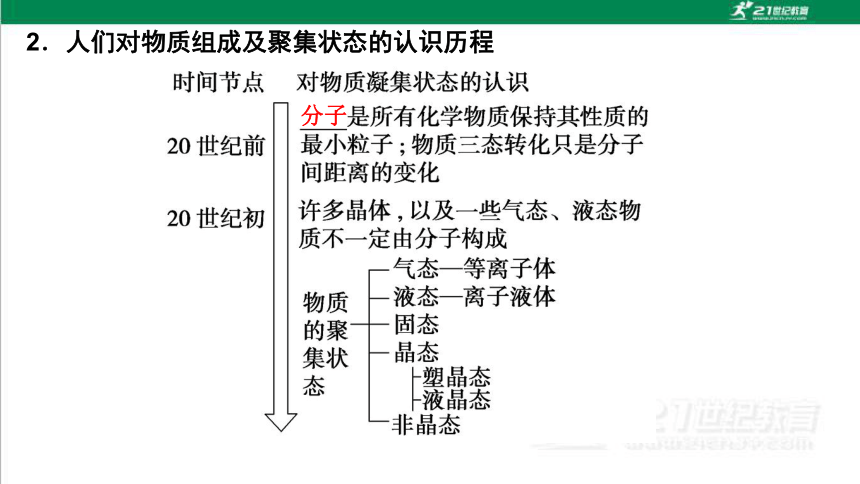
物质的三态通常是指固态、液态和气态。物质的聚集状态还有晶态、非晶态,以及介乎晶态和非晶态之间的塑晶态、液晶态等。
物质的聚集状态 微观结构 微观运动 宏观性质
固态 微粒紧密排列,微粒间的空隙很小 在固定的位置上振动 大多有固定的形状,几乎不能被压缩
液态 微粒排列较紧密,微粒间的空隙较小 介于固态和气态之间 没有固定的形状,不易被压缩
气态 微粒间的距离较大 可以自由移动 没有固定的形状,容易被压缩
2.人们对物质组成及聚集状态的认识历程
分子
3.等离子体
(1)定义:气态物质在高温或者在外加电场激发下,分子发生分解,产生电子和阳离子等。这种由电子、阳离子和电中性粒子组成的整体上呈电中性的物质聚集体称为等离子体。
(2)特点:等离子体是一种特殊的气体;等离子体具有良好的导电性和流动性。
(3)存在:日光灯和霓虹灯的灯管里,蜡烛的火焰里,极光和雷电里。
(4)应用:制造等离子体显示器、化学合成、核聚变等。
4.液晶
介于液态和晶态之间的物质状态,既具有液体的流动性、黏度、形变性等,又具有晶体的某些物理性质,如导热性、光学性质等,表现出类似晶体的各向异性。
应用:液晶已有广泛的应用。例如,手机、电脑和电视的液晶显示器;合成高强度液晶纤维已广泛应用于飞机、火箭、坦克、防弹衣等。
1. 正误判断,错误的说明原因。
(1)等离子体和离子液体都具有良好的导电性。
答案:正确。
(2)等离子体的基本构成粒子只有阴、阳离子。
答案:错误,等离子体是由电子、阳离子和电中性粒子组成的整体上呈电中性的物质聚集体。因此等离子体的基本构成粒子不是阴、阳离子。
应用评价
(3)电视和电脑的液晶显示器使用的液晶材料属于晶体,不能体现晶体的各向异性。
答案:错误,液晶分子的空间排列是不稳定的,但具有各向异性,属于非晶体。
2.液晶内部沿分子长轴方向呈有序排列。液晶属于晶体吗?
答案:晶体是三维有序,液晶分子有取向序、无位置序、分子可滑动,液晶是介于液态和晶态之间的物质状态,不属于晶体。
返回
任务二 晶体与非晶体
人们很早就注意到自然界里的许多物质具有规则的几何外形,并将具有多面体外形的固体称为晶体。在我国汉代,人们就曾用“雪花六出”来描绘雪花晶体。那么,究竟什么样的物质才能称为晶体?
情境探究
问题1:冰、食盐、铜、橡胶、宝石、纯碱都是日常生活中常见的固体物质,上述物质中哪些属于晶体?哪些属于非晶体?
提示:晶体:冰、食盐、铜、宝石、纯碱;非晶体:橡胶。
问题2:许多玻璃制品与雪花晶体一样,外形美观、透亮,为什么玻璃不是晶体呢?晶体与非晶体的本质区别是什么?
提示:玻璃中微观粒子的排列相对无序;晶体内原子在三维空间里呈周期性有序排列,而非晶体中原子排列相对无序。
1.晶体与非晶体的本质差异
2.获得晶体的三条途径
(1)________物质凝固。
(2)________物质冷却不经液态直接________(凝华)。
(3)________从溶液中析出。
新知构建
固体 自范性 微观结构
晶体 ____(能自发呈现_____外形) 原子在三维空间里呈_____有序排列
非晶体 ____(不能自发呈现多面体外形) 原子排列相对_____
有
多面体
周期性
无
无序
熔融态
气态
凝固
溶质
3.晶体的特性
(1)自范性:晶体能自发地呈现________外形的性质。
(2)各向异性:晶体在不同方向上表现出不同的_________。
(3)固定的熔点。
4.晶体与非晶体的区分方法
区分
方法 测熔点 晶体有固定的熔点,非晶体没有固定的熔点
可靠方法 对固体进行___________实验
多面体
物理性质
X射线衍射
1.正误判断,错误的说明原因。
(1)具有各向异性的固体可能是晶体。
答案:正确。
(2)晶体与非晶体的根本区别在于固体是否具有规则的几何外形。
答案:错误,晶体与非晶体的根本区别在于粒子在微观空间是否呈周期性的有序排列。
(3)X射线衍射是最可靠的区分晶体和非晶体的方法。
答案:正确。
应用评价
(4)用X射线衍射摄取石英玻璃和水晶的粉末得到的图谱是相同的。
答案:错误,石英玻璃为非晶态SiO2,水晶为晶态SiO2,二者研成粉末摄取的X射线衍射图谱不相同。
(5)因为晶体具有自范性,所以用红热的铁针刺涂有石蜡的水晶柱面,熔化的石蜡呈椭圆形。
答案:错误,晶体在导热性中具有各向异性,水晶柱面不同方向的导热性不同,故熔化的石蜡呈椭圆形。
2.(1)在下列物质中___________(填序号,下同)是晶体,____________是非晶体。
①塑料;②明矾;③松香;④玻璃;⑤CuSO4·5H2O;⑥冰糖;⑦糖果;⑧单晶硅;⑨铝块;⑩橡胶
明矾是KAl(SO4)2·12H2O,它和CuSO4·5H2O、冰糖、单晶硅、铝块都是晶体;塑料、松香、玻璃、糖果、橡胶都是非晶体;
②⑤⑥⑧⑨
①③④⑦⑩
(2)晶体和非晶体在外形上有差别,晶体都具有_______的几何外形,而非晶体__________的几何外形;另外非晶体的多种物理性质,在各个方向都是__________的,而晶体的多种物理性质在各个方向都是__________的。
晶体都具有规则的几何外形,非晶体没有规则的几何外形;晶体最大的特征就是各向异性和有固定的熔点,非晶体的多种物理性质,在各个方向都是各向同性;
规则
没有规则
各向同性
各向异性
(3)判断物质是晶体还是非晶体,比较正确的方法是_______。
①从外形上来判断
②从各向异性或各向同性上来判断
③从导电性能来判断
④从有无固定熔点来判断
晶体最大的特征就是各向异性和有固定的熔点,故选②④。
②④
返回
任务三 晶胞和晶体结构的测定
中科院物理所发现一种仅由镍、镁、碳三种元素构成的超导体,它是一种不含氧原子的钙钛矿结构的超导体,该超导体的晶胞如图所示。
情境探究
问题1:该晶胞中,镁原子和镍原子分别位于什么位置?
提示:该晶胞中,镁原子位于平行六面体的顶点上,镍原子位于面心上。
问题2:该晶体的化学式是什么?
提示:MgCNi3。Mg原子处于顶点上,故有8× =1个;
C原子处于晶胞的体心,完全属于该晶胞;Ni处于面心上,
故有6× =3个,故该晶体的化学式为MgCNi3。
问题3:已知该晶胞为正六面体,其边长为a cm,则与Mg原子距离最近的Ni原子之间的距离是多少?
提示: a cm。与顶点Mg原子距离最近的Ni原子位于相邻的面心上,二者之间的距离为面对角线长度的一半,即 a cm。
一、晶胞
1.概念
描述晶体结构的_________。
2.晶胞与晶体的关系
常规的晶胞都是________体,整块晶体可以看作是数量巨大的晶胞“无隙并置”而成。
(1)“无隙”是指相邻晶胞之间___________。
(2)“并置”是指所有晶胞都是_____排列的,取向_____。
(3)所有晶胞的_____及其内部的原子___________及几何排列(包括取向)是完全相同的。
新知构建
平行六面
无任何间隙
平行
相同
形状
种类、个数
基本单元
3.晶胞中粒子数目的计算
(1)铜晶胞
①位于顶角上的铜原子为____个晶胞共用。
②位于面心上的铜原子为____个晶胞共用。
因此晶体铜中完全属于某一晶胞的铜原子数是8× +6× =4。
8
2
(2)NaCl晶胞
①Cl-位于______和______,共有____个。
②Na+位于______和______,共有____个。
NaCl晶胞
顶角
面心
4
棱上
体心
4
(3)几种晶胞中原子数目的确定
结合下图,钠、锌、碘、金刚石晶胞中含有原子的数目分别为 、 、
、 。
2
2
8
8
二、晶体结构的测定
1.测量仪器:______________。
2.测定过程:当单一波长的X射线通过晶体时,会在记录仪上产生分立的斑点或者明锐的_______。
3.作用:通过晶体的X射线衍射实验获得衍射图后,经过计算可以从衍射图形获得晶体结构的有关信息。包括晶胞形状和大小、分子或原子在微观空间有序排列呈现的对称类型、原子在晶胞里的_______和_______等,以及结合晶体化学组成的信息推出原子之间的相互关系。
X射线衍射仪
衍射峰
数目
位置
4.测定示例——乙酸晶体结构的测定流程
乙酸晶体的X射线衍射实验 乙酸晶胞中含4个乙酸分子 测定晶胞中各原子的位置(即原子坐标) 计算原子间的距离 判断出哪些原子间存在化学键 确定键长和键角 分子的空间结构。
1.正误判断,错误的说明原因。
(1)晶胞都是平行六面体。
答案:错误,也可以是其他的形状。
(2)晶胞是晶体的最小重复单元。
答案:正确。
(3)已知晶胞的组成也无法推知晶体的组成。
答案:错误,已知晶胞的组成是可以推知晶体的组成。
(4)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过X射线衍射方法区分晶体、准晶体和非晶体。
答案:正确。
应用评价
2.回答下列问题:
(1)N和Cu元素形成的化合物的晶胞结构如图所示,该化合物的N原子个数为_____,Cu的原子个数为______。
1
3
N原子所在位置为顶点,根据均摊法,N原子个数为8× =1;铜原子所在位置为棱心,个数为12× =3;
(2)则该化合物的化学式为________。
Cu3N
该化合物的化学式为Cu3N;
(3)S和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的S与Cu的微粒个数比为________。
1∶1
根据晶胞结构,Cu原子所在位置为顶点和面心,个数为8× =4,S原子所在位置为内部,个数为4个,该化合物的S与Cu的微粒个数比为1∶1;
(4)价层电子排布式为3d54s2的原子,其原子元素符号为______。
Mn
价层电子排布式为3d54s2的原子,其原子序数为25,元素符号为Mn;
(5)CuaSnbSc中Cu元素有+1和+2两种价态,从结构上分析基态Cu+、
Cu2+中________更稳定,原因是___________________________________
______________。
Cu+
Cu+的价层电子排布式为3d10,全充满
的稳定结构
Cu+和Cu2+的价层电子排布为3d10和3d9,Cu+的价层电子排布全满,较稳定。
返回
随堂演练
1.下列关于晶体和非晶体的说法不正确的是
A.破损的NaCl晶体能在饱和NaCl溶液中自动变成规则的立方体
B.晶体某些物理性质的各向异性反映了晶体内部质点排列的有序性
C.导电性可用于区别晶体和玻璃体
D.固体SiO2可能是晶体,也可能是非晶体
√
A.破损的晶体能在溶液中得到修复,所以破损的NaCl晶体能在饱和NaCl溶液中自动变成规则的立方体,故A正确;B.晶体的各向异性反映了晶体内部质点排列的有序性,故B正确;C.根据晶体的定义,不能通过导电性来区别晶体和玻璃体,某些晶体和玻璃体均导电或不导电,故C错误;D.固体SiO2可能是晶体,也可能是非晶体,如水晶为晶体,玻璃为非晶体,故D正确;故答案选C。
2.下列过程不能得到晶体的是
A.对NaCl饱和溶液降温所得到的固体
B.气态水直接冷却成固态水
C.熔融的KNO3冷却后所得到的固体
D.液态的玻璃冷却后所得到的固体
得到晶体的三条途径:①溶质从溶液中析出;②气态物质凝华;③熔融态物质凝固。A选项符合①,B选项符合②,C选项符合③。由于玻璃属于非晶体,熔融后再冷却所得到的固体仍为非晶体。
√
3. Eu、Ti和O形成一种化合物,其晶胞为如图所示的立方体。
(1)Eu是镧系元素,位于元素周期表的____(填字母)。
A.s区 B.p区
C.d区 D.ds区
E.f区
Eu是镧系元素,位于元素周期表的第六周期,物质在参加反应时,原子核外电子最外层、次外层及倒数第三层的电子都会发生变化,因此属于f区的元素,故合理选项是E;
E
(2)在该晶胞中,Eu、Ti、O的粒子个数比是____________。
在该晶胞中,Eu原子个数为1,Ti原子个数为8× =1,含有的O原子个数为12× =3,则晶胞中Eu、Ti、O的粒子个数比是1∶1∶3;
1∶1∶3
(3)若将Ti原子置于立方体的体心,Eu原子置于立方体顶角,则O原子处于立方体的____(填字母)位置。
A.体心
B.面心
C.棱心
D.顶角
若将Ti原子置于立方体的体心,在一个晶胞中含有1个Ti原子,通过该Ti原子的8个晶胞中含有8个Eu原子,将8个Eu原子相连,形成一个立方体,Eu位于立方体的顶角上,O原子处于立方体的面心上,故合理选项是B;
B
(4)1个Eu原子和_____个O原子相邻,1个Ti原子和____个O原子相邻。1个O原子和____个Eu原子相邻,1个O原子和_____个Ti原子相邻。
根据图示可知:在晶胞中与Eu原子距离相等且最近的O原子有12个,距离为晶胞面对角线的一半;以晶胞顶点Ti原子为研究对象,在晶胞中与Ti原子距离相等且最近的O原子有6个,分别位于Ti原子上下、前后、左右6个方向,距离为晶胞边长的一半;
12
6
4
2
O原子位于晶胞棱边上,通过该棱边可以形成4个晶胞,每个晶胞中有一个Eu原子,因此与1个O原子和4个Eu原子距离相等且最近,距离是晶胞面对角线的一半;在1个O原子周围有2个Ti原子与O原子距离相等且最近,距离是晶胞边长的一半。
返回
课时测评
题点一 物质的聚集状态
1.等离子体和液晶在工业、农业、军事、宇航、天体等方面有着非常重要的应用价值。下列关于它们的说法错误的是
A.等离子体和液晶都是物质的一种聚集状态
B.液晶具有液体的流动性和晶体的各向异性
C.等离子体只含有离子
D.等离子体和液晶都可用于制造显示器
√
A项,等离子体是由电子、阳离子和电中性粒子(分子或原子)组成的整体上呈电中性的气态物质,液晶是介于液态和晶态之间的物质状态,正确;B项,在一定范围内存在液体流动性,也存在晶体各向异性的物质,称之为液晶,正确;C项,等离子体中既有带电的阳离子和电子,也有电中性的分子或原子,错误;D项,等离子体和液晶可以分别用于制造等离子体显示器、液晶显示器,正确。
2. 下列关于物质聚集状态的叙述中,错误的是
A.等离子体的基本构成微粒只有带电的离子和电子
B.气态是高度无序的体系存在状态
C.液晶内部分子沿分子长轴方向有序排列,使液晶具有各向异性
D.固态中的原子或者分子结合得较紧凑,相对运动较弱
√
A项,等离子体是呈电中性的,其基本构成微粒可以是带电的粒子也可以是中性粒子,错误;B项,物质处于气态时,分子间距离大,分子运动速度快,体系处于高度无序状态,正确;C项,液晶内部分子的排列沿分子长轴方向呈现出有序的排列,使液晶在折射率、磁化率、电导率等宏观性质方面表现出类似晶体的各向异性,正确;D项,据物质固态时微粒间距离较小可判断,固态中的原子或者分子结合的较紧凑,相对运动较弱,正确。
题点二 晶体与非晶体
3.晶体是一类非常重要的材料,在很多领域都有广泛的应用。我国现已能够拉制出直径为300 mm、重量达81 kg的大直径硅单晶,晶体硅大量用于电子产业。下列叙述正确的是
A.形成晶体硅的速率越快越好
B.晶体硅没有固定的熔、沸点
C.可用X射线衍射实验来鉴别晶体硅和玻璃
D.晶体硅的形成与晶体的自范性有关,而与各向异性无关
√
A项,晶体的形成都有一定的形成条件,如温度、压强、结晶速率等,但并不是说结晶速率越快越好,速率太快可能导致晶体质量下降,错误;B项,晶体都有固定的熔、沸点,则晶体硅一定有固定的熔、沸点,错误;C项,X射线衍射实验能够测出物质的内部结构,根据微粒是否有规则的排列可区分晶体与非晶体,正确;D项,晶体的形成与晶体的自范性和各向异性都有密切关系,错误。
4.金属玻璃是由金属元素或金属元素为主要成分的熔体通过快速冷却得到的具有非晶态结构的金属固体。以下关于金属玻璃的说法正确的是
A.金属玻璃能自发呈现多面体外形
B.金属玻璃具有固定的熔点
C.鉴别金属玻璃是否为晶体最可靠的科学方法为X射线衍射实验
D.金属玻璃是金属与二氧化硅的混合物
√
A项,根据题中描述,金属玻璃是非晶体,不能自发呈现多面体外形,错误;B项,金属玻璃是非晶体,没有固定熔、沸点,错误;C项,鉴别金属玻璃是否为晶体最可靠的科学方法为X射线衍射实验,正确;D项,金属玻璃是由金属元素或金属元素为主要成分的金属固体,错误。
5. 不能够支持石墨是晶体这一事实的选项是
A. 石墨和金刚石互为同素异形体
B.石墨中的碳原子呈周期性有序排列
C.石墨的熔点为3 625 ℃
D.在石墨的X射线衍射图谱上有明锐的衍射峰
√
是否互为同素异形体与是否为晶体这两者之间并无联系,如无定形碳也是金刚石、石墨的同素异形体,却属于非晶体。
6. 如图为一块密度、厚度均匀的矩形样品,长为宽的两倍,若用多用电表沿两对称轴测其电阻均为R,则这块样品一定是
A.金属
B.半导体
C.非晶体
D.晶体
由于AB=2CD,而AB、CD间的电阻却相等,说明样品横向(AB)与纵向(CD)的导电性不同,具有各向异性,而晶体的特征之一是各向异性,非晶体则具有各向同性,故该样品为晶体。
√
题点三 晶胞概念的理解
7.下列有关晶胞的叙述中正确的是
A.晶胞的结构就是晶体的结构
B.不同的晶体中,晶胞的大小和形状都相同
C.晶胞中的任何一个粒子都完全属于该晶胞
D.已知晶胞的组成就可推知晶体的组成
√
由晶胞的定义可知A错误;相同晶体中晶胞的大小和形状完全相同,不同晶体的晶胞大小和形状不一定相同,B错误;晶体中的大部分粒子被若干个晶胞所共有,不完全属于某个晶胞,C错误;知道晶胞的组成,利用“均摊法”即可推知晶体的组成,D正确。
8.关于测定晶体结构错误的是
A.对乙酸晶体进行测定,晶胞中含有1个乙酸分子
B.经过计算可以从衍射图形获得晶胞形状和大小
C.经过计算可以从衍射图形获得分子或原子在微观空间有序排列呈现的对称类型
D.经过计算可以从衍射图形获得原子在晶胞里的数目和位置
√
A项,对乙酸晶体进行测定,可以得到晶胞结构中含有4个乙酸分子,错误;B项,经过计算可以从衍射图形获得晶胞形状和大小,正确;C项,经过计算可以从衍射图形获得分子或原子在微观空间有序排列呈现的对称类型,正确;D项,经过计算可以从衍射图形获得原子在晶胞里的数目和位置,正确。
题点四 晶胞中粒子数目
9. 晶体内微粒总是按周期性规律重复排列,反映其结构特点的基本重复单位为晶胞,晶体可视为晶胞经平移无隙并置而成。以下是某些晶体的局部结构,可做为晶胞的是
√
按照题意,晶体可视为晶胞经平移无隙并置而成,是指相邻晶胞之间没有任何间隙,所有晶胞平行排列,取向相同。由此可知,平移后,重合位置的原子相同。A项,不管是左右或上下平移时,大圆表示的原子和小圆表示的原子位置重合,但不是同一种原子,因此该结构不能作为晶胞,错误;B项,不管是上下平移还是左右平移,各原子都可以与相同的原子重叠,可平移无隙并置得到晶体,因此该结构可以作为晶胞,正确;C项,上下平移时,位于面心的两个不同的原子位置会重合,因此该结构不能作为晶胞,错误;D项,该结构平移时会存在空隙,因此不能作为晶胞,错误。
10. 根据下列四种晶体的晶胞示意图,下列说法不正确的是
A.图Ⅰ:Cu晶胞平均含有的铜原子数是4
B.图Ⅱ:干冰晶胞平均含有CO2分子数是8
C.图Ⅲ:碘晶体中碘分子的排列有2种不同的方向
D.图Ⅳ:晶体M的化学式可能为AB
√
11. 已知某ABC3晶体的晶胞如图所示,晶胞参数为a nm,摩尔质量为M g/mol,下列说法正确的是
A.离A微粒距离最近且相等的B微粒的个数为12个
B.若m的坐标为(0,0,0),则p的坐标为
C.相邻两个C微粒最近距离为a nm
D.该晶胞的密度为 ×1021 g·cm-3
√
12. 固体二氧化硅有晶体和非晶体两种。根据下图回答:
(1)对比图Ⅰ和Ⅱ可知,晶体SiO2具有自范性,而非晶体SiO2没有自范性,本质原因是______________________________________________________
_____________________________________。
构成晶体的粒子在微观空间里呈现周期性有序排列,而构成非晶体的粒子在微观空间里排列相对无序
(2)观察三个图,区分晶体SiO2和非晶体SiO2最可靠的科学方法是________
___________________________。
二氧化硅进行X射线衍射实验
对固体
晶体的粒子在微观空间里呈现周期性有序排列,而非晶体的粒子排列相对无序;区分晶体和非晶体最可靠的科学方法是对固体进行X射线衍射实验。
13.元素X的某价态离子Xn+中所有电子正好充满K、L、M三个能层,它与N3-形成晶体的晶胞结构如图所示。
(1)该晶体的阳离子与阴离子个数之比为________。
Xn+位于晶胞的棱上,其数目为12× =3;N3-位于晶胞的顶角,其数目为8× =1,故二者个数之比为3∶1。
3∶1
(2)该晶体中Xn+的n=____。
由晶体的化学式X3N知,X所带电荷数为1。
1
(3)X元素的原子序数是_____。
因为K、L、M三个能层充满,故Xn+有2、8、18结构,所以X的原子序数是29。
29
(4)晶体中每个N3-被____个等距离的Xn+包围。
N3-位于晶胞顶角,故其被6个Xn+从上、下、左、右、前、后包围。
6
14.(1)金属K和C60能够发生反应产生一系列金属球碳盐KxC60,部分金属球碳盐具有超导性,是球碳族化合物的研究热点之一。某种KxC60的晶胞结构如图所示。C 位于立方体晶胞的顶点和面心,K+位于晶胞的体心和棱心,另外晶胞内还有8个K+。
KxC60中x=____。
3
(2)镧(La)镍(Ni)合金是一种储氢材料,这种合金的晶体结构已经测定,其基本结构单元如图所示,则该合金的化学式可表示为________________。
LaNi5(或Ni5La)
(3)砷化铟(InAs)是一种优良的半导体化合物,有广泛用途。InAs为原子之间以共价键的成键方式结合而成的晶体。其晶胞结构如图所示。一个晶胞中所含As的个数为____。
由晶胞结构可知,晶胞中位于体内的砷原子个数为4,位于顶点和面心的铟原子个数为8× =4;
4
(4)Cu的晶胞(图1)、Cu2O的晶胞(图2)如下所示。
金属铜的一个晶胞中的铜原子数与Cu2O一个晶胞中的铜原子数之比为________。
由Cu、Cu2O晶胞结构可知:在一个Cu晶胞中含有的Cu原子数目为8×
=4;在一个Cu2O晶胞中含有的Cu原子数目为4×1=4,故二者一个晶胞中含有的Cu原子数目比是4∶4=1∶1。
返回
1∶1
第一节 物质的聚集状态与晶体的常识
第三章 晶体结构与性质
任务一 物质的聚集状态
材料1:气态物质在高温或者在外加电场激发下,分子发生分解,产生电子和阳离子等。这种由电子、阳离子和电中性粒子组成的整体上呈电中性的物质聚集体称为等离子体。等离子体中的微粒带有电荷且能自由运动,使等离子体具有良好的导电性,加之具有很高的温度和流动性,使得等离子体用途十分广泛。
情境探究
材料2:1888年,奥地利人莱尼采尔发现,苯甲酸胆甾酯加热达到熔点后,先呈浑浊态,再加热达一定温度时,浑浊态变透明清亮态。1889年,德国人莱曼将上述熔点至澄清点温度范围内的物质状态命名为液晶,后称热致液晶。目前,液晶已有广泛的应用。
问题1:等离子体就是液态电解质吗?其存在状态及构成微粒是什么?
提示:不是。等离子体是一种特殊的气态物质,由电子、阳离子和电中性粒子(分子或原子)构成,整体呈电中性,而液态电解质由阴离子和阳离子或分子构成。
问题2:液晶是“液”(液态)还是“晶”(固态)
提示:液晶不是晶态也不是液态,是介于液态和晶态之间的物质状态。
问题3:液晶有什么特殊的性质?
提示:液晶既具有液体的流动性、黏度、形变性,又具有晶体的某些物理性质,如导热性、光学性质等。
问题4:说说你知道的在生产生活中等离子体、液晶的用途。
提示:等离子体可用于制造显示器、进行化学合成等,液晶用于显示器、合成高强度的液晶纤维用于航空和国防等。
1.物质的三态变化
物质的三态变化是物理变化,变化时克服分子间作用力或破坏化学键,但不会有新的化学键形成。
新知构建
物质不同聚集状态的特点
凝固
凝华
熔化
升华
汽化
液化
物质的三态通常是指固态、液态和气态。物质的聚集状态还有晶态、非晶态,以及介乎晶态和非晶态之间的塑晶态、液晶态等。
物质的聚集状态 微观结构 微观运动 宏观性质
固态 微粒紧密排列,微粒间的空隙很小 在固定的位置上振动 大多有固定的形状,几乎不能被压缩
液态 微粒排列较紧密,微粒间的空隙较小 介于固态和气态之间 没有固定的形状,不易被压缩
气态 微粒间的距离较大 可以自由移动 没有固定的形状,容易被压缩
2.人们对物质组成及聚集状态的认识历程
分子
3.等离子体
(1)定义:气态物质在高温或者在外加电场激发下,分子发生分解,产生电子和阳离子等。这种由电子、阳离子和电中性粒子组成的整体上呈电中性的物质聚集体称为等离子体。
(2)特点:等离子体是一种特殊的气体;等离子体具有良好的导电性和流动性。
(3)存在:日光灯和霓虹灯的灯管里,蜡烛的火焰里,极光和雷电里。
(4)应用:制造等离子体显示器、化学合成、核聚变等。
4.液晶
介于液态和晶态之间的物质状态,既具有液体的流动性、黏度、形变性等,又具有晶体的某些物理性质,如导热性、光学性质等,表现出类似晶体的各向异性。
应用:液晶已有广泛的应用。例如,手机、电脑和电视的液晶显示器;合成高强度液晶纤维已广泛应用于飞机、火箭、坦克、防弹衣等。
1. 正误判断,错误的说明原因。
(1)等离子体和离子液体都具有良好的导电性。
答案:正确。
(2)等离子体的基本构成粒子只有阴、阳离子。
答案:错误,等离子体是由电子、阳离子和电中性粒子组成的整体上呈电中性的物质聚集体。因此等离子体的基本构成粒子不是阴、阳离子。
应用评价
(3)电视和电脑的液晶显示器使用的液晶材料属于晶体,不能体现晶体的各向异性。
答案:错误,液晶分子的空间排列是不稳定的,但具有各向异性,属于非晶体。
2.液晶内部沿分子长轴方向呈有序排列。液晶属于晶体吗?
答案:晶体是三维有序,液晶分子有取向序、无位置序、分子可滑动,液晶是介于液态和晶态之间的物质状态,不属于晶体。
返回
任务二 晶体与非晶体
人们很早就注意到自然界里的许多物质具有规则的几何外形,并将具有多面体外形的固体称为晶体。在我国汉代,人们就曾用“雪花六出”来描绘雪花晶体。那么,究竟什么样的物质才能称为晶体?
情境探究
问题1:冰、食盐、铜、橡胶、宝石、纯碱都是日常生活中常见的固体物质,上述物质中哪些属于晶体?哪些属于非晶体?
提示:晶体:冰、食盐、铜、宝石、纯碱;非晶体:橡胶。
问题2:许多玻璃制品与雪花晶体一样,外形美观、透亮,为什么玻璃不是晶体呢?晶体与非晶体的本质区别是什么?
提示:玻璃中微观粒子的排列相对无序;晶体内原子在三维空间里呈周期性有序排列,而非晶体中原子排列相对无序。
1.晶体与非晶体的本质差异
2.获得晶体的三条途径
(1)________物质凝固。
(2)________物质冷却不经液态直接________(凝华)。
(3)________从溶液中析出。
新知构建
固体 自范性 微观结构
晶体 ____(能自发呈现_____外形) 原子在三维空间里呈_____有序排列
非晶体 ____(不能自发呈现多面体外形) 原子排列相对_____
有
多面体
周期性
无
无序
熔融态
气态
凝固
溶质
3.晶体的特性
(1)自范性:晶体能自发地呈现________外形的性质。
(2)各向异性:晶体在不同方向上表现出不同的_________。
(3)固定的熔点。
4.晶体与非晶体的区分方法
区分
方法 测熔点 晶体有固定的熔点,非晶体没有固定的熔点
可靠方法 对固体进行___________实验
多面体
物理性质
X射线衍射
1.正误判断,错误的说明原因。
(1)具有各向异性的固体可能是晶体。
答案:正确。
(2)晶体与非晶体的根本区别在于固体是否具有规则的几何外形。
答案:错误,晶体与非晶体的根本区别在于粒子在微观空间是否呈周期性的有序排列。
(3)X射线衍射是最可靠的区分晶体和非晶体的方法。
答案:正确。
应用评价
(4)用X射线衍射摄取石英玻璃和水晶的粉末得到的图谱是相同的。
答案:错误,石英玻璃为非晶态SiO2,水晶为晶态SiO2,二者研成粉末摄取的X射线衍射图谱不相同。
(5)因为晶体具有自范性,所以用红热的铁针刺涂有石蜡的水晶柱面,熔化的石蜡呈椭圆形。
答案:错误,晶体在导热性中具有各向异性,水晶柱面不同方向的导热性不同,故熔化的石蜡呈椭圆形。
2.(1)在下列物质中___________(填序号,下同)是晶体,____________是非晶体。
①塑料;②明矾;③松香;④玻璃;⑤CuSO4·5H2O;⑥冰糖;⑦糖果;⑧单晶硅;⑨铝块;⑩橡胶
明矾是KAl(SO4)2·12H2O,它和CuSO4·5H2O、冰糖、单晶硅、铝块都是晶体;塑料、松香、玻璃、糖果、橡胶都是非晶体;
②⑤⑥⑧⑨
①③④⑦⑩
(2)晶体和非晶体在外形上有差别,晶体都具有_______的几何外形,而非晶体__________的几何外形;另外非晶体的多种物理性质,在各个方向都是__________的,而晶体的多种物理性质在各个方向都是__________的。
晶体都具有规则的几何外形,非晶体没有规则的几何外形;晶体最大的特征就是各向异性和有固定的熔点,非晶体的多种物理性质,在各个方向都是各向同性;
规则
没有规则
各向同性
各向异性
(3)判断物质是晶体还是非晶体,比较正确的方法是_______。
①从外形上来判断
②从各向异性或各向同性上来判断
③从导电性能来判断
④从有无固定熔点来判断
晶体最大的特征就是各向异性和有固定的熔点,故选②④。
②④
返回
任务三 晶胞和晶体结构的测定
中科院物理所发现一种仅由镍、镁、碳三种元素构成的超导体,它是一种不含氧原子的钙钛矿结构的超导体,该超导体的晶胞如图所示。
情境探究
问题1:该晶胞中,镁原子和镍原子分别位于什么位置?
提示:该晶胞中,镁原子位于平行六面体的顶点上,镍原子位于面心上。
问题2:该晶体的化学式是什么?
提示:MgCNi3。Mg原子处于顶点上,故有8× =1个;
C原子处于晶胞的体心,完全属于该晶胞;Ni处于面心上,
故有6× =3个,故该晶体的化学式为MgCNi3。
问题3:已知该晶胞为正六面体,其边长为a cm,则与Mg原子距离最近的Ni原子之间的距离是多少?
提示: a cm。与顶点Mg原子距离最近的Ni原子位于相邻的面心上,二者之间的距离为面对角线长度的一半,即 a cm。
一、晶胞
1.概念
描述晶体结构的_________。
2.晶胞与晶体的关系
常规的晶胞都是________体,整块晶体可以看作是数量巨大的晶胞“无隙并置”而成。
(1)“无隙”是指相邻晶胞之间___________。
(2)“并置”是指所有晶胞都是_____排列的,取向_____。
(3)所有晶胞的_____及其内部的原子___________及几何排列(包括取向)是完全相同的。
新知构建
平行六面
无任何间隙
平行
相同
形状
种类、个数
基本单元
3.晶胞中粒子数目的计算
(1)铜晶胞
①位于顶角上的铜原子为____个晶胞共用。
②位于面心上的铜原子为____个晶胞共用。
因此晶体铜中完全属于某一晶胞的铜原子数是8× +6× =4。
8
2
(2)NaCl晶胞
①Cl-位于______和______,共有____个。
②Na+位于______和______,共有____个。
NaCl晶胞
顶角
面心
4
棱上
体心
4
(3)几种晶胞中原子数目的确定
结合下图,钠、锌、碘、金刚石晶胞中含有原子的数目分别为 、 、
、 。
2
2
8
8
二、晶体结构的测定
1.测量仪器:______________。
2.测定过程:当单一波长的X射线通过晶体时,会在记录仪上产生分立的斑点或者明锐的_______。
3.作用:通过晶体的X射线衍射实验获得衍射图后,经过计算可以从衍射图形获得晶体结构的有关信息。包括晶胞形状和大小、分子或原子在微观空间有序排列呈现的对称类型、原子在晶胞里的_______和_______等,以及结合晶体化学组成的信息推出原子之间的相互关系。
X射线衍射仪
衍射峰
数目
位置
4.测定示例——乙酸晶体结构的测定流程
乙酸晶体的X射线衍射实验 乙酸晶胞中含4个乙酸分子 测定晶胞中各原子的位置(即原子坐标) 计算原子间的距离 判断出哪些原子间存在化学键 确定键长和键角 分子的空间结构。
1.正误判断,错误的说明原因。
(1)晶胞都是平行六面体。
答案:错误,也可以是其他的形状。
(2)晶胞是晶体的最小重复单元。
答案:正确。
(3)已知晶胞的组成也无法推知晶体的组成。
答案:错误,已知晶胞的组成是可以推知晶体的组成。
(4)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过X射线衍射方法区分晶体、准晶体和非晶体。
答案:正确。
应用评价
2.回答下列问题:
(1)N和Cu元素形成的化合物的晶胞结构如图所示,该化合物的N原子个数为_____,Cu的原子个数为______。
1
3
N原子所在位置为顶点,根据均摊法,N原子个数为8× =1;铜原子所在位置为棱心,个数为12× =3;
(2)则该化合物的化学式为________。
Cu3N
该化合物的化学式为Cu3N;
(3)S和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的S与Cu的微粒个数比为________。
1∶1
根据晶胞结构,Cu原子所在位置为顶点和面心,个数为8× =4,S原子所在位置为内部,个数为4个,该化合物的S与Cu的微粒个数比为1∶1;
(4)价层电子排布式为3d54s2的原子,其原子元素符号为______。
Mn
价层电子排布式为3d54s2的原子,其原子序数为25,元素符号为Mn;
(5)CuaSnbSc中Cu元素有+1和+2两种价态,从结构上分析基态Cu+、
Cu2+中________更稳定,原因是___________________________________
______________。
Cu+
Cu+的价层电子排布式为3d10,全充满
的稳定结构
Cu+和Cu2+的价层电子排布为3d10和3d9,Cu+的价层电子排布全满,较稳定。
返回
随堂演练
1.下列关于晶体和非晶体的说法不正确的是
A.破损的NaCl晶体能在饱和NaCl溶液中自动变成规则的立方体
B.晶体某些物理性质的各向异性反映了晶体内部质点排列的有序性
C.导电性可用于区别晶体和玻璃体
D.固体SiO2可能是晶体,也可能是非晶体
√
A.破损的晶体能在溶液中得到修复,所以破损的NaCl晶体能在饱和NaCl溶液中自动变成规则的立方体,故A正确;B.晶体的各向异性反映了晶体内部质点排列的有序性,故B正确;C.根据晶体的定义,不能通过导电性来区别晶体和玻璃体,某些晶体和玻璃体均导电或不导电,故C错误;D.固体SiO2可能是晶体,也可能是非晶体,如水晶为晶体,玻璃为非晶体,故D正确;故答案选C。
2.下列过程不能得到晶体的是
A.对NaCl饱和溶液降温所得到的固体
B.气态水直接冷却成固态水
C.熔融的KNO3冷却后所得到的固体
D.液态的玻璃冷却后所得到的固体
得到晶体的三条途径:①溶质从溶液中析出;②气态物质凝华;③熔融态物质凝固。A选项符合①,B选项符合②,C选项符合③。由于玻璃属于非晶体,熔融后再冷却所得到的固体仍为非晶体。
√
3. Eu、Ti和O形成一种化合物,其晶胞为如图所示的立方体。
(1)Eu是镧系元素,位于元素周期表的____(填字母)。
A.s区 B.p区
C.d区 D.ds区
E.f区
Eu是镧系元素,位于元素周期表的第六周期,物质在参加反应时,原子核外电子最外层、次外层及倒数第三层的电子都会发生变化,因此属于f区的元素,故合理选项是E;
E
(2)在该晶胞中,Eu、Ti、O的粒子个数比是____________。
在该晶胞中,Eu原子个数为1,Ti原子个数为8× =1,含有的O原子个数为12× =3,则晶胞中Eu、Ti、O的粒子个数比是1∶1∶3;
1∶1∶3
(3)若将Ti原子置于立方体的体心,Eu原子置于立方体顶角,则O原子处于立方体的____(填字母)位置。
A.体心
B.面心
C.棱心
D.顶角
若将Ti原子置于立方体的体心,在一个晶胞中含有1个Ti原子,通过该Ti原子的8个晶胞中含有8个Eu原子,将8个Eu原子相连,形成一个立方体,Eu位于立方体的顶角上,O原子处于立方体的面心上,故合理选项是B;
B
(4)1个Eu原子和_____个O原子相邻,1个Ti原子和____个O原子相邻。1个O原子和____个Eu原子相邻,1个O原子和_____个Ti原子相邻。
根据图示可知:在晶胞中与Eu原子距离相等且最近的O原子有12个,距离为晶胞面对角线的一半;以晶胞顶点Ti原子为研究对象,在晶胞中与Ti原子距离相等且最近的O原子有6个,分别位于Ti原子上下、前后、左右6个方向,距离为晶胞边长的一半;
12
6
4
2
O原子位于晶胞棱边上,通过该棱边可以形成4个晶胞,每个晶胞中有一个Eu原子,因此与1个O原子和4个Eu原子距离相等且最近,距离是晶胞面对角线的一半;在1个O原子周围有2个Ti原子与O原子距离相等且最近,距离是晶胞边长的一半。
返回
课时测评
题点一 物质的聚集状态
1.等离子体和液晶在工业、农业、军事、宇航、天体等方面有着非常重要的应用价值。下列关于它们的说法错误的是
A.等离子体和液晶都是物质的一种聚集状态
B.液晶具有液体的流动性和晶体的各向异性
C.等离子体只含有离子
D.等离子体和液晶都可用于制造显示器
√
A项,等离子体是由电子、阳离子和电中性粒子(分子或原子)组成的整体上呈电中性的气态物质,液晶是介于液态和晶态之间的物质状态,正确;B项,在一定范围内存在液体流动性,也存在晶体各向异性的物质,称之为液晶,正确;C项,等离子体中既有带电的阳离子和电子,也有电中性的分子或原子,错误;D项,等离子体和液晶可以分别用于制造等离子体显示器、液晶显示器,正确。
2. 下列关于物质聚集状态的叙述中,错误的是
A.等离子体的基本构成微粒只有带电的离子和电子
B.气态是高度无序的体系存在状态
C.液晶内部分子沿分子长轴方向有序排列,使液晶具有各向异性
D.固态中的原子或者分子结合得较紧凑,相对运动较弱
√
A项,等离子体是呈电中性的,其基本构成微粒可以是带电的粒子也可以是中性粒子,错误;B项,物质处于气态时,分子间距离大,分子运动速度快,体系处于高度无序状态,正确;C项,液晶内部分子的排列沿分子长轴方向呈现出有序的排列,使液晶在折射率、磁化率、电导率等宏观性质方面表现出类似晶体的各向异性,正确;D项,据物质固态时微粒间距离较小可判断,固态中的原子或者分子结合的较紧凑,相对运动较弱,正确。
题点二 晶体与非晶体
3.晶体是一类非常重要的材料,在很多领域都有广泛的应用。我国现已能够拉制出直径为300 mm、重量达81 kg的大直径硅单晶,晶体硅大量用于电子产业。下列叙述正确的是
A.形成晶体硅的速率越快越好
B.晶体硅没有固定的熔、沸点
C.可用X射线衍射实验来鉴别晶体硅和玻璃
D.晶体硅的形成与晶体的自范性有关,而与各向异性无关
√
A项,晶体的形成都有一定的形成条件,如温度、压强、结晶速率等,但并不是说结晶速率越快越好,速率太快可能导致晶体质量下降,错误;B项,晶体都有固定的熔、沸点,则晶体硅一定有固定的熔、沸点,错误;C项,X射线衍射实验能够测出物质的内部结构,根据微粒是否有规则的排列可区分晶体与非晶体,正确;D项,晶体的形成与晶体的自范性和各向异性都有密切关系,错误。
4.金属玻璃是由金属元素或金属元素为主要成分的熔体通过快速冷却得到的具有非晶态结构的金属固体。以下关于金属玻璃的说法正确的是
A.金属玻璃能自发呈现多面体外形
B.金属玻璃具有固定的熔点
C.鉴别金属玻璃是否为晶体最可靠的科学方法为X射线衍射实验
D.金属玻璃是金属与二氧化硅的混合物
√
A项,根据题中描述,金属玻璃是非晶体,不能自发呈现多面体外形,错误;B项,金属玻璃是非晶体,没有固定熔、沸点,错误;C项,鉴别金属玻璃是否为晶体最可靠的科学方法为X射线衍射实验,正确;D项,金属玻璃是由金属元素或金属元素为主要成分的金属固体,错误。
5. 不能够支持石墨是晶体这一事实的选项是
A. 石墨和金刚石互为同素异形体
B.石墨中的碳原子呈周期性有序排列
C.石墨的熔点为3 625 ℃
D.在石墨的X射线衍射图谱上有明锐的衍射峰
√
是否互为同素异形体与是否为晶体这两者之间并无联系,如无定形碳也是金刚石、石墨的同素异形体,却属于非晶体。
6. 如图为一块密度、厚度均匀的矩形样品,长为宽的两倍,若用多用电表沿两对称轴测其电阻均为R,则这块样品一定是
A.金属
B.半导体
C.非晶体
D.晶体
由于AB=2CD,而AB、CD间的电阻却相等,说明样品横向(AB)与纵向(CD)的导电性不同,具有各向异性,而晶体的特征之一是各向异性,非晶体则具有各向同性,故该样品为晶体。
√
题点三 晶胞概念的理解
7.下列有关晶胞的叙述中正确的是
A.晶胞的结构就是晶体的结构
B.不同的晶体中,晶胞的大小和形状都相同
C.晶胞中的任何一个粒子都完全属于该晶胞
D.已知晶胞的组成就可推知晶体的组成
√
由晶胞的定义可知A错误;相同晶体中晶胞的大小和形状完全相同,不同晶体的晶胞大小和形状不一定相同,B错误;晶体中的大部分粒子被若干个晶胞所共有,不完全属于某个晶胞,C错误;知道晶胞的组成,利用“均摊法”即可推知晶体的组成,D正确。
8.关于测定晶体结构错误的是
A.对乙酸晶体进行测定,晶胞中含有1个乙酸分子
B.经过计算可以从衍射图形获得晶胞形状和大小
C.经过计算可以从衍射图形获得分子或原子在微观空间有序排列呈现的对称类型
D.经过计算可以从衍射图形获得原子在晶胞里的数目和位置
√
A项,对乙酸晶体进行测定,可以得到晶胞结构中含有4个乙酸分子,错误;B项,经过计算可以从衍射图形获得晶胞形状和大小,正确;C项,经过计算可以从衍射图形获得分子或原子在微观空间有序排列呈现的对称类型,正确;D项,经过计算可以从衍射图形获得原子在晶胞里的数目和位置,正确。
题点四 晶胞中粒子数目
9. 晶体内微粒总是按周期性规律重复排列,反映其结构特点的基本重复单位为晶胞,晶体可视为晶胞经平移无隙并置而成。以下是某些晶体的局部结构,可做为晶胞的是
√
按照题意,晶体可视为晶胞经平移无隙并置而成,是指相邻晶胞之间没有任何间隙,所有晶胞平行排列,取向相同。由此可知,平移后,重合位置的原子相同。A项,不管是左右或上下平移时,大圆表示的原子和小圆表示的原子位置重合,但不是同一种原子,因此该结构不能作为晶胞,错误;B项,不管是上下平移还是左右平移,各原子都可以与相同的原子重叠,可平移无隙并置得到晶体,因此该结构可以作为晶胞,正确;C项,上下平移时,位于面心的两个不同的原子位置会重合,因此该结构不能作为晶胞,错误;D项,该结构平移时会存在空隙,因此不能作为晶胞,错误。
10. 根据下列四种晶体的晶胞示意图,下列说法不正确的是
A.图Ⅰ:Cu晶胞平均含有的铜原子数是4
B.图Ⅱ:干冰晶胞平均含有CO2分子数是8
C.图Ⅲ:碘晶体中碘分子的排列有2种不同的方向
D.图Ⅳ:晶体M的化学式可能为AB
√
11. 已知某ABC3晶体的晶胞如图所示,晶胞参数为a nm,摩尔质量为M g/mol,下列说法正确的是
A.离A微粒距离最近且相等的B微粒的个数为12个
B.若m的坐标为(0,0,0),则p的坐标为
C.相邻两个C微粒最近距离为a nm
D.该晶胞的密度为 ×1021 g·cm-3
√
12. 固体二氧化硅有晶体和非晶体两种。根据下图回答:
(1)对比图Ⅰ和Ⅱ可知,晶体SiO2具有自范性,而非晶体SiO2没有自范性,本质原因是______________________________________________________
_____________________________________。
构成晶体的粒子在微观空间里呈现周期性有序排列,而构成非晶体的粒子在微观空间里排列相对无序
(2)观察三个图,区分晶体SiO2和非晶体SiO2最可靠的科学方法是________
___________________________。
二氧化硅进行X射线衍射实验
对固体
晶体的粒子在微观空间里呈现周期性有序排列,而非晶体的粒子排列相对无序;区分晶体和非晶体最可靠的科学方法是对固体进行X射线衍射实验。
13.元素X的某价态离子Xn+中所有电子正好充满K、L、M三个能层,它与N3-形成晶体的晶胞结构如图所示。
(1)该晶体的阳离子与阴离子个数之比为________。
Xn+位于晶胞的棱上,其数目为12× =3;N3-位于晶胞的顶角,其数目为8× =1,故二者个数之比为3∶1。
3∶1
(2)该晶体中Xn+的n=____。
由晶体的化学式X3N知,X所带电荷数为1。
1
(3)X元素的原子序数是_____。
因为K、L、M三个能层充满,故Xn+有2、8、18结构,所以X的原子序数是29。
29
(4)晶体中每个N3-被____个等距离的Xn+包围。
N3-位于晶胞顶角,故其被6个Xn+从上、下、左、右、前、后包围。
6
14.(1)金属K和C60能够发生反应产生一系列金属球碳盐KxC60,部分金属球碳盐具有超导性,是球碳族化合物的研究热点之一。某种KxC60的晶胞结构如图所示。C 位于立方体晶胞的顶点和面心,K+位于晶胞的体心和棱心,另外晶胞内还有8个K+。
KxC60中x=____。
3
(2)镧(La)镍(Ni)合金是一种储氢材料,这种合金的晶体结构已经测定,其基本结构单元如图所示,则该合金的化学式可表示为________________。
LaNi5(或Ni5La)
(3)砷化铟(InAs)是一种优良的半导体化合物,有广泛用途。InAs为原子之间以共价键的成键方式结合而成的晶体。其晶胞结构如图所示。一个晶胞中所含As的个数为____。
由晶胞结构可知,晶胞中位于体内的砷原子个数为4,位于顶点和面心的铟原子个数为8× =4;
4
(4)Cu的晶胞(图1)、Cu2O的晶胞(图2)如下所示。
金属铜的一个晶胞中的铜原子数与Cu2O一个晶胞中的铜原子数之比为________。
由Cu、Cu2O晶胞结构可知:在一个Cu晶胞中含有的Cu原子数目为8×
=4;在一个Cu2O晶胞中含有的Cu原子数目为4×1=4,故二者一个晶胞中含有的Cu原子数目比是4∶4=1∶1。
返回
1∶1
