人教版高中化学选择性必修2第一章原子结构与性质第一节第1课时能层与能级基态与激发态课件(45页ppt)
文档属性
| 名称 | 人教版高中化学选择性必修2第一章原子结构与性质第一节第1课时能层与能级基态与激发态课件(45页ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-09 00:00:00 | ||
图片预览











文档简介
(共45张PPT)
第1课时 能层与能级 基态与激发态
第一章 第一节 原子结构
任务一 能层与能级
亨利·莫斯莱和巴克拉首次于X射线吸收研究的实验中发现能层,巴克拉把它们称为K、L和M等能层,这些字母后来被n值1、2、3等取代。由玻尔的理论发展而来的现代量子物理学认为原子核外电子的可能状态是不连续的,因此各状态对应能量也是不连续的,这些能量值就是能级。
情境探究
问题1:基态氧原子核外包括哪些能层?电子占据哪些能级?L层上6个电子的能量都相同吗?
提示: K、L能层;1s、2s、2p能级;L层上6个电子的能量不完全相同,2s能级上电子能量相同,2p能级上电子能量相同。
问题2:基态铝原子核外有几种能量不同的电子?电子占据的最高能级符号是什么?
提示:5种;3p。
1.能层
(1)含义:根据核外电子的______不同,将核外电子分为不同的______。
(2)序号及符号
能层序号____________________________……分别用__________________
_________……表示,其中每层所容纳的电子数最多为2n2个(n为能层的序数)。
(3)能量关系
能层越高,电子的能量越高,能量的高低顺序为______________________
___________________________
新知构建
能量
能层
一、二、三、四、五、六、七
K、L、M、N、O、
P、Q
E(K)<E(L)<E(M)<
E(N)<E(O)<E(P)<E(Q)。
2.能级
(1)含义:根据多电子原子的同一能层的电子的能量也可能不同,将它们分为不同能级。
(2)表示方法:分别用相应能层的序数和字母____________等表示,如n能层的能级按能量由低到高的排列顺序为ns、np、nd、nf等。
s、p、d、f
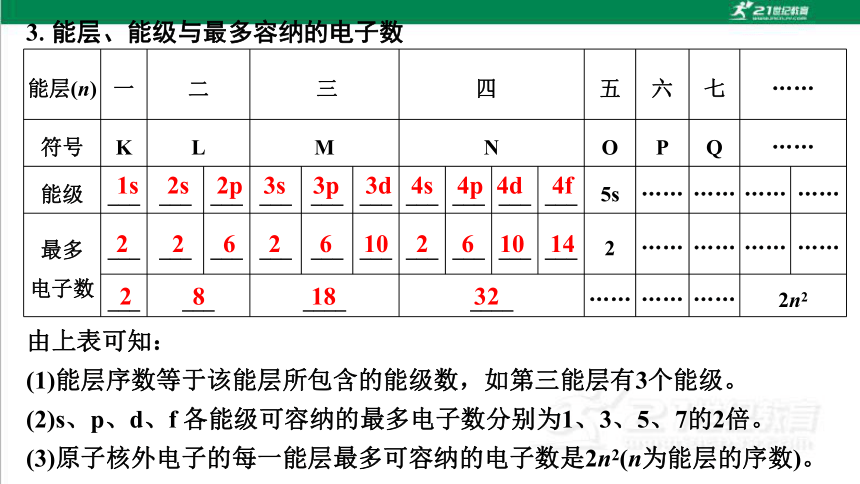
3.能层、能级与最多容纳的电子数
能层(n) 一 二 三 四 五 六 七 ……
符号 K L M N O P Q ……
能级 ___ ___ ___ ___ ___ ___ ___ ___ ___ ___ 5s …… …… …… ……
最多
电子数 ___ ___ ___ ___ ___ ___ ___ ___ ___ ___ 2 …… …… …… ……
___ ___ ____ ____ …… …… …… 2n2
由上表可知:
(1)能层序数等于该能层所包含的能级数,如第三能层有3个能级。
(2)s、p、d、f 各能级可容纳的最多电子数分别为1、3、5、7的2倍。
(3)原子核外电子的每一能层最多可容纳的电子数是2n2(n为能层的序数)。
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
2
2
6
2
6
10
2
6
10
14
2
8
18
32
1.正误判断,错误的说明原因。
(1)2d表示L层上的d能级。
答案:错误,L层没有d轨道。
(2)s能级的能量一定比p能级的能量低。
答案:错误,高能层的s能级的能量比低能层的p能级的能量高。
(3)各能级最多可容纳的电子数按s、p、d、f……的顺序依次为自然数中的奇数序列1、3、5、7……的2倍。
答案:正确。
(4)4s、4p、4d、4f能级的能量的高低顺序为E(4s)<E(4p)<E(4d)<E(4f)。
答案:正确。
应用评价
2.比较各能层或能级中电子能量大小:
(1)E(2s)________E(4s);
(2)E(3p)________E(3d);
(3)E(5d)________E(4d);
(4)E(3s)________E(2p);
(5)E(K)________E(L)________E(M)。
<
<
>
>
<
<
不同能层的能量按K、L、M、N、O、P、Q……的顺序依次升高,同一能层里,各能级的能量按s、p、d、f……的顺序依次升高。
返回
任务二 基态与激发态 原子光谱
很多金属或它们的化合物在无色火焰中灼烧时都会使火焰呈现出特征颜色。根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。因此人们在烟花中有意识地加入特定金属元素,使焰火更加绚丽多彩。
问题1:美丽的焰火跟原子结构有何关系?焰色试验中钠、钾、铜的火焰分别是什么颜色?
提示:美丽的焰火与原子核外电子发生跃迁有关,金属原子吸收能量从基态跃迁到激发态后,电子从高能级轨道跃迁回到低能级轨道时,将能量以光能的形式释放出来;焰色试验中钠、钾、铜的火焰分别为黄色、紫色和绿色。
情境探究
问题2:电子跃迁是如何完成的?是物理变化还是化学变化?
提示:电子跃迁是通过吸收能量或者释放能量来完成的;电子的跃迁是物理变化,而原子得失电子时发生的是化学变化。一般在能量相近的能级间发生电子跃迁。如从2p能级跃迁到3s能级。
问题3:金属元素的焰色试验利用的是原子的吸收光谱还是发射光谱?
提示:光(辐射)是电子跃迁释放能量的重要形式,焰色试验利用的是原子的发射光谱。
1.基态原子与激发态原子
(1)基态原子:处于__________状态的原子。
(2)激发态原子:基态原子______能量,它的电子会跃迁到______能级,变成激发态原子。
(3)基态、激发态相互间转化的能量变化
基态原子 激发态原子
新知构建
________,主要形式为____
__________
最低能量
吸收
较高
吸收能量
释放能量
光
2.光谱
(1)光谱的成因及分类
(2)光谱分析:在现代化学中,常利用原子光谱上的__________来鉴定元素,称为光谱分析。
吸收光谱
发射光谱
特征谱线
1.正误判断,错误的说明原因。
(1)光(辐射)是电子跃迁释放能量的重要形式之一。
答案:正确。
(2)霓虹灯光、激光、荧光都与原子核外电子跃迁吸收能量有关。
答案:错误,霓虹灯光、激光、荧光都与原子核外电子跃迁释放能量有关。
(3)产生激光的前提是原子要处于激发态。
答案:正确。
(4)电子跃迁时只吸收能量。
答案:错误,电子跃迁时可能吸收能量也可能释放能量。
应用评价
2.
(1)基态原子:处于__________状态的原子。
(2)基态原子________,电子跃迁到________,变为激发态原子。
(3)电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将________。
(4)________是电子跃迁释放能量的重要形式之一。
最低能量
吸收能量
较高能级
释放能量
光(辐射)
返回
随堂演练
1.在基态多电子原子中,关于核外电子能量的叙述错误的是
A.最易失去的电子能量最高
B.离核最远的电子能量最高
C.p能级电子能量一定高于s能级电子能量
D.在离核最近的区域内运动的电子能量最低
√
一般情况下,能层序数越大,能量越高。离核最远的,最易失去的电子都是处在能层序数大的位置,所以能量高;离核近的电子处在能层序数小的位置,所以能量低,故A、B、D都正确。p能级与s能级如果处在同一能层,p能级电子能量一定高于s能级电子能量,若不在同一能层,p能级电子能量不一定高于s能级电子能量,C项错误。
2.下列说法正确的是
A.同一原子中1s、2s、3s电子能量逐渐减小
B.同一原子中2p、3p、4p能级可容纳的最多电子数依次增多
C.能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动
D.各能层最多能容纳的电子数是2n2
能级符号相同,能层越大,电子能量越高,所以1s、2s、3s电子的能量逐渐增大,故A错误;同一原子中,2p、3p、4p可容纳的最多电子数相等,都为6,故B错误;能量低的电子在离核近的区域运动,能量高的电子在离核远的区域运动,故C错误;各能层最多含有的电子数为2n2,故D正确。
√
3.电子由3d能级跃迁至4p能级时,可通过光谱仪直接摄取
A.电子的运动轨迹图像
B.原子的吸收光谱
C.电子体积大小的图像
D.原子的发射光谱
能量E(3d)√
4.(1)已知短周期元素A、B,A元素原子的最外层电子数为m,次外层电子数为n;B元素原子的M层(有电子)电子数为m-n-1,L层电子数为m+n+2,则A为________(填元素符号,下同),B为________。
C
Na
短周期元素的原子最多有三个能层(K、L、M),则A元素原子的次外层只可能为K层或L层,n只可能是2或8,又因为B元素原子的L层电子数为m+n+2,而L层最多容纳8个电子,所以n只可能等于2。由m+n+2=8,得m=4。故A元素原子的核外电子排布情况为K层2个电子,L层4个电子,则A为C;B元素原子的核外电子排布情况为K层2个电子,L层8个电子,M层1个电子,则B为Na。
返回
(2)已知X元素原子的L层比Y元素原子的L层少3个电子,Y元素原子的核外电子总数比X元素原子的多5,则X、Y分别为________、________。
N
Mg
根据题意,Y元素原子的核外电子总数比X元素原子的多5,而Y元素原子的L层电子只比X元素原子的多3个,故Y元素原子的最外层不是L层,而是M层,根据核外电子排布规律可知,其L层为次外层时只能排8个电子,则X元素原子的L层有5个电子,其原子核外电子数为2+5=7,故X为N;Y元素原子核外电子数为7+5=12,故Y为Mg。
课时测评
题点一 能层的理解与应用
1.在同一个原子中,M能层上的电子与Q能层上的电子的能量
A.前者大于后者 B.后者大于前者
C.前者等于后者 D.无法确定
√
在同一个原子中,能层的能量由低到高的顺序是K、L、M、N、O、P、Q,故B正确。
2.某元素原子的核外有三个能层,最外能层有4个电子,该原子核内的质子数为
A.14 B.15
C.16 D.17
√
原子核外共有三个能层,最内层只有1s能级,可容纳2个电子,第二层有2s、2p两个能级,可容纳8个电子,最外层有4个电子,所以该原子核外有14个电子,又因在原子中核外电子数等于核内质子数,故选A。
3.以下能级符号正确的是
A.3f B.2d
C.4s D.2f
√
第三能层有3个能级(3s、3p、3d),没有3f能级,故A错误;第二能层有2个能级(2s和2p),没有2d能级,故B错误;第四能层有4个能级(4s、4p、4d、4f),故C正确;第二能层有2个能级(2s和2p),没有2f能级,故D错误。
4.下列说法中错误的是
A.某原子K层上只有一个电子
B.某离子M层和L层上的电子数均为K层的4倍
C.某原子M层上的电子数为L层电子数的4倍
D.存在核电荷数与最外层电子数相等的离子
√
氢原子K层上只有一个电子,A正确;Cl-、K+等离子M层和L层上的电子数均为K层的4倍,B正确;原子核外已有M层,则L层为全排满,即8个电子,这样M层就有32个电子,而M层为第三能层,最多容纳的电子数为18个,故不可能,C错误;O2-核电荷数为8,核外最外层电子数也为8,D正确。
题点二 能层和能级
5.N能层所含能级数、最多容纳电子数分别为
A.3、18 B.4、24
C.5、32 D.4、32
√
N能层为第四能层,含有的能级分别为s、p、d、f,最多可以容纳32个电子,D正确。
6.原子中的某一能层,最多能容纳的电子数目大于32,该能层可能会是
A.L能层 B.M能层
C.N能层 D.P能层
每一能层最多能容纳的电子数目为2n2,所以最多能容纳的电子数目大于32的能层,至少是第五能层。
√
7.以下能级符号表示正确的是
①5s ②1d ③2f ④1p ⑤2d ⑥3f ⑦4f ⑧5d ⑨3p ⑩6s
A.③⑤⑦⑧⑨⑩ B.①⑦⑧⑨⑩
C.①③⑤⑦⑨ D.②④⑥⑧⑩
√
每一个能层都有s能级,从第二能层开始出现p能级,从第三能层开始出现d能级,从第四能层开始出现f能级,B项正确。
8.下列多电子原子不同能级能量高低的比较错误的是
A.1s<2s<3s B.2p<3p<4p
C.3s<3p<3d D.4s>3d>3p
√
在多电子原子中,从3d能级开始有“能级交错”现象,实际4s能级的能量小于3d,所以D错误。
题点三 原子的激发态、基态与光谱
9.下列说法正确的是
A.自然界中的所有原子都处于基态
B.同一原子处于激发态时的能量一定高于基态时的能量
C.无论原子种类是否相同,基态原子的能量总是低于激发态原子的能量
D.激发态原子的能量较高,极易失去电子,表现出较强的还原性
√
处于最低能量状态的原子叫作基态原子,A错误。电子由较低能级向较高能级跃迁,叫激发,B正确。只有相同原子激发态原子的能量总是比原来基态原子的能量高,C错误。如果电子仅在内层激发,电子未获得足够的能量,不会失去,D错误。
10.下列说法中不正确的是
A.同一原子中,2p、3p、4p能级的轨道数依次增多
B.3p2表示3p能级有两个电子
C.d能级最多能容纳10个电子
D.处于最低能量状态的原子叫做基态原子
所有能层中的p能级都只有3个轨道,A项错误。
√
11.对焰色试验的描述正确的是
A.焰色试验只是金属单质特有的性质
B.焰色试验是化学变化
C.焰色试验是金属原子从基态跃迁到激发态时,将能量以光的形式表现出来
D.焰色试验是金属原子或离子从较高能量的激发态跃迁到较低能量的激发态或基态时,将能量以光的形式表现出来的现象
焰色试验是大多数金属元素的性质,是物理变化,从基态→激发态要吸收能量,从激发态→基态会释放能量。
√
12.图中所发生的现象与电子的跃迁无关的是
燃放烟火、霓虹灯、燃烧蜡烛等获得的光能都是电子跃迁时能量以光的形式释放出来导致的,而平面镜成像则是光线反射的结果。
√
13.填空。
(1)用符号填写能层所含能级种类:
K层:___;L层:_______;M层:__________;N层:______________。
(2)用数字填写能级所能容纳最多电子数目:
s:________;p:________;d:________;f:________。
(3)比较下列能级的能量高低(填“<”、“=”或“>”)。
①4s________3s________2s________1s;
②4f________4d________4p________4s;
③1s________2p________3d________4f。
1s
2s、2p
3s、3p、3d
4s、4p、4d、4f
2
6
10
14
>
>
>
>
>
>
<
<
<
14.(1)Cl原子核外电子能量最高的电子所在的能级是________。
(2)基态Si原子中,核外电子占据最高能层的符号为________,该能层上有________个能级,电子数为________。
Cl原子核外有17个电子,排布在1s、2s、2p、3s、3p 5个能级上,能量最高的是3p能级。
3p
Si原子核外有14个电子,K、L、M能层上分别有2、8、4个电子,所以电子占据的最高能层为M能层,该能层有3s、3p、3d三个能级,排有4个电子。
M
3
4
15.下表给出了五种元素的相关信息,其中A、B、C、D为短周期元素。
元素 相关信息
A 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料
B 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障
C 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂
D 室温下其单质呈粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰
E 它是人体不可缺少的微量元素,其单质也是日常生产和生活中不可缺少的金属原材料,常用于制造桥梁、楼房等
根据上述信息填空:
(1)B元素的基态原子含有__________个能层,其中第二能层中有哪几个能
级:________;画出D的原子结构示意图:_________。
2
2s和2p
元素 相关信息
A 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料
B 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障
C 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂
D 室温下其单质呈粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰
E 它是人体不可缺少的微量元素,其单质也是日常生产和生活中不可缺少的金属原材料,常用于制造桥梁、楼房等
氢气是一种清洁燃料,所以A为氢元素;臭氧对紫外线有吸收作用,是保护地球地表环境的重要屏障,所以B为氧元素,其基态原子含有K层与L层2个能层,L层为第二能层,有s、p两个能级(即2s和2p);氮、磷、钾是植物生长三要素,N2O俗名“笑气”,是早期医疗中使用的麻醉剂,所以C为氮元素;单质硫在氧气中燃烧,发出明亮的蓝紫色火焰,所以D为硫元素;日常生产和生活中最常用的金属是铁、铜和铝,其中只有铁是人体不可缺少的微量元素,所以E为铁元素。
(2)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,写出两者发生反应生成无毒物质的化学方程式:__________________________________。
元素 相关信息
A 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料
B 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障
C 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂
D 室温下其单质呈粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰
E 它是人体不可缺少的微量元素,其单质也是日常生产和生活中不可缺少的金属原材料,常用于制造桥梁、楼房等
氮和氢形成的原子个数比为1∶2的化合物为N2H4,氮和氧形成的原子个数比为1∶2的化合物有NO2和N2O4,其中N2O4是无色气体,NO2是红棕色气体,N2H4和N2O4反应生成无毒的N2和H2O。
(3)某矿藏主要含D、E两种元素组成的化合物,它在空气中高温条件下生成一种刺激性气体和一种红色氧化物。试写出该反应的化学方程式:__________________________________。
元素 相关信息
A 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料
B 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障
C 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂
D 室温下其单质呈粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰
E 它是人体不可缺少的微量元素,其单质也是日常生产和生活中不可缺少的金属原材料,常用于制造桥梁、楼房等
我国主要以黄铁矿(其主要成分是FeS2)为原料制备硫酸,其第一阶段的主要反应是煅烧黄铁矿,反应为4FeS2+11O2 2Fe2O3+8SO2。
16.有两种常见气态单质Am和Bn,已知2.4 g Am和2.1 g Bn所含的原子个数相等,分子数之比为2∶3。A原子L层的电子数是K层的3倍。
(1)A、B的元素符号分别为_________。
(2)Am中m的值为_____。
(3)B原子含有的能层数目为_____。
(4)A、B形成的一种气态化合物与水反应能生成由A、B形成的另一种气态化合物。写出该反应的化学方程式:_____________________________。
O、N
3
2
3NO2+H2O===2HNO3+NO
由A原子L层的电子数是K层的3倍,可知A为O。根据题意,设A、B的相对原子质量分别为x、y,则 ,解得7x=8y,2m=3n。由此可知B为N,Am为O3,Bn为N2。
返回
第1课时 能层与能级 基态与激发态
第一章 第一节 原子结构
任务一 能层与能级
亨利·莫斯莱和巴克拉首次于X射线吸收研究的实验中发现能层,巴克拉把它们称为K、L和M等能层,这些字母后来被n值1、2、3等取代。由玻尔的理论发展而来的现代量子物理学认为原子核外电子的可能状态是不连续的,因此各状态对应能量也是不连续的,这些能量值就是能级。
情境探究
问题1:基态氧原子核外包括哪些能层?电子占据哪些能级?L层上6个电子的能量都相同吗?
提示: K、L能层;1s、2s、2p能级;L层上6个电子的能量不完全相同,2s能级上电子能量相同,2p能级上电子能量相同。
问题2:基态铝原子核外有几种能量不同的电子?电子占据的最高能级符号是什么?
提示:5种;3p。
1.能层
(1)含义:根据核外电子的______不同,将核外电子分为不同的______。
(2)序号及符号
能层序号____________________________……分别用__________________
_________……表示,其中每层所容纳的电子数最多为2n2个(n为能层的序数)。
(3)能量关系
能层越高,电子的能量越高,能量的高低顺序为______________________
___________________________
新知构建
能量
能层
一、二、三、四、五、六、七
K、L、M、N、O、
P、Q
E(K)<E(L)<E(M)<
E(N)<E(O)<E(P)<E(Q)。
2.能级
(1)含义:根据多电子原子的同一能层的电子的能量也可能不同,将它们分为不同能级。
(2)表示方法:分别用相应能层的序数和字母____________等表示,如n能层的能级按能量由低到高的排列顺序为ns、np、nd、nf等。
s、p、d、f
3.能层、能级与最多容纳的电子数
能层(n) 一 二 三 四 五 六 七 ……
符号 K L M N O P Q ……
能级 ___ ___ ___ ___ ___ ___ ___ ___ ___ ___ 5s …… …… …… ……
最多
电子数 ___ ___ ___ ___ ___ ___ ___ ___ ___ ___ 2 …… …… …… ……
___ ___ ____ ____ …… …… …… 2n2
由上表可知:
(1)能层序数等于该能层所包含的能级数,如第三能层有3个能级。
(2)s、p、d、f 各能级可容纳的最多电子数分别为1、3、5、7的2倍。
(3)原子核外电子的每一能层最多可容纳的电子数是2n2(n为能层的序数)。
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
2
2
6
2
6
10
2
6
10
14
2
8
18
32
1.正误判断,错误的说明原因。
(1)2d表示L层上的d能级。
答案:错误,L层没有d轨道。
(2)s能级的能量一定比p能级的能量低。
答案:错误,高能层的s能级的能量比低能层的p能级的能量高。
(3)各能级最多可容纳的电子数按s、p、d、f……的顺序依次为自然数中的奇数序列1、3、5、7……的2倍。
答案:正确。
(4)4s、4p、4d、4f能级的能量的高低顺序为E(4s)<E(4p)<E(4d)<E(4f)。
答案:正确。
应用评价
2.比较各能层或能级中电子能量大小:
(1)E(2s)________E(4s);
(2)E(3p)________E(3d);
(3)E(5d)________E(4d);
(4)E(3s)________E(2p);
(5)E(K)________E(L)________E(M)。
<
<
>
>
<
<
不同能层的能量按K、L、M、N、O、P、Q……的顺序依次升高,同一能层里,各能级的能量按s、p、d、f……的顺序依次升高。
返回
任务二 基态与激发态 原子光谱
很多金属或它们的化合物在无色火焰中灼烧时都会使火焰呈现出特征颜色。根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。因此人们在烟花中有意识地加入特定金属元素,使焰火更加绚丽多彩。
问题1:美丽的焰火跟原子结构有何关系?焰色试验中钠、钾、铜的火焰分别是什么颜色?
提示:美丽的焰火与原子核外电子发生跃迁有关,金属原子吸收能量从基态跃迁到激发态后,电子从高能级轨道跃迁回到低能级轨道时,将能量以光能的形式释放出来;焰色试验中钠、钾、铜的火焰分别为黄色、紫色和绿色。
情境探究
问题2:电子跃迁是如何完成的?是物理变化还是化学变化?
提示:电子跃迁是通过吸收能量或者释放能量来完成的;电子的跃迁是物理变化,而原子得失电子时发生的是化学变化。一般在能量相近的能级间发生电子跃迁。如从2p能级跃迁到3s能级。
问题3:金属元素的焰色试验利用的是原子的吸收光谱还是发射光谱?
提示:光(辐射)是电子跃迁释放能量的重要形式,焰色试验利用的是原子的发射光谱。
1.基态原子与激发态原子
(1)基态原子:处于__________状态的原子。
(2)激发态原子:基态原子______能量,它的电子会跃迁到______能级,变成激发态原子。
(3)基态、激发态相互间转化的能量变化
基态原子 激发态原子
新知构建
________,主要形式为____
__________
最低能量
吸收
较高
吸收能量
释放能量
光
2.光谱
(1)光谱的成因及分类
(2)光谱分析:在现代化学中,常利用原子光谱上的__________来鉴定元素,称为光谱分析。
吸收光谱
发射光谱
特征谱线
1.正误判断,错误的说明原因。
(1)光(辐射)是电子跃迁释放能量的重要形式之一。
答案:正确。
(2)霓虹灯光、激光、荧光都与原子核外电子跃迁吸收能量有关。
答案:错误,霓虹灯光、激光、荧光都与原子核外电子跃迁释放能量有关。
(3)产生激光的前提是原子要处于激发态。
答案:正确。
(4)电子跃迁时只吸收能量。
答案:错误,电子跃迁时可能吸收能量也可能释放能量。
应用评价
2.
(1)基态原子:处于__________状态的原子。
(2)基态原子________,电子跃迁到________,变为激发态原子。
(3)电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将________。
(4)________是电子跃迁释放能量的重要形式之一。
最低能量
吸收能量
较高能级
释放能量
光(辐射)
返回
随堂演练
1.在基态多电子原子中,关于核外电子能量的叙述错误的是
A.最易失去的电子能量最高
B.离核最远的电子能量最高
C.p能级电子能量一定高于s能级电子能量
D.在离核最近的区域内运动的电子能量最低
√
一般情况下,能层序数越大,能量越高。离核最远的,最易失去的电子都是处在能层序数大的位置,所以能量高;离核近的电子处在能层序数小的位置,所以能量低,故A、B、D都正确。p能级与s能级如果处在同一能层,p能级电子能量一定高于s能级电子能量,若不在同一能层,p能级电子能量不一定高于s能级电子能量,C项错误。
2.下列说法正确的是
A.同一原子中1s、2s、3s电子能量逐渐减小
B.同一原子中2p、3p、4p能级可容纳的最多电子数依次增多
C.能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动
D.各能层最多能容纳的电子数是2n2
能级符号相同,能层越大,电子能量越高,所以1s、2s、3s电子的能量逐渐增大,故A错误;同一原子中,2p、3p、4p可容纳的最多电子数相等,都为6,故B错误;能量低的电子在离核近的区域运动,能量高的电子在离核远的区域运动,故C错误;各能层最多含有的电子数为2n2,故D正确。
√
3.电子由3d能级跃迁至4p能级时,可通过光谱仪直接摄取
A.电子的运动轨迹图像
B.原子的吸收光谱
C.电子体积大小的图像
D.原子的发射光谱
能量E(3d)
4.(1)已知短周期元素A、B,A元素原子的最外层电子数为m,次外层电子数为n;B元素原子的M层(有电子)电子数为m-n-1,L层电子数为m+n+2,则A为________(填元素符号,下同),B为________。
C
Na
短周期元素的原子最多有三个能层(K、L、M),则A元素原子的次外层只可能为K层或L层,n只可能是2或8,又因为B元素原子的L层电子数为m+n+2,而L层最多容纳8个电子,所以n只可能等于2。由m+n+2=8,得m=4。故A元素原子的核外电子排布情况为K层2个电子,L层4个电子,则A为C;B元素原子的核外电子排布情况为K层2个电子,L层8个电子,M层1个电子,则B为Na。
返回
(2)已知X元素原子的L层比Y元素原子的L层少3个电子,Y元素原子的核外电子总数比X元素原子的多5,则X、Y分别为________、________。
N
Mg
根据题意,Y元素原子的核外电子总数比X元素原子的多5,而Y元素原子的L层电子只比X元素原子的多3个,故Y元素原子的最外层不是L层,而是M层,根据核外电子排布规律可知,其L层为次外层时只能排8个电子,则X元素原子的L层有5个电子,其原子核外电子数为2+5=7,故X为N;Y元素原子核外电子数为7+5=12,故Y为Mg。
课时测评
题点一 能层的理解与应用
1.在同一个原子中,M能层上的电子与Q能层上的电子的能量
A.前者大于后者 B.后者大于前者
C.前者等于后者 D.无法确定
√
在同一个原子中,能层的能量由低到高的顺序是K、L、M、N、O、P、Q,故B正确。
2.某元素原子的核外有三个能层,最外能层有4个电子,该原子核内的质子数为
A.14 B.15
C.16 D.17
√
原子核外共有三个能层,最内层只有1s能级,可容纳2个电子,第二层有2s、2p两个能级,可容纳8个电子,最外层有4个电子,所以该原子核外有14个电子,又因在原子中核外电子数等于核内质子数,故选A。
3.以下能级符号正确的是
A.3f B.2d
C.4s D.2f
√
第三能层有3个能级(3s、3p、3d),没有3f能级,故A错误;第二能层有2个能级(2s和2p),没有2d能级,故B错误;第四能层有4个能级(4s、4p、4d、4f),故C正确;第二能层有2个能级(2s和2p),没有2f能级,故D错误。
4.下列说法中错误的是
A.某原子K层上只有一个电子
B.某离子M层和L层上的电子数均为K层的4倍
C.某原子M层上的电子数为L层电子数的4倍
D.存在核电荷数与最外层电子数相等的离子
√
氢原子K层上只有一个电子,A正确;Cl-、K+等离子M层和L层上的电子数均为K层的4倍,B正确;原子核外已有M层,则L层为全排满,即8个电子,这样M层就有32个电子,而M层为第三能层,最多容纳的电子数为18个,故不可能,C错误;O2-核电荷数为8,核外最外层电子数也为8,D正确。
题点二 能层和能级
5.N能层所含能级数、最多容纳电子数分别为
A.3、18 B.4、24
C.5、32 D.4、32
√
N能层为第四能层,含有的能级分别为s、p、d、f,最多可以容纳32个电子,D正确。
6.原子中的某一能层,最多能容纳的电子数目大于32,该能层可能会是
A.L能层 B.M能层
C.N能层 D.P能层
每一能层最多能容纳的电子数目为2n2,所以最多能容纳的电子数目大于32的能层,至少是第五能层。
√
7.以下能级符号表示正确的是
①5s ②1d ③2f ④1p ⑤2d ⑥3f ⑦4f ⑧5d ⑨3p ⑩6s
A.③⑤⑦⑧⑨⑩ B.①⑦⑧⑨⑩
C.①③⑤⑦⑨ D.②④⑥⑧⑩
√
每一个能层都有s能级,从第二能层开始出现p能级,从第三能层开始出现d能级,从第四能层开始出现f能级,B项正确。
8.下列多电子原子不同能级能量高低的比较错误的是
A.1s<2s<3s B.2p<3p<4p
C.3s<3p<3d D.4s>3d>3p
√
在多电子原子中,从3d能级开始有“能级交错”现象,实际4s能级的能量小于3d,所以D错误。
题点三 原子的激发态、基态与光谱
9.下列说法正确的是
A.自然界中的所有原子都处于基态
B.同一原子处于激发态时的能量一定高于基态时的能量
C.无论原子种类是否相同,基态原子的能量总是低于激发态原子的能量
D.激发态原子的能量较高,极易失去电子,表现出较强的还原性
√
处于最低能量状态的原子叫作基态原子,A错误。电子由较低能级向较高能级跃迁,叫激发,B正确。只有相同原子激发态原子的能量总是比原来基态原子的能量高,C错误。如果电子仅在内层激发,电子未获得足够的能量,不会失去,D错误。
10.下列说法中不正确的是
A.同一原子中,2p、3p、4p能级的轨道数依次增多
B.3p2表示3p能级有两个电子
C.d能级最多能容纳10个电子
D.处于最低能量状态的原子叫做基态原子
所有能层中的p能级都只有3个轨道,A项错误。
√
11.对焰色试验的描述正确的是
A.焰色试验只是金属单质特有的性质
B.焰色试验是化学变化
C.焰色试验是金属原子从基态跃迁到激发态时,将能量以光的形式表现出来
D.焰色试验是金属原子或离子从较高能量的激发态跃迁到较低能量的激发态或基态时,将能量以光的形式表现出来的现象
焰色试验是大多数金属元素的性质,是物理变化,从基态→激发态要吸收能量,从激发态→基态会释放能量。
√
12.图中所发生的现象与电子的跃迁无关的是
燃放烟火、霓虹灯、燃烧蜡烛等获得的光能都是电子跃迁时能量以光的形式释放出来导致的,而平面镜成像则是光线反射的结果。
√
13.填空。
(1)用符号填写能层所含能级种类:
K层:___;L层:_______;M层:__________;N层:______________。
(2)用数字填写能级所能容纳最多电子数目:
s:________;p:________;d:________;f:________。
(3)比较下列能级的能量高低(填“<”、“=”或“>”)。
①4s________3s________2s________1s;
②4f________4d________4p________4s;
③1s________2p________3d________4f。
1s
2s、2p
3s、3p、3d
4s、4p、4d、4f
2
6
10
14
>
>
>
>
>
>
<
<
<
14.(1)Cl原子核外电子能量最高的电子所在的能级是________。
(2)基态Si原子中,核外电子占据最高能层的符号为________,该能层上有________个能级,电子数为________。
Cl原子核外有17个电子,排布在1s、2s、2p、3s、3p 5个能级上,能量最高的是3p能级。
3p
Si原子核外有14个电子,K、L、M能层上分别有2、8、4个电子,所以电子占据的最高能层为M能层,该能层有3s、3p、3d三个能级,排有4个电子。
M
3
4
15.下表给出了五种元素的相关信息,其中A、B、C、D为短周期元素。
元素 相关信息
A 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料
B 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障
C 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂
D 室温下其单质呈粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰
E 它是人体不可缺少的微量元素,其单质也是日常生产和生活中不可缺少的金属原材料,常用于制造桥梁、楼房等
根据上述信息填空:
(1)B元素的基态原子含有__________个能层,其中第二能层中有哪几个能
级:________;画出D的原子结构示意图:_________。
2
2s和2p
元素 相关信息
A 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料
B 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障
C 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂
D 室温下其单质呈粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰
E 它是人体不可缺少的微量元素,其单质也是日常生产和生活中不可缺少的金属原材料,常用于制造桥梁、楼房等
氢气是一种清洁燃料,所以A为氢元素;臭氧对紫外线有吸收作用,是保护地球地表环境的重要屏障,所以B为氧元素,其基态原子含有K层与L层2个能层,L层为第二能层,有s、p两个能级(即2s和2p);氮、磷、钾是植物生长三要素,N2O俗名“笑气”,是早期医疗中使用的麻醉剂,所以C为氮元素;单质硫在氧气中燃烧,发出明亮的蓝紫色火焰,所以D为硫元素;日常生产和生活中最常用的金属是铁、铜和铝,其中只有铁是人体不可缺少的微量元素,所以E为铁元素。
(2)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,写出两者发生反应生成无毒物质的化学方程式:__________________________________。
元素 相关信息
A 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料
B 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障
C 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂
D 室温下其单质呈粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰
E 它是人体不可缺少的微量元素,其单质也是日常生产和生活中不可缺少的金属原材料,常用于制造桥梁、楼房等
氮和氢形成的原子个数比为1∶2的化合物为N2H4,氮和氧形成的原子个数比为1∶2的化合物有NO2和N2O4,其中N2O4是无色气体,NO2是红棕色气体,N2H4和N2O4反应生成无毒的N2和H2O。
(3)某矿藏主要含D、E两种元素组成的化合物,它在空气中高温条件下生成一种刺激性气体和一种红色氧化物。试写出该反应的化学方程式:__________________________________。
元素 相关信息
A 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料
B 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障
C 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂
D 室温下其单质呈粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰
E 它是人体不可缺少的微量元素,其单质也是日常生产和生活中不可缺少的金属原材料,常用于制造桥梁、楼房等
我国主要以黄铁矿(其主要成分是FeS2)为原料制备硫酸,其第一阶段的主要反应是煅烧黄铁矿,反应为4FeS2+11O2 2Fe2O3+8SO2。
16.有两种常见气态单质Am和Bn,已知2.4 g Am和2.1 g Bn所含的原子个数相等,分子数之比为2∶3。A原子L层的电子数是K层的3倍。
(1)A、B的元素符号分别为_________。
(2)Am中m的值为_____。
(3)B原子含有的能层数目为_____。
(4)A、B形成的一种气态化合物与水反应能生成由A、B形成的另一种气态化合物。写出该反应的化学方程式:_____________________________。
O、N
3
2
3NO2+H2O===2HNO3+NO
由A原子L层的电子数是K层的3倍,可知A为O。根据题意,设A、B的相对原子质量分别为x、y,则 ,解得7x=8y,2m=3n。由此可知B为N,Am为O3,Bn为N2。
返回
