人教版高中化学选择性必修1第二章化学反应速率与化学平衡第一节第3课时活化能课件(53页ppt)
文档属性
| 名称 | 人教版高中化学选择性必修1第二章化学反应速率与化学平衡第一节第3课时活化能课件(53页ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-10 08:42:19 | ||
图片预览










文档简介
(共53张PPT)
第3课时 活化能
第二章 第一节 化学反应速率
1.了解有效碰撞理论。
2.知道活化能的含义及其对化学反应速率的影响。
3.了解催化剂在生产、生活和科学研究领域中的重大作用。
课程标准
任务一 基元反应与反应历程
新知构建
1.基元反应
大多数的化学反应往往经过多个反应步骤才能实现。其中____________都称为基元反应。如2HI===H2+I2的两步基元反应为2HI―→H2+2I·、2I·―→I2。
2.反应机理
先后进行的_________反映了化学反应的反应历程,反应历程又称________。
基元反应的整个过程一般分为始态→过渡态→终态(或中间体、中间产物)。
每一步反应
基元反应
反应机理
应用评价
1.由反应物微粒一步直接实现的化学反应称为基元反应。某化学反应是通过三步基元反应实现:①Ce4++Mn2+―→Ce3++Mn3+;②Ce4++Mn3+ ―→ Ce3++Mn4+;③Ti++Mn4+ ―→ Ti3++Mn2+。由此可知:
(1)该反应的总反应的方程式为_____________________________。
(2)该反应的催化剂是________。
2Ce4++Ti+===2Ce3++Ti3+
Mn2+
催化剂是在化学反应里能改变反应物的化学反应速率(既能提高也能降低),而本身的质量和化学性质在化学反应前后都没有发生改变的物质。从三个反应可以看出Ce4+最终变为Ce3+,Ti+变为Ti3+,Mn2+没变,故为催化剂。
2.甲烷气相热分解反应的化学方程式为2CH4―→CH3—CH3+H2,该反应的机理如下:
①CH4―→·CH3+·H;
②______________________________;
③CH4+H·―→·CH3+H2;
④·CH3+H·―→CH4。
补充反应②的方程式。
烷烃的热解反应,是典型的自由基反应,自由基反应一般经历链引发、链传递、链终止的过程,故第二步反应属于链传递环节,产物中还有自由基生成,且生成物有乙烷,故确定其反应原理为·CH3+CH4―→CH3—CH3+H·。
·CH3+CH4―→CH3—CH3+H·
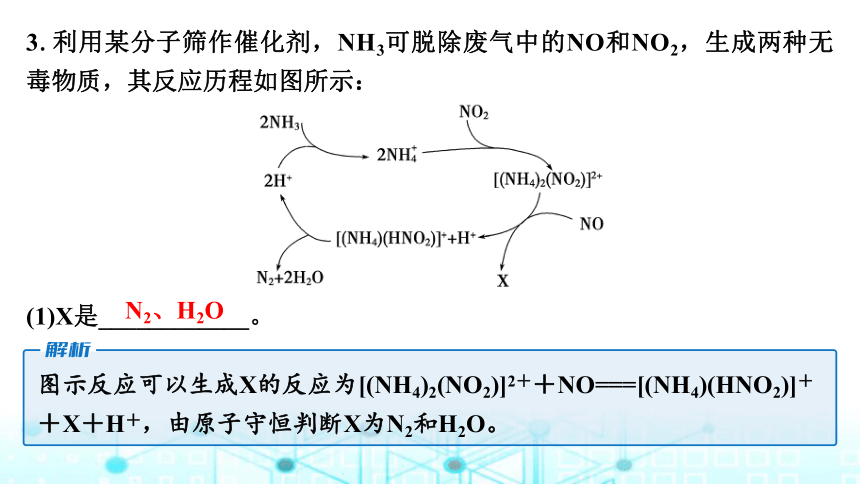
3.利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图所示:
(1)X是____________。
图示反应可以生成X的反应为[(NH4)2(NO2)]2++NO===[(NH4)(HNO2)]++X+H+,由原子守恒判断X为N2和H2O。
N2、H2O
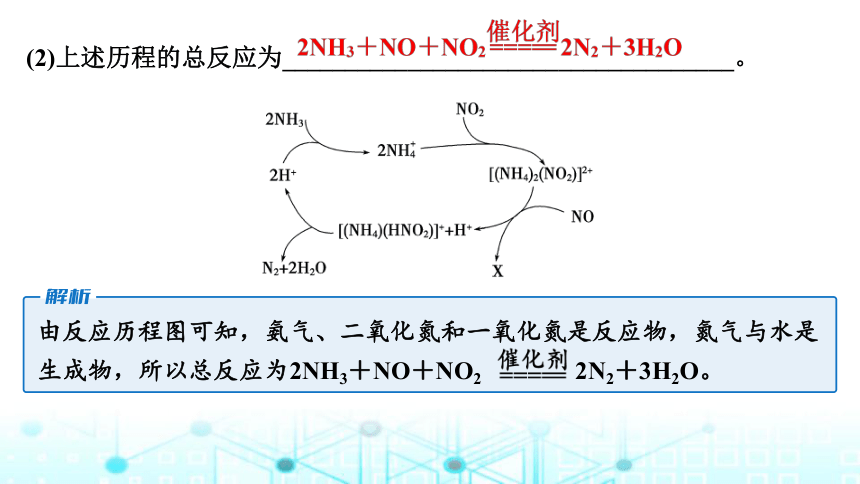
(2)上述历程的总反应为____________________________________。
由反应历程图可知,氨气、二氧化氮和一氧化氮是反应物,氮气与水是生成物,所以总反应为2NH3+NO+NO2 2N2+3H2O。
(3)由反应历程可知,[(NH4)(HNO2)]+是该反应的____________。
由反应历程可知,[(NH4)(HNO2)]+是该反应的中间产物。
返回
中间产物
任务二 有效碰撞理论
新知构建
1.有效碰撞
越快
2.活化分子和活化能
(1)活化分子:能够发生__________的分子。
对于某一化学反应来说,在一定条件下,反应物分子中活化分子的百分数是______的。
(2)活化能:活化分子具有的__________与反应物分子具有的平均能量之差,叫做反应的活化能。
有效碰撞
一定
平均能量
3.反应物、生成物的能量与活化能的关系图
活化能
放出的能量
逆反应
反应热
4.有效碰撞理论影响化学反应速率因素的解释
(1)浓度
反应物浓度增大→单位体积内活化分子数______→单位时间内有效碰撞的次数______→化学反应速率______;反之,化学反应速率______。
(2)压强
增大压强→气体体积缩小→反应物浓度增大→单位体积内活化分子数______→单位时间内有效碰撞的次数______→化学反应速率______;反之,化学反应速率______。
压强对化学反应速率的影响,可转化成浓度对化学反应速率的影响。
增多
增加
增大
减小
增多
增加
增大
减小
(3)温度
升高温度,反应物分子的能量______→使一部分原来能量较低的分子变成__________→活化分子的百分数______→单位时间内有效碰撞的次数______→化学反应速率______;反之,化学反应速率______。
(4)催化剂
使用催化剂→改变了反应历程(如右图),反应的活
化能______→更多的反应物分子成为__________
→活化分子的百分数______→单位时间内有效碰撞
的次数______→化学反应速率______。
增加
活化分子
增大
增加
增大
减小
降低
活化分子
增大
增加
增大
应用评价
1.判断正误,错误的说明其原因。
(1)活化能大的反应一定是吸热反应。
________________________________________________________________
(2)有效碰撞次数越多,反应速率越快。
________________________________________________________________
(3)催化剂能降低反应所需的活化能,ΔH也会发生变化。
________________________________________________________________
(4)只要条件合适,普通分子之间的碰撞也可能是有效碰撞。
________________________________________________________________
错误;吸热反应的判据与活化能大小无关。
错误;单位体积,单位时间内,有效碰撞次数越多,反应速率越快。
错误;催化剂能降低反应所需的活化能,但不能改变ΔH。
错误;活化分子之间发生的碰撞才有可能是有效碰撞。
2.甲酸被认为是理想的氢能载体,我国科技工作者运用DFT计算研究单分子HCOOH在催化剂表面分解产生H2的反应历程如图所示,其中吸附在催化剂表面的物种用*标注。
回答下列问题:
(1)该历程中决定正反应速率步骤的能垒(活化能)E正=________eV,该步骤的反应方程式为_________________________。
0.98
HCOOH*===HCOO*+H*
反应的活化能越大,反应速率越慢,化学反应速率取决于最慢的一步,由图可知,HCOOH*转化为HCOO*和H*的反应的活化能最大,反应速率最慢,则该历程中决定正反应速率步骤的反应方程式为HCOOH*===HCOO*+H*,能垒(活化能)E正=0.77 eV-(-0.21)eV=0.98 eV。
(2)该历程中甲酸分解制氢气的热化学方程式_________________________
_______________________。
由图可知,甲酸分解生成二氧化碳和氢气的反应为放热反应,反应热ΔH=-0.15NA eV·mol-1,则反应的热化学方程式为HCOOH(g)===CO2(g)+H2(g) ΔH=-0.15NA eV·mol-1。
HCOOH(g)===CO2(g)+H2(g)
ΔH=-0.15NA eV·mol-1
归纳总结
活化分子、有效碰撞与反应速率的关系
返回
随堂演练
1.乙炔在Pd表面选择加氢的反应机理如图(吸附在Pd表面上的物种用*标注),下列错误的是
A.该反应历程中最大能垒(活化能)为85 kJ/mol
B.乙炔催化加氢反应的ΔH<0
C.Pd为固体催化剂,一般其表面积越大,催化效果越好
D.C2H2* +H*→C2H3*的过程中只有化学键的形成
√
根据图示,该反应历程中最大能垒(活化能)为85 kJ/mol,故A正确; 根据图示,乙炔和氢气的总能量大于乙烯的能量,乙炔催化加氢反应的ΔH<0,故B正确;Pd为固体催化剂,反应物吸附在催化剂表面反应,一般其表面积越大,催化效果越好,故C正确;C2H +H*→C2H 的过程中有碳碳键的断裂和碳氢键的形成,故D错误;选D。
2.下列关于有效碰撞理论与影响速率因素之间关系不正确的是
A.活化分子间所发生的部分碰撞为有效碰撞
B.增大反应物浓度能够增大活化分子数,化学反应速率增大
C.升高温度,活化分子百分数增大,化学反应速率增大
D.选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大
√
活化分子间所发生的引起反应的碰撞称为有效碰撞,故A正确;增大反应物浓度可以增大单位体积分子数,从而增多活化分子数,导致反应速率增大,故B正确;升高温度可以导致活化分子数增多,故增大了活化分子百分数,反应速率增大,故C正确;选用适当的催化剂可以降低反应的活化能,导致活化分子百分数增多从而导致有效碰撞增多,反应速率增大,故D错误。
3.我国科学家研究了不同含金化合物催化乙烯加氢[C2H4(g)+H2(g)===C2H6(g) ΔH=a kJ·mol-1]的反应历程如下图所示,下列说法正确的是
A.1 mol C2H4(g)与1 mol H2(g)具有的能量之和小于1 mol C2H6(g)的能量
B.过渡态物质的稳定性:过渡态1>过渡态2
C.该反应的焓变:ΔH=-129.6 kJ·mol-1
D.相应的活化能:催化剂AuF<催化剂AuPF
√
由题图可知,该反应为反应物总能量高于生成物总能量的放热反应,故A错误;由题图可知,过渡态1的相对能量高于过渡态2,物质的能量越高,越不稳定,所以过渡态1的稳定性小于过渡态2,故B错误;由题图可知,反应的焓变ΔH=-[0-(-129.6 kJ·mol-1)]=-129.6 kJ·mol-1,故C正确;由题图可知,催化剂AuF、催化剂AuPF 的活化能分别为109.34 kJ·mol-1、26.3 kJ·mol-1,则催化剂AuF的活化能大于催化剂AuPF ,故D错误。
返回
课时测评
√
题点一 活化分子与有效碰撞理论
1.在体积可变的容器中发生反应N2+3H2 2NH3,当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是
A.分子运动速率加快,使反应物分子间的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C.活化分子百分数未变,但单位体积内活化分子数增加,有效碰撞次数增多
D.分子间距离减小,使所有的活化分子间的碰撞都成为有效碰撞
A项,由于温度不变,因此分子运动速率不变,错误;B项,由于温度不变,因此反应物分子的能量不变,错误;D项,增大压强使容器体积缩小时,单位体积内反应物浓度增大,单位体积内活化分子间的碰撞不一定都是有效碰撞,只有取向合适才能发生反应,才是有效碰撞,错误。
√
2.下列说法不正确的是
A.增大反应物浓度,活化分子百分数增大,有效碰撞次数增多
B.增大压强,单位体积内气体的活化分子数增多,有效碰撞次数增多
C.升高温度,活化分子百分数增加,分子运动速度加快,有效碰撞次数增多
D.催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞次数增多
增大反应物浓度,活化分子数目增多,但活化分子百分数不变。
√
题点二 化学反应历程能量探析
3.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程如图所示。下列说法不正确的是
A.该反应中正反应的活化能比逆反应的小
B.反应涉及的物质中,过渡态物质最不稳定
C.①→②放出能量并形成了C—C键
D.该反应中断裂反应物的化学键所需能量总和比形成生成物的化学键释放的能量总和大
根据图中信息得到该反应是放热反应,正反应的活化能比逆反应的小,故A正确;根据能量越低越稳定分析,反应涉及的物质中,过渡态物质最不稳定,故B正确;①→②是反应物到生成物,反应放出能量并形成了C—C键,故C正确;该反应是放热反应,因此该反应中断裂反应物的化学键所需能量总和比形成生成物的化学键释放的能量总和小,故D错误。综上所述,答案为D。
4.过渡态理论认为:化学反应不是
通过反应物分子的简单碰撞完成
的。在反应物分子生成产物分子的
过程中,首先生成一种高能量的活
化配合物,高能量的活化配合物再
进一步转化为产物分子。按照过渡态理论,NO2(g)+CO(g)===CO2(g)+NO(g)的反应历程如下,下列有关说法正确的是
A.第二步活化配合物之间的碰撞一定是有效碰撞
B.活化配合物的能量越高,第一步的反应速率越快
C.第一步反应需要吸收能量
D.该反应的反应速率主要取决于第二步反应
√
活化分子之间的碰撞不一定能发生反应,不一定是有效碰撞,故A项错误;活化配合物的能量越高,单位体积内的活化分子数目越少,有效碰撞的几率越小,第一步反应速率越慢,故B项错误;第一步反应断裂化学键,需要吸收能量,故C项正确;反应速率主要取决于慢反应的速率,故D项错误。
√
5.已知分解1 mol H2O2放出热量98 kJ,在含少量I-的溶液中,H2O2分解的机理为H2O2+I-===H2O+IO-(慢)、H2O2+IO-===H2O+O2+I-(快)。下列有关该反应的说法不正确的是
A.总反应中v(H2O2)∶v(O2)=2∶1
B.H2O2的分解速率与I-的浓度有关
C.该反应的催化剂是I-,而不是IO-
D.由于催化剂的加入降低了反应的活化能,使该反应活化能低于98 kJ·mol-1
总反应为2H2O2===2H2O+O2↑,速率之比等于化学计量数之比,则总反应中v(H2O2)∶v(O2)=2∶1,A正确;I-为催化剂,则H2O2的分解速率与I-的浓度有关,B正确;IO-为中间产物,该反应的催化剂是I-,C正确;催化剂可降低反应的活化能,但其活化能的大小不能确定,与ΔH更无任何必然联系,D错误。
√
题点三 有关活化能的图像分析
6.如图(Ea表示活化能)是CH4与Cl2生成CH3Cl的部分反应过程中各物质的能量变化关系图,下列说法正确的是
A.Cl·可由Cl2在高温条件下生成,是CH4与Cl2反应的中间产物
B.升高温度,反应速率加快,但活化分子的百分数不变
C.增大Cl2的浓度,既可提高反应速率,又可减小ΔH
D.第一步反应的速率大于第二步反应
CH4与Cl2生成CH3Cl的反应方程式为:CH4+Cl2 CH3Cl+HCl。Cl·由Cl2在光照条件下生成,是CH4与Cl2反应的“中间体”,选项A正确;Ea1、Ea2分别为第一步反应、第二步反应所需活化能,升高温度,反应所需活化能不变,即Ea1、Ea2不变,但活化分子的百分数增多,反应速率加快,选项B错误;Cl2是该反应的反应物,增大反应物的浓度,反应速率增大,而反应的ΔH和反应的途径无关,只与反应的始态和终态有关,即增大氯气的浓度不影响ΔH的大小,选项C错误;第一步反应所需活化能Ea1大于第二步反应所需活化能Ea2,第一步反应单位体积内活化分子百分数低于第二步反应,故第二步反应速率更大,选项D错误。答案选A。
√
13
√
8.N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其反应原理为N2O(g)+CO(g) CO2(g)+N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法不正确的是
A.ΔH=ΔH1+ΔH2
B.ΔH=-226 kJ·mol-1
C.该反应正反应的活化能小于逆反应的活化能
D.为了实现转化,需不断向反应器中补充Pt2O+和Pt2O
①N2O(g)+Pt2O+(s)===Pt2O (s)+N2(g) ΔH1,②Pt2O (s)+CO(g)===Pt2O+(s)+CO2(g) ΔH2,根据盖斯定律,①+②得到N2O(g)+CO(g) CO2(g)+N2(g) ΔH=ΔH1+ΔH2,故A正确;由图示分析可知,反应物的总能量高于生成物的总能量,反应为放热反应,反应焓变ΔH=134 kJ·mol-1-360 kJ·mol-1=-226 kJ·mol-1,故B正确;正反应的活化能Ea=134 kJ·mol-1,小于逆反应的活化能Eb=360 kJ·mol-1,故C正确;反应过程中Pt2O+和Pt2O 参与反应后又生成,不需要补充,故D错误。
√
9.H2和CO在催化剂作用下,可以合成
多种烃类化合物,该反应部分历程和
能量关系如图所示(*表示物质处于吸
附态,TS表示过渡态)。下列说法错
误的是
A.使用高活性催化剂可以降低反应的最大能垒(活化能)
B.在途径②中,*CH2OH与*H反应生成*CH2、*OH和*H的过程是*CO+4*H→*CH2+*OH+*H的决速步骤
C.在途径①中*CHOH与*2H反应生成*CH与*OH与*2H的过程中只有化学键的断裂
D.*CHOH+2*H→*CH2OH+*H过程中有极性键和非极性键的形成
催化剂改变反应历程,降低了反应的活
化能,使用高活性催化剂可以降低反应
的最大能垒(活化能),A正确;过渡态物
质的总能量与反应物总能量的差值为活
化能,即图中峰值越大则活化能越大,峰值越小则活化能越小,活化能越小反应越快,活化能越大反应越慢,决定总反应速率的是慢反应,据图可知在途径②中,*CH2OH与*H反应生成*CH2、*OH和*H的过程是*CO+4*H→*CH2+*OH+*H的决速步骤,B正确;*CHOH+*2H―→*CH+*OH+*2H过程中,只有碳氧键的断裂,C正确;*CHOH+2*H→*CH2OH+*H过程中有碳氢极性键的形成,没有非极性键的形成,D错误。
√
10.用氢气还原氮氧化物的反应为2H2+2NO===2H2O+N2,该反应速率与反应物浓度之间满足关系:v=k·cm(H2)·cn(NO),其中k是一个常数,m、n的值可由实验测定。科研团队测定了该反应在不同投料关系时N2起始反应速率,数据列于下表:
下列说法正确的是
A. m=2、n=1
B.实验2中NO的平均反应速率约为1.28×10-3 mol·L-1·s-1
C.增大反应物浓度,活化分子百分数增大,有效碰撞几率增大
D.与H2相比,NO浓度的变化对反应速率影响更为显著
实验
编号 起始浓度/(×10-3 mol·L-1) N2反应速率/
(×10-3 mol·L-1·s-1)
NO H2
1 6.00 1.00 3.19
2 6.00 2.00 6.38
3 1.00 6.00 0.48
4 2.00 6.00 1.92
利用编号1和2的实验数据, ,可以求出m=1,利用编号3和4的
实验数据, ,可以求出n=2,故A项错误;化学反应速率之比
等于化学计量数之比,2v(N2)=v(NO),则NO的平均反应速率约为1.28×10-2mol·L-1·s-1,故B项错误;增大反应物浓度,活化分子数目增多,但是活化分子百分数不变,有效碰撞几率增大,故C项错误;n=2,指数较大,对速率影响较大,或者经过数据对比,也可以得知,NO浓度的变化对反应速率影响更为显著,故D项正确。
11.回答下列问题。
(1)已知1 mol N2(g)与适量O2(g)反应生成NO(g),需吸收68 kJ的热量,该反应的热化学方程式为________________________________________。
N2(g)+O2(g)===2NO(g) ΔH=+68 kJ/mol
1 mol N2(g)与适量O2(g)反应生成NO(g),吸收68 kJ热量,反应吸热时焓变值为正值,所以该反应的热化学方程式为N2(g)+O2(g)===2NO(g) ΔH=+68 kJ·mol-1;
(2)请认真观察下图,然后回答问题。
①该反应的ΔH=_________________(用含E1、E2的代数式表示)。若向该反应中加入合适的催化剂,活化能__________(填“升高”、“降低”或“不变”),ΔH__________(填“升高”、“降低”或“不变”)。
(E2-E1)kJ/mol
降低
不变
该反应的ΔH=生成物的能量-反应物的能量=(E2-E1)kJ/mol;催化剂可降低反应的活化能,但不改变始末态,ΔH不变;
②若该图表示2H2O2(l) 2H2O(l)+O2(g) ΔH=-73.5 kJ·mol-1,该反应的活化能为54.3 kJ·mol-1,则其逆反应的活化能为________kJ·mol-1。
127.8
ΔH=正反应活化能-逆反应活化能=54.3 kJ·mol-1-x=-73.5 kJ·mol-1, x=127.8 kJ·mol-1;
(3)已知光照条件下,甲烷氯化反应是一个自由基型的取代反应。在链转移反应过程中,经历两步反应(·CH3和Cl·分别表示甲基和氯原子):
反应1:CH4(g)+Cl·(g)―→·CH3(g)+HCl(g)
反应2:·CH3(g)+Cl2(g)―→CH3Cl(g)+Cl·(g)
各物质的相对能量变化如图所示。
①该链转移反应的反应速率由第_____步反应决定。
1
由图可知,链转移反应的第1步活化能大,为慢反应,化学反应取决于慢反应,故链转移反应的反应速率由第1步反应决定;
②由图可知,过渡态结构的稳定性:过渡态1____过渡态2(填“<”、“>”或“=”)。
由图可知,过渡态1的能量高于过渡态2,过渡态结构的稳定性:过渡态1<过渡态2。
返回
<
第3课时 活化能
第二章 第一节 化学反应速率
1.了解有效碰撞理论。
2.知道活化能的含义及其对化学反应速率的影响。
3.了解催化剂在生产、生活和科学研究领域中的重大作用。
课程标准
任务一 基元反应与反应历程
新知构建
1.基元反应
大多数的化学反应往往经过多个反应步骤才能实现。其中____________都称为基元反应。如2HI===H2+I2的两步基元反应为2HI―→H2+2I·、2I·―→I2。
2.反应机理
先后进行的_________反映了化学反应的反应历程,反应历程又称________。
基元反应的整个过程一般分为始态→过渡态→终态(或中间体、中间产物)。
每一步反应
基元反应
反应机理
应用评价
1.由反应物微粒一步直接实现的化学反应称为基元反应。某化学反应是通过三步基元反应实现:①Ce4++Mn2+―→Ce3++Mn3+;②Ce4++Mn3+ ―→ Ce3++Mn4+;③Ti++Mn4+ ―→ Ti3++Mn2+。由此可知:
(1)该反应的总反应的方程式为_____________________________。
(2)该反应的催化剂是________。
2Ce4++Ti+===2Ce3++Ti3+
Mn2+
催化剂是在化学反应里能改变反应物的化学反应速率(既能提高也能降低),而本身的质量和化学性质在化学反应前后都没有发生改变的物质。从三个反应可以看出Ce4+最终变为Ce3+,Ti+变为Ti3+,Mn2+没变,故为催化剂。
2.甲烷气相热分解反应的化学方程式为2CH4―→CH3—CH3+H2,该反应的机理如下:
①CH4―→·CH3+·H;
②______________________________;
③CH4+H·―→·CH3+H2;
④·CH3+H·―→CH4。
补充反应②的方程式。
烷烃的热解反应,是典型的自由基反应,自由基反应一般经历链引发、链传递、链终止的过程,故第二步反应属于链传递环节,产物中还有自由基生成,且生成物有乙烷,故确定其反应原理为·CH3+CH4―→CH3—CH3+H·。
·CH3+CH4―→CH3—CH3+H·
3.利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图所示:
(1)X是____________。
图示反应可以生成X的反应为[(NH4)2(NO2)]2++NO===[(NH4)(HNO2)]++X+H+,由原子守恒判断X为N2和H2O。
N2、H2O
(2)上述历程的总反应为____________________________________。
由反应历程图可知,氨气、二氧化氮和一氧化氮是反应物,氮气与水是生成物,所以总反应为2NH3+NO+NO2 2N2+3H2O。
(3)由反应历程可知,[(NH4)(HNO2)]+是该反应的____________。
由反应历程可知,[(NH4)(HNO2)]+是该反应的中间产物。
返回
中间产物
任务二 有效碰撞理论
新知构建
1.有效碰撞
越快
2.活化分子和活化能
(1)活化分子:能够发生__________的分子。
对于某一化学反应来说,在一定条件下,反应物分子中活化分子的百分数是______的。
(2)活化能:活化分子具有的__________与反应物分子具有的平均能量之差,叫做反应的活化能。
有效碰撞
一定
平均能量
3.反应物、生成物的能量与活化能的关系图
活化能
放出的能量
逆反应
反应热
4.有效碰撞理论影响化学反应速率因素的解释
(1)浓度
反应物浓度增大→单位体积内活化分子数______→单位时间内有效碰撞的次数______→化学反应速率______;反之,化学反应速率______。
(2)压强
增大压强→气体体积缩小→反应物浓度增大→单位体积内活化分子数______→单位时间内有效碰撞的次数______→化学反应速率______;反之,化学反应速率______。
压强对化学反应速率的影响,可转化成浓度对化学反应速率的影响。
增多
增加
增大
减小
增多
增加
增大
减小
(3)温度
升高温度,反应物分子的能量______→使一部分原来能量较低的分子变成__________→活化分子的百分数______→单位时间内有效碰撞的次数______→化学反应速率______;反之,化学反应速率______。
(4)催化剂
使用催化剂→改变了反应历程(如右图),反应的活
化能______→更多的反应物分子成为__________
→活化分子的百分数______→单位时间内有效碰撞
的次数______→化学反应速率______。
增加
活化分子
增大
增加
增大
减小
降低
活化分子
增大
增加
增大
应用评价
1.判断正误,错误的说明其原因。
(1)活化能大的反应一定是吸热反应。
________________________________________________________________
(2)有效碰撞次数越多,反应速率越快。
________________________________________________________________
(3)催化剂能降低反应所需的活化能,ΔH也会发生变化。
________________________________________________________________
(4)只要条件合适,普通分子之间的碰撞也可能是有效碰撞。
________________________________________________________________
错误;吸热反应的判据与活化能大小无关。
错误;单位体积,单位时间内,有效碰撞次数越多,反应速率越快。
错误;催化剂能降低反应所需的活化能,但不能改变ΔH。
错误;活化分子之间发生的碰撞才有可能是有效碰撞。
2.甲酸被认为是理想的氢能载体,我国科技工作者运用DFT计算研究单分子HCOOH在催化剂表面分解产生H2的反应历程如图所示,其中吸附在催化剂表面的物种用*标注。
回答下列问题:
(1)该历程中决定正反应速率步骤的能垒(活化能)E正=________eV,该步骤的反应方程式为_________________________。
0.98
HCOOH*===HCOO*+H*
反应的活化能越大,反应速率越慢,化学反应速率取决于最慢的一步,由图可知,HCOOH*转化为HCOO*和H*的反应的活化能最大,反应速率最慢,则该历程中决定正反应速率步骤的反应方程式为HCOOH*===HCOO*+H*,能垒(活化能)E正=0.77 eV-(-0.21)eV=0.98 eV。
(2)该历程中甲酸分解制氢气的热化学方程式_________________________
_______________________。
由图可知,甲酸分解生成二氧化碳和氢气的反应为放热反应,反应热ΔH=-0.15NA eV·mol-1,则反应的热化学方程式为HCOOH(g)===CO2(g)+H2(g) ΔH=-0.15NA eV·mol-1。
HCOOH(g)===CO2(g)+H2(g)
ΔH=-0.15NA eV·mol-1
归纳总结
活化分子、有效碰撞与反应速率的关系
返回
随堂演练
1.乙炔在Pd表面选择加氢的反应机理如图(吸附在Pd表面上的物种用*标注),下列错误的是
A.该反应历程中最大能垒(活化能)为85 kJ/mol
B.乙炔催化加氢反应的ΔH<0
C.Pd为固体催化剂,一般其表面积越大,催化效果越好
D.C2H2* +H*→C2H3*的过程中只有化学键的形成
√
根据图示,该反应历程中最大能垒(活化能)为85 kJ/mol,故A正确; 根据图示,乙炔和氢气的总能量大于乙烯的能量,乙炔催化加氢反应的ΔH<0,故B正确;Pd为固体催化剂,反应物吸附在催化剂表面反应,一般其表面积越大,催化效果越好,故C正确;C2H +H*→C2H 的过程中有碳碳键的断裂和碳氢键的形成,故D错误;选D。
2.下列关于有效碰撞理论与影响速率因素之间关系不正确的是
A.活化分子间所发生的部分碰撞为有效碰撞
B.增大反应物浓度能够增大活化分子数,化学反应速率增大
C.升高温度,活化分子百分数增大,化学反应速率增大
D.选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大
√
活化分子间所发生的引起反应的碰撞称为有效碰撞,故A正确;增大反应物浓度可以增大单位体积分子数,从而增多活化分子数,导致反应速率增大,故B正确;升高温度可以导致活化分子数增多,故增大了活化分子百分数,反应速率增大,故C正确;选用适当的催化剂可以降低反应的活化能,导致活化分子百分数增多从而导致有效碰撞增多,反应速率增大,故D错误。
3.我国科学家研究了不同含金化合物催化乙烯加氢[C2H4(g)+H2(g)===C2H6(g) ΔH=a kJ·mol-1]的反应历程如下图所示,下列说法正确的是
A.1 mol C2H4(g)与1 mol H2(g)具有的能量之和小于1 mol C2H6(g)的能量
B.过渡态物质的稳定性:过渡态1>过渡态2
C.该反应的焓变:ΔH=-129.6 kJ·mol-1
D.相应的活化能:催化剂AuF<催化剂AuPF
√
由题图可知,该反应为反应物总能量高于生成物总能量的放热反应,故A错误;由题图可知,过渡态1的相对能量高于过渡态2,物质的能量越高,越不稳定,所以过渡态1的稳定性小于过渡态2,故B错误;由题图可知,反应的焓变ΔH=-[0-(-129.6 kJ·mol-1)]=-129.6 kJ·mol-1,故C正确;由题图可知,催化剂AuF、催化剂AuPF 的活化能分别为109.34 kJ·mol-1、26.3 kJ·mol-1,则催化剂AuF的活化能大于催化剂AuPF ,故D错误。
返回
课时测评
√
题点一 活化分子与有效碰撞理论
1.在体积可变的容器中发生反应N2+3H2 2NH3,当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是
A.分子运动速率加快,使反应物分子间的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C.活化分子百分数未变,但单位体积内活化分子数增加,有效碰撞次数增多
D.分子间距离减小,使所有的活化分子间的碰撞都成为有效碰撞
A项,由于温度不变,因此分子运动速率不变,错误;B项,由于温度不变,因此反应物分子的能量不变,错误;D项,增大压强使容器体积缩小时,单位体积内反应物浓度增大,单位体积内活化分子间的碰撞不一定都是有效碰撞,只有取向合适才能发生反应,才是有效碰撞,错误。
√
2.下列说法不正确的是
A.增大反应物浓度,活化分子百分数增大,有效碰撞次数增多
B.增大压强,单位体积内气体的活化分子数增多,有效碰撞次数增多
C.升高温度,活化分子百分数增加,分子运动速度加快,有效碰撞次数增多
D.催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞次数增多
增大反应物浓度,活化分子数目增多,但活化分子百分数不变。
√
题点二 化学反应历程能量探析
3.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程如图所示。下列说法不正确的是
A.该反应中正反应的活化能比逆反应的小
B.反应涉及的物质中,过渡态物质最不稳定
C.①→②放出能量并形成了C—C键
D.该反应中断裂反应物的化学键所需能量总和比形成生成物的化学键释放的能量总和大
根据图中信息得到该反应是放热反应,正反应的活化能比逆反应的小,故A正确;根据能量越低越稳定分析,反应涉及的物质中,过渡态物质最不稳定,故B正确;①→②是反应物到生成物,反应放出能量并形成了C—C键,故C正确;该反应是放热反应,因此该反应中断裂反应物的化学键所需能量总和比形成生成物的化学键释放的能量总和小,故D错误。综上所述,答案为D。
4.过渡态理论认为:化学反应不是
通过反应物分子的简单碰撞完成
的。在反应物分子生成产物分子的
过程中,首先生成一种高能量的活
化配合物,高能量的活化配合物再
进一步转化为产物分子。按照过渡态理论,NO2(g)+CO(g)===CO2(g)+NO(g)的反应历程如下,下列有关说法正确的是
A.第二步活化配合物之间的碰撞一定是有效碰撞
B.活化配合物的能量越高,第一步的反应速率越快
C.第一步反应需要吸收能量
D.该反应的反应速率主要取决于第二步反应
√
活化分子之间的碰撞不一定能发生反应,不一定是有效碰撞,故A项错误;活化配合物的能量越高,单位体积内的活化分子数目越少,有效碰撞的几率越小,第一步反应速率越慢,故B项错误;第一步反应断裂化学键,需要吸收能量,故C项正确;反应速率主要取决于慢反应的速率,故D项错误。
√
5.已知分解1 mol H2O2放出热量98 kJ,在含少量I-的溶液中,H2O2分解的机理为H2O2+I-===H2O+IO-(慢)、H2O2+IO-===H2O+O2+I-(快)。下列有关该反应的说法不正确的是
A.总反应中v(H2O2)∶v(O2)=2∶1
B.H2O2的分解速率与I-的浓度有关
C.该反应的催化剂是I-,而不是IO-
D.由于催化剂的加入降低了反应的活化能,使该反应活化能低于98 kJ·mol-1
总反应为2H2O2===2H2O+O2↑,速率之比等于化学计量数之比,则总反应中v(H2O2)∶v(O2)=2∶1,A正确;I-为催化剂,则H2O2的分解速率与I-的浓度有关,B正确;IO-为中间产物,该反应的催化剂是I-,C正确;催化剂可降低反应的活化能,但其活化能的大小不能确定,与ΔH更无任何必然联系,D错误。
√
题点三 有关活化能的图像分析
6.如图(Ea表示活化能)是CH4与Cl2生成CH3Cl的部分反应过程中各物质的能量变化关系图,下列说法正确的是
A.Cl·可由Cl2在高温条件下生成,是CH4与Cl2反应的中间产物
B.升高温度,反应速率加快,但活化分子的百分数不变
C.增大Cl2的浓度,既可提高反应速率,又可减小ΔH
D.第一步反应的速率大于第二步反应
CH4与Cl2生成CH3Cl的反应方程式为:CH4+Cl2 CH3Cl+HCl。Cl·由Cl2在光照条件下生成,是CH4与Cl2反应的“中间体”,选项A正确;Ea1、Ea2分别为第一步反应、第二步反应所需活化能,升高温度,反应所需活化能不变,即Ea1、Ea2不变,但活化分子的百分数增多,反应速率加快,选项B错误;Cl2是该反应的反应物,增大反应物的浓度,反应速率增大,而反应的ΔH和反应的途径无关,只与反应的始态和终态有关,即增大氯气的浓度不影响ΔH的大小,选项C错误;第一步反应所需活化能Ea1大于第二步反应所需活化能Ea2,第一步反应单位体积内活化分子百分数低于第二步反应,故第二步反应速率更大,选项D错误。答案选A。
√
13
√
8.N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其反应原理为N2O(g)+CO(g) CO2(g)+N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法不正确的是
A.ΔH=ΔH1+ΔH2
B.ΔH=-226 kJ·mol-1
C.该反应正反应的活化能小于逆反应的活化能
D.为了实现转化,需不断向反应器中补充Pt2O+和Pt2O
①N2O(g)+Pt2O+(s)===Pt2O (s)+N2(g) ΔH1,②Pt2O (s)+CO(g)===Pt2O+(s)+CO2(g) ΔH2,根据盖斯定律,①+②得到N2O(g)+CO(g) CO2(g)+N2(g) ΔH=ΔH1+ΔH2,故A正确;由图示分析可知,反应物的总能量高于生成物的总能量,反应为放热反应,反应焓变ΔH=134 kJ·mol-1-360 kJ·mol-1=-226 kJ·mol-1,故B正确;正反应的活化能Ea=134 kJ·mol-1,小于逆反应的活化能Eb=360 kJ·mol-1,故C正确;反应过程中Pt2O+和Pt2O 参与反应后又生成,不需要补充,故D错误。
√
9.H2和CO在催化剂作用下,可以合成
多种烃类化合物,该反应部分历程和
能量关系如图所示(*表示物质处于吸
附态,TS表示过渡态)。下列说法错
误的是
A.使用高活性催化剂可以降低反应的最大能垒(活化能)
B.在途径②中,*CH2OH与*H反应生成*CH2、*OH和*H的过程是*CO+4*H→*CH2+*OH+*H的决速步骤
C.在途径①中*CHOH与*2H反应生成*CH与*OH与*2H的过程中只有化学键的断裂
D.*CHOH+2*H→*CH2OH+*H过程中有极性键和非极性键的形成
催化剂改变反应历程,降低了反应的活
化能,使用高活性催化剂可以降低反应
的最大能垒(活化能),A正确;过渡态物
质的总能量与反应物总能量的差值为活
化能,即图中峰值越大则活化能越大,峰值越小则活化能越小,活化能越小反应越快,活化能越大反应越慢,决定总反应速率的是慢反应,据图可知在途径②中,*CH2OH与*H反应生成*CH2、*OH和*H的过程是*CO+4*H→*CH2+*OH+*H的决速步骤,B正确;*CHOH+*2H―→*CH+*OH+*2H过程中,只有碳氧键的断裂,C正确;*CHOH+2*H→*CH2OH+*H过程中有碳氢极性键的形成,没有非极性键的形成,D错误。
√
10.用氢气还原氮氧化物的反应为2H2+2NO===2H2O+N2,该反应速率与反应物浓度之间满足关系:v=k·cm(H2)·cn(NO),其中k是一个常数,m、n的值可由实验测定。科研团队测定了该反应在不同投料关系时N2起始反应速率,数据列于下表:
下列说法正确的是
A. m=2、n=1
B.实验2中NO的平均反应速率约为1.28×10-3 mol·L-1·s-1
C.增大反应物浓度,活化分子百分数增大,有效碰撞几率增大
D.与H2相比,NO浓度的变化对反应速率影响更为显著
实验
编号 起始浓度/(×10-3 mol·L-1) N2反应速率/
(×10-3 mol·L-1·s-1)
NO H2
1 6.00 1.00 3.19
2 6.00 2.00 6.38
3 1.00 6.00 0.48
4 2.00 6.00 1.92
利用编号1和2的实验数据, ,可以求出m=1,利用编号3和4的
实验数据, ,可以求出n=2,故A项错误;化学反应速率之比
等于化学计量数之比,2v(N2)=v(NO),则NO的平均反应速率约为1.28×10-2mol·L-1·s-1,故B项错误;增大反应物浓度,活化分子数目增多,但是活化分子百分数不变,有效碰撞几率增大,故C项错误;n=2,指数较大,对速率影响较大,或者经过数据对比,也可以得知,NO浓度的变化对反应速率影响更为显著,故D项正确。
11.回答下列问题。
(1)已知1 mol N2(g)与适量O2(g)反应生成NO(g),需吸收68 kJ的热量,该反应的热化学方程式为________________________________________。
N2(g)+O2(g)===2NO(g) ΔH=+68 kJ/mol
1 mol N2(g)与适量O2(g)反应生成NO(g),吸收68 kJ热量,反应吸热时焓变值为正值,所以该反应的热化学方程式为N2(g)+O2(g)===2NO(g) ΔH=+68 kJ·mol-1;
(2)请认真观察下图,然后回答问题。
①该反应的ΔH=_________________(用含E1、E2的代数式表示)。若向该反应中加入合适的催化剂,活化能__________(填“升高”、“降低”或“不变”),ΔH__________(填“升高”、“降低”或“不变”)。
(E2-E1)kJ/mol
降低
不变
该反应的ΔH=生成物的能量-反应物的能量=(E2-E1)kJ/mol;催化剂可降低反应的活化能,但不改变始末态,ΔH不变;
②若该图表示2H2O2(l) 2H2O(l)+O2(g) ΔH=-73.5 kJ·mol-1,该反应的活化能为54.3 kJ·mol-1,则其逆反应的活化能为________kJ·mol-1。
127.8
ΔH=正反应活化能-逆反应活化能=54.3 kJ·mol-1-x=-73.5 kJ·mol-1, x=127.8 kJ·mol-1;
(3)已知光照条件下,甲烷氯化反应是一个自由基型的取代反应。在链转移反应过程中,经历两步反应(·CH3和Cl·分别表示甲基和氯原子):
反应1:CH4(g)+Cl·(g)―→·CH3(g)+HCl(g)
反应2:·CH3(g)+Cl2(g)―→CH3Cl(g)+Cl·(g)
各物质的相对能量变化如图所示。
①该链转移反应的反应速率由第_____步反应决定。
1
由图可知,链转移反应的第1步活化能大,为慢反应,化学反应取决于慢反应,故链转移反应的反应速率由第1步反应决定;
②由图可知,过渡态结构的稳定性:过渡态1____过渡态2(填“<”、“>”或“=”)。
由图可知,过渡态1的能量高于过渡态2,过渡态结构的稳定性:过渡态1<过渡态2。
返回
<
