人教版高中化学选择性必修1第三章水溶液中的离子反应与平衡第三节第1课时盐类的水解课件(53页ppt)
文档属性
| 名称 | 人教版高中化学选择性必修1第三章水溶液中的离子反应与平衡第三节第1课时盐类的水解课件(53页ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-10 00:00:00 | ||
图片预览










文档简介
(共53张PPT)
第1课时 盐类的水解
第三章 第三节 盐类的水解
1.通过实验探究,认识盐类水解的原理。
2.能用化学用语正确表示盐类的水解,能通过实验证明盐类水解的
存在。
3.结合真实情境中的应用实例,能应用盐类的水解原理判断盐溶液
的酸碱性。
课程标准
任务一 盐溶液的酸碱性
新知构建
1.盐溶液的酸碱性
【实验探究】教材中实验现象如下表:
盐 NaCl Na2CO3 NH4Cl KNO3 CH3COONa (NH4)2SO4
盐溶液的酸碱性 中性 碱性 酸性 中性 碱性 酸性
盐的类型 强酸强碱盐 弱酸强碱盐 强酸弱碱盐 强酸强碱盐 弱酸强碱盐 强酸弱碱盐
请分析上述实验结果,归纳盐溶液的酸碱性与盐类型之间的关系。
盐的类型 强酸弱碱盐 强酸强碱盐 弱酸强碱盐
溶液的酸碱性 ______ ______ ______
酸性
中性
碱性
2.盐溶液呈现不同酸碱性的原因
(1)理论分析
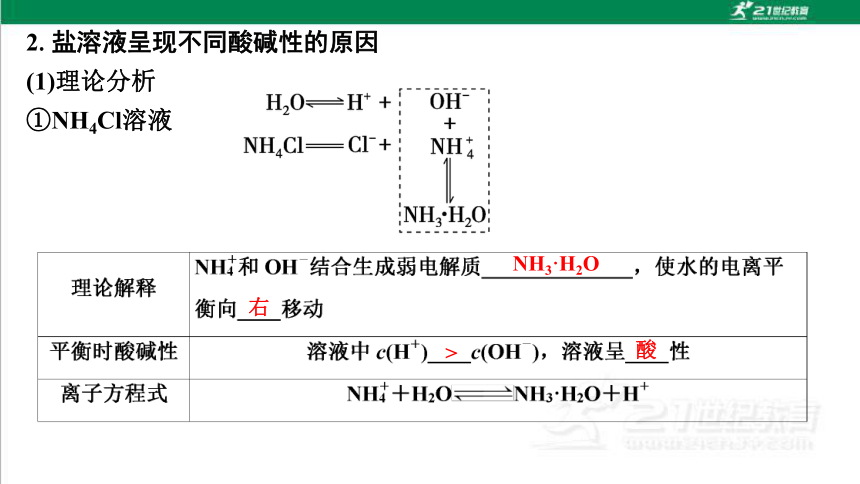
①NH4Cl溶液
NH3·H2O
右
>
酸
②CH3COONa溶液
理论解释 _______________和______结合生成弱电解质_______________,使水的电离平衡向右移动
平衡时酸碱性 溶液中c(H+)____c(OH-),溶液呈____性
离子方程式 CH3COO-+H2O CH3COOH+OH-
CH3COO-
H+
CH3COOH
<
碱
③Na2CO3溶液
由于H2CO3是二元酸,Na2CO3溶液水解分两步进行:
弱电解质
=
中
(2)盐类水解的原理
在水溶液中,盐电离出来的离子与水电离出的______________结合生成弱电解质的反应,叫做盐类的水解。
(3)实质
H+或OH-
1.请从化学的角度分析海水呈碱性的原因是什么?
交流研讨
3.NaHCO3、Na2CO3同样为碳酸盐,试分析等浓度二者的碱性强弱。
4.已知常温下HF和CH3COOH的电离常数分别为6.3×10-4、1.76×
10-5,试判断等浓度的NaF和CH3COONa溶液pH的大小。
提示:因Ka:HF>CH3COOH,故F-水解程度小于CH3COO-,NaF和CH3COONa溶液的pH后者大。
归纳总结
盐类的水解规律
应用评价
1.判断正误,错误的说明其原因。
(1)盐类的水解过程促进了水的电离。
______________________________________________________________
(2)酸式盐溶液一定显酸性。
______________________________________________________________
______________________________________________________________
(3)酸碱恰好中和生成的盐溶液一定显中性。
______________________________________________________________
正确。
错误,酸式盐溶液的酸碱性取决于酸式酸根是水解程度大还是电离程度大。
错误,不一定显中性。
(4)盐溶液显酸性、碱性还是中性,取决于溶液中c(H+)与c(OH-)的相对大小。
______________________________________________________________
(5)盐水解后,溶液不是呈酸性就是呈碱性。
______________________________________________________________
正确。
错误,醋酸铵水解后,显中性。
2.有下列盐溶液:
①KNO3 ②CuSO4 ③K2CO3 ④FeCl3 ⑤K2SO4 ⑥NaClO
⑦NH4Cl ⑧AgNO3
呈酸性的是___________(填序号,下同),呈碱性的是________,呈中性的是________。
②④⑦⑧
③⑥
①⑤
CuSO4、AgNO3、FeCl3、NH4Cl属于强酸弱碱盐,溶液呈酸性;K2CO3、NaClO属于强碱弱酸盐,溶液呈碱性;KNO3、K2SO4属于强酸强碱盐,溶液呈中性。
返回
任务二 盐类的水解离子方程式书写
1.请分析在Na2S溶液中,是否发生水解反应,如果反应,哪种离子发生了水解反应,水溶液显什么性?水解离子方程式如何写?
问题探究
2.FeCl3溶液显碱性,水解的离子方程式如何写?
4.AlCl3溶液与Na2CO3溶液混合生成气体和沉淀,写出反应的离子方程式。
5.CH3COONH4溶液呈中性,写出有关离子方程式。
新知构建
1.一般要求
2.三种类型的盐水解方程式的书写
(1)多元弱酸盐水解:分步进行,以第一步为主。
(2)多元弱碱盐水解:水解离子方程式一步完成。
(3)阴、阳离子强烈相互促进的水解:水解程度大,书写时要用“===”
“↑”“↓”等。
如Na2S溶液与AlCl3溶液混合后反应的离子方程式为3S2-+2Al3++6H2O===3H2S↑+2Al(OH)3↓。
应用评价
1.判断正误,错误的说明其原因。
错误,水解程度很小,Fe(OH)3不能加↓。
错误,多元弱酸的酸根要分步水解。
错误,水解程度很小,只能生成H2CO3不能变为CO2↑。
2.写出下列物质发生水解反应的离子方程式,并指明水溶液的酸碱性:
(1)Na2S:_______________________________________________________
_______。
(2)CuSO4:_________________________________________。
(3)CH3COONa:______________________________________________。
(4)Fe2(SO4)3:_________________________________________。
(5)NH4NO3:_________________________________________。
S2-+H2O HS-+OH-、HS-+H2O H2S+OH-;
碱性
Cu2++2H2O Cu(OH)2+2H+;酸性
CH3COO-+H2O CH3COOH+OH-;碱性
返回
Fe3++3H2O Fe(OH)3+3H+;酸性
随堂演练
√
1.下列关于盐溶液呈酸碱性的说法错误的是
A.盐溶液呈酸碱性的原因是破坏了水的电离平衡
B.NH4Cl溶液呈酸性是由于溶液中c(H+)>c(OH-)
C.在CH3COONa溶液中,由水电离的c(H+)≠c(OH-)
D.水电离出的H+或OH-与盐电离出的弱酸阴离子或弱碱阳离子结合,使盐溶液呈酸碱性
盐类水解的实质就是破坏了水的电离平衡,促进了水的电离,使溶液中的c(H+)与c(OH-)不相等,导致溶液呈酸性或碱性,A正确;溶液呈酸碱性的本质就是c(H+)与c(OH-)的相对大小,当c(H+)>c
(OH-)时溶液呈酸性,当c(H+)<c(OH-)时溶液呈碱性,NH4Cl溶液呈酸性是由于铵根离子水解,溶液中c(H+)>c(OH-),B正确;在醋酸钠溶液中,由于CH3COO-结合水电离出的H+生成难电离的醋酸,使溶液中的c(H+)<c(OH-),溶液呈碱性,而水自身电离出的c(H+)和c(OH-)一定是相等的,C错误;选项中所描述的就是盐类水解的实质,D正确;答案选C。
√
2.物质的量浓度相同的下列溶液中,按pH由小到大的顺序排列的是
A.Na2CO3、NaHCO3、NaCl、NH4Cl
B.Na2CO3、NaHCO3、NH4Cl、NaCl
C.(NH4)2SO4、NH4Cl、NaNO3、Na2S
D.NH4Cl、(NH4)2SO4、Na2S、NaNO3
3.下列说法及离子方程式正确的是
√
4.净水剂最常用的是絮凝剂,絮凝剂包括两大类,分别为无机絮凝剂、有机絮凝剂。无机絮凝剂为高价金属盐,如硫酸铝、硫酸铁、氯化铁、四氯化钛等。
(1)用离子方程式表示硫酸铝净水的原理:___________________________
__________。
Al3++3H2O Al(OH)3(胶
体)+3H+
(2)高铁酸盐(钠、钾)是六价铁盐,可用于水的消毒和净化。
①高铁酸盐能够消毒的原因是______________________________________
_______________________________________________________。
高铁酸盐是六价铁盐,有效成分是高铁酸
根离子,具有很强的氧化性,因此能通过氧化作用进行消毒
②高铁酸盐为何又能起到净水的作用?(写出有关的离子方程式)________
_____________________________________________________________________________________________________________________________。
高铁酸盐的还原产物是Fe3+,在溶液中发生水解:Fe3++ Fe(OH)3
(胶体)+3H+,胶体能够将水中的悬浮物聚集形成沉淀,能高效净水
消毒时
(3)工业中常用四氯化钛水解制备TiO2,写出化学方程式:_____________
___________________________。
TiCl4+(x+2)
H2O===TiO2·xH2O↓+4HCl
返回
课时测评
√
题点一 盐类水解的实质及规律
√
2.下列物质的水溶液中,除了水分子外,不存在其他分子的是
A.HCl B.NH4NO3
C.Na2S D.HClO
√
3.0.1 mol·L-1Na2CO3溶液和0.1 mol·L-1 NaHCO3溶液的pH,前者和后者的关系是
A.前者大 B.相等
C.前者小 D.不能肯定
√
4.现有等浓度的下列溶液:①醋酸,②硫酸氢钠,③醋酸钠,④碳酸,⑤碳酸钠,⑥硫酸钠。按溶液pH由小到大排列正确的是
A.④①②⑤⑥③ B.⑥①②④③⑤
C.②①④⑥③⑤ D.①④②③⑥⑤
等浓度的酸,越易电离的酸性越强,pH越小,等浓度的强碱弱酸盐,酸越弱,对应的盐的水溶液碱性越强,pH越大。
√
5.有四种物质的量浓度相同且由+1价阳离子A+、B+和-1价阴离子
X-、Y-构成的盐溶液。据测定,常温下AX溶液和BY溶液的pH都为7,AY溶液的pH>7,BX溶液的pH<7。据此推断,可能不水解的盐是
A.AX B.BX
C.AY D.BY
常温时,AX溶液和BY溶液的pH都为7,说明形成BY和AX的酸碱的强弱相当,可能是强酸强碱,也可能是强弱相当的弱酸弱碱。AY溶液的pH>7,则说明Y-所对应的酸一定是弱酸,BX溶液的pH<7,则说明B+所对应的碱一定是弱碱,X-和A+所对应的酸和碱可能是相对较强的,它们所形成的盐AX有可能不发生水解。
A项,HClO能氧化漂白pH试纸,错误;C项,25 ℃时,若测得HClO溶液pH>6,无论弱酸还是强酸,稀释10倍后,pH一定小于7,错误;D项,酸的体积未知,故不能根据消耗的NaOH溶液的体积的多少判断酸性强弱,错误。
√
6.下列一定能说明HClO是弱电解质的是
A.25 ℃时,用pH试纸测0.01 mol·L-1HClO的pH
B.25 ℃时,NaClO溶液的pH大于7
C.25 ℃时,若测得HClO溶液pH=a,取该溶液10.0 mL,加蒸馏水稀释至100.0 mL,测得pH=b,b-a<1,则HClO是弱酸
D.浓度相同的NaOH溶液分别与pH相同的次氯酸、盐酸反应呈中性,前者消耗的NaOH溶液的体积多
√
题点二 盐类水解方程式
7.下列方程式属于水解反应方程式的是
√
8.下列反应不属于水解反应或水解方程式不正确的是
A.①②③④ B.①②③
C.②③⑤ D.全部
√
题点三 溶液中微粒数目的简单比较
9.物质的量相等的下列物质形成的等体积溶液中,所含微粒种类最多的是
A.CaCl2 B.CH3COONa
C.NH3 D.K2S
√
10.等体积的下列溶液中,阴离子的总浓度最大的是
A.0.2 mol·L-1 K2S
B.0.1 mol·L-1 Ba(OH)2
C.0.2 mol·L-1 NaCl
D.0.2 mol·L-1 (NH4)2SO4
11.物质的量浓度相同的下列各物质的溶液,由水电离出的c(H+)由大到小的顺序是
①NaHSO4 ②NaHCO3 ③Na2CO3 ④Na2SO4
A.④③②① B.①②③④
C.③②④① D.③④②①
√
12.25 ℃时,有关浓度均为0.2 mol·L-1的NaHCO3和Na2CO3溶液的判断不正确的是
A.均存在电离平衡和水解平衡
B.存在的粒子种类不相同
C.c(OH-)前者小于后者
√
13.(1)浓度均为0.1 mol·L-1的8种溶液:①HNO3; ②H2SO4;
③CH3COOH;④Ba(OH)2;⑤NaOH;⑥CH3COONa;⑦KCl;
⑧NH4Cl。其溶液的pH由小到大的顺序是__________________(填序号)。
②①③⑧⑦⑥⑤④
先对物质分类,pH:碱>盐>酸。同类物质的pH的一般规律:碱:二元强碱>一元强碱>一元弱碱;酸:一元弱酸>一元强酸>二元强酸;盐:强碱弱酸盐>强酸强碱盐>强酸弱碱盐。
(2)室温时,pH=6的盐酸和pH=8的Na2CO3溶液中,水电离出的c(OH-)分别为x mol·L-1和y mol·L-1,两者的关系正确的是________(填字母)。
a.x=10-2y b.x=102y c.x=y d.x>y
a
①混合溶液呈____(填“酸”、“中”或“碱”)性,理由是____________
____________ (用离子方程式表示)。
碱
A-+H2O
HA+OH-
②混合溶液中由水电离出的c(H+)________(填“大于”、“小于”或“等于”)0.1 mol·L-1 NaOH溶液中由水电离出的c(H+)。
大于
14.磷是重要的元素,能形成多种含氧酸和含氧酸盐。回答下列问题:
(1)写出亚磷酸钠(Na2HPO3)中磷的化合价:____________。
+3
(2)当亚磷酸与少量NaOH溶液反应的离子方程式为____________________
_______________。
H3PO3+OH-===
(3)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式:_______
____________________________。
+ I2 +H2O===2HI+ H3PO4
H3PO3
亚磷酸被碘水氧化为磷酸,碘被还原为碘离子,其化学方程式为H3PO3+I2+H2O===2HI+H3PO4。
Ⅱ.已知:①次磷酸(H3PO2)是一种一元弱酸;
②常温下,电离平衡常数Ka(H3PO2)=5.9×10-2,Ka(CH3COOH)=1.8×10-5。
(4)下列说法正确的是________(填字母)。
B.NaH2PO2属于酸式盐
C.浓度均为0.1 mol·L-1的次磷酸(H3PO2)与盐酸相比前者导电能力强
D.0.1 mol·L-1 NaH2PO2溶液的pH比0.1 mol·L-1 CH3COONa溶液的pH小
AD
返回
第1课时 盐类的水解
第三章 第三节 盐类的水解
1.通过实验探究,认识盐类水解的原理。
2.能用化学用语正确表示盐类的水解,能通过实验证明盐类水解的
存在。
3.结合真实情境中的应用实例,能应用盐类的水解原理判断盐溶液
的酸碱性。
课程标准
任务一 盐溶液的酸碱性
新知构建
1.盐溶液的酸碱性
【实验探究】教材中实验现象如下表:
盐 NaCl Na2CO3 NH4Cl KNO3 CH3COONa (NH4)2SO4
盐溶液的酸碱性 中性 碱性 酸性 中性 碱性 酸性
盐的类型 强酸强碱盐 弱酸强碱盐 强酸弱碱盐 强酸强碱盐 弱酸强碱盐 强酸弱碱盐
请分析上述实验结果,归纳盐溶液的酸碱性与盐类型之间的关系。
盐的类型 强酸弱碱盐 强酸强碱盐 弱酸强碱盐
溶液的酸碱性 ______ ______ ______
酸性
中性
碱性
2.盐溶液呈现不同酸碱性的原因
(1)理论分析
①NH4Cl溶液
NH3·H2O
右
>
酸
②CH3COONa溶液
理论解释 _______________和______结合生成弱电解质_______________,使水的电离平衡向右移动
平衡时酸碱性 溶液中c(H+)____c(OH-),溶液呈____性
离子方程式 CH3COO-+H2O CH3COOH+OH-
CH3COO-
H+
CH3COOH
<
碱
③Na2CO3溶液
由于H2CO3是二元酸,Na2CO3溶液水解分两步进行:
弱电解质
=
中
(2)盐类水解的原理
在水溶液中,盐电离出来的离子与水电离出的______________结合生成弱电解质的反应,叫做盐类的水解。
(3)实质
H+或OH-
1.请从化学的角度分析海水呈碱性的原因是什么?
交流研讨
3.NaHCO3、Na2CO3同样为碳酸盐,试分析等浓度二者的碱性强弱。
4.已知常温下HF和CH3COOH的电离常数分别为6.3×10-4、1.76×
10-5,试判断等浓度的NaF和CH3COONa溶液pH的大小。
提示:因Ka:HF>CH3COOH,故F-水解程度小于CH3COO-,NaF和CH3COONa溶液的pH后者大。
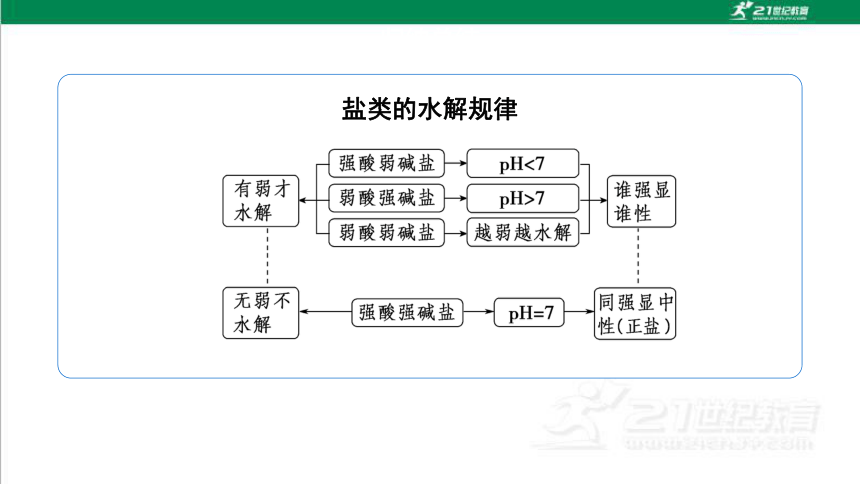
归纳总结
盐类的水解规律
应用评价
1.判断正误,错误的说明其原因。
(1)盐类的水解过程促进了水的电离。
______________________________________________________________
(2)酸式盐溶液一定显酸性。
______________________________________________________________
______________________________________________________________
(3)酸碱恰好中和生成的盐溶液一定显中性。
______________________________________________________________
正确。
错误,酸式盐溶液的酸碱性取决于酸式酸根是水解程度大还是电离程度大。
错误,不一定显中性。
(4)盐溶液显酸性、碱性还是中性,取决于溶液中c(H+)与c(OH-)的相对大小。
______________________________________________________________
(5)盐水解后,溶液不是呈酸性就是呈碱性。
______________________________________________________________
正确。
错误,醋酸铵水解后,显中性。
2.有下列盐溶液:
①KNO3 ②CuSO4 ③K2CO3 ④FeCl3 ⑤K2SO4 ⑥NaClO
⑦NH4Cl ⑧AgNO3
呈酸性的是___________(填序号,下同),呈碱性的是________,呈中性的是________。
②④⑦⑧
③⑥
①⑤
CuSO4、AgNO3、FeCl3、NH4Cl属于强酸弱碱盐,溶液呈酸性;K2CO3、NaClO属于强碱弱酸盐,溶液呈碱性;KNO3、K2SO4属于强酸强碱盐,溶液呈中性。
返回
任务二 盐类的水解离子方程式书写
1.请分析在Na2S溶液中,是否发生水解反应,如果反应,哪种离子发生了水解反应,水溶液显什么性?水解离子方程式如何写?
问题探究
2.FeCl3溶液显碱性,水解的离子方程式如何写?
4.AlCl3溶液与Na2CO3溶液混合生成气体和沉淀,写出反应的离子方程式。
5.CH3COONH4溶液呈中性,写出有关离子方程式。
新知构建
1.一般要求
2.三种类型的盐水解方程式的书写
(1)多元弱酸盐水解:分步进行,以第一步为主。
(2)多元弱碱盐水解:水解离子方程式一步完成。
(3)阴、阳离子强烈相互促进的水解:水解程度大,书写时要用“===”
“↑”“↓”等。
如Na2S溶液与AlCl3溶液混合后反应的离子方程式为3S2-+2Al3++6H2O===3H2S↑+2Al(OH)3↓。
应用评价
1.判断正误,错误的说明其原因。
错误,水解程度很小,Fe(OH)3不能加↓。
错误,多元弱酸的酸根要分步水解。
错误,水解程度很小,只能生成H2CO3不能变为CO2↑。
2.写出下列物质发生水解反应的离子方程式,并指明水溶液的酸碱性:
(1)Na2S:_______________________________________________________
_______。
(2)CuSO4:_________________________________________。
(3)CH3COONa:______________________________________________。
(4)Fe2(SO4)3:_________________________________________。
(5)NH4NO3:_________________________________________。
S2-+H2O HS-+OH-、HS-+H2O H2S+OH-;
碱性
Cu2++2H2O Cu(OH)2+2H+;酸性
CH3COO-+H2O CH3COOH+OH-;碱性
返回
Fe3++3H2O Fe(OH)3+3H+;酸性
随堂演练
√
1.下列关于盐溶液呈酸碱性的说法错误的是
A.盐溶液呈酸碱性的原因是破坏了水的电离平衡
B.NH4Cl溶液呈酸性是由于溶液中c(H+)>c(OH-)
C.在CH3COONa溶液中,由水电离的c(H+)≠c(OH-)
D.水电离出的H+或OH-与盐电离出的弱酸阴离子或弱碱阳离子结合,使盐溶液呈酸碱性
盐类水解的实质就是破坏了水的电离平衡,促进了水的电离,使溶液中的c(H+)与c(OH-)不相等,导致溶液呈酸性或碱性,A正确;溶液呈酸碱性的本质就是c(H+)与c(OH-)的相对大小,当c(H+)>c
(OH-)时溶液呈酸性,当c(H+)<c(OH-)时溶液呈碱性,NH4Cl溶液呈酸性是由于铵根离子水解,溶液中c(H+)>c(OH-),B正确;在醋酸钠溶液中,由于CH3COO-结合水电离出的H+生成难电离的醋酸,使溶液中的c(H+)<c(OH-),溶液呈碱性,而水自身电离出的c(H+)和c(OH-)一定是相等的,C错误;选项中所描述的就是盐类水解的实质,D正确;答案选C。
√
2.物质的量浓度相同的下列溶液中,按pH由小到大的顺序排列的是
A.Na2CO3、NaHCO3、NaCl、NH4Cl
B.Na2CO3、NaHCO3、NH4Cl、NaCl
C.(NH4)2SO4、NH4Cl、NaNO3、Na2S
D.NH4Cl、(NH4)2SO4、Na2S、NaNO3
3.下列说法及离子方程式正确的是
√
4.净水剂最常用的是絮凝剂,絮凝剂包括两大类,分别为无机絮凝剂、有机絮凝剂。无机絮凝剂为高价金属盐,如硫酸铝、硫酸铁、氯化铁、四氯化钛等。
(1)用离子方程式表示硫酸铝净水的原理:___________________________
__________。
Al3++3H2O Al(OH)3(胶
体)+3H+
(2)高铁酸盐(钠、钾)是六价铁盐,可用于水的消毒和净化。
①高铁酸盐能够消毒的原因是______________________________________
_______________________________________________________。
高铁酸盐是六价铁盐,有效成分是高铁酸
根离子,具有很强的氧化性,因此能通过氧化作用进行消毒
②高铁酸盐为何又能起到净水的作用?(写出有关的离子方程式)________
_____________________________________________________________________________________________________________________________。
高铁酸盐的还原产物是Fe3+,在溶液中发生水解:Fe3++ Fe(OH)3
(胶体)+3H+,胶体能够将水中的悬浮物聚集形成沉淀,能高效净水
消毒时
(3)工业中常用四氯化钛水解制备TiO2,写出化学方程式:_____________
___________________________。
TiCl4+(x+2)
H2O===TiO2·xH2O↓+4HCl
返回
课时测评
√
题点一 盐类水解的实质及规律
√
2.下列物质的水溶液中,除了水分子外,不存在其他分子的是
A.HCl B.NH4NO3
C.Na2S D.HClO
√
3.0.1 mol·L-1Na2CO3溶液和0.1 mol·L-1 NaHCO3溶液的pH,前者和后者的关系是
A.前者大 B.相等
C.前者小 D.不能肯定
√
4.现有等浓度的下列溶液:①醋酸,②硫酸氢钠,③醋酸钠,④碳酸,⑤碳酸钠,⑥硫酸钠。按溶液pH由小到大排列正确的是
A.④①②⑤⑥③ B.⑥①②④③⑤
C.②①④⑥③⑤ D.①④②③⑥⑤
等浓度的酸,越易电离的酸性越强,pH越小,等浓度的强碱弱酸盐,酸越弱,对应的盐的水溶液碱性越强,pH越大。
√
5.有四种物质的量浓度相同且由+1价阳离子A+、B+和-1价阴离子
X-、Y-构成的盐溶液。据测定,常温下AX溶液和BY溶液的pH都为7,AY溶液的pH>7,BX溶液的pH<7。据此推断,可能不水解的盐是
A.AX B.BX
C.AY D.BY
常温时,AX溶液和BY溶液的pH都为7,说明形成BY和AX的酸碱的强弱相当,可能是强酸强碱,也可能是强弱相当的弱酸弱碱。AY溶液的pH>7,则说明Y-所对应的酸一定是弱酸,BX溶液的pH<7,则说明B+所对应的碱一定是弱碱,X-和A+所对应的酸和碱可能是相对较强的,它们所形成的盐AX有可能不发生水解。
A项,HClO能氧化漂白pH试纸,错误;C项,25 ℃时,若测得HClO溶液pH>6,无论弱酸还是强酸,稀释10倍后,pH一定小于7,错误;D项,酸的体积未知,故不能根据消耗的NaOH溶液的体积的多少判断酸性强弱,错误。
√
6.下列一定能说明HClO是弱电解质的是
A.25 ℃时,用pH试纸测0.01 mol·L-1HClO的pH
B.25 ℃时,NaClO溶液的pH大于7
C.25 ℃时,若测得HClO溶液pH=a,取该溶液10.0 mL,加蒸馏水稀释至100.0 mL,测得pH=b,b-a<1,则HClO是弱酸
D.浓度相同的NaOH溶液分别与pH相同的次氯酸、盐酸反应呈中性,前者消耗的NaOH溶液的体积多
√
题点二 盐类水解方程式
7.下列方程式属于水解反应方程式的是
√
8.下列反应不属于水解反应或水解方程式不正确的是
A.①②③④ B.①②③
C.②③⑤ D.全部
√
题点三 溶液中微粒数目的简单比较
9.物质的量相等的下列物质形成的等体积溶液中,所含微粒种类最多的是
A.CaCl2 B.CH3COONa
C.NH3 D.K2S
√
10.等体积的下列溶液中,阴离子的总浓度最大的是
A.0.2 mol·L-1 K2S
B.0.1 mol·L-1 Ba(OH)2
C.0.2 mol·L-1 NaCl
D.0.2 mol·L-1 (NH4)2SO4
11.物质的量浓度相同的下列各物质的溶液,由水电离出的c(H+)由大到小的顺序是
①NaHSO4 ②NaHCO3 ③Na2CO3 ④Na2SO4
A.④③②① B.①②③④
C.③②④① D.③④②①
√
12.25 ℃时,有关浓度均为0.2 mol·L-1的NaHCO3和Na2CO3溶液的判断不正确的是
A.均存在电离平衡和水解平衡
B.存在的粒子种类不相同
C.c(OH-)前者小于后者
√
13.(1)浓度均为0.1 mol·L-1的8种溶液:①HNO3; ②H2SO4;
③CH3COOH;④Ba(OH)2;⑤NaOH;⑥CH3COONa;⑦KCl;
⑧NH4Cl。其溶液的pH由小到大的顺序是__________________(填序号)。
②①③⑧⑦⑥⑤④
先对物质分类,pH:碱>盐>酸。同类物质的pH的一般规律:碱:二元强碱>一元强碱>一元弱碱;酸:一元弱酸>一元强酸>二元强酸;盐:强碱弱酸盐>强酸强碱盐>强酸弱碱盐。
(2)室温时,pH=6的盐酸和pH=8的Na2CO3溶液中,水电离出的c(OH-)分别为x mol·L-1和y mol·L-1,两者的关系正确的是________(填字母)。
a.x=10-2y b.x=102y c.x=y d.x>y
a
①混合溶液呈____(填“酸”、“中”或“碱”)性,理由是____________
____________ (用离子方程式表示)。
碱
A-+H2O
HA+OH-
②混合溶液中由水电离出的c(H+)________(填“大于”、“小于”或“等于”)0.1 mol·L-1 NaOH溶液中由水电离出的c(H+)。
大于
14.磷是重要的元素,能形成多种含氧酸和含氧酸盐。回答下列问题:
(1)写出亚磷酸钠(Na2HPO3)中磷的化合价:____________。
+3
(2)当亚磷酸与少量NaOH溶液反应的离子方程式为____________________
_______________。
H3PO3+OH-===
(3)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式:_______
____________________________。
+ I2 +H2O===2HI+ H3PO4
H3PO3
亚磷酸被碘水氧化为磷酸,碘被还原为碘离子,其化学方程式为H3PO3+I2+H2O===2HI+H3PO4。
Ⅱ.已知:①次磷酸(H3PO2)是一种一元弱酸;
②常温下,电离平衡常数Ka(H3PO2)=5.9×10-2,Ka(CH3COOH)=1.8×10-5。
(4)下列说法正确的是________(填字母)。
B.NaH2PO2属于酸式盐
C.浓度均为0.1 mol·L-1的次磷酸(H3PO2)与盐酸相比前者导电能力强
D.0.1 mol·L-1 NaH2PO2溶液的pH比0.1 mol·L-1 CH3COONa溶液的pH小
AD
返回
