人教版高中化学选择性必修1第四章化学反应电能第一节第2课时化学电源课件(65页ppt)
文档属性
| 名称 | 人教版高中化学选择性必修1第四章化学反应电能第一节第2课时化学电源课件(65页ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-10 00:00:00 | ||
图片预览










文档简介
(共65张PPT)
第2课时 化学电源
第四章 第一节 原电池
1.了解常见化学电源的工作原理。
2. 能列举常见的化学电源,并能利用相关信息分析化学电源的工
作原理。
课程标准
任务一 化学电源和一次电池
新知构建
(一)化学电源
1.概念:化学电源是将化学能变成电能的装置。
2.分类
3.判断电池优劣的主要标准
(1)比能量:即单位质量或单位体积所能输出电能的多少,单位(W·h)/kg或(W·h)/L。
(2)比功率:即单位质量或单位体积所能输出功率的大小,单位W/kg或W/L。
(3)电池可储存时间的长短。
(二)一次电池
1.一次电池:随着使用,一次电池中能发生氧化还原反应的物质逐渐被消耗,当这些物质被消耗到一定程度时,电池就不能继续使用了。一次电池中电解质溶液制成胶状,不流动,也叫做________。
干电池
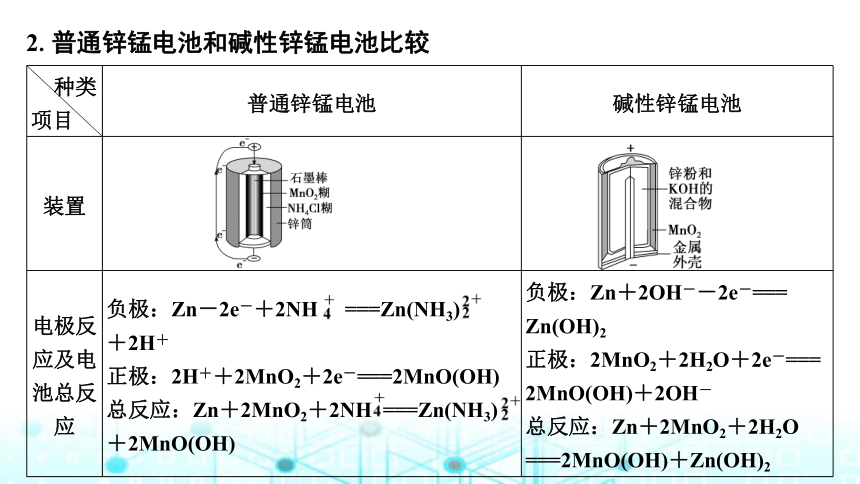
2.普通锌锰电池和碱性锌锰电池比较
种类
项目 普通锌锰电池 碱性锌锰电池
装置
电极反应及电池总反应 负极:Zn-2e-+2NH ===Zn(NH3)
+2H+
正极:2H++2MnO2+2e-===2MnO(OH)
总反应:Zn+2MnO2+2NH ===Zn(NH3)+2MnO(OH) 负极:Zn+2OH--2e-===
Zn(OH)2
正极:2MnO2+2H2O+2e-===
2MnO(OH)+2OH-
总反应:Zn+2MnO2+2H2O
===2MnO(OH)+Zn(OH)2
种类
项目 普通锌锰电池 碱性锌锰电池
特点 优点:制作简单,价格便宜。
缺点:新电池会发生自动放电,使存放时间缩短,放电后电压下降较快 优点:克服了普通锌锰电池的缺点,单位质量所输出的电能多,储存时间长,适用于大电流和连续放电
应用评价
1.判断正误,错误的说明其原因。
(1)化学电池可以将化学能全部转化成电能。
答案:错误,有一部分化学能会转化成热能。
(2)锌锰干电池中,锌电极是负极。
答案:正确。
(3)利用原电池装置,可以将化学能转化为电能。
答案:正确。
(4)碱性锌锰电池中,锌作负极,溶解转化为Zn2+,MnO2作正极,转化为MnO(OH)。
答案:错误,碱性锌锰电池中,锌作负极,转化为Zn(OH)2,MnO2作正极,转化为MnO(OH)。
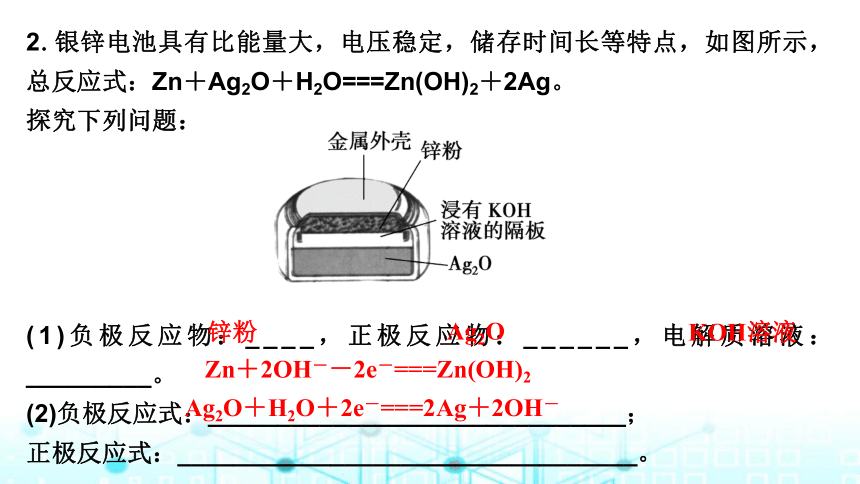
2.银锌电池具有比能量大,电压稳定,储存时间长等特点,如图所示,总反应式:Zn+Ag2O+H2O===Zn(OH)2+2Ag。
探究下列问题:
(1)负极反应物:____,正极反应物:______,电解质溶液:_________。
(2)负极反应式:______________________________;
正极反应式:_________________________________。
锌粉
Ag2O
KOH溶液
Zn+2OH--2e-===Zn(OH)2
Ag2O+H2O+2e-===2Ag+2OH-
练后归纳
返回
电极反应式的书写
1.准确判断原电池的正负极。
2.高度注意电解质的酸碱性
在正、负极上发生的电极反应不是孤立的,它往往与电解质溶液紧密联系。
3.牢牢抓住总的反应方程式
从理论上讲,任何一个自发的氧化还原反应均可设计成原电池,而两个电极反应相加即得总的反应方程式。
4.不能忽视电子转移数相等。
任务二 二次电池
问题探究
一种充电电池的原料为H2,其电池反应为H2+2NiOOH 2Ni(OH)2,
它具有比能量多等优点,常作为电动汽车、卫星等的电源。
1.该电池内电解质溶液呈酸性还是碱性?
提示:由H2→OH-知呈碱性。
2.放电时的电极反应式如何书写?
提示:负极:H2+2OH--2e-===2H2O
正极:2NiOOH+2H2O+2e-===2Ni(OH)2+2OH-。
3.充电时的电极反应式如何书写?
提示:阴极:2H2O+2e-===H2↑+2OH-
阳极:2Ni(OH)2+2OH--2e-===2NiOOH+2H2O。
4.电池充电时,外接电源的负极连接二次电池的哪个电极?
提示:负极。
1.可充电电池复杂电极反应式的书写方法
第一步:先标出放电(原电池)总反应式中变价元素的化合价,确定电子转移的方向与数目,指出参与负极和正极反应的物质。
如铅酸蓄电池中:
第二步:写出一个比较容易书写的电极反应式,书写时一定要注意电极产物是否与电解质溶液共存。如铅酸蓄电池的负极反应式为Pb+ -2e-===PbSO4。
新知构建
第三步:在电子守恒的基础上,用总反应式减去写出的电极反应式,即得另一极的反应式。如铅酸蓄电池的正极反应式可用总反应式-负极反应式得到,即Pb+PbO2+4H++ -(Pb+SO -2e-)===2PbSO4+2H2O-PbSO4,整理得:PbO2+4H++ +2e-===PbSO4+2H2O。
2.可充电电池充、放电时电极的连接
3.铅酸蓄电池是一种常见的二次电池,其放电反应和充电反应表示如下:
Pb+PbO2+2H2SO4 2PbSO4+2H2O。
(1)负极是Pb,正极是PbO2,电解质溶液是稀硫酸。
(2)放电反应原理
①负极反应式是Pb+ -2e-===PbSO4;
②正极反应式是PbO2+4H++ +2e-===PbSO4+2H2O;
③放电过程中,负极质量的变化是增大,电解质溶液pH的变化是增大。
(3)充电反应原理
①阴极(发生还原反应)反应式是Pb +2e-===Pb+ ;
②阳极(发生氧化反应)反应式是PbSO4+2H2O-2e-===PbO2+4H++ ;
③充电时,铅酸蓄电池正极与直流电源正极相连,负极与直流电源负极相连。
应用评价
1.判断正误,错误的说明其原因。
(1)二次电池的放电过程,负极质量一定减小。
答案:错误,二次电池的放电过程,负极质量不一定减小,例如铅酸蓄电池负极由Pb变为了PbSO4,质量增加。
(2)可充电电池的充、放电过程是可逆反应。
答案:错误,可充电电池的充、放电过程条件不同,不是可逆反应。
(3)铅酸蓄电池充电时,正极接直流电源正极,发生还原反应。
答案:错误,铅酸蓄电池充电时,正极接直流电源正极,发生氧化反应。
(4)锂离子电池放电时,Li+移向正极区。
答案:正确。
2.探究锂离子电池工作原理,填写下列空白。
(1)负极(嵌锂石墨LixCy)反应为___________________________________。正极(钴酸锂LiCoO2)反应为_____________________________________。
总反应为____________________________________。
LixCy-xe-===xLi++Cy
Li1-xCoO2+xLi++xe-===LiCoO2
LixCy+Li1-xCoO2 LiCoO2+Cy
(2)放电时,Li+从石墨中脱嵌移向___极,嵌入钴酸锂晶体中,充电时,Li+从钴酸锂晶体中脱嵌,由正极回到负极,嵌入石墨中。这样在放电、充电时,锂离子往返于电池的正极、负极之间,完成化学能与电能的相互转化。
正
返回
任务三 燃料电池
情境探究
设计出燃料电池使汽油氧化直接产生电流是21世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一个电极通入汽油蒸气[以壬烷(C9H20)代表汽油],电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。
1.该电池放电时发生的化学方程式如何书写?
提示:该电池放电时发生的化学反应就是壬烷燃烧的化学反应:C9H20+14O2===9CO2+10H2O。
2.该电池的正极反应如何书写?负极发生什么反应?
提示:该电池的正极是氧气,得电子,电极反应式是O2+4e-===2O2-。负极失去电子发生氧化反应。
3.固体电解质里的O2-的移动方向是怎样的?
提示:原电池中阴离子O2-向负极移动。
4.向外电路释放电子的电极为哪一极?
提示:负极。原电池中电子由负极流出,经外电路流向正极。
5.若用KOH溶液代替固体电解质,则放电时负极电极反应式如何书写?
提示:C9H20+74OH--56e-=== +47H2O。
新知构建
1.燃料电池的工作原理
(1)连续地将燃料(常见的有氢气、烃、肼、甲醇、氨、煤气等气体或液体)和氧化剂的化学能直接转化为电能。
(2)燃料电池的电极本身不参与氧化还原反应,只是一个催化转化元件。
(3)工作时,燃料和氧化剂连续地由外部供给并在电极上进行反应,生成物不断地被排出。
2.燃料电池的优点
(1)氧化剂与燃料在工作时不断地由外部供给,生成物不断地被排出,能连续不断地提供电能。
(2)能量转换率高,有利于节约能源。
(3)排放的废弃物少,绿色环保。
3.燃料电池的种类
(1)氢氧燃料电池
①构成:氢氧燃料电池以氢气为燃料,氧气为氧化剂,铂作电极材料。
②工作原理:如图所示的氢氧燃料电池的电解质溶液为酸性,在负极室通入H2,H2在Pt催化下分解为H,H再失去电子成为H+进入电解质溶液,
H+可以穿过质子交换膜进入正极室;在正极室通入O2,经过Pt催化,O2得到电子生成H2O。
③电极反应
介质 电极 电池反应:2H2+O2===2H2O
酸性(H+) 负极 2H2-4e-===4H+
正极 O2+4H++4e-===2H2O
中性
(Na2SO4) 负极 2H2-4e-===4H+
正极 O2+2H2O+4e-===4OH-
碱性
(OH-) 负极 2H2+4OH--4e-===4H2O
正极 O2+2H2O+4e-===4OH-
(2)燃料电池的燃料除氢气外,还有烃、肼、甲醇、氨、煤气等液体或气体。若用导线相连的两个铂电极插入KOH溶液中,然后向两极分别通入甲醇(CH3OH)和氧气,发生原电池反应。在负极发生氧化反应的是CH3OH,其最终产物是H2O、 ,负极反应式是2CH3OH+16OH--12e-=== +12H2O;正极反应式是3O2+6H2O+12e-===12OH-;总反应式是2CH3OH+3O2+4OH-=== +6H2O。
应用评价
1.判断正误,错误的说明其原因。
(1)以葡萄糖为燃料的微生物燃料电池,放电过程中,H+从正极区向负极区迁移。
答案:错误,放电过程中,H+从负极区向正极区迁移。
(2)燃料电池中通入燃料的一极为正极。
答案:错误,燃料电池中通入燃料的一极为负极。
(3)氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e-===2H2O。
答案:正确。
(4)燃料电池电极材料本身不参与化学反应。
答案:正确。
2.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:
(1)这种电池放电时发生反应的化学方程式:_________________________
______。
2CH3OH+3O2===2CO2+
4H2O
燃料电池的电池反应为燃料的氧化反应,在酸性条件下生成的CO2不与H2SO4反应,故电池反应为2CH3OH+3O2===2CO2+4H2O。
(2)此电池的正极反应式:_________________________,
负极反应式:_____________________________________。
3O2+12H++12e-===6H2O
2CH3OH+2H2O-12e-===2CO2+12H+
电池的正极为O2,得电子,由于是酸性电解质,所以会生成H2O,用电池总反应式减去正极反应式即可得出负极反应式。
(3)电解液中H+向_____极移动,向外电路释放电子的电极是________。
(4)使用该燃料电池的另一个好处是_______________。
正
负极
对环境无污染
H+移向正极,在正极生成水。
产物是CO2和H2O,不会对环境造成污染。
返回
随堂演练
√
1.碱性锌锰电池是普通锌锰电池的升级换代产品。图1、图2分别为碱性锌锰电池和普通锌锰电池的构造图。其总反应分别为Zn+2MnO2+2H2O===2MnO(OH)+Zn(OH)2、Zn+2MnO2+2NH4Cl===Zn(NH3)2Cl2+2MnO(OH)。下列关于两种电池的说法中,不正确的是
A.工作时,电子都由Zn流出
B.两种电池中都是MnO2被还原
C.工作时,KOH不参与电极反应
D.碱性锌锰电池比普通锌锰电池性能更好
由总反应可知,碱性锌锰电池:负极上Zn被氧
化生成Zn(OH)2,正极上MnO2被还原生成
MnO(OH);普通锌锰电池:负极上Zn被氧化
生成Zn(NH3)2Cl2,正极上MnO2被还原生成MnO(OH),据此解答。两种电池都是Zn一端作负极,电子由负极流出,则工作时,电子都由Zn流出,A正确;两种电池的正极都是MnO2被还原生成MnO(OH),B正确;碱性锌锰电池工作时,负极上Zn被氧化生成Zn(OH)2,其电极反应式为Zn-2e-+2OH-===Zn(OH)2,则KOH参与电极反应,C错误;普通锌锰电池电解质为酸性,易被腐蚀、发生自放电,碱性锌锰电池不易发生自放电,则碱性锌锰电池比普通锌锰电池性能更好,D正确;故选C。
√
2.(2023·四川成都高二期中)某甲烷燃料电池的构造如下图所示,a、b为电极,C、D为选择性离子交换膜,只允许一种离子通过。下列说法正确的是
A.电子由a沿导线流向b,再由b通过电解质溶液流回a
B.a电极的电极反应式为CH4-8e-+8OH-===CO2+6H2O
C.出口Y中KOH的质量分数小于ω%
D.b是电池正极
由题图可知,通入甲烷的a电极为燃料电池的负
极,碱性条件下甲烷在负极失去电子发生氧化反
应生成碳酸根离子和水,电极反应式为CH4-8e-
+10OH-=== +7H2O,通入氧气的b电极为
正极,氧气在正极得到电子发生还原反应生成氢氧根离子,电极反应式为O2+4e-+2H2O===4OH-。电解质溶液不能传递电子,故A错误;由分析可知,通入甲烷的a电极为燃料电池的负极,碱性条件下甲烷在负极失去电子发生氧化反应生成碳酸根离子和水,电极反应式为CH4-8e-+10OH-=== +7H2O,故B错误;由分析可知,通入氧气的b电极为正极,氧气在正极得到电子发生还原反应生成氢氧根离子,所以出口Y中氢氧化钾的质量分数大于ω%,故C错误;由分析可知,通入氧气的b电极为正极,故D正确;故选D。
3.(2023·辽宁卷)某低成本储能电池原理如下图所示。下列说法正确的是
A.放电时负极质量减小
B.储能过程中电能转变为化学能
C.放电时右侧H+通过质子交换膜移向左侧
D.充电总反应:Pb+ +2Fe3+===PbSO4+2Fe2+
√
该储能电池放电时,Pb为负极,失电子结合硫酸根离子生成PbSO4,则多孔碳电极为正极,正极上Fe3+得电子转化为Fe2+,充电时,多孔碳电极为阳极,Fe2+失电子生成Fe3+,PbSO4电极为阴极,PbSO4得电子生成Pb和硫酸。放电时负极上Pb失电子结合硫酸根离子生成PbSO4附着在负极上,负极质量增大,A错误;储能过程中,该装置为电解池,将电能转化为化学能,B正确;放电时,右侧为正极,电解质溶液中的阳离子向正极移动,左侧的H+通过质子交换膜移向右侧,C错误;充电时,总反应为PbSO4+2Fe2+===Pb+ +2Fe3+,D错误;故选B。
4.(2023·四川成都高二期末)原电池原理在生产生活中有着广泛的应用。
(1)食品保鲜常用的“双吸剂”是由还原铁粉、生石灰、氯化钠、炭粉按一定比例组成的混合物,可同时吸收水和氧气。“双吸剂”中CaO的主要作用是______;在吸收氧气的过程中形成了原电池,则炭粉上发生的电极反应式为_______________________________。
氧化钙可以和水反应,故“双吸剂”中CaO的主要作用是吸水;炭粉作为原电池的正极,发生还原反应,其发生的电极反应式为O2+2H2O+4e-===4OH-;
吸水
O2+2H2O+4e-===4OH-
(2)电化学气敏传感器可用于监测大气环境中的
SO2含量,其工作原理如图所示,电极a、b均
为惰性电极。电极b是___极(填“正”或“负”),
请写出负极的电极反应式:___________________
_____________,放电时H+向___极(填“a”或“b”)
迁移。
氧气得到电子,则通入氧气的一极为正极;二氧化硫失去电子被氧化,则通入二氧化硫的一极为负极,负极的电极反应式为SO2+2H2O-2e-=== +4H+;阳离子向正极迁移,则氢离子向b极移动;
正
SO2+2H2O-2e-
=== +4H+
b
(3)铅酸蓄电池是一种广泛使用的二次电池,其放电时的反应方程式为Pb+PbO2+2H2SO4===2PbSO4+2H2O,则其正极的电极反应式为________
___________________________________,当电路中通过2mol电子时负极质量增加______g。
返回
由铅酸蓄电池放电时的反应方程式Pb+PbO2+2H2SO4===2PbSO4+2H2O,可得其正极的电极反应式为PbO2+ +4H++2e-===2H2O+PbSO4,负极的电极反应式为Pb+ -2e-===PbSO4,当电路中通过2mol电子时生成1molPbSO4,增加的质量为 的质量,即m=1mol ×96g·mol-1=96g。
PbO2
96
+ +4H++2e-===2H2O+PbSO4
课时测评
√
题点一 一次电池
1.以前所用锌—锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为Zn-2e-===Zn2+,2MnO2+ +2e-===Mn2O3+2NH3+H2O。下列有关锌—锰干电池的叙述中,正确的是
A.干电池中锌筒为正极,石墨棒为负极
B.干电池长时间连续工作后,糊状物可能流出,腐蚀用电器
C.干电池工作时,电流方向是由锌筒经外电路流向石墨棒
D.干电池可实现化学能向电能和电能向化学能的相互转化
锌—锰干电池中,较活泼的金属锌筒为负极,石墨棒为正极,A错误;长时间使用后,锌筒上消耗出现空洞,糊状电解质流出,容易腐蚀用电器,B正确;原电池中电子流动方向由负极经外电路流向正极,而电流方向相反,C错误;干电池中只有化学能转化为电能,D错误。
√
2.某种锂电池用金属锂和石墨作电极材料,电解质溶液是由四氯铝酸锂
(LiAlCl4)溶解在亚硫酰氯( )中形成的,电池总反应式为4Li+
2SOCl2===4LiCl+SO2↑+S,下列叙述正确的是(已知:亚硫酰氯遇水会分解)
A.电解质溶液中混入水,对电池反应无影响
B.金属锂被还原,作电池的负极
C.电池工作过程中,Cl-向石墨电极移动
D.电池工作过程中,金属锂提供的电子与正极析出S的物质的量之比为4∶1
A项,Li可与水反应,且SOCl2遇水会分解,错误;B项,金属锂作原电池的负极,被氧化,错误;C项,金属锂作负极,石墨为正极,电池工作时阴离子向负极移动,错误;D项,由总反应式可知,金属锂失去4mol电子,正极生成1molS,正确。
√
由电池总反应式可知,锌为负极,电子从负极流出经外电路流向正极;外电路中每通过0.2mol电子,理论上参加反应的锌为0.1mol,即质量减少6.5g。
3.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。碱性锌锰电池以氢氧化钾溶液为电解液,电池总反应式为Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnO(OH)(s)。下列说法中错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为2MnO2(s)+2H2O(l)+2e-===2MnO(OH)(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量减少6.5g
√
题点二 二次电池
4.下列图示都是原电池原理在化学电源中的应用。
下列有关说法中正确的是
A.铅酸蓄电池在放电时,其负极是铅电极
B.氢氧燃料电池中,H2所在电极发生的反应为H2-2e-+2OH-===2H2O
C.氢氧燃料电池中,通入O2的一极为负极
D.铅酸蓄电池放电后,PbO2极质量减小
铅酸蓄电池在放电时,铅是负极,由铅变成硫酸铅,A正确;氢氧燃料电池中,电解质溶液为酸性,所以H2所在电极发生的反应为H2-2e-===2H+,B错误;氢氧燃料电池中,通入O2的一极为正极,C错误;铅酸蓄电池放电后,PbO2极变成PbSO4,质量增重,D错误;故选A。
√
5.某种钠离子的二次电池,其放电工作原理如图所示。
下列说法正确的是
A.放电时,石墨上的电势比MnPO4上的高
B.充电时,石墨接直流电源的正极
C.充电时,Na+由右侧经过离子交换膜迁移到左侧
D.放电时,正极反应为NaMnPO4+e-===MnPO4+Na+
该装置为钠离子的二次电池,根据放电工作原理的装置以及原电池工作原理,左端电极为负极,电极反应式为Na-e-===Na+,右端电极为正极,电极反应式为MnPO4+Na++e-===NaMnPO4,据此分析;根据上述分析,石墨为负极,MnPO4为正极,正极电势高于负极电势,即MnPO4电势高于石墨,故A错误;
二次电池充电时,电池正极接电源的正极,电池负极接电源的负极,石墨为负极,充电时,应接电源的负极,故B错误;充电时,石墨电极反应式为Na++e-===Na,MnPO4电极反应式为NaMnPO4-e-===Na++MnPO4,Na+从右侧经过离子交换膜迁移到左侧,故C正确;根据上述分析,放电时正极反应式为MnPO4+Na++e-===NaMnPO4,故D错误;答案为C。
√
题点三 燃料电池
6.直接硼氢化物( )燃料电池(DBFC)具有理论电池电压高和能量密度大等特点,其工作原理如图所示。下列叙述正确的是
A.电极N为负极,电极R为正极,箭头方向为电流移动方向
B.交换膜为质子交换膜,放电时阳离子向电池的正极定向移动
C.放电时,电极N上的电极反应式为 +8e-+8OH-=== +6H2O
D.电极R通入O2,电池放电一段时间后,电极R附近溶液的pH升高
Na+由N极移向R极,可知电极N为负极、电极R为正极,箭头方向为电子移动方向,故A错误;根据题图,Na+透过阳离子交换膜,放电时
Na+向电池的正极定向移动,故B错误;放电时,N是负极,电极N上的电极反应式为 -8e-+8OH-=== +6H2O,故C错误;电极R通入O2,电极反应式为O2+4e-+2H2O===4OH-,电池放电一段时间后,电极R附近溶液的pH升高,故D正确;故选D。
√
7.美国海军海底战事中心与麻省理工学院共同研制成功了用于潜航器的镁—过氧化氢燃料电池系统。其工作原理如图所示。以下说法错误的是
A.电池的负极反应式为Mg-2e-===Mg2+
B.电池工作时,H+向负极移动
C.电池工作一段时间后,溶液的pH增大
D.电池总反应式是Mg+H2O2+2H+===Mg2++2H2O
Mg-H2O2燃料电池中Mg作负极,电极反应式为Mg-2e-===Mg2+,Pt作正极,电极反应式为H2O2+2H++2e-===2H2O,总反应式为Mg+H2O2+2H+===Mg2++2H2O,消耗H+,使溶液中c(H+)减小,pH增大,原电池中阳离子移向正极,即H+移向正极。
√
8.工业生产中的二氧化碳过度排放加剧了地球的温室效应,某科技工作团队研究利用电化学将其转化为CO作为燃料再利用,转化的基本原理如图所示。
下列说法正确的是
A.M为电池负极,电池工作一段时间,M极附近溶液pH不变
B.N为电池正极,电极反应式为CO2+2e-===CO+O2-
C.穿过“交换膜”的箭头表示的是溶液中质子的移动方向
D.电路中转移1mol电子时,N极电解质溶液增重8g
根据题图,M极上水失电子放出氧气,M电极
发生氧化反应,M为电池负极,负极反应式是
2H2O-4e-===4H++O2↑,电池工作一段时
间,M极附近溶液pH降低,故A错误;根据题
图,N极上二氧化碳得电子生成一氧化碳,N电极发生还原反应,N为电池正极,电极反应式为CO2+2e-+2H+===CO+H2O,故B错误;原电池中阳离子向正极移动,N是正极,穿过“交换膜”的箭头表示的是溶液中质子的移动方向,故C正确;根据CO2+2e-+2H+===CO+H2O,电路中转移1mol电子时,N极生成0.5mol水,电解质溶液增重9g,故D错误;故选C。
9.(1)二氧化硫—空气质子交换膜燃料电池可以利用大气中所含SO2快速启动,其装置示意图如图:
①质子的流动方向为________(填“从A到B”或“从B到A”)。
根据题图,A为燃料电池的负极,B为燃料电池的正极,在原电池电解质溶液中,质子由负极向正极移动,即从A到B。
从A到B
②负极的电极反应式为______________________________。
负极发生氧化反应,二氧化硫被氧化为硫酸根离子,电极反应式为SO2-2e-+2H2O=== +4H+。
SO2-2e-+2H2O=== +4H+
(2)NH3-O2燃料电池的结构如图所示:
①a极为电池的____(填“正”或“负”)极。
②当生成1molN2时,电路中流过电子的物质的量为________。
a极通入氨,是负极,b极通入氧气,是正极。
负
6mol
氨气中N的化合价由-3变成0,当生成1molN2时,转移6mol电子。
分析总反应式中元素化合价的变化,可得Li失电子,化合价升高作负极:Li-e-===Li+。
10.Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应式可表示为4Li+2SOCl2===4LiCl+S+SO2↑。
请回答下列问题:
(1)电池的负极材料为________,发生的电极反应为_________________。
Li
Li-e-===Li+
(2)电池正极发生的电极反应为______________________________。
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴入SOCl2中,实验现象是______________________
__________,反应的化学方程式为______________________________。
2SOCl2+4e-===4Cl-+S+SO2↑
出现白雾,有刺激性气味
SOCl2+H2O===SO2↑+2HCl↑
气体生成
题中已给出信息:碱液吸收时的产物是Na2SO3和NaCl,则没有碱液吸收时的产物应为SO2和HCl,进而推出现象。
SOCl2中S元素得电子,化合价降低,从题给电池反应可推出产物为
Cl-、S、SO2(或用总反应式减去负极反应式)。
(4)组装该电池必须在无水、无氧的条件下进行,原因是______________
________________________________________。
(5)熔融状态下,钠的单质和FeCl2能组成可充电电池(装置示意图如图),反应原理为2Na+FeCl2===Fe+2NaCl。
放电时,电池的正极反应式为_________________;该电池的电解质为______________。
构成电池的主要
成分Li能与氧气、水反应,SOCl2也与水反应
Fe2++2e-===Fe
β-Al2O3 固体
返回
第2课时 化学电源
第四章 第一节 原电池
1.了解常见化学电源的工作原理。
2. 能列举常见的化学电源,并能利用相关信息分析化学电源的工
作原理。
课程标准
任务一 化学电源和一次电池
新知构建
(一)化学电源
1.概念:化学电源是将化学能变成电能的装置。
2.分类
3.判断电池优劣的主要标准
(1)比能量:即单位质量或单位体积所能输出电能的多少,单位(W·h)/kg或(W·h)/L。
(2)比功率:即单位质量或单位体积所能输出功率的大小,单位W/kg或W/L。
(3)电池可储存时间的长短。
(二)一次电池
1.一次电池:随着使用,一次电池中能发生氧化还原反应的物质逐渐被消耗,当这些物质被消耗到一定程度时,电池就不能继续使用了。一次电池中电解质溶液制成胶状,不流动,也叫做________。
干电池
2.普通锌锰电池和碱性锌锰电池比较
种类
项目 普通锌锰电池 碱性锌锰电池
装置
电极反应及电池总反应 负极:Zn-2e-+2NH ===Zn(NH3)
+2H+
正极:2H++2MnO2+2e-===2MnO(OH)
总反应:Zn+2MnO2+2NH ===Zn(NH3)+2MnO(OH) 负极:Zn+2OH--2e-===
Zn(OH)2
正极:2MnO2+2H2O+2e-===
2MnO(OH)+2OH-
总反应:Zn+2MnO2+2H2O
===2MnO(OH)+Zn(OH)2
种类
项目 普通锌锰电池 碱性锌锰电池
特点 优点:制作简单,价格便宜。
缺点:新电池会发生自动放电,使存放时间缩短,放电后电压下降较快 优点:克服了普通锌锰电池的缺点,单位质量所输出的电能多,储存时间长,适用于大电流和连续放电
应用评价
1.判断正误,错误的说明其原因。
(1)化学电池可以将化学能全部转化成电能。
答案:错误,有一部分化学能会转化成热能。
(2)锌锰干电池中,锌电极是负极。
答案:正确。
(3)利用原电池装置,可以将化学能转化为电能。
答案:正确。
(4)碱性锌锰电池中,锌作负极,溶解转化为Zn2+,MnO2作正极,转化为MnO(OH)。
答案:错误,碱性锌锰电池中,锌作负极,转化为Zn(OH)2,MnO2作正极,转化为MnO(OH)。
2.银锌电池具有比能量大,电压稳定,储存时间长等特点,如图所示,总反应式:Zn+Ag2O+H2O===Zn(OH)2+2Ag。
探究下列问题:
(1)负极反应物:____,正极反应物:______,电解质溶液:_________。
(2)负极反应式:______________________________;
正极反应式:_________________________________。
锌粉
Ag2O
KOH溶液
Zn+2OH--2e-===Zn(OH)2
Ag2O+H2O+2e-===2Ag+2OH-
练后归纳
返回
电极反应式的书写
1.准确判断原电池的正负极。
2.高度注意电解质的酸碱性
在正、负极上发生的电极反应不是孤立的,它往往与电解质溶液紧密联系。
3.牢牢抓住总的反应方程式
从理论上讲,任何一个自发的氧化还原反应均可设计成原电池,而两个电极反应相加即得总的反应方程式。
4.不能忽视电子转移数相等。
任务二 二次电池
问题探究
一种充电电池的原料为H2,其电池反应为H2+2NiOOH 2Ni(OH)2,
它具有比能量多等优点,常作为电动汽车、卫星等的电源。
1.该电池内电解质溶液呈酸性还是碱性?
提示:由H2→OH-知呈碱性。
2.放电时的电极反应式如何书写?
提示:负极:H2+2OH--2e-===2H2O
正极:2NiOOH+2H2O+2e-===2Ni(OH)2+2OH-。
3.充电时的电极反应式如何书写?
提示:阴极:2H2O+2e-===H2↑+2OH-
阳极:2Ni(OH)2+2OH--2e-===2NiOOH+2H2O。
4.电池充电时,外接电源的负极连接二次电池的哪个电极?
提示:负极。
1.可充电电池复杂电极反应式的书写方法
第一步:先标出放电(原电池)总反应式中变价元素的化合价,确定电子转移的方向与数目,指出参与负极和正极反应的物质。
如铅酸蓄电池中:
第二步:写出一个比较容易书写的电极反应式,书写时一定要注意电极产物是否与电解质溶液共存。如铅酸蓄电池的负极反应式为Pb+ -2e-===PbSO4。
新知构建
第三步:在电子守恒的基础上,用总反应式减去写出的电极反应式,即得另一极的反应式。如铅酸蓄电池的正极反应式可用总反应式-负极反应式得到,即Pb+PbO2+4H++ -(Pb+SO -2e-)===2PbSO4+2H2O-PbSO4,整理得:PbO2+4H++ +2e-===PbSO4+2H2O。
2.可充电电池充、放电时电极的连接
3.铅酸蓄电池是一种常见的二次电池,其放电反应和充电反应表示如下:
Pb+PbO2+2H2SO4 2PbSO4+2H2O。
(1)负极是Pb,正极是PbO2,电解质溶液是稀硫酸。
(2)放电反应原理
①负极反应式是Pb+ -2e-===PbSO4;
②正极反应式是PbO2+4H++ +2e-===PbSO4+2H2O;
③放电过程中,负极质量的变化是增大,电解质溶液pH的变化是增大。
(3)充电反应原理
①阴极(发生还原反应)反应式是Pb +2e-===Pb+ ;
②阳极(发生氧化反应)反应式是PbSO4+2H2O-2e-===PbO2+4H++ ;
③充电时,铅酸蓄电池正极与直流电源正极相连,负极与直流电源负极相连。
应用评价
1.判断正误,错误的说明其原因。
(1)二次电池的放电过程,负极质量一定减小。
答案:错误,二次电池的放电过程,负极质量不一定减小,例如铅酸蓄电池负极由Pb变为了PbSO4,质量增加。
(2)可充电电池的充、放电过程是可逆反应。
答案:错误,可充电电池的充、放电过程条件不同,不是可逆反应。
(3)铅酸蓄电池充电时,正极接直流电源正极,发生还原反应。
答案:错误,铅酸蓄电池充电时,正极接直流电源正极,发生氧化反应。
(4)锂离子电池放电时,Li+移向正极区。
答案:正确。
2.探究锂离子电池工作原理,填写下列空白。
(1)负极(嵌锂石墨LixCy)反应为___________________________________。正极(钴酸锂LiCoO2)反应为_____________________________________。
总反应为____________________________________。
LixCy-xe-===xLi++Cy
Li1-xCoO2+xLi++xe-===LiCoO2
LixCy+Li1-xCoO2 LiCoO2+Cy
(2)放电时,Li+从石墨中脱嵌移向___极,嵌入钴酸锂晶体中,充电时,Li+从钴酸锂晶体中脱嵌,由正极回到负极,嵌入石墨中。这样在放电、充电时,锂离子往返于电池的正极、负极之间,完成化学能与电能的相互转化。
正
返回
任务三 燃料电池
情境探究
设计出燃料电池使汽油氧化直接产生电流是21世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一个电极通入汽油蒸气[以壬烷(C9H20)代表汽油],电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。
1.该电池放电时发生的化学方程式如何书写?
提示:该电池放电时发生的化学反应就是壬烷燃烧的化学反应:C9H20+14O2===9CO2+10H2O。
2.该电池的正极反应如何书写?负极发生什么反应?
提示:该电池的正极是氧气,得电子,电极反应式是O2+4e-===2O2-。负极失去电子发生氧化反应。
3.固体电解质里的O2-的移动方向是怎样的?
提示:原电池中阴离子O2-向负极移动。
4.向外电路释放电子的电极为哪一极?
提示:负极。原电池中电子由负极流出,经外电路流向正极。
5.若用KOH溶液代替固体电解质,则放电时负极电极反应式如何书写?
提示:C9H20+74OH--56e-=== +47H2O。
新知构建
1.燃料电池的工作原理
(1)连续地将燃料(常见的有氢气、烃、肼、甲醇、氨、煤气等气体或液体)和氧化剂的化学能直接转化为电能。
(2)燃料电池的电极本身不参与氧化还原反应,只是一个催化转化元件。
(3)工作时,燃料和氧化剂连续地由外部供给并在电极上进行反应,生成物不断地被排出。
2.燃料电池的优点
(1)氧化剂与燃料在工作时不断地由外部供给,生成物不断地被排出,能连续不断地提供电能。
(2)能量转换率高,有利于节约能源。
(3)排放的废弃物少,绿色环保。
3.燃料电池的种类
(1)氢氧燃料电池
①构成:氢氧燃料电池以氢气为燃料,氧气为氧化剂,铂作电极材料。
②工作原理:如图所示的氢氧燃料电池的电解质溶液为酸性,在负极室通入H2,H2在Pt催化下分解为H,H再失去电子成为H+进入电解质溶液,
H+可以穿过质子交换膜进入正极室;在正极室通入O2,经过Pt催化,O2得到电子生成H2O。
③电极反应
介质 电极 电池反应:2H2+O2===2H2O
酸性(H+) 负极 2H2-4e-===4H+
正极 O2+4H++4e-===2H2O
中性
(Na2SO4) 负极 2H2-4e-===4H+
正极 O2+2H2O+4e-===4OH-
碱性
(OH-) 负极 2H2+4OH--4e-===4H2O
正极 O2+2H2O+4e-===4OH-
(2)燃料电池的燃料除氢气外,还有烃、肼、甲醇、氨、煤气等液体或气体。若用导线相连的两个铂电极插入KOH溶液中,然后向两极分别通入甲醇(CH3OH)和氧气,发生原电池反应。在负极发生氧化反应的是CH3OH,其最终产物是H2O、 ,负极反应式是2CH3OH+16OH--12e-=== +12H2O;正极反应式是3O2+6H2O+12e-===12OH-;总反应式是2CH3OH+3O2+4OH-=== +6H2O。
应用评价
1.判断正误,错误的说明其原因。
(1)以葡萄糖为燃料的微生物燃料电池,放电过程中,H+从正极区向负极区迁移。
答案:错误,放电过程中,H+从负极区向正极区迁移。
(2)燃料电池中通入燃料的一极为正极。
答案:错误,燃料电池中通入燃料的一极为负极。
(3)氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e-===2H2O。
答案:正确。
(4)燃料电池电极材料本身不参与化学反应。
答案:正确。
2.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:
(1)这种电池放电时发生反应的化学方程式:_________________________
______。
2CH3OH+3O2===2CO2+
4H2O
燃料电池的电池反应为燃料的氧化反应,在酸性条件下生成的CO2不与H2SO4反应,故电池反应为2CH3OH+3O2===2CO2+4H2O。
(2)此电池的正极反应式:_________________________,
负极反应式:_____________________________________。
3O2+12H++12e-===6H2O
2CH3OH+2H2O-12e-===2CO2+12H+
电池的正极为O2,得电子,由于是酸性电解质,所以会生成H2O,用电池总反应式减去正极反应式即可得出负极反应式。
(3)电解液中H+向_____极移动,向外电路释放电子的电极是________。
(4)使用该燃料电池的另一个好处是_______________。
正
负极
对环境无污染
H+移向正极,在正极生成水。
产物是CO2和H2O,不会对环境造成污染。
返回
随堂演练
√
1.碱性锌锰电池是普通锌锰电池的升级换代产品。图1、图2分别为碱性锌锰电池和普通锌锰电池的构造图。其总反应分别为Zn+2MnO2+2H2O===2MnO(OH)+Zn(OH)2、Zn+2MnO2+2NH4Cl===Zn(NH3)2Cl2+2MnO(OH)。下列关于两种电池的说法中,不正确的是
A.工作时,电子都由Zn流出
B.两种电池中都是MnO2被还原
C.工作时,KOH不参与电极反应
D.碱性锌锰电池比普通锌锰电池性能更好
由总反应可知,碱性锌锰电池:负极上Zn被氧
化生成Zn(OH)2,正极上MnO2被还原生成
MnO(OH);普通锌锰电池:负极上Zn被氧化
生成Zn(NH3)2Cl2,正极上MnO2被还原生成MnO(OH),据此解答。两种电池都是Zn一端作负极,电子由负极流出,则工作时,电子都由Zn流出,A正确;两种电池的正极都是MnO2被还原生成MnO(OH),B正确;碱性锌锰电池工作时,负极上Zn被氧化生成Zn(OH)2,其电极反应式为Zn-2e-+2OH-===Zn(OH)2,则KOH参与电极反应,C错误;普通锌锰电池电解质为酸性,易被腐蚀、发生自放电,碱性锌锰电池不易发生自放电,则碱性锌锰电池比普通锌锰电池性能更好,D正确;故选C。
√
2.(2023·四川成都高二期中)某甲烷燃料电池的构造如下图所示,a、b为电极,C、D为选择性离子交换膜,只允许一种离子通过。下列说法正确的是
A.电子由a沿导线流向b,再由b通过电解质溶液流回a
B.a电极的电极反应式为CH4-8e-+8OH-===CO2+6H2O
C.出口Y中KOH的质量分数小于ω%
D.b是电池正极
由题图可知,通入甲烷的a电极为燃料电池的负
极,碱性条件下甲烷在负极失去电子发生氧化反
应生成碳酸根离子和水,电极反应式为CH4-8e-
+10OH-=== +7H2O,通入氧气的b电极为
正极,氧气在正极得到电子发生还原反应生成氢氧根离子,电极反应式为O2+4e-+2H2O===4OH-。电解质溶液不能传递电子,故A错误;由分析可知,通入甲烷的a电极为燃料电池的负极,碱性条件下甲烷在负极失去电子发生氧化反应生成碳酸根离子和水,电极反应式为CH4-8e-+10OH-=== +7H2O,故B错误;由分析可知,通入氧气的b电极为正极,氧气在正极得到电子发生还原反应生成氢氧根离子,所以出口Y中氢氧化钾的质量分数大于ω%,故C错误;由分析可知,通入氧气的b电极为正极,故D正确;故选D。
3.(2023·辽宁卷)某低成本储能电池原理如下图所示。下列说法正确的是
A.放电时负极质量减小
B.储能过程中电能转变为化学能
C.放电时右侧H+通过质子交换膜移向左侧
D.充电总反应:Pb+ +2Fe3+===PbSO4+2Fe2+
√
该储能电池放电时,Pb为负极,失电子结合硫酸根离子生成PbSO4,则多孔碳电极为正极,正极上Fe3+得电子转化为Fe2+,充电时,多孔碳电极为阳极,Fe2+失电子生成Fe3+,PbSO4电极为阴极,PbSO4得电子生成Pb和硫酸。放电时负极上Pb失电子结合硫酸根离子生成PbSO4附着在负极上,负极质量增大,A错误;储能过程中,该装置为电解池,将电能转化为化学能,B正确;放电时,右侧为正极,电解质溶液中的阳离子向正极移动,左侧的H+通过质子交换膜移向右侧,C错误;充电时,总反应为PbSO4+2Fe2+===Pb+ +2Fe3+,D错误;故选B。
4.(2023·四川成都高二期末)原电池原理在生产生活中有着广泛的应用。
(1)食品保鲜常用的“双吸剂”是由还原铁粉、生石灰、氯化钠、炭粉按一定比例组成的混合物,可同时吸收水和氧气。“双吸剂”中CaO的主要作用是______;在吸收氧气的过程中形成了原电池,则炭粉上发生的电极反应式为_______________________________。
氧化钙可以和水反应,故“双吸剂”中CaO的主要作用是吸水;炭粉作为原电池的正极,发生还原反应,其发生的电极反应式为O2+2H2O+4e-===4OH-;
吸水
O2+2H2O+4e-===4OH-
(2)电化学气敏传感器可用于监测大气环境中的
SO2含量,其工作原理如图所示,电极a、b均
为惰性电极。电极b是___极(填“正”或“负”),
请写出负极的电极反应式:___________________
_____________,放电时H+向___极(填“a”或“b”)
迁移。
氧气得到电子,则通入氧气的一极为正极;二氧化硫失去电子被氧化,则通入二氧化硫的一极为负极,负极的电极反应式为SO2+2H2O-2e-=== +4H+;阳离子向正极迁移,则氢离子向b极移动;
正
SO2+2H2O-2e-
=== +4H+
b
(3)铅酸蓄电池是一种广泛使用的二次电池,其放电时的反应方程式为Pb+PbO2+2H2SO4===2PbSO4+2H2O,则其正极的电极反应式为________
___________________________________,当电路中通过2mol电子时负极质量增加______g。
返回
由铅酸蓄电池放电时的反应方程式Pb+PbO2+2H2SO4===2PbSO4+2H2O,可得其正极的电极反应式为PbO2+ +4H++2e-===2H2O+PbSO4,负极的电极反应式为Pb+ -2e-===PbSO4,当电路中通过2mol电子时生成1molPbSO4,增加的质量为 的质量,即m=1mol ×96g·mol-1=96g。
PbO2
96
+ +4H++2e-===2H2O+PbSO4
课时测评
√
题点一 一次电池
1.以前所用锌—锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为Zn-2e-===Zn2+,2MnO2+ +2e-===Mn2O3+2NH3+H2O。下列有关锌—锰干电池的叙述中,正确的是
A.干电池中锌筒为正极,石墨棒为负极
B.干电池长时间连续工作后,糊状物可能流出,腐蚀用电器
C.干电池工作时,电流方向是由锌筒经外电路流向石墨棒
D.干电池可实现化学能向电能和电能向化学能的相互转化
锌—锰干电池中,较活泼的金属锌筒为负极,石墨棒为正极,A错误;长时间使用后,锌筒上消耗出现空洞,糊状电解质流出,容易腐蚀用电器,B正确;原电池中电子流动方向由负极经外电路流向正极,而电流方向相反,C错误;干电池中只有化学能转化为电能,D错误。
√
2.某种锂电池用金属锂和石墨作电极材料,电解质溶液是由四氯铝酸锂
(LiAlCl4)溶解在亚硫酰氯( )中形成的,电池总反应式为4Li+
2SOCl2===4LiCl+SO2↑+S,下列叙述正确的是(已知:亚硫酰氯遇水会分解)
A.电解质溶液中混入水,对电池反应无影响
B.金属锂被还原,作电池的负极
C.电池工作过程中,Cl-向石墨电极移动
D.电池工作过程中,金属锂提供的电子与正极析出S的物质的量之比为4∶1
A项,Li可与水反应,且SOCl2遇水会分解,错误;B项,金属锂作原电池的负极,被氧化,错误;C项,金属锂作负极,石墨为正极,电池工作时阴离子向负极移动,错误;D项,由总反应式可知,金属锂失去4mol电子,正极生成1molS,正确。
√
由电池总反应式可知,锌为负极,电子从负极流出经外电路流向正极;外电路中每通过0.2mol电子,理论上参加反应的锌为0.1mol,即质量减少6.5g。
3.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。碱性锌锰电池以氢氧化钾溶液为电解液,电池总反应式为Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnO(OH)(s)。下列说法中错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为2MnO2(s)+2H2O(l)+2e-===2MnO(OH)(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量减少6.5g
√
题点二 二次电池
4.下列图示都是原电池原理在化学电源中的应用。
下列有关说法中正确的是
A.铅酸蓄电池在放电时,其负极是铅电极
B.氢氧燃料电池中,H2所在电极发生的反应为H2-2e-+2OH-===2H2O
C.氢氧燃料电池中,通入O2的一极为负极
D.铅酸蓄电池放电后,PbO2极质量减小
铅酸蓄电池在放电时,铅是负极,由铅变成硫酸铅,A正确;氢氧燃料电池中,电解质溶液为酸性,所以H2所在电极发生的反应为H2-2e-===2H+,B错误;氢氧燃料电池中,通入O2的一极为正极,C错误;铅酸蓄电池放电后,PbO2极变成PbSO4,质量增重,D错误;故选A。
√
5.某种钠离子的二次电池,其放电工作原理如图所示。
下列说法正确的是
A.放电时,石墨上的电势比MnPO4上的高
B.充电时,石墨接直流电源的正极
C.充电时,Na+由右侧经过离子交换膜迁移到左侧
D.放电时,正极反应为NaMnPO4+e-===MnPO4+Na+
该装置为钠离子的二次电池,根据放电工作原理的装置以及原电池工作原理,左端电极为负极,电极反应式为Na-e-===Na+,右端电极为正极,电极反应式为MnPO4+Na++e-===NaMnPO4,据此分析;根据上述分析,石墨为负极,MnPO4为正极,正极电势高于负极电势,即MnPO4电势高于石墨,故A错误;
二次电池充电时,电池正极接电源的正极,电池负极接电源的负极,石墨为负极,充电时,应接电源的负极,故B错误;充电时,石墨电极反应式为Na++e-===Na,MnPO4电极反应式为NaMnPO4-e-===Na++MnPO4,Na+从右侧经过离子交换膜迁移到左侧,故C正确;根据上述分析,放电时正极反应式为MnPO4+Na++e-===NaMnPO4,故D错误;答案为C。
√
题点三 燃料电池
6.直接硼氢化物( )燃料电池(DBFC)具有理论电池电压高和能量密度大等特点,其工作原理如图所示。下列叙述正确的是
A.电极N为负极,电极R为正极,箭头方向为电流移动方向
B.交换膜为质子交换膜,放电时阳离子向电池的正极定向移动
C.放电时,电极N上的电极反应式为 +8e-+8OH-=== +6H2O
D.电极R通入O2,电池放电一段时间后,电极R附近溶液的pH升高
Na+由N极移向R极,可知电极N为负极、电极R为正极,箭头方向为电子移动方向,故A错误;根据题图,Na+透过阳离子交换膜,放电时
Na+向电池的正极定向移动,故B错误;放电时,N是负极,电极N上的电极反应式为 -8e-+8OH-=== +6H2O,故C错误;电极R通入O2,电极反应式为O2+4e-+2H2O===4OH-,电池放电一段时间后,电极R附近溶液的pH升高,故D正确;故选D。
√
7.美国海军海底战事中心与麻省理工学院共同研制成功了用于潜航器的镁—过氧化氢燃料电池系统。其工作原理如图所示。以下说法错误的是
A.电池的负极反应式为Mg-2e-===Mg2+
B.电池工作时,H+向负极移动
C.电池工作一段时间后,溶液的pH增大
D.电池总反应式是Mg+H2O2+2H+===Mg2++2H2O
Mg-H2O2燃料电池中Mg作负极,电极反应式为Mg-2e-===Mg2+,Pt作正极,电极反应式为H2O2+2H++2e-===2H2O,总反应式为Mg+H2O2+2H+===Mg2++2H2O,消耗H+,使溶液中c(H+)减小,pH增大,原电池中阳离子移向正极,即H+移向正极。
√
8.工业生产中的二氧化碳过度排放加剧了地球的温室效应,某科技工作团队研究利用电化学将其转化为CO作为燃料再利用,转化的基本原理如图所示。
下列说法正确的是
A.M为电池负极,电池工作一段时间,M极附近溶液pH不变
B.N为电池正极,电极反应式为CO2+2e-===CO+O2-
C.穿过“交换膜”的箭头表示的是溶液中质子的移动方向
D.电路中转移1mol电子时,N极电解质溶液增重8g
根据题图,M极上水失电子放出氧气,M电极
发生氧化反应,M为电池负极,负极反应式是
2H2O-4e-===4H++O2↑,电池工作一段时
间,M极附近溶液pH降低,故A错误;根据题
图,N极上二氧化碳得电子生成一氧化碳,N电极发生还原反应,N为电池正极,电极反应式为CO2+2e-+2H+===CO+H2O,故B错误;原电池中阳离子向正极移动,N是正极,穿过“交换膜”的箭头表示的是溶液中质子的移动方向,故C正确;根据CO2+2e-+2H+===CO+H2O,电路中转移1mol电子时,N极生成0.5mol水,电解质溶液增重9g,故D错误;故选C。
9.(1)二氧化硫—空气质子交换膜燃料电池可以利用大气中所含SO2快速启动,其装置示意图如图:
①质子的流动方向为________(填“从A到B”或“从B到A”)。
根据题图,A为燃料电池的负极,B为燃料电池的正极,在原电池电解质溶液中,质子由负极向正极移动,即从A到B。
从A到B
②负极的电极反应式为______________________________。
负极发生氧化反应,二氧化硫被氧化为硫酸根离子,电极反应式为SO2-2e-+2H2O=== +4H+。
SO2-2e-+2H2O=== +4H+
(2)NH3-O2燃料电池的结构如图所示:
①a极为电池的____(填“正”或“负”)极。
②当生成1molN2时,电路中流过电子的物质的量为________。
a极通入氨,是负极,b极通入氧气,是正极。
负
6mol
氨气中N的化合价由-3变成0,当生成1molN2时,转移6mol电子。
分析总反应式中元素化合价的变化,可得Li失电子,化合价升高作负极:Li-e-===Li+。
10.Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应式可表示为4Li+2SOCl2===4LiCl+S+SO2↑。
请回答下列问题:
(1)电池的负极材料为________,发生的电极反应为_________________。
Li
Li-e-===Li+
(2)电池正极发生的电极反应为______________________________。
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴入SOCl2中,实验现象是______________________
__________,反应的化学方程式为______________________________。
2SOCl2+4e-===4Cl-+S+SO2↑
出现白雾,有刺激性气味
SOCl2+H2O===SO2↑+2HCl↑
气体生成
题中已给出信息:碱液吸收时的产物是Na2SO3和NaCl,则没有碱液吸收时的产物应为SO2和HCl,进而推出现象。
SOCl2中S元素得电子,化合价降低,从题给电池反应可推出产物为
Cl-、S、SO2(或用总反应式减去负极反应式)。
(4)组装该电池必须在无水、无氧的条件下进行,原因是______________
________________________________________。
(5)熔融状态下,钠的单质和FeCl2能组成可充电电池(装置示意图如图),反应原理为2Na+FeCl2===Fe+2NaCl。
放电时,电池的正极反应式为_________________;该电池的电解质为______________。
构成电池的主要
成分Li能与氧气、水反应,SOCl2也与水反应
Fe2++2e-===Fe
β-Al2O3 固体
返回
