人教版高中化学选择性必修1第一章化学反应的热效应第一节第1课时反应热焓变课件(52页ppt)
文档属性
| 名称 | 人教版高中化学选择性必修1第一章化学反应的热效应第一节第1课时反应热焓变课件(52页ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-10 09:03:20 | ||
图片预览










文档简介
(共52张PPT)
第1课时 反应热 焓变
第一章 第一节 反应热
1.知道内能是体系内物质的各种能量的总和,受温度、压强、物质 的聚集状态的影响。
2.认识化学能与热能的相互转化,恒温恒压条件下化学反应的反应 热可以用焓变表示。
3.能辨识化学反应中的能量转化形式,能解释化学反应中能量变化 的本质。变表
课程标准
任务一 反应热及其测定
新知构建
1.体系与环境
以研究盐酸与NaOH溶液的反应为例,我们将试
管中的盐酸、NaOH溶液及发生的反应等看作一
个反应______,简称体系(又称______),盛溶液
的试管和溶液之外的空气等看作______。
2.反应热
因温度不同而在体系与环境之间交换或传递的能量是______。
在等温条件下,化学反应体系向环境______或从环境______的热量,称为化学反应的热效应,简称________。
体系
系统
环境
热量
释放
吸收
反应热
3.中和反应反应热的测定
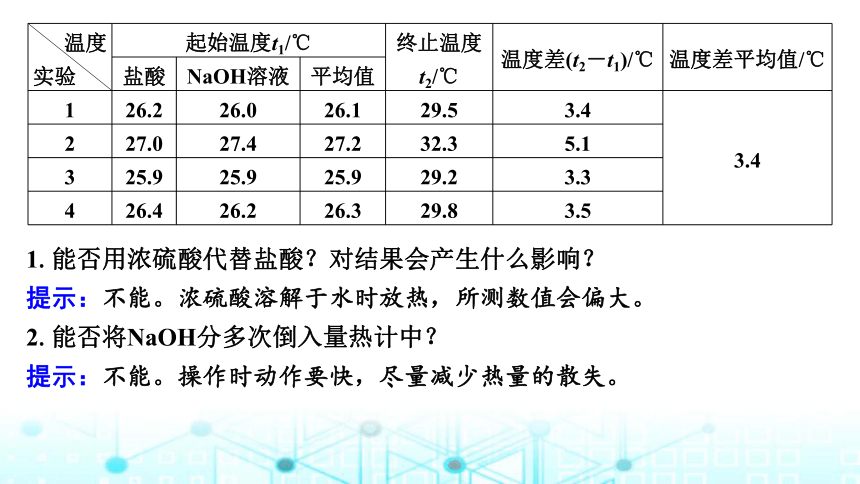
某同学根据课本的实验获得实验数据如下表,请填写下表中的空白,并思考以下问题。
温度
实验 起始温度t1/℃ 终止温度t2/℃ 温度差(t2-t1)/℃ 温度差平
均值/℃
盐酸 NaOH溶液 平均值
1 26.2 26.0 26.1 29.5 3.4 ______
2 27.0 27.4 27.2 32.3 5.1
3 25.9 25.9 25.9 29.2 3.3
4 26.4 26.2 26.3 29.8 3.5
交流研讨
3.4
提示:本实验应先求终止温度和起始温度的差值,再取平均值,以便发现差别较大的数据。若某数据与其他数据相差太大,应舍去。
1.能否用浓硫酸代替盐酸?对结果会产生什么影响?
提示:不能。浓硫酸溶解于水时放热,所测数值会偏大。
2.能否将NaOH分多次倒入量热计中?
提示:不能。操作时动作要快,尽量减少热量的散失。
温度
实验 起始温度t1/℃ 终止温度
t2/℃ 温度差(t2-t1)/℃ 温度差平均值/℃
盐酸 NaOH溶液 平均值
1 26.2 26.0 26.1 29.5 3.4 3.4
2 27.0 27.4 27.2 32.3 5.1
3 25.9 25.9 25.9 29.2 3.3
4 26.4 26.2 26.3 29.8 3.5
归纳总结
1.为了保证盐酸完全被中和,采用稍过量的NaOH溶液。
2.测量完盐酸的温度后,温度计应冲洗干净并擦干。
3.酸、碱溶液一次迅速混合。
应用评价
1.判断正误,错误的说明其原因。
(1)浓硫酸与NaOH溶液反应生成1 mol H2O(l),放出的热量为57.3 kJ。
________________________________________________________________________________________________________________________________
错误;因为浓硫酸稀释要放热,所以浓硫酸与NaOH溶液反应生成1 mol H2O(l),放出的热量大于57.3 kJ。
(2)同一中和反应中生成1 mol H2O(l)的反应热与酸碱的用量有关。
________________________________________________________________________________________________________________________________
错误;同一中和反应中既然是生成1 mol H2O(l)的反应热,酸碱的量就固定了。
(3)中和反应反应热的测定实验中的玻璃搅拌器换成铜质搅拌器效果更好。
________________________________________________________________
(4)中和反应反应热的测定实验中,应将50 mL 0.55 mol·L-1 NaOH溶液分多次倒入小烧杯。
________________________________________________________________________________________________________________________________
错误;铜质搅拌器的导热性好,容易造成热量损失,使测量结果偏小。
错误;中和反应反应热的测定实验中,应将50 mL 0.55 mol·L-1 NaOH溶液一次倒入小烧杯,避免热量损失。
2.50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH
溶液在如图所示的装置中进行中和反应。通过测定反应过程
中所放出的热量可计算中和反应反应热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是____________。
(2)隔热层的作用是___________________________。
(3)倒入NaOH溶液的正确操作是______(填字母)。
a.沿玻璃棒缓慢倒入
b.分三次少量倒入
c.一次迅速倒入
玻璃搅拌器
减少实验过程中的热量损失
c
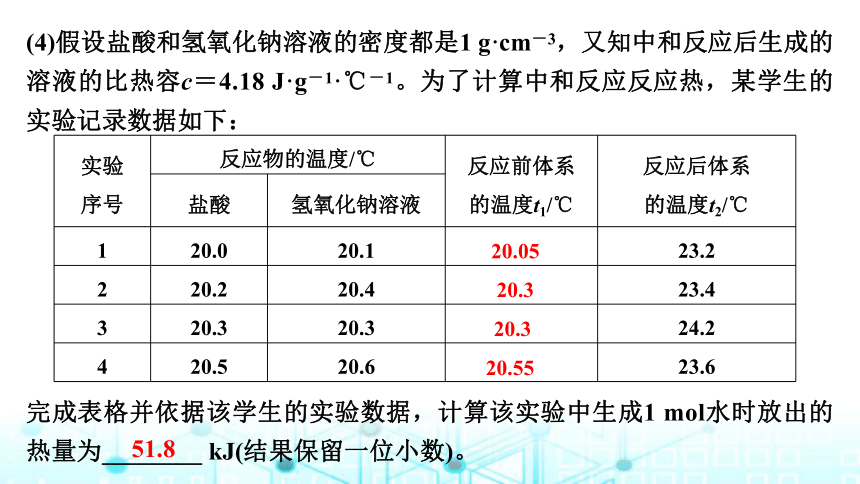
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成的溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和反应反应热,某学生的实验记录数据如下:
实验
序号 反应物的温度/℃ 反应前体系
的温度t1/℃ 反应后体系
的温度t2/℃
盐酸 氢氧化钠溶液
1 20.0 20.1 23.2
2 20.2 20.4 23.4
3 20.3 20.3 24.2
4 20.5 20.6 23.6
完成表格并依据该学生的实验数据,计算该实验中生成1 mol水时放出的热量为________ kJ(结果保留一位小数)。
20.05
20.3
20.3
20.55
51.8
四次实验(t2-t1)的值分别为3.15、3.1、3.9、3.05,第三次明显偏大,舍弃,则最终温度差平均值为第1、2、4组实验的温度差之和除以3,为
3.1,平均值代入公式 计算即可。
实验
序号 反应物的温度/℃ 反应前体系
的温度t1/℃ 反应后体系
的温度t2/℃
盐酸 氢氧化钠溶液
1 20.0 20.1 20.05 23.2
2 20.2 20.4 20.3 23.4
3 20.3 20.3 20.3 24.2
4 20.5 20.6 20.55 23.6
题后反思
返回
不考虑装置的隔热因素,能引起实验误差的因素有以下2个方面:
任务二 反应热与焓变
新知构建
1.宏观角度认识反应热
(1)内能:体系内物质的各种______的总和,受温度、压强和物质的聚集状态等影响。
(2)焓与焓变
注意:在等压条件下进行的化学反应,其反应热等于反应的焓变。
能量
生成物
反应物
kJ·mol-1
kJ/mol
H
(3)ΔH与吸热反应和放热反应
ΔH=________总能量-________总能量。
生成物
反应物
交流研讨
1.放热反应不需要加热就能反应,吸热反应不加热就不反应,对吗?
提示:不正确。反应放热还是吸热,与反应物和生成物具有的能量有关,与加热与否无必然关系。
2.做实验时,假如吸热反应和放热反应都用到酒精灯,怎样判断该反应是吸热反应还是放热反应?放热反应加热的目的是什么?
提示:持续用酒精灯加热,撤掉酒精灯反应就停止的反应是吸热反应;开始用酒精灯加热,反应开始后,撤去酒精灯仍能继续反应的是放热反应。放热反应加热的目的一般是加快反应速率。
2.微观角度理解反应热
H2(g)+Cl2(g)===2HCl(g)的能量变化如下图所示:
(键能:在25 ℃和101 kPa下,气态分子中1 mol化学键解离成气态原子所吸收的能量),请同学们讨论回答,该反应的焓变是多少?
提示:ΔH=(436+243) kJ·mol-1-(431+431) kJ·mol-1=-183 kJ·mol-1,ΔH=反应物总键能-生成物总键能。
思维建模
化学反应的实质和特征
特别提醒:化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因。
应用评价
1.判断正误,错误的说明其原因。
(1)化学变化中的能量变化都是化学能与热能间的相互转化。
________________________________________________________________________________________________________________________________
(2)伴有能量变化的一定是化学反应。
________________________________________________________________
(3)加热条件下发生的反应均为吸热反应。
________________________________________________________________
(4)浓硫酸溶于水时,体系的温度升高,该过程属于放热反应。
________________________________________________________________
错误;化学变化中的能量变化除了化学能与热能间的相互转化,还有与光能、电能等其他形式能的转化。
错误;伴有能量变化的不一定是化学反应,还可能是物理反应。
错误;加热条件下发生的反应也可以是放热反应。
错误;该反应是物理变化,不是化学反应。
(1)a、b、c分别代表什么意义?
a:____________________;
b:___________________;
c:________。
(2)该反应是________(填“放热”或“吸热”)反应,ΔH____(填“>”或“<”)0。
旧键断裂吸收的能量
新键形成放出的能量
反应热
放热
<
题后反思
1.ΔH=H(生成物)-H(反应物)。
2.ΔH=E(反应物的总键能)-E(生成物的总键能)。
3.ΔH>0为吸热反应,ΔH<0为放热反应。
返回
随堂演练
√
1.某同学通过实验测出稀盐酸和稀NaOH溶液(碱稍过量)中和反应的反应热ΔH=-52.3 kJ·mol-1,造成这一结果的原因不可能是
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入小烧杯中
D.用测量盐酸的温度计直接测定NaOH溶液的温度
若装置保温、隔热效果差,会造成较多的热量损失,测得的反应热偏大,A项可能;仰视读数时,实际量取的溶液体积多于应该量取的溶液体积,会导致放出的热量变多,此种情况下测得的ΔH<-57.3 kJ·mol-1,
B项不可能;C项操作会导致较多的热量损失,C项可能;D项操作会导致测得的NaOH溶液的初始温度偏高,最后计算出的反应放出的热量比实际放出的热量少,D项可能。
据条件知该反应是放热反应,只有D项酸与碱发生的中和反应属于放热反应,而A、B、C三项均为吸热反应。
√
2.下列反应中反应物总能量高于生成物总能量的是
A.二氧化碳与碳生成一氧化碳
B.碳与水蒸气生成一氧化碳和氢气
C.碳酸钙受热分解
D.盐酸与氢氧化钠溶液反应
3.化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是
A.每生成2 mol AB(g)吸收b kJ热量
B.反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A键和1 mol B—B键,放出a kJ能量
√
根据图像可知,反应物的总能量低于生
成物的总能量,该反应是吸热反应,每
生成2 mol AB(g)吸收(a-b) kJ热量,
A、C两项错误;根据反应热等于生成
物总能量与反应物总能量的差值可知,
该反应热ΔH=+(a-b) kJ·mol-1,B项正确;化学键断裂吸收能量,D项错误。
4.铝热反应是以铝粉和氧化铁为主要反应物的放热反应。当温度超过1 250 ℃时,铝粉剧烈氧化,燃烧而放出大量热。这种放热反应的温度可达3 000 ℃以上。铝热反应非常迅速,作用时间短。加入硅铁粉时,可使作用缓和,利于延长作用的时间。为用于浇注温度为1 000~1 100 ℃左右的铜合金铸件,可再加少量氧化剂,如硝酸钠、硝酸钾等;还可加入镁作为点火剂,使其在较低温度下发生化学反应。该反应经常用于焊接钢轨,冶炼金属。
(1)阅读材料思考,该反应是吸热反应还是放热反应?放热反应是否不需要加热就能发生呢?
答案:铝热反应为放热反应 铝热反应需要在高温下引发,因此放热反应有时也需要加热才能发生。
(2)写出铝与氧化铁反应的方程式,并用图示表示反应物与生成物能量的相对大小。
答案:2Al+Fe2O3 Al2O3+2Fe
图示:
=====
高温
返回
课时测评
√
题点一 中和反应反应热及其测定
1.已知中和热的数值是57.3 kJ/mol。下列反应物混合时,产生的热量等于57.3 kJ的是
A.1 mol/L稀HCl(aq)和1 mol/L稀NaOH(aq)
B.500 mL 2.0 mol/L的HCl(aq)和500 mL 2.1 mol/L的NaOH(aq)
C.500 mL 2.0 mol/L的CH3COOH(aq)和500 mL 2.0 mol/L的NaOH(aq)
D.1 mol/L稀CH3COOH(aq)和1 mol/L稀NaOH(aq)
只知道酸和碱的浓度,但是不知道溶液的体积,无法确定生成水的量的多少,也无法确定放热多少,故A不符合题意;500 mL 2.0 mol/L的HCl(aq)的物质的量为2.0 mol/L×0.5 L=1 mol,500 mL 2.1 mol/L的NaOH(aq)的物质的量为2.1 mol/L×0.5 L=1.05 mol,NaOH(aq)过量,HCl(aq)完全反应,反应生成的水的物质的量是1 mol,放出的热量是为57.3 kJ,故B符合题意;500 mL 2.0 mol/L的CH3COOH(aq)的物质的量为2.0 mol/L×0.5 L=1 mol,500 mL 2.0 mol/L的NaOH(aq)的物质的量为2.0 mol/L×0.5 L=
1 mol,反应生成的水的物质的量是1 mol,但是醋酸是弱酸,弱酸电离吸热,放出的热量小于57.3 kJ,故C不符合题意;只知道酸和碱的浓度,但是不知道溶液的体积,无法确定生成水的量的多少,也无法确定放热多少,并且醋酸是弱酸,弱酸电离吸热,故D不符合题意; 答案选B。
√
2.某同学设计如图所示实验,探究反应中的能量变化。
下列判断正确的是
A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验(c)中将环形玻璃搅拌棒改为铁质搅拌器,则测定数值偏低
D.若用NaOH固体代替NaOH溶液与盐酸反应测定中和反应的反应热,测定数值不变
金属与酸的反应、中和反应为放热反应,氢氧化钡晶体和氯化铵固体的反应为吸热反应,即(a)、(c)所涉及的反应是放热反应,A错误;相同质量的铝片和铝粉与酸反应放出的热量相同,B错误;铁制搅拌器导热效果好,会损失部分热量,导致测定的放出的热量数值偏小,C正确;氢氧化钠固体溶于水放热,测定的数值偏大,D错误;故选C。
√
化学反应的能量变化可以表现为很多方面,如转化为热能、电能、光能等,A错误;在一个确定的化学反应关系中,反应物的总焓不一定高于生成物的总焓,但总是不同,C正确,D错误;焓变是指在一定条件下化学反应的反应热,不仅仅指 1 mol 物质参加反应时的能量变化,B错误。
题点二 焓变和反应热概念的理解
3.(2023·巴楚县第一中学高二期末)下列说法正确的是
A.化学反应中的能量变化都表现为热量变化
B.焓变是指1 mol物质参加反应时的能量变化
C.在一个确定的化学反应关系中,反应物的总焓与生成物的总焓一定不同
D.在一个确定的化学反应关系中,反应物的总焓总是高于生成物的总焓
4.某学生用如图所示装置进行化学反应X+2Y===2Z
能量变化情况的研究。当向试管中滴加试剂Y时,观察
到U形管中液面甲处下降、乙处上升。下列关于该反应
的叙述正确的是
①该反应为放热反应 ②该反应为吸热反应 ③生成物的总能量比反应物的总能量高 ④反应物的总能量比生成物的总能量高 ⑤该反应过程可以看成贮存于X、Y内部的部分能量转化为热能而释放出来
A.①④⑤ B.①④
C.①③ D.②③⑤
√
当向试管中加入试剂Y时,看到U形管中液面甲处下降、
乙处上升,说明该反应为放热反应,放出的热使集气瓶
中的气体膨胀而出现该现象,故①正确;在放热反应中,
反应物的总能量高于生成物的总能量,故④正确;该反
应过程可以看成贮存于X、Y内部的部分能量转化为热能而释放出来,故⑤正确。综上所述,A项符合题意。
√
NaOH固体溶于水是物理变化,不属于放热反应,①不选;石灰石分解是吸热反应,③不选;NH4Cl与Ba(OH)2·8H2O混合反应是吸热反应,⑥不选。
√
6.(2023·信阳高二检测)化学反应原理的研究始终与物质变化、能量变化紧密相连,过程中释放或吸收的能量在生产、生活和科学研究中具有广泛的应用。下列变化过程中,属于放热反应的是
①NaOH固体溶于水 ②燃烧木炭取暖 ③煅烧石灰石制生石灰 ④铝热反应 ⑤酸与碱的中和反应 ⑥NH4Cl与Ba(OH)2·8H2O混合搅拌
A.①③⑥ B.①④⑤
C.②③④ D.②④⑤
√
题点四 反应热与化学键的关系
7.(2023·四川峨眉山高二期中)H2与O2发生反应的过程用模型图示意如下(“-”表示化学键),下列说法不正确的是
A.过程 Ⅰ 是吸热过程
B.该反应过程中所有旧化学键都断裂,且形成了新化学键
C.过程Ⅲ一定是放热过程
D.该反应的能量转化形式只能以热能的形式进行
过程Ⅰ分子中化学键断裂形成原子,属于吸热过程,故A正确;过程Ⅰ中所有旧化学键均断裂,过程Ⅲ为新化学键形成的过程,故B正确;过程Ⅲ为新化学键形成的过程,是放热过程,故C正确。
8.H2和I2在一定条件下发生反应H2(g)+I2(g) 2HI(g) ΔH=-a kJ·mol-1,
反应过程如图所示。已知a、b、c均大于零。
下列说法不正确的是
A.反应物的总能量高于生成物的总能量
B.断开1 mol H—H键和1 mol I—I键所需能量大于断开2 mol H—I键所需能量
C.断开2 mol H—I键所需能量约为(c+b+a) kJ
D.向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
√
√
题点五 能量变化图像
9.石墨在一定条件下能转化为金刚石,其能量变化如图所示,其中E1=393.5 kJ/mol,E2=395.4 kJ/mol,下列说法正确的是
A.石墨转化为金刚石属于物理变化
B.金刚石能量比石墨能量高 1.9 kJ/mol
C.金刚石的稳定性强于石墨
D.E1表示1 mol C(s,石墨)所具有的总能量
石墨与金刚石的结构不同,则石墨转化为金
刚石属于化学变化,A说法错误;根据图像
可知,C(s,石墨)===C(s,金刚石) ΔH=
+1.9 kJ/mol,则金刚石能量比石墨能量高
1.9 kJ/mol,B说法正确;相同量的金刚石
具有的能量高于石墨,则石墨的稳定性强于金刚石,C说法错误;E1表示1 mol C(s,石墨)完全生成二氧化碳气体时,所释放的总能量,D说法错误;答案为B。
1 mol I2(g)和1 mol H2(g)反应生成2 mol HI(g)放出12 kJ能量,该反应为放热反应,D项错误。
√
10.关于下图的说法不正确的是
A.1 mol固态碘与1 mol氢气化合生成2 mol HI气体时,需要吸收5 kJ的能量
B.2 mol HI气体分解生成1 mol碘蒸气与1 mol氢气时需要吸收12 kJ的能量
C.1 mol固态碘变为1 mol碘蒸气时需要吸收17 kJ的能量
D.碘蒸气与氢气反应生成HI气体的反应是吸热反应
11.二氧化碳是一种常见的气体,它不仅是绿色植物光合作用不可缺少的原料,而且在生产、生活中都有重要的用途。近年来,由于人类活动(如化石燃料燃烧)影响,二氧化碳含量逐渐增长,出现温室效应、全球气候变暖、冰川融化等恶劣现象,对二氧化碳的回收利用显得尤为重要。
Ⅰ.(1)已知工业上采用高温煅烧石灰石的方法来制备CO2,其反应的化学方程式为____________________________;该反应是______(填“吸热”或“放热”)反应。
根据信息高温煅烧石灰石制备CO2,可写出CaCO3 CaO+CO2↑,该反应为分解反应,反应吸热。
====
高温
吸热
CaCO3 CaO+CO2↑
=====
高温
Ⅱ.已知CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)===CH2=CH2(g)+4H2O(g)。
(2)几种物质的能量如表所示(在25 ℃、101 kPa条件下,规定单质的能量为0,测得其他物质生成时的反应热为其具有的能量):
则该反应的ΔH=________ kJ·mol-1。
物质 CO2(g) H2(g) CH2==CH2(g) H2O(g)
能量/ (kJ·mol-1) -394 0 52 -242
-128
ΔH=E(生成物能量总和)-E(反应物能量总和)=(52-242×4-0+394×2) kJ·mol-1=-128 kJ·mol-1。
(3)几种化学键的键能如表所示:
则a=________。
化学键 C=O H—H C=C C—H H—O
能量/(kJ·mol-1) 803 436 615 a 463
ΔH=E(反应物键能总和)-E(生成物键能总和)=(803×4+436×6-615-4a-463×8) kJ·mol-1=-128 kJ·mol-1,解得a=409.25。
409.25
返回
第1课时 反应热 焓变
第一章 第一节 反应热
1.知道内能是体系内物质的各种能量的总和,受温度、压强、物质 的聚集状态的影响。
2.认识化学能与热能的相互转化,恒温恒压条件下化学反应的反应 热可以用焓变表示。
3.能辨识化学反应中的能量转化形式,能解释化学反应中能量变化 的本质。变表
课程标准
任务一 反应热及其测定
新知构建
1.体系与环境
以研究盐酸与NaOH溶液的反应为例,我们将试
管中的盐酸、NaOH溶液及发生的反应等看作一
个反应______,简称体系(又称______),盛溶液
的试管和溶液之外的空气等看作______。
2.反应热
因温度不同而在体系与环境之间交换或传递的能量是______。
在等温条件下,化学反应体系向环境______或从环境______的热量,称为化学反应的热效应,简称________。
体系
系统
环境
热量
释放
吸收
反应热
3.中和反应反应热的测定
某同学根据课本的实验获得实验数据如下表,请填写下表中的空白,并思考以下问题。
温度
实验 起始温度t1/℃ 终止温度t2/℃ 温度差(t2-t1)/℃ 温度差平
均值/℃
盐酸 NaOH溶液 平均值
1 26.2 26.0 26.1 29.5 3.4 ______
2 27.0 27.4 27.2 32.3 5.1
3 25.9 25.9 25.9 29.2 3.3
4 26.4 26.2 26.3 29.8 3.5
交流研讨
3.4
提示:本实验应先求终止温度和起始温度的差值,再取平均值,以便发现差别较大的数据。若某数据与其他数据相差太大,应舍去。
1.能否用浓硫酸代替盐酸?对结果会产生什么影响?
提示:不能。浓硫酸溶解于水时放热,所测数值会偏大。
2.能否将NaOH分多次倒入量热计中?
提示:不能。操作时动作要快,尽量减少热量的散失。
温度
实验 起始温度t1/℃ 终止温度
t2/℃ 温度差(t2-t1)/℃ 温度差平均值/℃
盐酸 NaOH溶液 平均值
1 26.2 26.0 26.1 29.5 3.4 3.4
2 27.0 27.4 27.2 32.3 5.1
3 25.9 25.9 25.9 29.2 3.3
4 26.4 26.2 26.3 29.8 3.5
归纳总结
1.为了保证盐酸完全被中和,采用稍过量的NaOH溶液。
2.测量完盐酸的温度后,温度计应冲洗干净并擦干。
3.酸、碱溶液一次迅速混合。
应用评价
1.判断正误,错误的说明其原因。
(1)浓硫酸与NaOH溶液反应生成1 mol H2O(l),放出的热量为57.3 kJ。
________________________________________________________________________________________________________________________________
错误;因为浓硫酸稀释要放热,所以浓硫酸与NaOH溶液反应生成1 mol H2O(l),放出的热量大于57.3 kJ。
(2)同一中和反应中生成1 mol H2O(l)的反应热与酸碱的用量有关。
________________________________________________________________________________________________________________________________
错误;同一中和反应中既然是生成1 mol H2O(l)的反应热,酸碱的量就固定了。
(3)中和反应反应热的测定实验中的玻璃搅拌器换成铜质搅拌器效果更好。
________________________________________________________________
(4)中和反应反应热的测定实验中,应将50 mL 0.55 mol·L-1 NaOH溶液分多次倒入小烧杯。
________________________________________________________________________________________________________________________________
错误;铜质搅拌器的导热性好,容易造成热量损失,使测量结果偏小。
错误;中和反应反应热的测定实验中,应将50 mL 0.55 mol·L-1 NaOH溶液一次倒入小烧杯,避免热量损失。
2.50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH
溶液在如图所示的装置中进行中和反应。通过测定反应过程
中所放出的热量可计算中和反应反应热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是____________。
(2)隔热层的作用是___________________________。
(3)倒入NaOH溶液的正确操作是______(填字母)。
a.沿玻璃棒缓慢倒入
b.分三次少量倒入
c.一次迅速倒入
玻璃搅拌器
减少实验过程中的热量损失
c
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成的溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和反应反应热,某学生的实验记录数据如下:
实验
序号 反应物的温度/℃ 反应前体系
的温度t1/℃ 反应后体系
的温度t2/℃
盐酸 氢氧化钠溶液
1 20.0 20.1 23.2
2 20.2 20.4 23.4
3 20.3 20.3 24.2
4 20.5 20.6 23.6
完成表格并依据该学生的实验数据,计算该实验中生成1 mol水时放出的热量为________ kJ(结果保留一位小数)。
20.05
20.3
20.3
20.55
51.8
四次实验(t2-t1)的值分别为3.15、3.1、3.9、3.05,第三次明显偏大,舍弃,则最终温度差平均值为第1、2、4组实验的温度差之和除以3,为
3.1,平均值代入公式 计算即可。
实验
序号 反应物的温度/℃ 反应前体系
的温度t1/℃ 反应后体系
的温度t2/℃
盐酸 氢氧化钠溶液
1 20.0 20.1 20.05 23.2
2 20.2 20.4 20.3 23.4
3 20.3 20.3 20.3 24.2
4 20.5 20.6 20.55 23.6
题后反思
返回
不考虑装置的隔热因素,能引起实验误差的因素有以下2个方面:
任务二 反应热与焓变
新知构建
1.宏观角度认识反应热
(1)内能:体系内物质的各种______的总和,受温度、压强和物质的聚集状态等影响。
(2)焓与焓变
注意:在等压条件下进行的化学反应,其反应热等于反应的焓变。
能量
生成物
反应物
kJ·mol-1
kJ/mol
H
(3)ΔH与吸热反应和放热反应
ΔH=________总能量-________总能量。
生成物
反应物
交流研讨
1.放热反应不需要加热就能反应,吸热反应不加热就不反应,对吗?
提示:不正确。反应放热还是吸热,与反应物和生成物具有的能量有关,与加热与否无必然关系。
2.做实验时,假如吸热反应和放热反应都用到酒精灯,怎样判断该反应是吸热反应还是放热反应?放热反应加热的目的是什么?
提示:持续用酒精灯加热,撤掉酒精灯反应就停止的反应是吸热反应;开始用酒精灯加热,反应开始后,撤去酒精灯仍能继续反应的是放热反应。放热反应加热的目的一般是加快反应速率。
2.微观角度理解反应热
H2(g)+Cl2(g)===2HCl(g)的能量变化如下图所示:
(键能:在25 ℃和101 kPa下,气态分子中1 mol化学键解离成气态原子所吸收的能量),请同学们讨论回答,该反应的焓变是多少?
提示:ΔH=(436+243) kJ·mol-1-(431+431) kJ·mol-1=-183 kJ·mol-1,ΔH=反应物总键能-生成物总键能。
思维建模
化学反应的实质和特征
特别提醒:化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因。
应用评价
1.判断正误,错误的说明其原因。
(1)化学变化中的能量变化都是化学能与热能间的相互转化。
________________________________________________________________________________________________________________________________
(2)伴有能量变化的一定是化学反应。
________________________________________________________________
(3)加热条件下发生的反应均为吸热反应。
________________________________________________________________
(4)浓硫酸溶于水时,体系的温度升高,该过程属于放热反应。
________________________________________________________________
错误;化学变化中的能量变化除了化学能与热能间的相互转化,还有与光能、电能等其他形式能的转化。
错误;伴有能量变化的不一定是化学反应,还可能是物理反应。
错误;加热条件下发生的反应也可以是放热反应。
错误;该反应是物理变化,不是化学反应。
(1)a、b、c分别代表什么意义?
a:____________________;
b:___________________;
c:________。
(2)该反应是________(填“放热”或“吸热”)反应,ΔH____(填“>”或“<”)0。
旧键断裂吸收的能量
新键形成放出的能量
反应热
放热
<
题后反思
1.ΔH=H(生成物)-H(反应物)。
2.ΔH=E(反应物的总键能)-E(生成物的总键能)。
3.ΔH>0为吸热反应,ΔH<0为放热反应。
返回
随堂演练
√
1.某同学通过实验测出稀盐酸和稀NaOH溶液(碱稍过量)中和反应的反应热ΔH=-52.3 kJ·mol-1,造成这一结果的原因不可能是
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入小烧杯中
D.用测量盐酸的温度计直接测定NaOH溶液的温度
若装置保温、隔热效果差,会造成较多的热量损失,测得的反应热偏大,A项可能;仰视读数时,实际量取的溶液体积多于应该量取的溶液体积,会导致放出的热量变多,此种情况下测得的ΔH<-57.3 kJ·mol-1,
B项不可能;C项操作会导致较多的热量损失,C项可能;D项操作会导致测得的NaOH溶液的初始温度偏高,最后计算出的反应放出的热量比实际放出的热量少,D项可能。
据条件知该反应是放热反应,只有D项酸与碱发生的中和反应属于放热反应,而A、B、C三项均为吸热反应。
√
2.下列反应中反应物总能量高于生成物总能量的是
A.二氧化碳与碳生成一氧化碳
B.碳与水蒸气生成一氧化碳和氢气
C.碳酸钙受热分解
D.盐酸与氢氧化钠溶液反应
3.化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是
A.每生成2 mol AB(g)吸收b kJ热量
B.反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A键和1 mol B—B键,放出a kJ能量
√
根据图像可知,反应物的总能量低于生
成物的总能量,该反应是吸热反应,每
生成2 mol AB(g)吸收(a-b) kJ热量,
A、C两项错误;根据反应热等于生成
物总能量与反应物总能量的差值可知,
该反应热ΔH=+(a-b) kJ·mol-1,B项正确;化学键断裂吸收能量,D项错误。
4.铝热反应是以铝粉和氧化铁为主要反应物的放热反应。当温度超过1 250 ℃时,铝粉剧烈氧化,燃烧而放出大量热。这种放热反应的温度可达3 000 ℃以上。铝热反应非常迅速,作用时间短。加入硅铁粉时,可使作用缓和,利于延长作用的时间。为用于浇注温度为1 000~1 100 ℃左右的铜合金铸件,可再加少量氧化剂,如硝酸钠、硝酸钾等;还可加入镁作为点火剂,使其在较低温度下发生化学反应。该反应经常用于焊接钢轨,冶炼金属。
(1)阅读材料思考,该反应是吸热反应还是放热反应?放热反应是否不需要加热就能发生呢?
答案:铝热反应为放热反应 铝热反应需要在高温下引发,因此放热反应有时也需要加热才能发生。
(2)写出铝与氧化铁反应的方程式,并用图示表示反应物与生成物能量的相对大小。
答案:2Al+Fe2O3 Al2O3+2Fe
图示:
=====
高温
返回
课时测评
√
题点一 中和反应反应热及其测定
1.已知中和热的数值是57.3 kJ/mol。下列反应物混合时,产生的热量等于57.3 kJ的是
A.1 mol/L稀HCl(aq)和1 mol/L稀NaOH(aq)
B.500 mL 2.0 mol/L的HCl(aq)和500 mL 2.1 mol/L的NaOH(aq)
C.500 mL 2.0 mol/L的CH3COOH(aq)和500 mL 2.0 mol/L的NaOH(aq)
D.1 mol/L稀CH3COOH(aq)和1 mol/L稀NaOH(aq)
只知道酸和碱的浓度,但是不知道溶液的体积,无法确定生成水的量的多少,也无法确定放热多少,故A不符合题意;500 mL 2.0 mol/L的HCl(aq)的物质的量为2.0 mol/L×0.5 L=1 mol,500 mL 2.1 mol/L的NaOH(aq)的物质的量为2.1 mol/L×0.5 L=1.05 mol,NaOH(aq)过量,HCl(aq)完全反应,反应生成的水的物质的量是1 mol,放出的热量是为57.3 kJ,故B符合题意;500 mL 2.0 mol/L的CH3COOH(aq)的物质的量为2.0 mol/L×0.5 L=1 mol,500 mL 2.0 mol/L的NaOH(aq)的物质的量为2.0 mol/L×0.5 L=
1 mol,反应生成的水的物质的量是1 mol,但是醋酸是弱酸,弱酸电离吸热,放出的热量小于57.3 kJ,故C不符合题意;只知道酸和碱的浓度,但是不知道溶液的体积,无法确定生成水的量的多少,也无法确定放热多少,并且醋酸是弱酸,弱酸电离吸热,故D不符合题意; 答案选B。
√
2.某同学设计如图所示实验,探究反应中的能量变化。
下列判断正确的是
A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验(c)中将环形玻璃搅拌棒改为铁质搅拌器,则测定数值偏低
D.若用NaOH固体代替NaOH溶液与盐酸反应测定中和反应的反应热,测定数值不变
金属与酸的反应、中和反应为放热反应,氢氧化钡晶体和氯化铵固体的反应为吸热反应,即(a)、(c)所涉及的反应是放热反应,A错误;相同质量的铝片和铝粉与酸反应放出的热量相同,B错误;铁制搅拌器导热效果好,会损失部分热量,导致测定的放出的热量数值偏小,C正确;氢氧化钠固体溶于水放热,测定的数值偏大,D错误;故选C。
√
化学反应的能量变化可以表现为很多方面,如转化为热能、电能、光能等,A错误;在一个确定的化学反应关系中,反应物的总焓不一定高于生成物的总焓,但总是不同,C正确,D错误;焓变是指在一定条件下化学反应的反应热,不仅仅指 1 mol 物质参加反应时的能量变化,B错误。
题点二 焓变和反应热概念的理解
3.(2023·巴楚县第一中学高二期末)下列说法正确的是
A.化学反应中的能量变化都表现为热量变化
B.焓变是指1 mol物质参加反应时的能量变化
C.在一个确定的化学反应关系中,反应物的总焓与生成物的总焓一定不同
D.在一个确定的化学反应关系中,反应物的总焓总是高于生成物的总焓
4.某学生用如图所示装置进行化学反应X+2Y===2Z
能量变化情况的研究。当向试管中滴加试剂Y时,观察
到U形管中液面甲处下降、乙处上升。下列关于该反应
的叙述正确的是
①该反应为放热反应 ②该反应为吸热反应 ③生成物的总能量比反应物的总能量高 ④反应物的总能量比生成物的总能量高 ⑤该反应过程可以看成贮存于X、Y内部的部分能量转化为热能而释放出来
A.①④⑤ B.①④
C.①③ D.②③⑤
√
当向试管中加入试剂Y时,看到U形管中液面甲处下降、
乙处上升,说明该反应为放热反应,放出的热使集气瓶
中的气体膨胀而出现该现象,故①正确;在放热反应中,
反应物的总能量高于生成物的总能量,故④正确;该反
应过程可以看成贮存于X、Y内部的部分能量转化为热能而释放出来,故⑤正确。综上所述,A项符合题意。
√
NaOH固体溶于水是物理变化,不属于放热反应,①不选;石灰石分解是吸热反应,③不选;NH4Cl与Ba(OH)2·8H2O混合反应是吸热反应,⑥不选。
√
6.(2023·信阳高二检测)化学反应原理的研究始终与物质变化、能量变化紧密相连,过程中释放或吸收的能量在生产、生活和科学研究中具有广泛的应用。下列变化过程中,属于放热反应的是
①NaOH固体溶于水 ②燃烧木炭取暖 ③煅烧石灰石制生石灰 ④铝热反应 ⑤酸与碱的中和反应 ⑥NH4Cl与Ba(OH)2·8H2O混合搅拌
A.①③⑥ B.①④⑤
C.②③④ D.②④⑤
√
题点四 反应热与化学键的关系
7.(2023·四川峨眉山高二期中)H2与O2发生反应的过程用模型图示意如下(“-”表示化学键),下列说法不正确的是
A.过程 Ⅰ 是吸热过程
B.该反应过程中所有旧化学键都断裂,且形成了新化学键
C.过程Ⅲ一定是放热过程
D.该反应的能量转化形式只能以热能的形式进行
过程Ⅰ分子中化学键断裂形成原子,属于吸热过程,故A正确;过程Ⅰ中所有旧化学键均断裂,过程Ⅲ为新化学键形成的过程,故B正确;过程Ⅲ为新化学键形成的过程,是放热过程,故C正确。
8.H2和I2在一定条件下发生反应H2(g)+I2(g) 2HI(g) ΔH=-a kJ·mol-1,
反应过程如图所示。已知a、b、c均大于零。
下列说法不正确的是
A.反应物的总能量高于生成物的总能量
B.断开1 mol H—H键和1 mol I—I键所需能量大于断开2 mol H—I键所需能量
C.断开2 mol H—I键所需能量约为(c+b+a) kJ
D.向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
√
√
题点五 能量变化图像
9.石墨在一定条件下能转化为金刚石,其能量变化如图所示,其中E1=393.5 kJ/mol,E2=395.4 kJ/mol,下列说法正确的是
A.石墨转化为金刚石属于物理变化
B.金刚石能量比石墨能量高 1.9 kJ/mol
C.金刚石的稳定性强于石墨
D.E1表示1 mol C(s,石墨)所具有的总能量
石墨与金刚石的结构不同,则石墨转化为金
刚石属于化学变化,A说法错误;根据图像
可知,C(s,石墨)===C(s,金刚石) ΔH=
+1.9 kJ/mol,则金刚石能量比石墨能量高
1.9 kJ/mol,B说法正确;相同量的金刚石
具有的能量高于石墨,则石墨的稳定性强于金刚石,C说法错误;E1表示1 mol C(s,石墨)完全生成二氧化碳气体时,所释放的总能量,D说法错误;答案为B。
1 mol I2(g)和1 mol H2(g)反应生成2 mol HI(g)放出12 kJ能量,该反应为放热反应,D项错误。
√
10.关于下图的说法不正确的是
A.1 mol固态碘与1 mol氢气化合生成2 mol HI气体时,需要吸收5 kJ的能量
B.2 mol HI气体分解生成1 mol碘蒸气与1 mol氢气时需要吸收12 kJ的能量
C.1 mol固态碘变为1 mol碘蒸气时需要吸收17 kJ的能量
D.碘蒸气与氢气反应生成HI气体的反应是吸热反应
11.二氧化碳是一种常见的气体,它不仅是绿色植物光合作用不可缺少的原料,而且在生产、生活中都有重要的用途。近年来,由于人类活动(如化石燃料燃烧)影响,二氧化碳含量逐渐增长,出现温室效应、全球气候变暖、冰川融化等恶劣现象,对二氧化碳的回收利用显得尤为重要。
Ⅰ.(1)已知工业上采用高温煅烧石灰石的方法来制备CO2,其反应的化学方程式为____________________________;该反应是______(填“吸热”或“放热”)反应。
根据信息高温煅烧石灰石制备CO2,可写出CaCO3 CaO+CO2↑,该反应为分解反应,反应吸热。
====
高温
吸热
CaCO3 CaO+CO2↑
=====
高温
Ⅱ.已知CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)===CH2=CH2(g)+4H2O(g)。
(2)几种物质的能量如表所示(在25 ℃、101 kPa条件下,规定单质的能量为0,测得其他物质生成时的反应热为其具有的能量):
则该反应的ΔH=________ kJ·mol-1。
物质 CO2(g) H2(g) CH2==CH2(g) H2O(g)
能量/ (kJ·mol-1) -394 0 52 -242
-128
ΔH=E(生成物能量总和)-E(反应物能量总和)=(52-242×4-0+394×2) kJ·mol-1=-128 kJ·mol-1。
(3)几种化学键的键能如表所示:
则a=________。
化学键 C=O H—H C=C C—H H—O
能量/(kJ·mol-1) 803 436 615 a 463
ΔH=E(反应物键能总和)-E(生成物键能总和)=(803×4+436×6-615-4a-463×8) kJ·mol-1=-128 kJ·mol-1,解得a=409.25。
409.25
返回
