人教版高中化学必修第一册第二章海水中的重要元素钠和氯第三节第1课时物质的量摩尔质量课件(46页ppt)
文档属性
| 名称 | 人教版高中化学必修第一册第二章海水中的重要元素钠和氯第三节第1课时物质的量摩尔质量课件(46页ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-10 09:06:49 | ||
图片预览










文档简介
(共46张PPT)
第1课时 物质的量 摩尔质量
第二章 第三节 物质的量
1.了解物质的量及其单位、阿伏加德罗常数、摩尔质量的含义与应用。
2.能从物质的量的角度认识物质的组成及变化,建立物质的量、物质的质量和微观粒子数之间计算的思维模型。
学习目标
任务一 物质的量的单位——摩尔
新知构建
1.物质的量
(1)物质的量:表示含有____________的集合体的物理量,用符号n表示。
(2)物质的量的单位——摩尔
一定数目粒子
mol
6.02×1023
分子
离子
原子
(3)表示方法及含义
如1 mol H指1 mol________,1 mol H2(氢气)指1 mol___________,不能说1 mol氢,指代不明确。
氢原子
氢分子
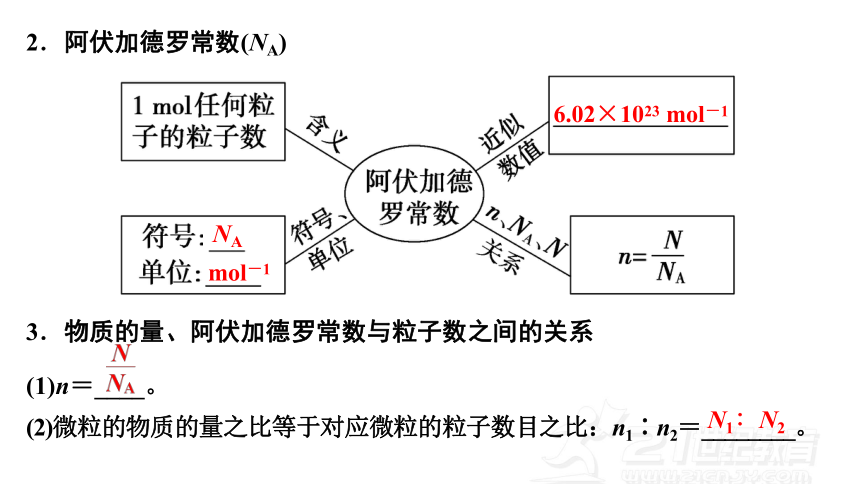
2.阿伏加德罗常数(NA)
3.物质的量、阿伏加德罗常数与粒子数之间的关系
(1)n=____。
(2)微粒的物质的量之比等于对应微粒的粒子数目之比:n1∶n2=________。
N1∶N2
NA
mol-1
6.02×1023 mol-1
交流研讨
(1)通过下图可进一步认识水的组成,并理解物质的量与微粒数目的关系。
1.204×1024
6.02×1023
2 mol
1 mol
(2)运用物质的量与微粒数目的关系,分析下列问题。
①0.3 mol H2O中含 mol原子,含 个电子。
②若测得某Na2SO4溶液中含有0.5 mol SO ,则溶液中含有 mol Na+。
③1 mol Na2SO4中含有Na+的数目是 ,
与其含有相同Na+数目的NaCl的物质的量为 。
0.9
1.806×1024
1
1.204×1024
2 mol
典题应用
1.正误判断,错误的说明原因。
(1)物质的量描述的对象是分子、原子等微观粒子: 。
(2)1 mol任何粒子所含有的粒子数相等: 。
(3)摩尔是国际单位制中七个基本物理量之一:_______________________
。
(4)阿伏加德罗常数就是6.02×1023:_________________________________
。
正确
正确
错误。物质的量是国际单位制中七个基本物理量之一,摩尔是物质的量的单位
错误。阿伏加德罗常数通常用6.02×
1023mol-1表示,其单位为mol-1
2.指出下列表述中的错误。
(1)0.5 mol H2O中含有1 mol H+: 。
(2)1 mol 氧: 。
(3)0.5 mol氢元素: 。
3.(1) 个 CO2含有0.5 mol氧原子。
(2) mol NH3与0.3 mol H2O中所含H原子一样多。
0.5 mol H2O中含1 mol氢原子
没有指明氧原子或氧分子,正确应为1 mol O或1 mol O2
元素不属于微粒,不能用“摩尔”表示
1.505×1023
0.2
返回
任务二 摩尔质量
新知构建
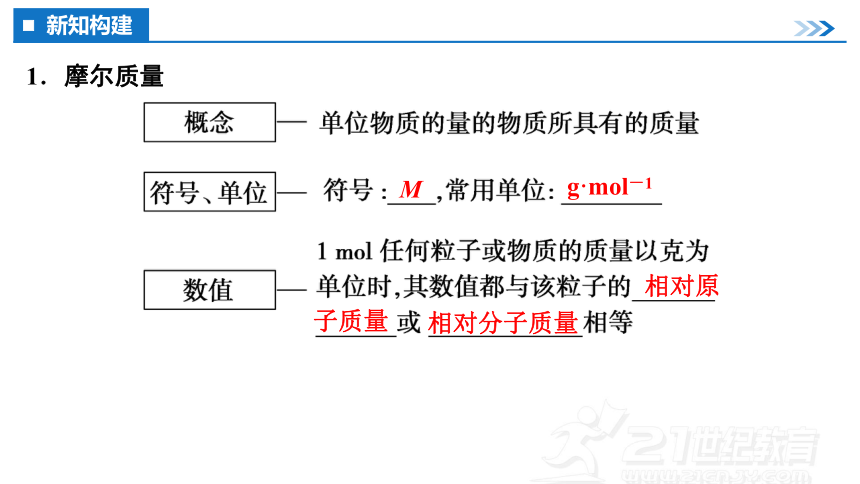
1.摩尔质量
M
g·mol-1
相对原
相对分子质量
子质量
新知构建
2.物质的量(n)、质量(m)和摩尔质量(M)之间的关系
(1)n=____。
(2)同一物质,物质的量之比等于质量之比:n1∶n2=________。
m1∶m2
交流研讨
(1)探究摩尔质量与相对原子(分子)质量之间的区别与联系。
提示:①摩尔质量与1 mol粒子的质量含义不同,但有一定的联系。例如,H2O的摩尔质量为18 g·mol-1,1 mol H2O的质量是18 g。
②当摩尔质量的单位取“g·mol-1”时,其数值与相对原子质量或相对分子质量相等,但物理意义、单位都不同,在计算或使用时要注意区分。例如,Mr(H2O)=18,M(H2O)=18 g·mol-1。
(2)结合下列问题,总结摩尔质量的计算方法。
①已知氨气的相对分子质量为17,则氨气的摩尔质量为 。
②1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为 。
③已知一个铁原子的质量为b g,则铁的摩尔质量为 。
④NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为 。
17 g·mol-1
64 g·mol-1
bNA g·mol-1
归纳总结
计算摩尔质量的三种方法
1.已知任意状态物质的质量时:M= (定义式)。
2.已知一个分子的质量时:M=m(分子)×NA。
3.已知一个分子的质量和一个12C原子的质量时:M= ×
12 g·mol-1。
典题应用
(1)9 g H2O的物质的量为 ,含有的氢原子数为 。
(2)3.01×1023个H2SO4分子的物质的量为 ,质量为 。
(3)0.5 mol H2SO4分子中N(H)= ,N(O)= 。
(4)Fe的摩尔质量为56 g·mol-1,则1个Fe原子质量为___________________
(列式)。
0.5 mol
6.02×1023
0.5 mol
49 g
6.02×1023
1.204×1024
返回
随堂达标演练
√
1.(2023·郑州管城区高一检测)摩尔起源于希腊文mole,原意为“堆量”,是在1971年10月,由41个国家参加的第14届国际计量大会上决定增加的国际单位制(SI)的第七个基本单位。下列关于“摩尔”的理解正确的是
A.摩尔是国际科学界建议采用的一种物理量
B.摩尔是物质的量的单位,简称摩,符号为mol
C.我们把含有6.02×1023个粒子的任何粒子的集合体计量为1摩尔
D.1 mol氧含6.02×1023个O2
摩尔只是物质的量这一物理量的单位,不是一种物理量,A错误;含6.02×1023个粒子的集合体不一定计量为1摩尔,如含6.02×1023个氧原子的O2的物质的量是0.5 mol,C错误;1 mol氧含义不明确,应说1 mol O2含6.02×1023个氧分子,D错误。
√
2.碳中和指控制一段时间内温室气体排放总量,实现CO2“零排放”。CO2的摩尔质量为
A.12 B.44 g·mol-1
C.12 g·mol-1 D.44
摩尔质量的单位是g/mol,质量单位是g,故A、B、C项错误,D项正确。
√
3.下列叙述正确的是
A.1 mol O的质量是32 g·mol-1
B.OH-的摩尔质量是17 g
C.1 mol H2O的质量是18 g·mol-1
D.CO2的摩尔质量是44 g·mol-1
4.(2023·山东济阳高一段考)已知硫酸中含有3.01×1023个氧原子,硫酸的物质的量是
A.0.500 mol B.1.00 mol
C.0.250 mol D.0.125 mol
√
(2)CO的质量为 。
5.已知0.4 mol CO和CO2的混合气体共14.4 g,则
(1)混合气体的平均摩尔质量为 ;
36 g·mol-1
5.6 g
设混合气体中CO的物质的量为x mol,CO2的物质的量为y mol,则28 g·mol-1×x mol+44 g·mol-1×y mol=14.4 g,x mol+y mol=0.4 mol,解得x=0.2,y=0.2,则m(CO)=0.2 mol×28 g·mol-1=5.6 g。
返回
课时测评
√
题点一 物质的量及其单位
1.(2023·福建安溪高一检测)下列叙述中不正确的是
A.2 mol铁原子 B.1 mol Fe3+
C.0.5 mol氧 D.0.5 mol氮气
0.5 mol氧,是指0.5 mol氧气还是0.5 mol氧原子不清楚,指代不明确,故C错误。
√
2.(2023·广东新丰高一段考)下列有关阿伏加德罗常数(NA)的说法不正确的是
A.0.012 kg 12C所含有的碳原子数为NA个
B.NA的近似值为6.02×1023 mol-1
C.1 mol H2O含有的水分子数目为NA个
D.NA个Cl2的质量为35.5 g
NA个Cl2即物质的量为1 mol,而Cl2的摩尔质量为71 g/mol,故NA个Cl2的质量是71 g。
√
由n(SO2)=n(SO3),得N(SO2)∶N(SO3)=1∶1;A项,应为1∶1;C项,应为3∶4;D项,m(SO2)∶m(SO3)=M(SO2)∶M(SO3)=64∶80=4∶5。
3.(2023·浙江宁海一中段考)相同物质的量的SO2和SO3,下列说法正确的是
A.硫元素的质量比为5∶4
B.分子数之比为1∶1
C.原子总数之比为4∶3
D.质量之比为1∶1
√
题点二 摩尔质量
4.下列说法中正确的是
A.硫酸的摩尔质量是98 g
B.2 mol OH-的质量是34 g
C.铁原子的摩尔质量等于它的相对原子质量
D.1 mol N2的质量是14 g
硫酸的摩尔质量是98 g·mol-1,故A错误;铁原子的摩尔质量是以g·mol-1为单位,数值上等于铁原子的相对原子质量,故C错误;1 mol N2的质量m(N2)=n×M=1 mol×28 g·mol-1=28 g,故D错误。
√
5.下雪时,常用融雪剂清理路面。醋酸钾(CH3COOK)是常用的融雪剂,但对道路、混凝土构件、桥梁设施等有害,对植物生长也有影响,目前正在研究环保高效的融雪剂。下列关于CH3COOK的叙述正确的是
A.CH3COOK的相对分子质量为98 g·mol-1
B.CH3COOK的摩尔质量为98 g
C.1 mol CH3COOK含有1.806×1024个H原子
D.1 mol CH3COOK含有2 mol氧
CH3COOK的相对分子质量为98,故A错误;摩尔质量的单位为g·mol-1,在数值上等于该物质的相对分子质量,故B错误;CH3COOK中含3个H原子,故1 mol CH3COOK含有3 mol H原子,即1.806×1024个H原子,故C正确;指代不明,没指明是氧原子还是氧气分子,故D错误。
√
题点三 与 =n= 有关的综合计算
6.25 g胆矾(CuSO4·5H2O)固体的物质的量为
A.0.16 mol B.0.05 mol
C.0.08 mol D.0.10 mol
√
7.已知1.505×1023个X气体分子的质量为8 g,则X气体的摩尔质量是
A.16 g B.32 g
C.64 g·mol-1 D.32 g·mol-1
√
8.1 g 氮气含a个分子,则阿伏加德罗常数可表示为
√
9.(2023·浙江嵊州一中段考)下列数量的各物质中,含分子个数最多的是
A.1 mol HCl B.3.01×1023个氧分子
C.22 g CO2 D.0.5 g H2
√
10.设NA代表阿伏加德罗常数的值,下列说法正确的是
A.2.4 g金属镁变成镁离子时失去的电子数目为0.1NA
B.在1 mol Na2SO4中Na+数约为6.02×1023
C.1 mol氮气所含的电子数目为NA
D.17 g氨气所含电子数目为10NA
由公式n= 可知,质量相等时,物质的量与摩尔质量成反比,故等质量的CO和CO2,物质的量之比为44∶28=11∶7,氧原子个数比为(11×1)∶(7×2)=11∶14。
11.(2023·山东高密高一检测)(1)等质量的CO和CO2,物质的量之比为 ;氧原子个数之比为 。
11∶7
11∶14
硫酸的摩尔质量为98 g·mol-1,所以1.5 mol H2SO4的质量是147 g,含有3 mol 氢原子,含有6 mol的氧原子,即96 g氧原子。
(2)1.5 mol H2SO4的质量是 g,其中含有 mol 氢原子,含有 g氧原子。
根据n= ,可知9.03×1023个氨分子含1.5 mol NH3,所以含4.5 mol氢原子。
147
3
96
1.5
(3)9.03×1023个氨分子含 mol NH3, mol氢原子。
4.5
CH4、HCl、O2的摩尔质量分别是16 g·mol-1、36.5 g·mol-1、32 g·mol-1,故摩尔质量由小到大的顺序是①③②。
12.在一定条件下,有下列物质:①8 g CH4 ②6.02×1023个HCl分子 ③2 mol O2。按由小到大的顺序填写下列空白(填序号):
(1)摩尔质量: 。
①③②
(2)物质的量: 。
①②③
分子数目与物质的量成正比,故顺序同(2)。
(3)分子数: 。
①②③
结合(2)可知,①中原子的物质的量:0.5 mol×5=2.5 mol,②中原子的物质的量:1 mol×2=2 mol,③中原子的物质的量:2 mol×2=
4 mol,故原子数目由小到大的顺序是②①③。
(4)原子总数: 。
②①③
(5)质量: 。
①②③
结合(2)可知,1 mol HCl的质量是36.5 g,2 mol O2的质量是64 g,故质量由小到大的顺序是①②③。
Na2R的物质的量为0.2 mol,其摩尔质量为12.4 g÷0.2 mol=62 g·mol-1。
13.已知12.4 g Na2R中含有Na+0.4 mol。
(1)Na2R的摩尔质量为 。
62 g·mol-1
R的摩尔质量为62 g·mol-1-2×23 g·mol-1=16 g·mol-1。
(2)R的相对原子质量为 。
16
(3)若Na2R中含R的质量为1.6 g,则Na2R的物质的量为 。
0.1 mol
1.6 g R的物质的量n(R)=1.6 g÷16 g·mol-1=0.1 mol,n(Na2R)=n(R)=0.1 mol。
14.下图是已破损的维生素C(简写作VC)说明书部分信息。已知维生素C由碳、氢、氧三种元素组成。回答下列问题:
(1)VC的化学式为 ,摩尔质量为 。
C6H8O6
176 g·mol-1
VC中碳、氢元素的质量比为(12×6)∶(1×8)=9∶1;0.1 mol VC中含氧原子数为0.6NA。
(2)VC中碳、氢元素的质量比为 ,0.1 mol VC中含氧原子数为 。
9∶1
0.6NA
(3)某同学妈妈每天按上述用法与用量服用该VC片剂,该同学建议妈妈食用西红柿来代替VC片,若100 g西红柿含30 mg VC,则该同学妈妈每天需食用西红柿 g才可达到服用上述VC片的效果。
返回
200
第1课时 物质的量 摩尔质量
第二章 第三节 物质的量
1.了解物质的量及其单位、阿伏加德罗常数、摩尔质量的含义与应用。
2.能从物质的量的角度认识物质的组成及变化,建立物质的量、物质的质量和微观粒子数之间计算的思维模型。
学习目标
任务一 物质的量的单位——摩尔
新知构建
1.物质的量
(1)物质的量:表示含有____________的集合体的物理量,用符号n表示。
(2)物质的量的单位——摩尔
一定数目粒子
mol
6.02×1023
分子
离子
原子
(3)表示方法及含义
如1 mol H指1 mol________,1 mol H2(氢气)指1 mol___________,不能说1 mol氢,指代不明确。
氢原子
氢分子
2.阿伏加德罗常数(NA)
3.物质的量、阿伏加德罗常数与粒子数之间的关系
(1)n=____。
(2)微粒的物质的量之比等于对应微粒的粒子数目之比:n1∶n2=________。
N1∶N2
NA
mol-1
6.02×1023 mol-1
交流研讨
(1)通过下图可进一步认识水的组成,并理解物质的量与微粒数目的关系。
1.204×1024
6.02×1023
2 mol
1 mol
(2)运用物质的量与微粒数目的关系,分析下列问题。
①0.3 mol H2O中含 mol原子,含 个电子。
②若测得某Na2SO4溶液中含有0.5 mol SO ,则溶液中含有 mol Na+。
③1 mol Na2SO4中含有Na+的数目是 ,
与其含有相同Na+数目的NaCl的物质的量为 。
0.9
1.806×1024
1
1.204×1024
2 mol
典题应用
1.正误判断,错误的说明原因。
(1)物质的量描述的对象是分子、原子等微观粒子: 。
(2)1 mol任何粒子所含有的粒子数相等: 。
(3)摩尔是国际单位制中七个基本物理量之一:_______________________
。
(4)阿伏加德罗常数就是6.02×1023:_________________________________
。
正确
正确
错误。物质的量是国际单位制中七个基本物理量之一,摩尔是物质的量的单位
错误。阿伏加德罗常数通常用6.02×
1023mol-1表示,其单位为mol-1
2.指出下列表述中的错误。
(1)0.5 mol H2O中含有1 mol H+: 。
(2)1 mol 氧: 。
(3)0.5 mol氢元素: 。
3.(1) 个 CO2含有0.5 mol氧原子。
(2) mol NH3与0.3 mol H2O中所含H原子一样多。
0.5 mol H2O中含1 mol氢原子
没有指明氧原子或氧分子,正确应为1 mol O或1 mol O2
元素不属于微粒,不能用“摩尔”表示
1.505×1023
0.2
返回
任务二 摩尔质量
新知构建
1.摩尔质量
M
g·mol-1
相对原
相对分子质量
子质量
新知构建
2.物质的量(n)、质量(m)和摩尔质量(M)之间的关系
(1)n=____。
(2)同一物质,物质的量之比等于质量之比:n1∶n2=________。
m1∶m2
交流研讨
(1)探究摩尔质量与相对原子(分子)质量之间的区别与联系。
提示:①摩尔质量与1 mol粒子的质量含义不同,但有一定的联系。例如,H2O的摩尔质量为18 g·mol-1,1 mol H2O的质量是18 g。
②当摩尔质量的单位取“g·mol-1”时,其数值与相对原子质量或相对分子质量相等,但物理意义、单位都不同,在计算或使用时要注意区分。例如,Mr(H2O)=18,M(H2O)=18 g·mol-1。
(2)结合下列问题,总结摩尔质量的计算方法。
①已知氨气的相对分子质量为17,则氨气的摩尔质量为 。
②1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为 。
③已知一个铁原子的质量为b g,则铁的摩尔质量为 。
④NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为 。
17 g·mol-1
64 g·mol-1
bNA g·mol-1
归纳总结
计算摩尔质量的三种方法
1.已知任意状态物质的质量时:M= (定义式)。
2.已知一个分子的质量时:M=m(分子)×NA。
3.已知一个分子的质量和一个12C原子的质量时:M= ×
12 g·mol-1。
典题应用
(1)9 g H2O的物质的量为 ,含有的氢原子数为 。
(2)3.01×1023个H2SO4分子的物质的量为 ,质量为 。
(3)0.5 mol H2SO4分子中N(H)= ,N(O)= 。
(4)Fe的摩尔质量为56 g·mol-1,则1个Fe原子质量为___________________
(列式)。
0.5 mol
6.02×1023
0.5 mol
49 g
6.02×1023
1.204×1024
返回
随堂达标演练
√
1.(2023·郑州管城区高一检测)摩尔起源于希腊文mole,原意为“堆量”,是在1971年10月,由41个国家参加的第14届国际计量大会上决定增加的国际单位制(SI)的第七个基本单位。下列关于“摩尔”的理解正确的是
A.摩尔是国际科学界建议采用的一种物理量
B.摩尔是物质的量的单位,简称摩,符号为mol
C.我们把含有6.02×1023个粒子的任何粒子的集合体计量为1摩尔
D.1 mol氧含6.02×1023个O2
摩尔只是物质的量这一物理量的单位,不是一种物理量,A错误;含6.02×1023个粒子的集合体不一定计量为1摩尔,如含6.02×1023个氧原子的O2的物质的量是0.5 mol,C错误;1 mol氧含义不明确,应说1 mol O2含6.02×1023个氧分子,D错误。
√
2.碳中和指控制一段时间内温室气体排放总量,实现CO2“零排放”。CO2的摩尔质量为
A.12 B.44 g·mol-1
C.12 g·mol-1 D.44
摩尔质量的单位是g/mol,质量单位是g,故A、B、C项错误,D项正确。
√
3.下列叙述正确的是
A.1 mol O的质量是32 g·mol-1
B.OH-的摩尔质量是17 g
C.1 mol H2O的质量是18 g·mol-1
D.CO2的摩尔质量是44 g·mol-1
4.(2023·山东济阳高一段考)已知硫酸中含有3.01×1023个氧原子,硫酸的物质的量是
A.0.500 mol B.1.00 mol
C.0.250 mol D.0.125 mol
√
(2)CO的质量为 。
5.已知0.4 mol CO和CO2的混合气体共14.4 g,则
(1)混合气体的平均摩尔质量为 ;
36 g·mol-1
5.6 g
设混合气体中CO的物质的量为x mol,CO2的物质的量为y mol,则28 g·mol-1×x mol+44 g·mol-1×y mol=14.4 g,x mol+y mol=0.4 mol,解得x=0.2,y=0.2,则m(CO)=0.2 mol×28 g·mol-1=5.6 g。
返回
课时测评
√
题点一 物质的量及其单位
1.(2023·福建安溪高一检测)下列叙述中不正确的是
A.2 mol铁原子 B.1 mol Fe3+
C.0.5 mol氧 D.0.5 mol氮气
0.5 mol氧,是指0.5 mol氧气还是0.5 mol氧原子不清楚,指代不明确,故C错误。
√
2.(2023·广东新丰高一段考)下列有关阿伏加德罗常数(NA)的说法不正确的是
A.0.012 kg 12C所含有的碳原子数为NA个
B.NA的近似值为6.02×1023 mol-1
C.1 mol H2O含有的水分子数目为NA个
D.NA个Cl2的质量为35.5 g
NA个Cl2即物质的量为1 mol,而Cl2的摩尔质量为71 g/mol,故NA个Cl2的质量是71 g。
√
由n(SO2)=n(SO3),得N(SO2)∶N(SO3)=1∶1;A项,应为1∶1;C项,应为3∶4;D项,m(SO2)∶m(SO3)=M(SO2)∶M(SO3)=64∶80=4∶5。
3.(2023·浙江宁海一中段考)相同物质的量的SO2和SO3,下列说法正确的是
A.硫元素的质量比为5∶4
B.分子数之比为1∶1
C.原子总数之比为4∶3
D.质量之比为1∶1
√
题点二 摩尔质量
4.下列说法中正确的是
A.硫酸的摩尔质量是98 g
B.2 mol OH-的质量是34 g
C.铁原子的摩尔质量等于它的相对原子质量
D.1 mol N2的质量是14 g
硫酸的摩尔质量是98 g·mol-1,故A错误;铁原子的摩尔质量是以g·mol-1为单位,数值上等于铁原子的相对原子质量,故C错误;1 mol N2的质量m(N2)=n×M=1 mol×28 g·mol-1=28 g,故D错误。
√
5.下雪时,常用融雪剂清理路面。醋酸钾(CH3COOK)是常用的融雪剂,但对道路、混凝土构件、桥梁设施等有害,对植物生长也有影响,目前正在研究环保高效的融雪剂。下列关于CH3COOK的叙述正确的是
A.CH3COOK的相对分子质量为98 g·mol-1
B.CH3COOK的摩尔质量为98 g
C.1 mol CH3COOK含有1.806×1024个H原子
D.1 mol CH3COOK含有2 mol氧
CH3COOK的相对分子质量为98,故A错误;摩尔质量的单位为g·mol-1,在数值上等于该物质的相对分子质量,故B错误;CH3COOK中含3个H原子,故1 mol CH3COOK含有3 mol H原子,即1.806×1024个H原子,故C正确;指代不明,没指明是氧原子还是氧气分子,故D错误。
√
题点三 与 =n= 有关的综合计算
6.25 g胆矾(CuSO4·5H2O)固体的物质的量为
A.0.16 mol B.0.05 mol
C.0.08 mol D.0.10 mol
√
7.已知1.505×1023个X气体分子的质量为8 g,则X气体的摩尔质量是
A.16 g B.32 g
C.64 g·mol-1 D.32 g·mol-1
√
8.1 g 氮气含a个分子,则阿伏加德罗常数可表示为
√
9.(2023·浙江嵊州一中段考)下列数量的各物质中,含分子个数最多的是
A.1 mol HCl B.3.01×1023个氧分子
C.22 g CO2 D.0.5 g H2
√
10.设NA代表阿伏加德罗常数的值,下列说法正确的是
A.2.4 g金属镁变成镁离子时失去的电子数目为0.1NA
B.在1 mol Na2SO4中Na+数约为6.02×1023
C.1 mol氮气所含的电子数目为NA
D.17 g氨气所含电子数目为10NA
由公式n= 可知,质量相等时,物质的量与摩尔质量成反比,故等质量的CO和CO2,物质的量之比为44∶28=11∶7,氧原子个数比为(11×1)∶(7×2)=11∶14。
11.(2023·山东高密高一检测)(1)等质量的CO和CO2,物质的量之比为 ;氧原子个数之比为 。
11∶7
11∶14
硫酸的摩尔质量为98 g·mol-1,所以1.5 mol H2SO4的质量是147 g,含有3 mol 氢原子,含有6 mol的氧原子,即96 g氧原子。
(2)1.5 mol H2SO4的质量是 g,其中含有 mol 氢原子,含有 g氧原子。
根据n= ,可知9.03×1023个氨分子含1.5 mol NH3,所以含4.5 mol氢原子。
147
3
96
1.5
(3)9.03×1023个氨分子含 mol NH3, mol氢原子。
4.5
CH4、HCl、O2的摩尔质量分别是16 g·mol-1、36.5 g·mol-1、32 g·mol-1,故摩尔质量由小到大的顺序是①③②。
12.在一定条件下,有下列物质:①8 g CH4 ②6.02×1023个HCl分子 ③2 mol O2。按由小到大的顺序填写下列空白(填序号):
(1)摩尔质量: 。
①③②
(2)物质的量: 。
①②③
分子数目与物质的量成正比,故顺序同(2)。
(3)分子数: 。
①②③
结合(2)可知,①中原子的物质的量:0.5 mol×5=2.5 mol,②中原子的物质的量:1 mol×2=2 mol,③中原子的物质的量:2 mol×2=
4 mol,故原子数目由小到大的顺序是②①③。
(4)原子总数: 。
②①③
(5)质量: 。
①②③
结合(2)可知,1 mol HCl的质量是36.5 g,2 mol O2的质量是64 g,故质量由小到大的顺序是①②③。
Na2R的物质的量为0.2 mol,其摩尔质量为12.4 g÷0.2 mol=62 g·mol-1。
13.已知12.4 g Na2R中含有Na+0.4 mol。
(1)Na2R的摩尔质量为 。
62 g·mol-1
R的摩尔质量为62 g·mol-1-2×23 g·mol-1=16 g·mol-1。
(2)R的相对原子质量为 。
16
(3)若Na2R中含R的质量为1.6 g,则Na2R的物质的量为 。
0.1 mol
1.6 g R的物质的量n(R)=1.6 g÷16 g·mol-1=0.1 mol,n(Na2R)=n(R)=0.1 mol。
14.下图是已破损的维生素C(简写作VC)说明书部分信息。已知维生素C由碳、氢、氧三种元素组成。回答下列问题:
(1)VC的化学式为 ,摩尔质量为 。
C6H8O6
176 g·mol-1
VC中碳、氢元素的质量比为(12×6)∶(1×8)=9∶1;0.1 mol VC中含氧原子数为0.6NA。
(2)VC中碳、氢元素的质量比为 ,0.1 mol VC中含氧原子数为 。
9∶1
0.6NA
(3)某同学妈妈每天按上述用法与用量服用该VC片剂,该同学建议妈妈食用西红柿来代替VC片,若100 g西红柿含30 mg VC,则该同学妈妈每天需食用西红柿 g才可达到服用上述VC片的效果。
返回
200
